Treonina amoniaco liasa
| L -treonina amoniaco-liasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Una representación en 3D de la caricatura del tetrámero de treonina desaminasa | |||||||||
| Identificadores | |||||||||
| N.º CE | 4.3.1.19 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
La treonina amoniaco-liasa (EC 4.3.1.19, nombre sistemático L -treonina amoniaco-liasa (formadora de 2-oxobutanoato) , también conocida comúnmente como treonina desaminasa o treonina deshidratasa , es una enzima responsable de catalizar la conversión de L -treonina en α-cetobutirato y amoniaco :
- L -treonina = 2-oxobutanoato + NH 3 (reacción global)
- (1a) L -treonina = 2-aminobut-2-enoato + H 2 O
- (1b) 2-aminobut-2-enoato = 2-iminobutanoato (espontáneo)
- (1c) 2-iminobutanoato + H2O = 2-oxobutanoato + NH3 (espontáneo)
El α-cetobutirato se puede convertir en L - isoleucina , por lo que la treonina amoniaco-liasa funciona como una enzima clave en la síntesis de BCAA . [1] Emplea un cofactor piridoxal-5'-fosfato , similar a muchas enzimas involucradas en el metabolismo de los aminoácidos . Se encuentra en bacterias , levaduras y plantas , aunque la mayoría de las investigaciones hasta la fecha se han centrado en las formas de la enzima en bacterias. Esta enzima fue una de las primeras en las que se observó y estudió directamente la inhibición por retroalimentación negativa por el producto final de una vía metabólica . [2] La enzima sirve como un excelente ejemplo de las estrategias reguladoras utilizadas en la homeostasis de los aminoácidos .
Estructura
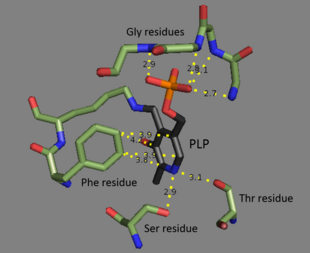
La treonina amoniaco-liasa es un tetrámero de subunidades idénticas y está organizada como un dímero de dímeros. Cada subunidad tiene dos dominios : un dominio que contiene el sitio activo catalítico y un dominio con sitios reguladores alostéricos . Se ha demostrado que los dos son regiones distintas, [3] pero el sitio regulador de una subunidad en realidad interactúa con el sitio catalítico de otra subunidad. [4] Ambos dominios contienen el motivo estructural repetitivo de láminas beta rodeadas de hélices alfa . [5] Si bien el sitio de unión de la treonina no se entiende perfectamente, los estudios estructurales revelan cómo se une el cofactor fosfato de piridoxal. [4] El cofactor PLP está unido a un residuo de lisina por medio de una base de Schiff , y el grupo fosfato de PLP se mantiene en su lugar por grupos amina derivados de una secuencia repetida de residuos de glicina . El anillo aromático está unido a la fenilalanina , y el nitrógeno en el anillo está unido por enlaces de hidrógeno a residuos que contienen grupos hidroxilo . [6]
Mecanismo
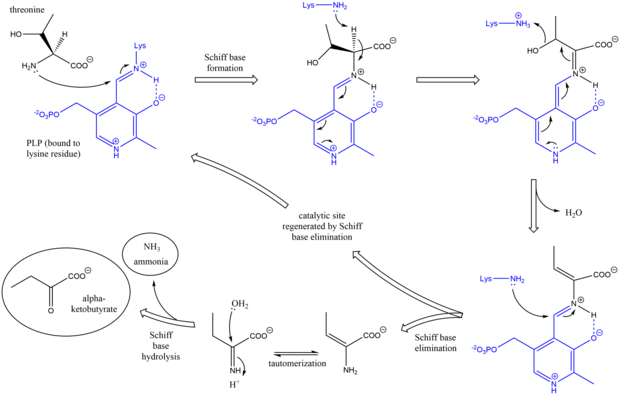
El mecanismo de la treonina amoniaco-liasa es análogo a otras enzimas desaminadoras de PLP en su uso de intermediarios de base de Schiff . [7] Inicialmente, el grupo amino de la treonina ataca la base de Schiff lisina/PLP, desplazando a la lisina. Después de la desprotonación del carbono alfa del aminoácido y la deshidratación posterior (de ahí el nombre común treonina deshidratasa ), se forma una nueva base de Schiff. Esta base de Schiff es reemplazada por el ataque de la lisina, reformando el PLP catalíticamente activo y liberando un producto inicial que contiene alqueno . Este producto se tautomeriza y, después de la hidrólisis de la base de Schiff, se generan los productos finales. [8] [9] Después de que se genera el producto final alfa-cetobutirato, la isoleucina se sintetiza progresando a través de los intermediarios alfa-acetohidroxibutirato a alfa-beta-dihidroxi-beta-metilvalerato, luego a alfa-ceto-beta-metilvalerato. [10]
Regulación
Se ha demostrado que la treonina amoniaco-liasa no sigue la cinética de Michaelis-Menten , sino que está sujeta a un control alostérico complejo. [11] La enzima es inhibida por la isoleucina, el producto de la vía en la que participa, y es activada por la valina , el producto de una vía paralela. [1] Por lo tanto, un aumento en la concentración de isoleucina detiene su producción, y un aumento en la concentración de valina desvía el material de partida (hidroxietil- TPP ) de la producción de valina. La enzima tiene dos sitios de unión para la isoleucina; uno tiene una alta afinidad por la isoleucina y el otro tiene una baja afinidad. [12] La unión de la isoleucina al sitio de alta afinidad aumenta la afinidad de unión del sitio de baja afinidad, y la desactivación de la enzima ocurre cuando la isoleucina se une al sitio de baja afinidad. La valina promueve la actividad enzimática al unirse competitivamente al sitio de alta afinidad, evitando que la isoleucina tenga un efecto inhibidor. [12] La combinación de estos dos métodos de retroalimentación equilibra la concentración de BCAA.

Isoformas y otras funciones
Se han observado múltiples formas de treonina amoniaco-liasa en una variedad de especies de organismos. En Escherichia coli , un sistema en el que la enzima se ha estudiado ampliamente, se encuentran dos formas diferentes de la enzima. Una es biosintética y se asemeja a las características enzimáticas presentadas aquí, mientras que la otra es degradativa y funciona para generar fragmentos de carbono para la producción de energía . [2] El par de isoformas también se ha observado en otras bacterias. En muchas bacterias, la isoforma biodegradativa de la enzima se expresa en condiciones anaeróbicas y es promovida por cAMP y treonina, mientras que la isoforma biosintética se expresa en condiciones aeróbicas . [13] Esto permite a la bacteria equilibrar las reservas de energía e inhibir las vías sintéticas que consumen energía cuando la energía no es abundante.
En las plantas, la treonina amoniaco-liasa es importante en los mecanismos de defensa contra los herbívoros y se regula positivamente en respuesta al estrés abiótico . [14] Una isoforma adaptada de la enzima con propiedades únicas que disuaden a los herbívoros se expresa en las hojas de las plantas. El dominio catalítico de esta isoforma es extremadamente resistente a la proteólisis , mientras que el dominio regulador se degrada fácilmente, por lo que al ser ingerida por otro organismo, las capacidades de desaminación de treonina de la enzima no se controlan. Esto degrada la treonina antes de que el herbívoro pueda absorberla, privando al herbívoro de un aminoácido esencial . [15] Los estudios de la treonina amoniaco-liasa en plantas también han ofrecido nuevas estrategias en el desarrollo de OGM con mayor valor nutricional al aumentar el contenido de aminoácidos esenciales. [14]
Se han encontrado otras formas más exóticas de la enzima que son extremadamente pequeñas en tamaño, pero aún conservan todas las funciones catalíticas y reguladoras. [4]
Evolución
Existen cinco tipos principales de plegamiento para las enzimas dependientes de PLP. La treonina amoniaco-liasa es un miembro de la familia de pliegues tipo II, también conocida como la familia de la triptófano sintasa . [7] Aunque la treonina amoniaco-liasa no posee tunelización de sustrato como la triptófano sintasa, contiene mucha homología conservada . La treonina amoniaco-liasa está más estrechamente relacionada con la serina deshidratasa , y ambas poseen el mismo mecanismo catalítico general. [9] De hecho, se ha demostrado que la treonina amoniaco-liasa exhibe cierta especificidad hacia la serina y puede convertir la serina en piruvato . [2] El dominio regulador de la treonina amoniaco-liasa es muy similar al dominio regulador de la fosfoglicerato deshidrogenasa . [4] Todas estas relaciones demuestran que la treonina amoniaco-liasa tiene estrechos vínculos evolutivos con estas enzimas. Debido al grado de conservación de la estructura y secuencia de las enzimas que reconocen aminoácidos, es probable que la diversidad evolutiva de estas enzimas se haya producido por la combinación de dominios reguladores y catalíticos individuales de diversas maneras. [1]
Relevancia para los humanos
La treonina amoniaco-liasa no se encuentra en los seres humanos. Por lo tanto, este es un ejemplo de por qué los seres humanos no pueden sintetizar los 20 aminoácidos proteinogénicos ; en este caso específico, los seres humanos no pueden convertir la treonina en isoleucina y deben consumir isoleucina en la dieta. [1] La enzima también se ha estudiado en el pasado como un posible agente supresor de tumores por las razones descritas anteriormente, ya que priva a las células tumorales de un aminoácido esencial y las mata, [16] pero este tratamiento no se ha utilizado.
Referencias
- ^ abcde Berg JM, Tymoczko JL, Stryer L (2012). Bioquímica (7.ª ed.). Nueva York: WH Freeman and Company. ISBN 978-1-4292-7635-1.
- ^ abc Umbarger HE, Brown B (enero de 1957). "Desaminación de treonina en Escherichia coli. II. Evidencia de dos desaminasas de L-treonina". Journal of Bacteriology . 73 (1): 105–12. doi :10.1128/jb.73.1.105-112.1957. PMC 289754 . PMID 13405870.
- ^ Changeux JP (1963). "Interacciones alostéricas en la L-treonina desaminasa biosintética de E. coli K12". Simposios de Cold Spring Harbor sobre biología cuantitativa . 28 : 497–504. doi :10.1101/SQB.1963.028.01.066.
- ^ abcd Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eisenstein E (abril de 1998). "Estructura y control de la treonina desaminasa alostérica dependiente de fosfato de piridoxal". Estructura . 6 (4): 465–75. doi : 10.1016/s0969-2126(98)00048-3 . PMID 9562556.
- ^ Schneider G, Käck H, Lindqvist Y (enero de 2000). "La variedad de enzimas dependientes de la vitamina B6". Estructura . 8 (1): R1-6. doi : 10.1016/S0969-2126(00)00085-X . PMID 10673430.
- ^ ab Goto M (2005). "Estructura cristalina de la treonina desaminasa T.th. HB8". doi :10.2210/pdb1ve5/pdb.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ ab Eliot AC, Kirsch JF (2004). "Enzimas de fosfato de piridoxal: consideraciones mecanicistas, estructurales y evolutivas". Revisión anual de bioquímica . 73 (1): 383–415. doi :10.1146/annurev.biochem.73.011303.074021. PMID 15189147.
- ^ ab Umbarger HE (2009). "Threonine Deaminases". En Meister A (ed.). Avances en enzimología y áreas relacionadas de la biología molecular . Avances en enzimología y áreas relacionadas de la biología molecular. Vol. 37. John Wiley & Sons. págs. 349–95. doi :10.1002/9780470122822.ch6. ISBN 978-0-471-59172-6. Número PMID 4570068.
- ^ abc Jin J, Hanefeld U (marzo de 2011). "La adición selectiva de agua a los enlaces C=C; las enzimas son los mejores químicos". Chemical Communications . 47 (9): 2502–10. doi :10.1039/c0cc04153j. PMID 21243161.
- ^ Squires CH, Levinthal M, De Felice M (noviembre de 1981). "Un papel de la treonina desaminasa en la regulación de la biosíntesis de alfa-acetolactato en Escherichia coli K12". Journal of General Microbiology . 127 (1): 19–25. doi : 10.1099/00221287-127-1-19 . PMID 7040602.
- ^ Changeux JP (1961). "Los mecanismos de control de retroalimentación de la L-treonina desaminasa biosintética por L-isoleucina". Simposios de Cold Spring Harbor sobre biología cuantitativa . 26 : 313–8. doi :10.1101/SQB.1961.026.01.037. PMID 13878122.
- ^ ab Wessel PM, Graciet E, Douce R, Dumas R (diciembre de 2000). "Evidencia de dos sitios de unión efectores distintos en la treonina desaminasa mediante mutagénesis dirigida al sitio, experimentos cinéticos y de unión" (PDF) . Biochemistry . 39 (49): 15136–43. doi :10.1021/bi001625c. PMID 11106492.
- ^ Luginbuhl GH, Hofler JG, Decedue CJ, Burns RO (octubre de 1974). "L-treonina desaminasa biodegradativa de Salmonella typhimurium". Revista de bacteriología . 120 (1): 559–61. doi :10.1128/jb.120.1.559-561.1974. PMC 245803 . PMID 4370904.
- ^ ab Joshi V, Joung JG, Fei Z, Jander G (octubre de 2010). "Interdependencia del metabolismo de treonina, metionina e isoleucina en plantas: acumulación y regulación transcripcional bajo estrés abiótico". Amino Acids . 39 (4): 933–47. doi :10.1007/s00726-010-0505-7. PMID 20186554. S2CID 22641155.
- ^ Gonzales-Vigil E, Bianchetti CM, Phillips GN, Howe GA (abril de 2011). "Evolución adaptativa de la treonina desaminasa en la defensa de las plantas contra insectos herbívoros". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (14): 5897–902. Bibcode :2011PNAS..108.5897G. doi : 10.1073/pnas.1016157108 . PMC 3078374 . PMID 21436043.
- ^ Greenfield RS, Wellner D (agosto de 1977). "Efectos de la treonina desaminasa en el crecimiento y la viabilidad de células de mamíferos en cultivos de tejidos y su citotoxicidad selectiva hacia células leucémicas". Cancer Research . 37 (8 Pt 1): 2523–9. PMID 559542.
