ARN de transferencia
| ARNt | |
|---|---|
| Identificadores | |
| Símbolo | a |
| RFAM | RF00005 |
| Otros datos | |
| Tipo de ARN | gen , ARNt |
| Estructuras del PDB | PDBe 3icq, 1asy, 1asz, 1il2, 2tra, 3tra, 486d, 1fir, 1yfg, 3eph, 3epj, 3epk, 3epl, 1efw, 1c0a, 2ake, 2azx, 2dr2, 1f7u, 1f7v, 3foz, 2hgp, 2j00, 2j02, 2ow8, 2v46, 2v48, 2wdg, 2wdh, 2wdk, 2wdm, 2wh1 |
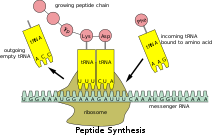
El ARN de transferencia (abreviado ARNt y anteriormente denominado ARNs , por ARN soluble [1] ) es una molécula adaptadora compuesta de ARN , típicamente de 76 a 90 nucleótidos de longitud (en eucariotas). [2] En una célula , proporciona el enlace físico entre el código genético en el ARN mensajero (ARNm) y la secuencia de aminoácidos de las proteínas, llevando la secuencia correcta de aminoácidos para ser combinada por la maquinaria de síntesis de proteínas, el ribosoma . Cada codón de tres nucleótidos en el ARNm se complementa con un anticodón de tres nucleótidos en el ARNt. Como tal, los ARNt son un componente necesario de la traducción , la síntesis biológica de nuevas proteínas de acuerdo con el código genético.
Descripción general
El proceso de traducción comienza con la información almacenada en la secuencia de nucleótidos del ADN . Esta se transforma primero en ARNm, luego el ARNt especifica qué codón de tres nucleótidos del código genético corresponde a qué aminoácido. [3] Cada codón de ARNm es reconocido por un tipo particular de ARNt, que se acopla a él a lo largo de un anticodón de tres nucleótidos, y juntos forman tres pares de bases complementarias .
En el otro extremo del ARNt hay una unión covalente al aminoácido correspondiente a la secuencia del anticodón, y cada tipo de ARNt se une a un aminoácido específico. Como el código genético contiene múltiples codones que especifican el mismo aminoácido, hay varias moléculas de ARNt que tienen diferentes anticodones que transportan el mismo aminoácido.
La unión covalente al extremo 3' del ARNt es catalizada por enzimas llamadas aminoacil ARNt sintetasas . Durante la síntesis de proteínas, los ARNt con aminoácidos unidos son entregados al ribosoma por proteínas llamadas factores de elongación , que ayudan en la asociación del ARNt con el ribosoma, la síntesis del nuevo polipéptido y la translocación (movimiento) del ribosoma a lo largo del ARNm. Si el anticodón del ARNt coincide con el ARNm, otro ARNt ya unido al ribosoma transfiere la cadena polipeptídica en crecimiento desde su extremo 3' al aminoácido unido al extremo 3' del ARNt recién entregado, una reacción catalizada por el ribosoma. Una gran cantidad de nucleótidos individuales en una molécula de ARNt pueden modificarse químicamente , a menudo por metilación o desamidación . Estas bases inusuales a veces afectan la interacción del ARNt con los ribosomas y a veces aparecen en el anticodón para alterar las propiedades de apareamiento de bases. [4]
Estructura
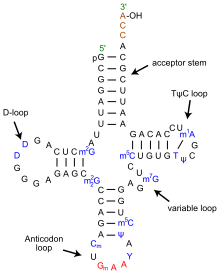

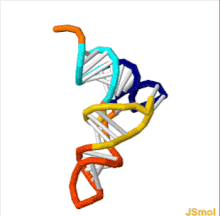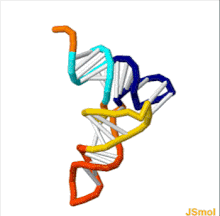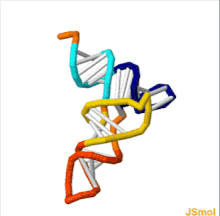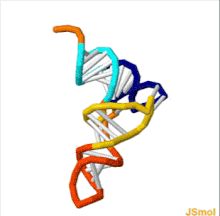
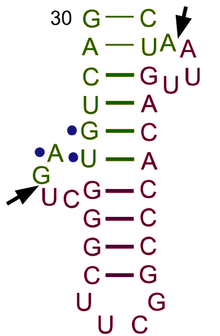
La estructura del ARNt se puede descomponer en su estructura primaria , su estructura secundaria (generalmente visualizada como la estructura de hoja de trébol ) y su estructura terciaria [6] (todos los ARNt tienen una estructura 3D en forma de L similar que les permite encajar en los sitios P y A del ribosoma ). La estructura de hoja de trébol se convierte en la estructura 3D en forma de L a través del apilamiento coaxial de las hélices, que es un motivo de estructura terciaria de ARN común . Las longitudes de cada brazo, así como el "diámetro" del bucle, en una molécula de ARNt varían de una especie a otra. [6] [7] La estructura del ARNt consta de lo siguiente:
- El tallo aceptor es un tallo de 7 a 9 pares de bases (pb) formado por el apareamiento de bases del nucleótido 5'-terminal con el nucleótido 3'-terminal (que contiene la cola CCA utilizada para unir el aminoácido). El tallo aceptor puede contener pares de bases que no sean de Watson-Crick. [6] [8]
- La cola CCA es una secuencia de citosina -citosina- adenina en el extremo 3' de la molécula de ARNt. El aminoácido cargado en el ARNt por las aminoacil-ARNt sintetasas , para formar aminoacil-ARNt , está unido covalentemente al grupo hidroxilo 3' en la cola CCA. [9] Esta secuencia es importante para el reconocimiento del ARNt por enzimas y crítica en la traducción. [10] [11] En procariotas, la secuencia CCA se transcribe en algunas secuencias de ARNt. En la mayoría de los ARNt procariotas y eucariotas, la secuencia CCA se agrega durante el procesamiento y, por lo tanto, no aparece en el gen del ARNt. [12]
- El bucle D es un tallo de 4 a 6 pb que termina en un bucle que a menudo contiene dihidrouridina . [6]
- El bucle anticodón es un tallo de 5 pb cuyo bucle contiene el anticodón. [6]
- El bucle TΨC recibe ese nombre debido a la presencia característica de la base inusual Ψ en el bucle, donde Ψ es pseudouridina , una uridina modificada . La base modificada se encuentra a menudo dentro de la secuencia 5'-TΨCGA-3', con la T ( ribotimidina , m5U) y la A formando un par de bases. [13]
- El bucle variable o bucle V se encuentra entre el bucle anticodón y el bucle ΨU y, como su nombre lo indica, varía en tamaño de 3 a 21 bases. En algunos ARNt, el "bucle" es lo suficientemente largo como para formar un tallo rígido, el brazo variable . [14] Los ARNt con un bucle V de más de 10 bases de longitud se clasifican como "clase II" y el resto se denomina "clase I". [15]
Anticodón
Un anticodón [16] es una unidad de tres nucleótidos correspondientes a las tres bases de un codón de ARNm . Cada ARNt tiene una secuencia de triplete anticodón distinta que puede formar 3 pares de bases complementarias a uno o más codones para un aminoácido. Algunos anticodones se aparean con más de un codón debido al apareamiento de bases oscilante . Con frecuencia, el primer nucleótido del anticodón es uno que no se encuentra en el ARNm: inosina , que puede unirse con hidrógeno a más de una base en la posición del codón correspondiente. [4] : 29.3.9 En el código genético , es común que un solo aminoácido esté especificado por las cuatro posibilidades de tercera posición, o al menos por pirimidinas y purinas ; por ejemplo, el aminoácido glicina está codificado por las secuencias de codones GGU, GGC, GGA y GGG. Otros nucleótidos modificados también pueden aparecer en la primera posición del anticodón (a veces conocida como la "posición de oscilación"), lo que produce cambios sutiles en el código genético, como por ejemplo en las mitocondrias . [17] La posibilidad de bases oscilantes reduce la cantidad de tipos de ARNt necesarios: en lugar de 61 tipos con uno para cada codón de sentido del código genético estándar), solo se requieren 31 ARNt para traducir, de manera inequívoca, los 61 codones de sentido. [3] [18]
Nomenclatura
Un ARNt se nombra comúnmente por su aminoácido previsto (por ejemplo, ARNt-Asn ), por su secuencia anticodón (por ejemplo, ARNt(GUU) ) o por ambos (por ejemplo, ARNt-Asn(GUU) o ARNtAsociación
Guu). [19] Estas dos características describen la función principal del ARNt, pero en realidad no cubren toda la diversidad de variación del ARNt; como resultado, se agregan sufijos numéricos para diferenciarlos. [20] Los ARNt destinados al mismo aminoácido se denominan "isotipos"; aquellos con la misma secuencia de anticodón se denominan "isoaceptores"; y aquellos en los que ambos son iguales pero difieren en otros lugares se denominan "isodecodificadores". [21]
Aminoacilación
La aminoacilación es el proceso de añadir un grupo aminoacilo a un compuesto. Une covalentemente un aminoácido al extremo 3' CCA de una molécula de ARNt. Cada ARNt es aminoacilado (o cargado ) con un aminoácido específico por una aminoacila ARNt sintetasa . Normalmente hay una sola aminoacila ARNt sintetasa para cada aminoácido, a pesar del hecho de que puede haber más de un ARNt y más de un anticodón para un aminoácido. El reconocimiento del ARNt apropiado por las sintetasas no está mediado únicamente por el anticodón, y el tallo aceptor a menudo juega un papel destacado. [22] Reacción:
Ciertos organismos pueden tener una o más sintetasas de aminofosfato-ARNt faltantes. Esto hace que el ARNt se cargue con un aminoácido químicamente relacionado y, mediante el uso de una enzima o enzimas, el ARNt se modifica para que se cargue correctamente. Por ejemplo, en Helicobacter pylori falta la sintetasa de glutaminil-ARNt. Por lo tanto, la sintetasa de glutamato-ARNt carga el ARNt-glutamina (ARNt-Gln) con glutamato . Luego, una amidotransferasa convierte la cadena lateral ácida del glutamato en amida, formando el gln-ARNt-Gln correctamente cargado.
Unión al ribosoma
El ribosoma tiene tres sitios de unión para las moléculas de ARNt que abarcan el espacio entre las dos subunidades ribosómicas : los sitios A (aminoacilo) , [24] P (peptidilo) y E (salida) . Además, el ribosoma tiene otros dos sitios para la unión del ARNt que se utilizan durante la decodificación del ARNm o durante el inicio de la síntesis de proteínas . Estos son el sitio T (llamado factor de elongación Tu ) y el sitio I (iniciación). [25] [26] Por convención, los sitios de unión del ARNt se denotan con el sitio en la subunidad ribosómica pequeña enumerado primero y el sitio en la subunidad ribosómica grande enumerado segundo. Por ejemplo, el sitio A a menudo se escribe A/A, el sitio P, P/P, y el sitio E, E/E. [25] Las proteínas de unión como L27, L2, L14, L15, L16 en los sitios A y P han sido determinadas mediante etiquetado de afinidad por AP Czernilofsky et al. ( Proc. Natl. Acad. Sci, EE. UU. , págs. 230-234, 1974).
Una vez que se completa la iniciación de la traducción, el primer ARNt aminoacilado se ubica en el sitio P/P, listo para el ciclo de elongación descrito a continuación. Durante la elongación de la traducción, el ARNt primero se une al ribosoma como parte de un complejo con el factor de elongación Tu ( EF-Tu ) o su contraparte eucariota ( eEF-1 ) o arqueal. Este sitio de unión inicial del ARNt se llama sitio A/T. En el sitio A/T, la mitad del sitio A reside en la subunidad ribosómica pequeña donde se ubica el sitio de decodificación del ARNm. El sitio de decodificación del ARNm es donde se lee el codón del ARNm durante la traducción. La mitad del sitio T reside principalmente en la subunidad ribosómica grande donde EF-Tu o eEF-1 interactúa con el ribosoma. Una vez que se completa la decodificación del ARNm, el ARNt aminoacilado se une en el sitio A/A y está listo para que se forme el siguiente enlace peptídico [27] con su aminoácido unido. El peptidil-ARNt, que transfiere el polipéptido en crecimiento al aminoacil-ARNt unido en el sitio A/A, se une en el sitio P/P. Una vez que se forma el enlace peptídico, el ARNt en el sitio P/P se acila, o tiene un extremo 3' libre, y el ARNt en el sitio A/A disocia la cadena polipeptídica en crecimiento. Para permitir el siguiente ciclo de elongación, los ARNt se mueven a través de los sitios de unión híbridos A/P y P/E, antes de completar el ciclo y residir en los sitios P/P y E/E. Una vez que los ARNt A/A y P/P se han movido a los sitios P/P y E/E, el ARNm también se ha movido un codón y el sitio A/T está vacante, listo para la siguiente ronda de decodificación del ARNm. El ARNt unido en el sitio E/E luego abandona el ribosoma.
El sitio P/I es en realidad el primero en unirse al ARNt aminoacilado, que es entregado por un factor de iniciación llamado IF2 en bacterias. [26] Sin embargo, la existencia del sitio P/I en ribosomas eucariotas o arqueales aún no ha sido confirmada. La proteína L27 del sitio P ha sido determinada por etiquetado de afinidad por E. Collatz y AP Czernilofsky ( FEBS Lett. , Vol. 63, pp. 283–286, 1976).
genes de ARNt
Los organismos varían en el número de genes de ARNt en su genoma . Por ejemplo, el gusano nematodo C. elegans , un organismo modelo comúnmente utilizado en estudios genéticos , tiene 29.647 genes en su genoma nuclear , [28] de los cuales 620 codifican ARNt. [29] [30] La levadura en ciernes Saccharomyces cerevisiae tiene 275 genes de ARNt en su genoma. El número de genes de ARNt por genoma puede variar ampliamente, con especies bacterianas de grupos como Fusobacteria y Tenericutes que tienen alrededor de 30 genes por genoma, mientras que genomas eucariotas complejos como el pez cebra ( Danio rerio ) pueden tener más de 10 mil genes de ARNt. [31]
En el genoma humano, que, según estimaciones de enero de 2013, tiene alrededor de 20.848 genes codificadores de proteínas [32] en total, hay 497 genes nucleares que codifican moléculas de ARNt citoplasmático y 324 pseudogenes derivados del ARNt , genes de ARNt que se cree que ya no son funcionales [33] (aunque se ha demostrado que los pseudoARNt están involucrados en la resistencia a los antibióticos en las bacterias). [34] Al igual que con todos los eucariotas, hay 22 genes de ARNt mitocondriales [35] en los humanos. Las mutaciones en algunos de estos genes se han asociado con enfermedades graves como el síndrome MELAS . También se han identificado regiones en los cromosomas nucleares, muy similares en secuencia a los genes de ARNt mitocondriales (parecidos al ARNt). [36] Estos parecidos al ARNt también se consideran parte del ADN mitocondrial nuclear (genes transferidos de las mitocondrias al núcleo). [36] [37] El fenómeno de múltiples copias nucleares de ARNt mitocondrial (similares al ARNt) se ha observado en muchos organismos superiores, desde el ser humano hasta la zarigüeya, [38] lo que sugiere la posibilidad de que estos similares sean funcionales.
Los genes de ARNt citoplasmáticos se pueden agrupar en 49 familias según sus características anticodónicas. Estos genes se encuentran en todos los cromosomas, excepto en el cromosoma 22 y el cromosoma Y. Se observa una alta concentración en 6p (140 genes de ARNt), así como en el cromosoma 1. [33]
El HGNC , en colaboración con la base de datos de ARNt genómico (GtRNAdb) y expertos en el campo, ha aprobado nombres únicos para los genes humanos que codifican ARNt.
Por lo general, los genes de ARNt de bacterias son más cortos (media = 77,6 pb) que los ARNt de arqueas (media = 83,1 pb) y eucariotas (media = 84,7 pb). [31] El ARNt maduro sigue un patrón opuesto, siendo los ARNt de bacterias generalmente más largos (mediana = 77,6 nt) que los ARNt de arqueas (mediana = 76,8 nt), y los eucariotas exhiben los ARNt maduros más cortos (mediana = 74,5 nt). [31]
Evolución
El contenido de ARNt genómico es una característica diferenciadora de los genomas entre los dominios biológicos de la vida: Archaea presenta la situación más simple en términos de contenido de ARNt genómico con un número uniforme de copias de genes, Bacteria tiene una situación intermedia y Eukarya presenta la situación más compleja. [39] Eukarya presenta no solo más contenido de genes de ARNt que los otros dos reinos sino también una alta variación en el número de copias de genes entre diferentes isoaceptores, y esta complejidad parece deberse a duplicaciones de genes de ARNt y cambios en la especificidad del anticodón [ cita requerida ] .
La evolución del número de copias del gen ARNt en diferentes especies se ha relacionado con la aparición de enzimas específicas de modificación del ARNt (uridina metiltransferasas en bacterias y adenosina desaminasas en Eukarya), que aumentan la capacidad de decodificación de un ARNt determinado. [39] Como ejemplo, el ARNt Ala codifica cuatro isoaceptores de ARNt diferentes (AGC, UGC, GGC y CGC). En Eukarya, los isoaceptores AGC están extremadamente enriquecidos en número de copias de genes en comparación con el resto de isoaceptores, y esto se ha correlacionado con su modificación de A a I de su base oscilante. Esta misma tendencia se ha demostrado para la mayoría de los aminoácidos de las especies eucariotas. De hecho, el efecto de estas dos modificaciones del ARNt también se ve en el sesgo de uso de codones . Los genes altamente expresados parecen estar enriquecidos en codones que utilizan exclusivamente codones que serán decodificados por estos ARNt modificados, lo que sugiere un posible papel de estos codones (y en consecuencia de estas modificaciones del ARNt) en la eficiencia de la traducción. [39]
Muchas especies han perdido ARNt específicos durante la evolución. Por ejemplo, tanto los mamíferos como las aves carecen de los mismos 14 de los 64 genes de ARNt posibles, pero otras formas de vida contienen estos ARNt. [40] Para traducir codones para los que falta un ARNt de emparejamiento exacto, los organismos recurren a una estrategia llamada wobbling , en la que los pares de ARNt/ARNm imperfectamente emparejados siguen dando lugar a la traducción, aunque esta estrategia también aumenta la propensión a errores de traducción. [41] Las razones por las que se han perdido genes de ARNt durante la evolución siguen siendo objeto de debate, pero pueden estar relacionadas con la mejora de la resistencia a la infección viral. [42] Debido a que los tripletes de nucleótidos pueden presentar más combinaciones que aminoácidos y ARNt asociados, existe redundancia en el código genético y varios codones de 3 nucleótidos diferentes pueden expresar el mismo aminoácido. Este sesgo de codón es lo que necesita la optimización de codones.
Origen hipotético
La mitad superior del ARNt (que consiste en el brazo T y el tallo aceptor con el grupo fosfato 5'-terminal y el grupo CCA 3'-terminal) y la mitad inferior (que consiste en el brazo D y el brazo anticodón) son unidades independientes en estructura así como en función. La mitad superior puede haber evolucionado primero incluyendo la etiqueta genómica 3'-terminal que originalmente puede haber marcado moléculas similares al ARNt para la replicación en el mundo del ARN temprano . La mitad inferior puede haber evolucionado más tarde como una expansión, por ejemplo, cuando la síntesis de proteínas comenzó en el mundo del ARN y lo convirtió en un mundo de ribonucleoproteínas ( mundo RNP ). Este escenario propuesto se llama hipótesis de la etiqueta genómica. De hecho, el ARNt y los agregados similares al ARNt tienen una importante influencia catalítica (es decir, como ribozimas ) en la replicación todavía hoy. Estas funciones pueden considerarse como " fósiles moleculares (o químicos) " del mundo del ARN. [43] En marzo de 2021, los investigadores informaron evidencia que sugiere que una forma temprana de ARN de transferencia podría haber sido una molécula de ribozima replicadora en el desarrollo muy temprano de la vida, o abiogénesis . [44] [45]
Fragmentos derivados del ARNt
Los fragmentos derivados de ARNt (o tRF) son moléculas cortas que emergen después de la escisión de los ARNt maduros o la transcripción precursora. [46] [47] [48] [49] Tanto los ARNt citoplasmáticos como los mitocondriales pueden producir fragmentos. [50] Hay al menos cuatro tipos estructurales de tRF que se cree que se originan a partir de ARNt maduros, incluidas las mitades de ARNt relativamente largas y los 5'-tRF, 3'-tRF e i-tRF cortos. [46] [50] [51] El ARNt precursor se puede escindir para producir moléculas a partir de las secuencias líder 5' o de rastro 3'. Las enzimas de escisión incluyen angiogenina, Dicer, ARNasa Z y ARNasa P. [46] [47] Especialmente en el caso de la angiogenina, los tRF tienen un fosfato cíclico característicamente inusual en su extremo 3' y un grupo hidroxilo en el extremo 5'. [52] Los tRF parecen desempeñar un papel en la interferencia del ARN , específicamente en la supresión de retrovirus y retrotransposones que utilizan ARNt como cebador para la replicación. Los medios ARNt escindidos por la angiogenina también se conocen como ARNti. La biogénesis de fragmentos más pequeños, incluidos los que funcionan como piARN , es menos comprendida. [53]
Los tRF tienen múltiples dependencias y funciones; como exhibir cambios significativos entre sexos, entre razas y estado de enfermedad. [50] [54] [55] Funcionalmente, pueden cargarse en Ago y actuar a través de vías de RNAi, [48] [51] [56] participar en la formación de gránulos de estrés, [57] desplazar ARNm de proteínas de unión a ARN [58] o inhibir la traducción. [59] A nivel de sistema o de organismo, los cuatro tipos de tRF tienen un espectro diverso de actividades. Funcionalmente, los tRF están asociados con la infección viral, [60] cáncer, [51] proliferación celular [52] y también con la regulación transgeneracional epigenética del metabolismo. [61]
Los tRF no se limitan a los humanos y se ha demostrado que existen en múltiples organismos. [51] [62] [63] [64]
Hay dos herramientas en línea disponibles para aquellos que deseen aprender más sobre los tRF: el marco para la exploración interactiva de fragmentos de ARN mitocondriales y nucleares (MINTbase) [ 65 ] [ 66 ] y la base de datos relacional de Fragmentos relacionados con ARN de transferencia (tRFdb). [67] MINTbase también proporciona un esquema de nombres para la denominación de tRF llamado placas de licencia de tRF (o MINTcodes) que es independiente del genoma; el esquema comprime una secuencia de ARN en una cadena más corta.
ARNt modificados genéticamente
Los ARNt con anticodones modificados y/o tallos aceptores se pueden utilizar para modificar el código genético. Los científicos han reutilizado con éxito los codones (de sentido y de terminación) para aceptar aminoácidos (naturales y nuevos), tanto para la iniciación (ver: codón de inicio ) como para la elongación.
En 1990, el ARNtfMet2
UA(modificado a partir del ARNtCAU fMet2
El gen metY) se insertó en E. coli , lo que provocó que iniciara la síntesis de proteínas en el codón de parada UAG, siempre que esté precedido por una fuerte secuencia Shine-Dalgarno . En la iniciación, no solo inserta la formilmetionina tradicional , sino también formilglutamina, ya que la glutamil-ARNt sintasa también reconoce el nuevo ARNt. [68] El experimento se repitió en 1993, ahora con un ARNt elongador modificado para ser reconocido por la metionil-ARNt formiltransferasa . [69] Se obtuvo un resultado similar en Mycobacterium . [70] Experimentos posteriores mostraron que el nuevo ARNt era ortogonal al codón de inicio AUG regular, sin mostrar eventos de iniciación de traducción fuera del objetivo detectables en una cepa de E. coli recodificada genómicamente . [71]
Biogénesis del ARNt
En las células eucariotas , los ARNt son transcritos por la ARN polimerasa III como pre-ARNt en el núcleo. [72] La ARN polimerasa III reconoce dos secuencias promotoras aguas abajo altamente conservadas: la región de control intragénica 5' (5'-ICR, región de control D o caja A) y la 3'-ICR (región de control T o caja B) dentro de los genes de ARNt. [2] [73] [74] El primer promotor comienza en +8 de los ARNt maduros y el segundo promotor se encuentra 30-60 nucleótidos aguas abajo del primer promotor. La transcripción termina después de un tramo de cuatro o más timidinas . [2] [74]
Los pre-ARNt sufren modificaciones extensas dentro del núcleo. Algunos pre-ARNt contienen intrones que se empalman, o cortan, para formar la molécula de ARNt funcional; [75] en las bacterias estos se auto -empalman , mientras que en eucariotas y arqueas son eliminados por endonucleasas de empalme de ARNt . [76] El pre-ARNt eucariota contiene un motivo de estructura de protuberancia-hélice-protuberancia (BHB) que es importante para el reconocimiento y empalme preciso del intrón de ARNt por endonucleasas. [77] Esta posición y estructura del motivo se conservan evolutivamente. Sin embargo, algunos organismos, como las algas unicelulares, tienen una posición no canónica del motivo BHB, así como los extremos 5' y 3' de la secuencia del intrón empalmado. [77] La secuencia 5′ es eliminada por la ARNasa P , [78] mientras que el extremo 3′ es eliminado por la enzima ARNt Z. [79] Una excepción notable es la arqueona Nanoarchaeum equitans , que no posee una enzima ARNasa P y tiene un promotor colocado de tal manera que la transcripción comienza en el extremo 5′ del ARNt maduro. [80] La cola CCA 3′ no moldeada es agregada por una nucleotidil transferasa . [81] Antes de que los ARNt sean exportados al citoplasma por Los1/ Xpo-t , [82] [83] los ARNt son aminoacilados . [84] El orden de los eventos de procesamiento no se conserva. Por ejemplo, en la levadura , el empalme no se lleva a cabo en el núcleo sino en el lado citoplasmático de las membranas mitocondriales . [85]
Historia
La existencia del ARNt fue planteada por primera vez por Francis Crick como la " hipótesis del adaptador ", basada en la suposición de que debe existir una molécula adaptadora capaz de mediar la traducción del alfabeto del ARN al alfabeto proteico. Paul C Zamecnik , Mahlon Hoagland y Mary Louise Stephenson descubrieron el ARNt. [86] [87] [88] A principios de la década de 1960, Alex Rich y Donald Caspar , dos investigadores de Boston, el grupo de Jacques Fresco de la Universidad de Princeton y un grupo del Reino Unido en el King's College de Londres , llevaron a cabo importantes investigaciones sobre la estructura . [89] En 1965, Robert W. Holley de la Universidad de Cornell informó sobre la estructura primaria y sugirió tres estructuras secundarias. [90] El ARNt fue cristalizado por primera vez en Madison, Wisconsin, por Robert M. Bock. [91] La estructura en forma de hoja de trébol fue comprobada por varios otros estudios en los años siguientes [92] y finalmente fue confirmada usando estudios de cristalografía de rayos X en 1974. Dos grupos independientes, Kim Sung-Hou trabajando bajo la dirección de Alexander Rich y un grupo británico encabezado por Aaron Klug , publicaron los mismos hallazgos cristalográficos dentro de un año. [93] [94]
Relevancia clínica
La interferencia con la aminoacilación puede ser útil como un enfoque para tratar algunas enfermedades: las células cancerosas pueden ser relativamente vulnerables a la aminoacilación alterada en comparación con las células sanas. La síntesis de proteínas asociada con el cáncer y la biología viral a menudo depende en gran medida de moléculas de ARNt específicas. Por ejemplo, para el cáncer de hígado, cargar el ARNt-Lys-CUU con lisina sostiene el crecimiento y la metástasis de las células del cáncer de hígado, mientras que las células sanas tienen una dependencia mucho menor de este ARNt para sustentar la fisiología celular. [95] De manera similar, el virus de la hepatitis E requiere un paisaje de ARNt que difiere sustancialmente del asociado con las células no infectadas. [96] Por lo tanto, la inhibición de la aminoacilación de especies específicas de ARNt se considera una vía novedosa y prometedora para el tratamiento racional de una plétora de enfermedades.
Véase también
Referencias
- ^ Plescia OJ, Palczuk NC, Cora-Figueroa E, Mukherjee A, Braun W (octubre de 1965). "Producción de anticuerpos contra el ARN soluble (ARNs)". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 54 (4): 1281–1285. Bibcode :1965PNAS...54.1281P. doi : 10.1073/pnas.54.4.1281 . PMC 219862 . PMID 5219832.
- ^ abc Sharp SJ, Schaack J, Cooley L, Burke DJ, Söll D (1985). "Estructura y transcripción de genes de ARNt eucariotas". CRC Critical Reviews in Biochemistry . 19 (2): 107–144. doi :10.3109/10409238509082541. PMID 3905254.
- ^ ab Crick FH (diciembre de 1968). "El origen del código genético". Revista de Biología Molecular . 38 (3): 367–379. doi :10.1016/0022-2836(68)90392-6. PMID 4887876. S2CID 4144681.
- ^ ab Stryer L, Berg JM, Tymoczko JL (2002). Bioquímica (5ª ed.). San Francisco: WH Freeman. ISBN 978-0-7167-4955-4.
- ^ "ARN de transferencia (ARNt)". Proteopedia.org . Consultado el 7 de noviembre de 2018 .
- ^ abcde Itoh Y, Sekine S, Suetsugu S, Yokoyama S (julio de 2013). "Estructura terciaria del ARNt de serenocisteína bacteriana". Nucleic Acids Research . 41 (13): 6729–6738. doi :10.1093/nar/gkt321. PMC 3711452 . PMID 23649835.
- ^ Goodenbour JM, Pan T (29 de octubre de 2006). "Diversidad de genes de ARNt en eucariotas". Nucleic Acids Research . 34 (21): 6137–6146. doi :10.1093/nar/gkl725. PMC 1693877 . PMID 17088292.
- ^ Jahn M, Rogers MJ, Söll D (julio de 1991). "Los nucleótidos del tallo anticodón y aceptor en el ARNt(Gln) son los principales elementos de reconocimiento para la glutaminil-ARNt sintetasa de E. coli". Nature . 352 (6332): 258–260. Bibcode :1991Natur.352..258J. doi :10.1038/352258a0. PMID 1857423. S2CID 4263705.
- ^ Ibba M, Soll D (junio de 2000). "Síntesis de aminoacil-ARNt". Revisión anual de bioquímica . 69 (1): 617–650. doi :10.1146/annurev.biochem.69.1.617. PMID 10966471.
- ^ Sprinzl M, Cramer F (1979). "El extremo -CCA del ARNt y su papel en la biosíntesis de proteínas". Progreso en la investigación de ácidos nucleicos y biología molecular . 22 : 1–69. doi :10.1016/s0079-6603(08)60798-9. ISBN 978-0-12-540022-0. PMID 392600.
- ^ Green R, Noller HF (1997). "Ribosomas y traducción". Revista anual de bioquímica . 66 : 679–716. doi :10.1146/annurev.biochem.66.1.679. PMID 9242921.
- ^ Aebi M, Kirchner G, Chen JY, Vijayraghavan U, Jacobson A, Martin NC, Abelson J, et al. (septiembre de 1990). "Aislamiento de un mutante sensible a la temperatura con una nucleotidiltransferasa de ARNt alterada y clonación del gen que codifica la nucleotidiltransferasa de ARNt en la levadura Saccharomyces cerevisiae". The Journal of Biological Chemistry . 265 (27): 16216–16220. doi : 10.1016/S0021-9258(17)46210-7 . PMID 2204621.
- ^ Chan, CW; Chetnani, B; Mondragón, A (septiembre de 2013). "Estructura y función del motivo estructural T-loop en ARN no codificantes". Wiley Interdisciplinary Reviews. ARN . 4 (5): 507–22. doi :10.1002/wrna.1175. PMC 3748142 . PMID 23754657.
- ^ Prabhakar A, Krahn N, Zhang J, Vargas-Rodriguez O, Krupkin M, Fu Z, Acosta-Reyes FJ, Ge X, Choi J, Crnković A, Ehrenberg M, Puglisi EV, Söll D, Puglisi J (julio de 2022) . "Descubriendo obstáculos en la traducción durante el desarrollo de un ARNt sintético". Ácidos nucleicos Res . 50 (18): 10201–10211. doi : 10.1093/nar/gkac576. PMC 9561287 . PMID 35882385.
- ^ Brennan, T.; Sundaralingam, M. (1 de noviembre de 1976). "Estructura de moléculas de ARN de transferencia que contienen el bucle variable largo". Investigación de ácidos nucleicos . 3 (11): 3235–3252. doi : 10.1093/nar/3.11.3235 . PMC 343166 . PMID 794835.
- ^ Felsenfeld G, Cantoni GL (mayo de 1964). "Uso de estudios de desnaturalización térmica para investigar la secuencia de bases del ARN pequeño de serina de levadura". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 51 (5): 818–826. Bibcode :1964PNAS...51..818F. doi : 10.1073/pnas.51.5.818 . PMC 300168 . PMID 14172997.
- ^ Suzuki T, Suzuki T (junio de 2014). "Un panorama completo de modificaciones postranscripcionales en ARNt mitocondriales de mamíferos". Nucleic Acids Research . 42 (11): 7346–7357. doi :10.1093/nar/gku390. PMC 4066797 . PMID 24831542.
- ^ Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Biología celular molecular . WH Freeman: Nueva York. 5.ª ed. ISBN 978-0716743668 [ página necesaria ]
- ^ Parisien, Marc; Wang, Xiaoyun; Pan, Tao (diciembre de 2013). "Diversidad de genes de ARNt humanos del proyecto de los 1000 genomas". RNA Biology . 10 (12): 1853–1867. doi : 10.4161/rna.27361 . PMC 3917988 . PMID 24448271.
- ^ Chan, PP; Lowe, TM (4 de enero de 2016). "GtRNAdb 2.0: una base de datos ampliada de genes de ARN de transferencia identificados en genomas completos y borradores". Nucleic Acids Research . 44 (D1): D184-9. doi : 10.1093/nar/gkv1309 . PMC 4702915 . PMID 26673694.
- ^ Hughes, Laetitia A.; Rudler, Danielle L.; Siira, Stefan J.; McCubbin, Tim; Raven, Samuel A.; Browne, Jasmin M.; Ermer, Judith A.; Rientjes, Jeanette; Rodger, Jennifer; Marcellin, Esteban; Rackham, Oliver; Filipovska, Aleksandra (18 de abril de 2023). "La variación del número de copias en los genes isodecodificadores del ARNt perjudica el desarrollo de los mamíferos y la traducción equilibrada". Nature Communications . 14 (1): 2210. Bibcode :2023NatCo..14.2210H. doi : 10.1038/s41467-023-37843-9 . PMC 10113395 . PMID 37072429.
- ^ Schimmel P, Giegé R, Moras D, Yokoyama S (octubre de 1993). "Un código de ARN operativo para aminoácidos y posible relación con el código genético". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (19): 8763–8768. Bibcode :1993PNAS...90.8763S. doi : 10.1073/pnas.90.19.8763 . PMC 47440 . PMID 7692438.
- ^ Dunkle JA, Wang L, Feldman MB, Pulk A, Chen VB, Kapral GJ, Noeske J, Richardson JS, Blanchard SC, Cate JH (mayo de 2011). "Estructuras del ribosoma bacteriano en estados clásicos e híbridos de unión del ARNt". Science . 332 (6032): 981–984. Bibcode :2011Sci...332..981D. doi :10.1126/science.1202692. PMC 3176341 . PMID 21596992.
- ^ Konevega AL, Soboleva NG, Makhno VI, Semenkov YP, Wintermeyer W, Rodnina MV, Katunin VI (enero de 2004). "Las bases de purina en la posición 37 del ARNt estabilizan la interacción codón-anticodón en el sitio A del ribosoma mediante apilamiento e interacciones dependientes de Mg2+". ARN . 10 (1): 90–101. doi :10.1261/rna.5142404. PMC 1370521 . PMID 14681588.
- ^ ab Agirrezabala X, Frank J (agosto de 2009). "Elongación en la traducción como una interacción dinámica entre el ribosoma, el ARNt y los factores de elongación EF-G y EF-Tu". Quarterly Reviews of Biophysics . 42 (3): 159–200. doi :10.1017/S0033583509990060. PMC 2832932 . PMID 20025795.
- ^ ab Allen GS, Zavialov A, Gursky R, Ehrenberg M, Frank J (junio de 2005). "La estructura crio-EM de un complejo de iniciación de la traducción de Escherichia coli". Cell . 121 (5): 703–712. doi : 10.1016/j.cell.2005.03.023 . PMID 15935757. S2CID 16146867.
- ^ Tirumalai MR, Rivas M, Tran Q, Fox GE (noviembre de 2021). "El centro de la peptidil transferasa: una ventana al pasado". Microbiol Mol Biol Rev . 85 (4): e0010421. doi :10.1128/MMBR.00104-21. PMC 8579967 . PMID 34756086.
- ^ Sitio web de WormBase, http://www.wormbase.org Archivado el 20 de abril de 2017 en Wayback Machine , lanzamiento WS187, fecha 25 de enero de 2008.
- ^ Spieth J, Lawson D (enero de 2006). "Descripción general de la estructura genética". WormBook : 1–10. doi :10.1895/wormbook.1.65.1. PMC 4781370 . PMID 18023127.
- ^ Hartwell LH, Hood L, Goldberg ML, Reynolds AE, Silver LM, Veres RC. (2004). Genética: de los genes a los genomas, 2.ª ed. McGraw-Hill: Nueva York. pág. 264.
- ^ abc Santos, Fenícia Brito; Del-Bem, Luiz-Eduardo (enero de 2023). "La evolución del número de copias y el repertorio de ARNt en la vida celular". Genes . 14 (1): 27. doi : 10.3390/genes14010027 . ISSN 2073-4425. PMC 9858662 . PMID 36672768.
- ^ Lanzamiento de Ensembl 70 - enero de 2013 http://www.ensembl.org/Homo_sapiens/Info/StatsTable?db=core Archivado el 15 de diciembre de 2013 en Wayback Machine.
- ^ ab Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (Consorcio Internacional de Secuenciación del Genoma Humano) (febrero de 2001). "Secuenciación inicial y análisis del genoma humano" (PDF) . Nature . 409 (6822): 860–921. Bibcode :2001Natur.409..860L. doi : 10.1038/35057062 . PMID 11237011.
- ^ Rogers TE, Ataide SF, Dare K, Katz A, Seveau S, Roy H, Ibba M (2012). "Un pseudo-ARNt modula la resistencia a los antibióticos en Bacillus cereus". PLOS ONE . 7 (7): e41248. Bibcode :2012PLoSO...741248R. doi : 10.1371/journal.pone.0041248 . PMC 3399842 . PMID 22815980.
- ^ Hartwell LH, Hood L, Goldberg ML, Reynolds AE, Silver LM, Veres RC. (2004). Genética: de los genes a los genomas, 2.ª ed. McGraw-Hill: Nueva York. pág. 529.
- ^ ab Telonis AG, Loher P, Kirino Y, Rigoutsos I (2014). "Pareces de ARNt nucleares y mitocondriales en el genoma humano". Frontiers in Genetics . 5 : 344. doi : 10.3389/fgene.2014.00344 . PMC 4189335 . PMID 25339973.
- ^ Ramos A, Barbena E, Mateiu L, del Mar González M, Mairal Q, Lima M, Montiel R, Aluja MP, Santos C, et al. (noviembre de 2011). "Inserciones nucleares de origen mitocondrial: actualización de bases de datos y utilidad en estudios de cáncer". Mitocondria . 11 (6): 946–953. doi :10.1016/j.mito.2011.08.009. PMID 21907832.
- ^ Telonis AG, Kirino Y, Rigoutsos I (2015). "Pareces mitocondriales de ARNt en cromosomas nucleares: ¿podrían ser funcionales?". RNA Biol . 12 (4): 375–380. doi :10.1080/15476286.2015.1017239. PMC 4615777. PMID 25849196 .
- ^ abc Novoa EM, Pavon-Eternod M, Pan T, Ribas de Pouplana L (marzo de 2012). "Un papel para las modificaciones del ARNt en la estructura del genoma y el uso de codones". Cell . 149 (1): 202–213. doi : 10.1016/j.cell.2012.01.050 . PMID 22464330. S2CID 16487609.
- ^ Ou X, Peng W, Yang Z, Cao J, Wang M, Peppelenbosch MP, Pan Q, Cheng A (noviembre de 2020). "Genes de ARNt evolutivamente faltantes y conservados en humanos y aves". Infect. Genet. Evol . 85 : 104460. doi : 10.1016/j.meegid.2020.104460 . hdl : 1765/129010 . PMID 32679345.
- ^ Ou X, Cao J, Cheng A, Peppelenbosch MP, Pan Q (marzo de 2019). "Errores en la decodificación traduccional: ¿bamboleo del ARNt o incorporación incorrecta?". PLOS Genetics . 15 (3): 2979–2986. doi : 10.1371/journal.pgen.1008017 . PMC 3158919 . PMID 21930591.
- ^ Ou X, Wang M, Mao S, Cao J, Cheng A, Zhu D, Chen S, Jia R, Liu M, Yang Q, Wu Y, Zhao X, Zhang S, Liu Y, Yu Y, Zhang L, Chen X, Peppelenbosch MP, Pan Q (julio de 2018). "La traducción incompatible impulsa una evolución convergente y una atenuación viral durante el desarrollo de una vacuna viva atenuada". Portada. Cell. Infect. Microbiol . 8 : 249. doi : 10.3389 /fcimb.2018.00249 . PMC 6058041. PMID 30073153.
- ^ Maizels, Nancy; Weiner, Alan M. (1999). "La hipótesis de la etiqueta genómica: lo que los fósiles moleculares nos dicen sobre la evolución del ARNt". El mundo del ARN (2.ª ed.). Cold Spring Harbor Laboratory Press. CiteSeerX 10.1.1.708.7795 . ISBN 978-0-87969-561-3. Recuperado el 16 de febrero de 2024 .
- ^ Kühnlein, Alexandra; Lanzmich, Simon A.; Brun, Dieter (2 de marzo de 2021). "Las secuencias de ARNt pueden ensamblarse en un replicador". eLife . 10 . doi : 10.7554/eLife.63431 . PMC 7924937 . PMID 33648631.
- ^ Maximilian, Ludwig (3 de abril de 2021). "Resolviendo el problema del huevo y la gallina: "Un paso más cerca de la reconstrucción del origen de la vida"". SciTechDaily . Consultado el 3 de abril de 2021 .
- ^ abc Gebetsberger J, Polacek N (diciembre de 2013). "Cortar tRNA para impulsar la diversidad funcional de ncRNA". Biología del ARN . 10 (12): 1798–1806. doi :10.4161/rna.27177. PMC 3917982 . PMID 24351723.
- ^ ab Shigematsu M, Honda S, Kirino Y (2014). "ARN de transferencia como fuente de ARN funcional pequeño". Revista de biología molecular e imágenes moleculares . 1 (2): 8. PMC 4572697 . PMID 26389128.
- ^ ab Sobala A, Hutvagner G (2011). "Fragmentos derivados del ARN de transferencia: orígenes, procesamiento y funciones" (PDF) . Wiley Interdisciplinary Reviews: ARN . 2 (6): 853–862. doi :10.1002/wrna.96. hdl : 10453/18187 . PMID : 21976287. S2CID : 206554146.
- ^ Keam SP, Hutvagner G (noviembre de 2015). "Fragmentos derivados de ARNt (tRF): nuevas funciones emergentes para un ARN antiguo en la regulación de la expresión génica". Life . 5 (4): 1638–1651. Bibcode :2015Life....5.1638K. doi : 10.3390/life5041638 . PMC 4695841 . PMID 26703738.
- ^ abc Telonis AG, Loher P, Honda S, Jing Y, Palazzo J, Kirino Y, Rigoutsos I (julio de 2015). "La disección de las complejidades de los fragmentos derivados del ARNt mediante transcriptomas personalizados revela nuevas clases de fragmentos y dependencias inesperadas". Oncotarget . 6 (28): 24797–822. doi :10.18632/oncotarget.4695. PMC 4694795 . PMID 26325506.
- ^ abcd Kumar P, Anaya J, Mudunuri SB, Dutta A (octubre de 2014). "El metaanálisis de fragmentos de ARN derivados de ARNt revela que están conservados evolutivamente y se asocian con proteínas AGO para reconocer dianas específicas de ARN". BMC Biology . 12 : 78. doi : 10.1186/s12915-014-0078-0 . PMC 4203973 . PMID 25270025.
- ^ ab Honda S, Loher P, Shigematsu M, Palazzo JP, Suzuki R, Imoto I, Rigoutsos I, Kirino Y (julio de 2015). "Las mitades de ARNt dependientes de hormonas sexuales mejoran la proliferación celular en cánceres de mama y próstata". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (29): E3816–E3825. Bibcode :2015PNAS..112E3816H. doi : 10.1073/pnas.1510077112 . PMC 4517238 . PMID 26124144.
- ^ Schorn, AJ; Martienssen, R (octubre de 2018). "Tie-Break: el huésped y los retrotransposones interactúan con el ARNt". Tendencias en biología celular . 28 (10): 793–806. doi :10.1016/j.tcb.2018.05.006. PMC 6520983 . PMID 29934075.
- ^ Telonis AG, Rigoutsos I (marzo de 2018). "Disparidades raciales en la contribución de las isoformas de miRNA y los fragmentos derivados de ARNt al cáncer de mama triple negativo". Cancer Res . 78 (5): 1140–54. doi :10.1158/0008-5472.CAN-17-1947. PMC 5935570 . PMID 29229607.
- ^ Telonis AG, Loher P, Magee R, Pliatsika V, Londin E, Kirino Y, Rigoutsos I (junio de 2019). "Los fragmentos de ARNt muestran entrelazamiento con ARNm de contenido de repetición específico y tienen vínculos con disparidades". Cancer Res . 79 (12): 3034–49. doi :10.1158/0008-5472.CAN-19-0789. PMC 6571059 . PMID 30996049.
- ^ Shigematsu M, Kirino Y (2015). "ARN corto no codificante derivado de ARNt como socios interactuantes de las proteínas argonautas". Regulación genética y biología de sistemas . 9 : 27–33. doi :10.4137/GRSB.S29411. PMC 4567038 . PMID 26401098.
- ^ Emara MM, Ivanov P, Hickman T, Dawra N, Tisdale S, Kedersha N, Hu GF, Anderson P (abril de 2010). "Los ARN inducidos por estrés derivados de ARNt inducidos por angiogenina promueven el ensamblaje de gránulos de estrés inducidos por estrés". The Journal of Biological Chemistry . 285 (14): 10959–10968. doi : 10.1074/jbc.M109.077560 . PMC 2856301 . PMID 20129916.
- ^ Goodarzi H, Liu X, Nguyen HC, Zhang S, Fish L, Tavazoie SF (mayo de 2015). "Los fragmentos derivados del ARNt endógeno suprimen la progresión del cáncer de mama mediante el desplazamiento de YBX1". Cell . 161 (4): 790–802. doi :10.1016/j.cell.2015.02.053. PMC 4457382 . PMID 25957686.
- ^ Ivanov P, Emara MM, Villen J, Gygi SP, Anderson P (agosto de 2011). "Los fragmentos de ARNt inducidos por angiogenina inhiben la iniciación de la traducción". Molecular Cell . 43 (4): 613–623. doi :10.1016/j.molcel.2011.06.022. PMC 3160621 . PMID 21855800.
- ^ Selitsky SR, Baran-Gale J, Honda M, Yamane D, Masaki T, Fannin EE, Guerra B, Shirasaki T, Shimakami T, Kaneko S, Lanford RE, Lemon SM, Sethupathy P (enero de 2015). "Los ARN derivados de ARNt pequeños aumentan y son más abundantes que los microARN en la hepatitis B y C crónica". Scientific Reports . 5 : 7675. Bibcode :2015NatSR...5E7675S. doi :10.1038/srep07675. PMC 4286764 . PMID 25567797.
- ^ Sharma U, Conine CC, Shea JM, Boskovic A, Derr AG, Bing XY, Belleannee C, Kucukural A, Serra RW, Sun F, Song L, Carone BR, Ricci EP, Li XZ, Fauquier L, Moore MJ, Sullivan R, Mello CC, Garber M, Rando OJ (enero de 2016). "Biogénesis y función de fragmentos de ARNt durante la maduración y fertilización de los espermatozoides en mamíferos". Ciencia . 351 (6271): 391–396. Código Bib : 2016 Ciencia... 351.. 391S. doi : 10.1126/ciencia.aad6780. PMC 4888079 . PMID 26721685.
- ^ Casas E, Cai G, Neill JD (2015). "Caracterización de fragmentos de ARN circulantes derivados del ARN de transferencia en el ganado". Frontiers in Genetics . 6 : 271. doi : 10.3389/fgene.2015.00271 . PMC 4547532 . PMID 26379699.
- ^ Hirose Y, Ikeda KT, Noro E, Hiraoka K, Tomita M, Kanai A (julio de 2015). "Mapeo preciso y dinámica de fragmentos derivados de ARNt (tRF) en el desarrollo de Triops cancriformis (camarón renacuajo)". BMC Genetics . 16 : 83. doi : 10.1186/s12863-015-0245-5 . PMC 4501094 . PMID 26168920.
- ^ Karaiskos S, Naqvi AS, Swanson KE, Grigoriev A (septiembre de 2015). "Modulación impulsada por la edad de fragmentos derivados de ARNt en Drosophila y sus objetivos potenciales". Biology Direct . 10 : 51. doi : 10.1186/s13062-015-0081-6 . PMC 4572633 . PMID 26374501.
- ^ Pliatsika V, Loher P, Telonis AG, Rigoutsos I (agosto de 2016). "MINTbase: un marco para la exploración interactiva de fragmentos de ARNt mitocondriales y nucleares". Bioinformática . 32 (16): 2481–2489. doi :10.1093/bioinformatics/btw194. PMC 4978933 . PMID 27153631.
- ^ Pliatsika V, Loher P, Magee R, Telonis AG, Londin E, Shigematsu M, Kirino Y, Rigoutsos I (enero de 2018). "MINTbase v2.0: una base de datos completa para fragmentos derivados de ARNt que incluye fragmentos nucleares y mitocondriales de todos los proyectos del Atlas del Genoma del Cáncer". Investigación de ácidos nucleicos . 46(D1) (D1): D152–D159. doi :10.1093/nar/gkx1075. PMC 5753276 . PMID 29186503.
- ^ Kumar P, Mudunuri SB, Anaya J, Dutta A (enero de 2015). "tRFdb: una base de datos para fragmentos de ARN de transferencia". Nucleic Acids Research . 43 (número de la base de datos): D141-5. doi :10.1093/nar/gku1138. PMC 4383946 . PMID 25392422.
- ^ Varshney, U; RajBhandary, UL (febrero de 1990). "Inicio de la síntesis de proteínas a partir de un codón de terminación". Actas de la Academia Nacional de Ciencias . 87 (4): 1586–1590. Bibcode :1990PNAS...87.1586V. doi : 10.1073/pnas.87.4.1586 . PMC 53520 . PMID 2406724.
- ^ Varshney, U; Lee, CP; RajBhandary, UL (15 de marzo de 1993). "Del ARNt elongador al ARNt iniciador". Actas de la Academia Nacional de Ciencias . 90 (6): 2305–2309. Bibcode :1993PNAS...90.2305V. doi : 10.1073/pnas.90.6.2305 . PMC 46075 . PMID 8460138.
- ^ Govindan A, Miryala S, Mondal S, Varshney U (noviembre de 2018). "Desarrollo de sistemas de ensayo para la decodificación del codón ámbar en los pasos de iniciación y elongación en micobacterias". Journal of Bacteriology . 200 (22). doi :10.1128/jb.00372-18. PMC 6199473 . PMID 30181124.
- ^ Vincent RM, Wright BW, Jaschke PR (abril de 2019). "Medición de la ortogonalidad del ARNt iniciador de Amber en un organismo recodificado genómicamente". ACS Synthetic Biology . 8 (4): 675–685. doi :10.1021/acssynbio.9b00021. PMID 30856316. S2CID 75136654.
- ^ White RJ (marzo de 1997). "Regulación de las ARN polimerasas I y III por la proteína del retinoblastoma: ¿un mecanismo para el control del crecimiento?". Tendencias en Ciencias Bioquímicas . 22 (3): 77–80. doi :10.1016/S0968-0004(96)10067-0. PMID 9066256.
- ^ Sharp S, Dingermann T, Söll D (septiembre de 1982). "Las secuencias intragénicas mínimas requeridas para la promoción de la transcripción del gen ARNt eucariota". Nucleic Acids Research . 10 (18): 5393–5406. doi :10.1093/nar/10.18.5393. PMC 320884 . PMID 6924209.
- ^ ab Dieci G, Fiorino G, Castelnuovo M, Teichmann M, Pagano A (diciembre de 2007). "El transcriptoma de la ARN polimerasa III en expansión". Tendencias en Genética . 23 (12): 614–622. doi :10.1016/j.tig.2007.09.001. hdl : 11381/1706964 . PMID 17977614.
- ^ Tocchini-Valentini GD, Fruscoloni P, Tocchini-Valentini GP (diciembre de 2009). "Procesamiento de pretRNA que contiene múltiples intrones". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (48): 20246–20251. Bibcode :2009PNAS..10620246T. doi : 10.1073/pnas.0911658106 . PMC 2787110 . PMID 19910528.
- ^ Abelson J, Trotta CR, Li H (mayo de 1998). "Empalme de ARNt". Revista de química biológica . 273 (21): 12685–12688. doi : 10.1074/jbc.273.21.12685 . PMID 9582290.
- ^ ab Soma A (2014). "Genes de ARNt permutados circularmente: su expresión e implicaciones para su relevancia fisiológica y desarrollo". Frontiers in Genetics . 5 : 63. doi : 10.3389/fgene.2014.00063 . PMC 3978253 . PMID 24744771.
- ^ Frank DN, Pace NR (1998). "Ribonucleasa P: unidad y diversidad en una ribozima procesadora de ARNt". Revisión anual de bioquímica . 67 (1): 153–180. doi : 10.1146/annurev.biochem.67.1.153 . PMID 9759486.
- ^ Ceballos M, Vioque A (2007). "tRNase Z". Protein and Peptide Letters . 14 (2): 137–145. doi :10.2174/092986607779816050. PMID 17305600.
- ^ Randau L, Schröder I, Söll D (mayo de 2008). "Vida sin ARNasa P". Nature . 453 (7191): 120–123. Código Bibliográfico :2008Natur.453..120R. doi :10.1038/nature06833. PMID 18451863. S2CID 3103527.
- ^ Weiner AM (octubre de 2004). "Maduración del ARNt: polimerización del ARN sin una plantilla de ácido nucleico". Current Biology . 14 (20): R883-5. Bibcode :2004CBio...14.R883W. doi : 10.1016/j.cub.2004.09.069 . PMID 15498478.
- ^ Kutay U, Lipowsky G, Izaurralde E, Bischoff FR, Schwarzmaier P, Hartmann E, Görlich D (febrero de 1998). "Identificación de un receptor de exportación nuclear específico de ARNt". Molecular Cell . 1 (3): 359–369. doi : 10.1016/S1097-2765(00)80036-2 . PMID 9660920.
- ^ Arts GJ, Fornerod M, Mattaj IW (marzo de 1998). "Identificación de un receptor nuclear de exportación para ARNt". Current Biology . 8 (6): 305–314. Bibcode :1998CBio....8..305A. doi : 10.1016/S0960-9822(98)70130-7 . PMID 9512417. S2CID 17803674.
- ^ Arts GJ, Kuersten S, Romby P, Ehresmann B, Mattaj IW (diciembre de 1998). "El papel de exportin-t en la exportación nuclear selectiva de ARNt maduros". The EMBO Journal . 17 (24): 7430–7441. doi :10.1093/emboj/17.24.7430. PMC 1171087 . PMID 9857198.
- ^ Yoshihisa T, Yunoki-Esaki K, Ohshima C, Tanaka N, Endo T (agosto de 2003). "Posibilidad de empalme de pre-ARNt citoplasmático: la endonucleasa de empalme de ARNt de levadura se localiza principalmente en las mitocondrias". Biología molecular de la célula . 14 (8): 3266–3279. doi :10.1091/mbc.E02-11-0757. PMC 181566 . PMID 12925762.
- ^ Zamecnik, Paul Charles. "Efecto del aumento de las concentraciones de ATP en la incorporación de C14-ATP en el ARN de la fracción de pH 5". collections.countway.harvard.edu . Consultado el 28 de febrero de 2024 .
- ^ Kresge, Nicole; Simoni, Robert D.; Hill, Robert L. (7 de octubre de 2005). "El descubrimiento del ARNt por Paul C. Zamecnik". Journal of Biological Chemistry . 280 (40): e37–e39. doi : 10.1016/S0021-9258(20)79029-0 – vía www.jbc.org.
- ^ Hoagland, Mahlon B. (1959). «Ácidos nucleicos y proteínas». Scientific American . 201 (6): 55–61. ISSN 0036-8733.
- ^ Clark BF (octubre de 2006). "La estructura cristalina del ARNt" (PDF) . Journal of Biosciences . 31 (4): 453–457. doi :10.1007/BF02705184. PMID 17206065. S2CID 19558731.
- ^ Holley RW, Apgar J, Everett GA, Madison JT, Marquisee M, Merrill SH, Penswick JR, Zamir A (marzo de 1965). "Estructura de un ácido ribonucleico". Science . 147 (3664): 1462–1465. Bibcode :1965Sci...147.1462H. doi :10.1126/science.147.3664.1462. PMID 14263761. S2CID 40989800.
- ^ "Obituario". The New York Times . 4 de julio de 1991.
- ^ "El Premio Nobel de Fisiología o Medicina 1968: Robert W. Holley – Datos". Nobel Prize Outreach AB. 2022. Consultado el 18 de marzo de 2022 .
- ^ Ladner JE, Jack A, Robertus JD, Brown RS, Rhodes D, Clark BF, Klug A (noviembre de 1975). "Estructura del ARN de transferencia de fenilalanina de levadura a una resolución de 2,5 A". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 72 (11): 4414–4418. Bibcode :1975PNAS...72.4414L. doi : 10.1073/pnas.72.11.4414 . PMC 388732 . PMID 1105583.
- ^ Kim SH, Quigley GJ, Suddath FL, McPherson A, Sneden D, Kim JJ, Weinzierl J, Rich A (enero de 1973). "Estructura tridimensional del ARN de transferencia de fenilalanina de levadura: plegamiento de la cadena de polinucleótidos". Science . 179 (4070): 285–288. Bibcode :1973Sci...179..285K. doi :10.1126/science.179.4070.285. PMID 4566654. S2CID 28916938.
- ^ Zhang R, Noordam L, Ou X, Ma B, Li Y, Das P, Shi S, Liu J, Wang L, Li P, Verstegen MM, Reddy DS, van der Laan LJ, Peppelenbosch MP, Kwekkeboom J, Smits R , Pan Q (enero de 2021). "El proceso biológico de carga de lisina-ARNt es terapéuticamente abordable en el cáncer de hígado". Hígado Int . 41 (1): 206–219. doi :10.1111/liv.14692. PMC 7820958 . PMID 33084231.
- ^ Ou X, Ma B, Zhang R, Miao Z, Cheng A, Peppelenbosch MP, Pan Q (junio de 2020). "Un método de qPCR simplificado que revela la remodelación del ARNt tras la infección por el virus de la hepatitis E de genotipo 3". FEBS Letters . 594 (12): 2005–2015. doi : 10.1002/1873-3468.13764 . hdl : 1765/126038 . PMID 32133647.
Enlaces externos
- tRNAdb (versión actualizada y completamente reestructurada de la compilación de ARNt de Spritzl)
- El sorprendente papel del ARNt en el crecimiento del cáncer de mama
- El vínculo entre el ARNt y las enfermedades cardíacas y los accidentes cerebrovasculares
- GtRNAdb: Colección de ARNt identificados a partir de genomas completos
- HGNC: Nomenclatura genética de los ARNt humanos
- Molécula del mes © RCSB Protein Data Bank:
- ARN de transferencia
- Sintetasas de aminoacil-ARNt
- Factores de elongación
- Entrada de Rfam para ARNt
