Oxidación del alcohol
La oxidación de alcoholes es un conjunto de reacciones de oxidación en química orgánica que convierten los alcoholes en aldehídos , cetonas , ácidos carboxílicos y ésteres . La reacción se aplica principalmente a alcoholes primarios y secundarios. Los alcoholes secundarios forman cetonas, mientras que los alcoholes primarios forman aldehídos o ácidos carboxílicos. [1]
Se pueden utilizar una variedad de oxidantes.

Casi todas las oxidaciones a escala industrial utilizan oxígeno o aire como oxidante. [2]
Mediante una variedad de mecanismos, la eliminación de un equivalente de hidruro convierte un alcohol primario o secundario en un aldehído o cetona, respectivamente. La oxidación de alcoholes primarios a ácidos carboxílicos normalmente procede a través del aldehído correspondiente, que se transforma a través de un hidrato de aldehído ( gem -diol, R-CH(OH) 2 ) por reacción con agua. Por lo tanto, la oxidación de un alcohol primario a nivel de aldehído sin oxidación adicional al ácido carboxílico es posible realizando la reacción en ausencia de agua, de modo que no se puede formar ningún hidrato de aldehído.

A aldehídos y cetonas
En la industria
Las operaciones más grandes involucran la conversión de metanol y etanol en formaldehído y acetaldehído , que se producen en escala de millones de toneladas anualmente. Ambos procesos utilizan O2 como oxidante. La oxidación del metanol emplea un catalizador basado en óxido de molibdeno. Otros aldehídos y cetonas a gran escala se producen por autooxidación o hidrocarburos: benzaldehído a partir de tolueno , acroleína a partir de propileno , acetona a partir de cumeno , ciclohexanona a partir de ciclohexanol . [2]
Laboratorio
En los laboratorios de enseñanza y en operaciones a pequeña escala, se han desarrollado muchos reactivos para la oxidación de alcoholes secundarios a cetonas y de alcoholes primarios a aldehídos. Los alcoholes alílicos y bencílicos son especialmente propensos a la oxidación. Los aldehídos son susceptibles a la sobreoxidación a ácidos carboxílicos.
Reactivos de cromo (VI)

Los reactivos de cromo (VI) se utilizan comúnmente para estas oxidaciones. Una familia de reactivos de Cr (VI) emplea el complejo CrO 3 (piridina) 2 . [3]
- Reactivo de Sarett : solución de CrO 3 (piridina) 2 en piridina. Se popularizó para la oxidación selectiva de alcoholes primarios y secundarios a compuestos carbonílicos.
- El reactivo de Collins es una solución del mismo CrO 3 (piridina) 2 pero en diclorometano. La variante de Ratcliffe del reactivo de Collins se relaciona con los detalles de la preparación de esta solución, es decir, la adición de trióxido de cromo a una solución de piridina en cloruro de metileno. [4]
Una segunda familia de reactivos de Cr(VI) son las sales , que presentan el catión piridinio (C 5 H 5 NH + ).
- El dicromato de piridinio (PDC) es la sal de piridio del dicromato, [Cr 2 O 7 ] 2- .
- El clorocromato de piridinio (PCC) es la sal de piridinio de [CrO 3 Cl] − .
Estas sales son menos reactivas, más fáciles de manipular y más selectivas que el reactivo de Collins en las oxidaciones de alcoholes.
Los reactivos anteriores representan mejoras con respecto al antiguo reactivo de Jones , una solución de trióxido de cromo en ácido sulfúrico acuoso .
Dess-Martin y oxidaciones relacionadas
El peryodinano de Dess-Martin es un oxidante suave para la conversión de alcoholes en aldehídos o cetonas. [5] La reacción se realiza en condiciones estándar, a temperatura ambiente, con mayor frecuencia en diclorometano . La reacción tarda entre media hora y dos horas en completarse. Luego, el producto se separa del peryodinano gastado. [6] Se han desarrollado muchos oxidantes basados en yodosilo, por ejemplo, IBX .
Oxidación de Swern
La oxidación de Swern utiliza cloruro de oxalilo , dimetilsulfóxido y una base orgánica, como trietilamina .
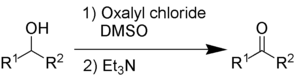
Los subproductos son sulfuro de dimetilo (Me2S ) , monóxido de carbono (CO), dióxido de carbono (CO2 ) y , cuando se utiliza trietilamina como base, cloruro de trietilamonio ( C6H15NHCl ) .
El cloruro de N-terc-butilbencenosulfinimidoilo relacionado combina tanto el azufre (IV), la base y el ácido de Lewis activador en una molécula.
Oxidación de Oppenauer
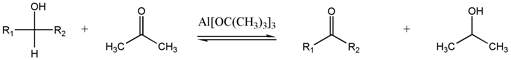
Este método poco utilizado interconvierte alcoholes y carbonilos.
Métodos de nicho
La oxidación de Ley utiliza NMO como oxidante estequiométrico con perrutenato de tetrapropilamonio como catalizador.
La oxidación con Fétizon , otro método poco utilizado, utiliza carbonato de plata soportado sobre celita. Este reactivo funciona mediante oxidación de un solo electrón por los cationes de plata.

Otro método es la oxidación catalizada por oxoamonio .
Además, se ha informado que el hipoclorito de sodio (o blanqueador doméstico) en acetona convierte eficazmente los alcoholes secundarios en presencia de alcoholes primarios (oxidación de Stevens). [7]
Los complejos de metales de transición solubles catalizan la oxidación de alcoholes en presencia de dioxígeno u otro oxidante terminal. [8]
Oxidación de dioles

La oxidación a mayor escala de los 1,2-dioles produce glioxal a partir de etilenglicol. La conversión utiliza aire o, a veces, ácido nítrico . [2]
En el laboratorio, los dioles vecinales sufren una rotura oxidativa en un enlace carbono-carbono con algunos oxidantes como el peryodato de sodio (NaIO 4 ), el (diacetoxiyodo)benceno (PhI(OAc) 2 ) [9] o el tetraacetato de plomo (Pb(OAc) 4 ), lo que da como resultado la generación de dos grupos carbonilo . La reacción también se conoce como escisión del glicol .
A los ácidos carboxílicos

En la industria
La oxidación de alcoholes primarios a ácidos carboxílicos se puede llevar a cabo utilizando una variedad de reactivos, pero el O2 / aire y el ácido nítrico dominan como oxidantes a escala comercial. Las oxidaciones a gran escala de este tipo se utilizan para la conversión de ciclohexanol solo o como una mezcla con ciclohexanona a ácido adípico . De manera similar, el ciclododecanol se convierte en ácido dicarboxílico de 12 carbonos. El 3,5,5-trimetilciclohexanol se oxida de manera similar a ácido trimetiladípico. [2]
Se han desarrollado muchos reactivos especiales para oxidaciones a escala de laboratorio de alcoholes a ácidos carboxílicos.
Permanganato de potasio
El permanganato de potasio (KMnO 4 ) oxida alcoholes primarios a ácidos carboxílicos de manera muy eficiente. Esta reacción, que fue descrita por primera vez en detalle por Fournier, [10] [11] se lleva a cabo típicamente añadiendo KMnO 4 a una solución o suspensión del alcohol en una solución acuosa alcalina. Para que la reacción se lleve a cabo de manera eficiente, el alcohol debe estar al menos parcialmente disuelto en la solución acuosa. Esto se puede facilitar mediante la adición de un codisolvente orgánico como dioxano , piridina , acetona o t -BuOH . El KMnO 4 reacciona con muchos grupos funcionales , como alcoholes secundarios, 1,2-dioles, aldehídos, alquenos, oximas, sulfuros y tioles, y dobles enlaces carbono-carbono. Por lo tanto, la selectividad es un problema.

Oxidación de Jones
El llamado reactivo de Jones , preparado a partir de trióxido de cromo (CrO 3 ) y ácido sulfúrico acuoso , oxida alcoholes a un ácido carboxílico. El protocolo proporciona con frecuencia cantidades sustanciales de ésteres . [13] Los problemas son la toxicidad y el daño ambiental del reactivo. Se han descrito variantes catalíticas, que implican el tratamiento con un exceso de ácido peryódico (H 5 IO 6 ). [14]

Oxidación en dos etapas de alcoholes a ácidos a través de aldehídos aislados
Como muchas de las condiciones antes mencionadas para la oxidación de alcoholes primarios a ácidos son duras y no son compatibles con los grupos protectores comunes, los químicos orgánicos suelen utilizar un procedimiento de dos pasos para la oxidación a ácidos. El alcohol se oxida a un aldehído utilizando uno de los muchos procedimientos anteriores. Esta secuencia se utiliza a menudo en la síntesis de productos naturales, como en su síntesis de platencina. [16]
Métodos y reactivos de nicho
El tetróxido de rutenio es un agente agresivo, poco utilizado, que permite condiciones de reacción suaves.
Oxidación de Heyns. [17]
El uso de cloritos como oxidantes terminales junto con hipocloritos y TEMPO da lugar a ácidos carboxílicos sin productos secundarios de cloración. [18] La reacción se lleva a cabo normalmente en dos pasos en el mismo recipiente: se efectúa una oxidación parcial con TEMPO e hipoclorito, y luego se añade clorito para completar la oxidación. Solo se observa la oxidación primaria del alcohol. Junto con la dihidroxilación de Sharpless, este método se puede utilizar para generar α-hidroxiácidos enantiopuros. [19]
La oxidación de Pinnick utiliza clorito de sodio . [20]
Referencias
- ^ Burton, George y otros (2000). Química avanzada de Salters: Química (2.ª ed.) . Heinemann. ISBN 0-435-63120-9
- ^ abcd Teles, J. Henrique; Hermans, Ive; Franz, Gerhard; Sheldon, Roger A. (2015). "Oxidación". Ullmann's Encyclopedia of Industrial Chemistry . págs. 1–103. doi :10.1002/14356007.a18_261.pub2. ISBN 978-3-527-30385-4.
- ^ "Reactivos a base de cromo". Oxidación de alcoholes a aldehídos y cetonas . Reacciones básicas en síntesis orgánica. 2006. págs. 1–95. doi :10.1007/0-387-25725-X_1. ISBN 0-387-23607-4.
- ^ JC Collins, WW Hess (1972). "Aldehídos a partir de alcoholes primarios por oxidación con trióxido de cromo: heptanal". Organic Syntheses . 52 : 5. doi :10.15227/orgsyn.052.0005.
- ^ Dess, DB; Martin, JC J. Am. Chem. Soc. 1991 , 113 , 7277–87.
- ^ JS Yadav, et al. "Líquidos iónicos reciclables de segunda generación como solventes ecológicos para la oxidación de alcoholes con reactivos de yodo hipervalente", Tetrahedron , 2004 , 60 , 2131–35
- ^ Stevens R, Chapman KT, Weller HN (1980). "Procedimiento conveniente y económico para la oxidación de alcoholes secundarios a cetonas". Journal of Organic Chemistry . 45 (10): 2030–2032. doi :10.1021/jo01298a066.
- ^ Parmeggiani, Camilla; Cardona, Francesca (3 de enero de 2012). "Catalizadores basados en metales de transición en la oxidación aeróbica de alcoholes". Química verde . 14 (3): 547–564. doi :10.1039/C2GC16344F. ISSN 1463-9270.
- ^ Nicolaou KC, Adsool VA, Hale CR (abril de 2010). "Un procedimiento conveniente para la escisión oxidativa de enlaces olefínicos con PhI(OAc)2, NMO y OsO4 catalítico". Organic Letters . 12 (7): 1552–5. doi :10.1021/ol100290a. PMC 2848477 . PMID 20192259.
- ^ Fournier, HM (1907). "Transformación de alcoholes primarios saturès en ácidos monobasiques correspondientes". CR Acad. Ciencia. : 331.
- ^ Fournier, HM (20 de julio de 1909). "Sur la préparation des acides gras et de leurs anhydres". Toro. Soc. Chim. P. : 920.
- ^ Ciufolini, MA; Swaminathan, S. (1989). "Síntesis de un segmento depsipeptídico modelo de luzopeptinas (BBM 928), potentes antibióticos antitumorales y antirretrovirales". Tetrahedron Lett. 30 (23): 3027. doi :10.1016/S0040-4039(00)99393-6.
- ^ "Reactivos a base de cromo". Oxidación de alcoholes a aldehídos y cetonas . Reacciones básicas en síntesis orgánica. 2006. págs. 1–95. doi :10.1007/0-387-25725-X_1. ISBN 0-387-23607-4.
- ^ Canción, ZJ; Zhao, M.; Desmond, R.; Divino, P.; Tschaen, DM; Tillyer, R.; Frey, L.; Heid, R.; Xu, F.; fomentar, B.; Li, J.; Escariador, R.; Volante, R.; Grabowski, EJJ; Muñecas, UH; Reider, PJ (1999). "Síntesis asimétrica práctica de un antagonista del receptor de endotelina". J. Org. Química. 64 (26): 9658. doi : 10.1021/jo991292t.
- ^ Crimmins, MT y DeBaillie, AC (2006). "Síntesis total enantioselectiva de bistramida A". J. Am. Chem. Soc. 128 (15): 4936–7. doi :10.1021/ja057686l. PMC 2546575. PMID 16608311 .
- ^ Nicolaou KC; Scott Tria G.; Edmonds DJ (2008). "Síntesis total de platencina". Angew. Chem. 120 (9): 1804. doi :10.1002/ange.200800066.
- ^ Marcos Fernández; Gabriel Tojo (2006). Oxidación de alcoholes primarios a ácidos carboxílicos: una guía para la práctica común actual (Reacciones básicas en síntesis orgánica) . Berlín: Springer. ISBN 0-387-35431-X.
- ^ Canción, ZJ; Zhao, M.; Desmond, R.; Divino, P.; Tschaen, DM; Tillyer, R.; Frey, L.; Heid, R.; Xu, F.; fomentar, B.; Li, J.; Escariador, R.; Volante, R.; Grabowski, EJJ; Muñecas, UH; Reider, PJ; Okada, S.; Kato, Y.; Mano, EJ Org. Química. 1999 , 64 , 9658.
- ^ Sin filo, KB; Amberg, W.; Bennani, YL; Crispino, GA; Hartung, J.; Jeong, KS; Kwong, HL; Morikawa, K.; Wang, ZM; Xu, D.; Zhang, XL J. Org. Química. 1992 , 57 , 2768.
- ^ Bal BS; Childers, Jr. WE; Pinnick HW (1981). "Oxidación de aldehídos α,β-insaturados". Tetrahedron (resumen). 37 (11): 2091. doi :10.1016/S0040-4020(01)97963-3.