Anemia drepanocítica
| Anemia drepanocítica | |
|---|---|
| Otros nombres | Enfermedad de células falciformes; drepanocitosis (fecha de caducidad) |
 | |
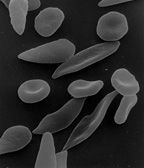
| La figura (A) muestra glóbulos rojos normales que fluyen libremente a través de un vaso sanguíneo. El recuadro muestra una sección transversal de un glóbulo rojo normal con hemoglobina normal . La figura (B) muestra glóbulos rojos falciformes anormales que se adhieren al punto de ramificación de un vaso sanguíneo. La imagen del recuadro muestra una sección transversal de una célula falciforme con largas hebras de hemoglobina falciforme (HbS) polimerizada que se estiran y distorsionan la forma de la célula para que parezca una luna creciente. | |
| Especialidad | Hematología , genética médica |
| Síntomas | Ataques de dolor, anemia , hinchazón en manos y pies , infecciones bacterianas , accidente cerebrovascular [1] |
| Complicaciones | Dolor crónico , accidente cerebrovascular , necrosis ósea aséptica , cálculos biliares , úlceras en las piernas , priapismo , hipertensión pulmonar , problemas de visión, problemas renales [2] |
| Inicio habitual | 5-6 meses de edad [1] |
| Causas | Genético, mutación homocigótica en el gen de la hemoglobina S. [3] |
| Método de diagnóstico | Análisis de sangre [4] |
| Tratamiento | Vacunación , antibióticos , ingesta elevada de líquidos, suplementación con ácido fólico , analgésicos , transfusiones de sangre [5] [6] |
| Pronóstico | Esperanza de vida 40-60 años (mundo desarrollado) [2] |
| Frecuencia | 7,7 millones (2021) [7] |
| Fallecidos | 34.000 pa (un factor que contribuye a otros 376.000 pa) [7] |
La enfermedad de células falciformes ( ECF ), también llamada simplemente anemia falciforme , es un grupo de trastornos sanguíneos relacionados con la hemoglobina que generalmente se heredan . [2] El tipo más común se conoce como anemia de células falciformes . [2] La anemia de células falciformes resulta en una anomalía en la hemoglobina, la proteína transportadora de oxígeno que se encuentra en los glóbulos rojos . [2] Esto lleva a que los glóbulos rojos adopten una forma anormal similar a una hoz en determinadas circunstancias; con esta forma, no pueden deformarse al pasar por los capilares , lo que causa bloqueos. [2] Los problemas de la enfermedad de células falciformes suelen comenzar alrededor de los 5 a 6 meses de edad. [1] Pueden desarrollarse varios problemas de salud, como ataques de dolor (conocidos como crisis de células falciformes ) en las articulaciones, anemia , hinchazón en las manos y los pies, infecciones bacterianas , mareos [8] y accidente cerebrovascular . [1] La probabilidad de síntomas graves, incluido el dolor a largo plazo, aumenta con la edad. [2] Sin tratamiento, las personas con anemia falciforme rara vez llegan a la edad adulta, pero con una buena atención médica, la expectativa de vida media es de entre 58 y 66 años. [9] [10] Todos los órganos principales se ven afectados por la enfermedad de células falciformes. El hígado, el corazón, los riñones, la vesícula biliar, los ojos, los huesos y las articulaciones también pueden sufrir daños debido a las funciones anormales de las células falciformes y su incapacidad para fluir correctamente a través de los vasos sanguíneos pequeños. [11]
La enfermedad de células falciformes se produce cuando una persona hereda dos copias anormales del gen de la β-globina que produce la hemoglobina, una de cada progenitor. [3] Existen varios subtipos, dependiendo de la mutación exacta en cada gen de la hemoglobina. [2] Un ataque puede ser desencadenado por cambios de temperatura, estrés, deshidratación y gran altitud. [1] Una persona con una sola copia anormal no suele tener síntomas y se dice que tiene el rasgo de células falciformes . [3] A estas personas también se las conoce como portadoras . [5] El diagnóstico se realiza mediante un análisis de sangre , y algunos países realizan pruebas a todos los bebés al nacer para detectar la enfermedad. [4] El diagnóstico también es posible durante el embarazo. [4]
El cuidado de las personas con anemia de células falciformes puede incluir la prevención de infecciones con vacunas y antibióticos , una ingesta elevada de líquidos, suplementos de ácido fólico y analgésicos . [5] [6] Otras medidas pueden incluir la transfusión de sangre y el medicamento hidroxicarbamida (hidroxiurea). [6] En 2023, se aprobaron nuevas terapias genéticas que implican la modificación genética y el reemplazo de células madre formadoras de sangre en la médula ósea. [12] [13]
A partir de 2021 [actualizar], se estima que la SCD afecta a alrededor de 7,7 millones de personas en todo el mundo, causando directamente 34.000 muertes anuales y un factor contribuyente a otras 376.000 muertes. [7] Se cree que alrededor del 80% de los casos de enfermedad de células falciformes ocurren en África subsahariana . [14] También ocurre en menor grado en partes de la India , el sur de Europa , Asia occidental , el norte de África y entre personas de origen africano (subsaharianos) que viven en otras partes del mundo. [15] La condición fue descrita por primera vez en la literatura médica por el médico estadounidense James B. Herrick en 1910. [16] [17] En 1949, su transmisión genética fue determinada por EA Beet y JV Neel. [17] En 1954, se estableció que los portadores del gen anormal están protegidos en cierto grado contra la malaria . [17]
Signos y síntomas
_(14768428942).jpg/440px-The_diseases_of_infancy_and_childhood_(1920)_(14768428942).jpg)


Los síntomas de la enfermedad de células falciformes suelen aparecer en la primera infancia. La gravedad de los síntomas puede variar de una persona a otra, al igual que la frecuencia de los episodios de crisis. [18] [14] La enfermedad de células falciformes puede provocar diversas complicaciones agudas y crónicas , varias de las cuales tienen una alta tasa de mortalidad. [19]
Primeros acontecimientos
Cuando la anemia falciforme se presenta durante el primer año de vida, el problema más común es un episodio de dolor e hinchazón en las manos y los pies del niño, conocido como dactilitis o "síndrome mano-pie". La palidez , la ictericia y la fatiga también pueden ser signos tempranos debido a la anemia resultante de la enfermedad de células falciformes. [20]
Entre los niños mayores de 2 años, la presentación inicial más frecuente es un evento doloroso de tipo generalizado o variable, y una versión ligeramente menos común aparece como un evento de dolor torácico agudo. La dactilitis rara vez o nunca ocurre en niños mayores de 2 años. [20] [21]
Eventos críticos
Crisis vaso-oclusiva
También denominada "crisis de células falciformes" o "crisis drepanocítica", la crisis vasooclusiva (VOC) se manifiesta principalmente como dolor extremo, que afecta con mayor frecuencia al pecho, la espalda, las piernas y/o los brazos. [22] La causa subyacente son los glóbulos rojos en forma de hoz que obstruyen los capilares y restringen el flujo sanguíneo a un órgano, lo que resulta en isquemia , dolor , necrosis y, a menudo, daño orgánico. La frecuencia, gravedad y duración de estas crisis varían considerablemente. Las crisis dolorosas se tratan con hidratación, analgésicos y transfusión de sangre ; el manejo del dolor requiere la administración de fármacos opioides a intervalos regulares hasta que la crisis se haya resuelto. Para las crisis más leves, un subgrupo de pacientes se maneja con medicamentos antiinflamatorios no esteroides como diclofenaco o naproxeno . Para las crisis más graves, la mayoría de los pacientes requieren tratamiento hospitalario para opioides intravenosos; los dispositivos de analgesia controlados por el paciente se utilizan comúnmente en este entorno. Las crisis vasooclusivas que afectan órganos como el pene [23] o los pulmones se consideran una emergencia y se tratan con transfusiones de glóbulos rojos. Se recomienda la espirometría incentivada , una técnica para estimular la respiración profunda y minimizar el desarrollo de atelectasias . [24]
Aunque no siempre está claro qué desencadena una VOC, cualquier cosa que provoque la constricción de los vasos sanguíneos es un desencadenante potencial. Esto incluye el estrés físico o mental , el frío y la deshidratación . [25] " Después de que la HbS se desoxigena en los capilares, lleva algún tiempo (segundos) para la polimerización de la HbS y la posterior transformación de flexible a rígida. Si el tiempo de tránsito de los glóbulos rojos a través de la microvasculatura es más largo que el tiempo de polimerización, los glóbulos rojos falciformes se alojarán en la microvasculatura " . [26]
Crisis de secuestro esplénico
El bazo es especialmente propenso a sufrir daños en la SCD debido a su papel como filtro de sangre. Una crisis de secuestro esplénico, también conocida como crisis del bazo, es una emergencia médica que ocurre cuando los glóbulos rojos falciformes bloquean el mecanismo de filtrado del bazo , lo que hace que el bazo se hinche y se llene de sangre. La acumulación de glóbulos rojos en el bazo da como resultado una caída repentina de la hemoglobina circulante y una anemia potencialmente mortal. Los síntomas incluyen dolor en el lado izquierdo, bazo hinchado (que se puede detectar mediante palpación ), fatiga, mareos, irritabilidad, ritmo cardíaco rápido o piel pálida. Afecta más comúnmente a niños pequeños, la edad media de la primera aparición es de 1,4 años. A la edad de 5 años, los casos repetidos de secuestro causan cicatrices y, finalmente, atrofia del bazo . [27] [28] [29]
El tratamiento es de apoyo, con transfusión de sangre si los niveles de hemoglobina bajan demasiado. Puede ser necesaria una esplenectomía total o parcial . [30] Las consecuencias a largo plazo de la pérdida de la función del bazo son una mayor susceptibilidad a las infecciones bacterianas . [29]
Síndrome torácico agudo
El síndrome torácico agudo es causado por una VOC que afecta los pulmones, posiblemente desencadenada por una infección o por émbolos que han circulado desde otros órganos. Los síntomas incluyen sibilancia, dolor torácico, fiebre, infiltrado pulmonar (visible en la radiografía) e hipoxemia . Después de la crisis drepanocítica (ver arriba), es la segunda causa más común de hospitalización y representa aproximadamente el 25% de las muertes en pacientes con drepanocitosis. La mayoría de los casos se presentan con crisis vasooclusivas y luego desarrollan un síndrome torácico agudo. [31] [32]
Crisis aplásica
Las crisis aplásicas son casos de un empeoramiento agudo de la anemia de base del paciente, que produce palidez , frecuencia cardíaca rápida y fatiga. Esta crisis normalmente es desencadenada por el parvovirus B19 , que afecta directamente la producción de glóbulos rojos al invadir los precursores de los glóbulos rojos y multiplicarse en ellos y destruirlos. [33] La infección por parvovirus [34] impide casi por completo la producción de glóbulos rojos durante dos o tres días (aplasia de glóbulos rojos). En individuos normales, esto tiene pocas consecuencias, pero la vida acortada de los glóbulos rojos de los pacientes con SCD da lugar a una situación abrupta y potencialmente mortal. El recuento de reticulocitos cae drásticamente durante la enfermedad (lo que provoca reticulocitopenia ), la producción de glóbulos rojos disminuye y la rápida destrucción de los glóbulos rojos existentes conduce a una anemia aguda y grave. Esta crisis tarda entre cuatro y siete días en resolverse. La mayoría de los pacientes pueden tratarse con medidas de apoyo; algunos necesitan una transfusión de sangre. [35]
Complicaciones
La anemia de células falciformes puede provocar diversas complicaciones, entre ellas: [36]
- El riesgo de infecciones bacterianas graves aumenta debido a la pérdida de tejido funcional del bazo. Estas infecciones suelen estar causadas por bacterias como Streptococcus pneumoniae y Haemophilus influenzae . La profilaxis diaria con penicilina es el tratamiento más utilizado durante la infancia, y algunos hematólogos continúan el tratamiento indefinidamente. Los pacientes se benefician de la vacunación sistemática contra S. pneumoniae . [37]
- El accidente cerebrovascular puede ser consecuencia de un bloqueo de los vasos sanguíneos del cerebro, lo que provoca entumecimiento, confusión o debilidad que pueden ser duraderos. El accidente cerebrovascular asintomático no causa síntomas inmediatos, pero se asocia a daño cerebral. El accidente cerebrovascular asintomático es probablemente cinco veces más común que el accidente cerebrovascular sintomático. Alrededor del 10 al 15 % de los niños con ECF tienen accidentes cerebrovasculares, y los accidentes cerebrovasculares asintomáticos predominan en los pacientes más jóvenes. [36] [38] [39]
- La colelitiasis (cálculos biliares) y la colecistitis pueden ser resultado de la producción excesiva de bilirrubina y su precipitación debido a una hemólisis prolongada . [40]
- La necrosis avascular ( necrosis ósea aséptica ) de la cadera y otras articulaciones importantes puede ocurrir como resultado de la isquemia. [41]
- Priapismo e infarto del pene [42]
- Osteomielitis (infección ósea bacteriana) como resultado de daño al bazo, comúnmente causada por Staphylococcus aureus o especies de Salmonella . [8]
- La insuficiencia renal crónica debida a nefropatía falciforme se manifiesta con hipertensión , pérdida de proteínas en la orina , pérdida de glóbulos rojos en la orina y empeoramiento de la anemia. Si progresa a insuficiencia renal terminal , tiene un mal pronóstico. [43] [44]
- Las úlceras en las piernas son relativamente comunes en la ECF y pueden ser incapacitantes. [45]
- En los ojos, la retinopatía de fondo, la retinopatía proliferativa, las hemorragias vítreas y los desprendimientos de retina pueden provocar ceguera. [46] Se recomiendan controles oculares anuales regulares.
- Durante el embarazo, restricción del crecimiento intrauterino , aborto espontáneo y preeclampsia.
- Dolor crónico: Incluso en ausencia de dolor vasooclusivo agudo, muchos pacientes presentan dolor crónico no informado. [47]
- La hipertensión pulmonar (aumento de la presión en la arteria pulmonar ) puede provocar tensión en el ventrículo derecho y riesgo de insuficiencia cardíaca ; los síntomas típicos son dificultad para respirar, disminución de la tolerancia al ejercicio y episodios de síncope . [48] El 21% de los niños y el 30% de los adultos tienen evidencia de hipertensión pulmonar cuando se les realiza la prueba; esto se asocia con una distancia de caminata reducida y un aumento de la mortalidad. [49]
- Miocardiopatía y disfunción diastólica del ventrículo izquierdo causadas por fibrosis o cicatrización de los tejidos cardíacos. [50] [51] Esto también contribuye a la hipertensión pulmonar, disminución de la capacidad de ejercicio y arritmias . [52]
Genética


La hemoglobina es una proteína transportadora de oxígeno que se encuentra en los eritrocitos y que transporta el oxígeno desde los pulmones (o en el feto, desde la placenta) hasta los tejidos. Cada molécula de hemoglobina está compuesta por 4 subunidades proteicas, denominadas globinas . [53] Normalmente, los seres humanos tenemos:
- Hemoglobina F (hemoglobina fetal, HbF), que consta de dos cadenas alfa (α-globina) y dos cadenas gamma (γ-globina). Esta predomina durante el desarrollo del feto y hasta aproximadamente las 6 semanas de edad. Posteriormente, la hemoglobina A predomina durante toda la vida. [54]
- Hemoglobina A (hemoglobina del adulto, HbA), que consta de dos cadenas alfa y dos cadenas beta (β-globina). Es el tetrámero de hemoglobina humana más común y representa más del 97 % de la hemoglobina total de los glóbulos rojos en adultos normales. [55]
- La hemoglobina A2 (HbA2) es una segunda forma de hemoglobina adulta y está compuesta por dos cadenas alfa y dos delta ( δ-globina ). Esta hemoglobina normalmente constituye entre el 1 y el 3 % de la hemoglobina en adultos. [55]
La β-globina está codificada por el gen HBB en el cromosoma humano 11 ; las mutaciones en este gen producen variantes de la proteína que están implicadas en la hemoglobina s anormal . La mutación que causa la enfermedad de células falciformes da como resultado una hemoglobina anormal conocida como hemoglobina S (HbS), que reemplaza a la HbA en adultos. [18] El genoma humano contiene un par de genes para la β-globina; en las personas con enfermedad de células falciformes, ambos genes están afectados y las células eritropoyéticas en la médula ósea solo crearán HbS. En las personas con rasgo de células falciformes , solo un gen es anormal; la eritropoyesis genera una mezcla de HbA normal y HbS falciforme. La persona tiene muy pocos o ningún síntoma de enfermedad de células falciformes, pero es portadora del gen y puede transmitirlo a sus hijos. [56]

La enfermedad de células falciformes tiene un patrón autosómico recesivo de herencia de los padres. [57] Ambas copias del gen afectado deben tener la misma mutación ( condición homocigótica ) para que una persona se vea afectada por un trastorno autosómico recesivo. Una persona afectada generalmente tiene padres no afectados que son portadores de un gen mutado y un gen normal ( condición heterocigótica ) y se denominan portadores genéticos ; es posible que no presenten ningún síntoma. [58] Cuando ambos padres tienen el rasgo de células falciformes, cualquier niño tiene un 25% de probabilidades de padecer enfermedad de células falciformes; un 25% de probabilidades de no tener alelos de células falciformes y un 50% de probabilidades de padecer la condición heterocigótica (ver diagrama). [59]
Existen varios haplotipos diferentes de la mutación del gen de la anemia falciforme, lo que indica que probablemente surgió de manera espontánea en diferentes áreas geográficas. Las variantes se conocen como Camerún, Senegal, Benín, Bantú y Arabia Saudita-Asiática. [60] Estas son clínicamente importantes porque algunas están asociadas con niveles más altos de HbF, por ejemplo, las variantes de Senegal y Arabia Saudita-Asiática, y tienden a causar una enfermedad más leve. [61]

El defecto genético es una mutación de un solo nucleótido del gen de la β-globina, que da como resultado que el glutamato sea sustituido por valina en la posición 6 de la cadena de la β-globina. [62] La hemoglobina S con esta mutación se conoce como HbS, a diferencia de la HbA adulta normal. En condiciones de concentración normal de oxígeno , esto no causa efectos aparentes en la estructura de la hemoglobina o su capacidad para transportar oxígeno por el cuerpo. Sin embargo, la forma desoxi de la HbS tiene un parche hidrófobo expuesto que hace que las moléculas de HbS se unan para formar largas cadenas inflexibles. En condiciones de baja concentración de oxígeno en el torrente sanguíneo, como ejercicio, estrés, altitud o deshidratación, la polimerización de la HbS forma precipitados fibrosos dentro del glóbulo rojo. [63] En personas homocigotas para la mutación de la anemia falciforme, la presencia de polímeros de cadena larga de HbS distorsiona la forma del glóbulo rojo de una forma suave, similar a una rosquilla , a la forma de hoz, haciéndolo frágil y susceptible a bloquearse o romperse dentro de los capilares . [62]
En las personas heterocigotas para la HbS ( portadoras de la enfermedad de células falciformes), los problemas de polimerización son menores porque el alelo normal puede producir la mitad de la hemoglobina. Los portadores de la enfermedad de células falciformes presentan síntomas sólo si se les priva de oxígeno (por ejemplo, en la altura) o cuando están gravemente deshidratados . [64]
Malaria



La anemia falciforme es más frecuente en áreas que históricamente han estado asociadas con la malaria endémica . El rasgo drepanocítico proporciona a los portadores una ventaja de supervivencia contra la mortalidad por malaria en comparación con las personas con hemoglobina normal en regiones donde la malaria es endémica. [65] [66]
La infección por el parásito de la malaria afecta a los portadores asintomáticos del gen de la hemoglobina anormal de forma diferente a los pacientes con anemia falciforme completa. Los portadores (heterocigotos para el gen) que contraen malaria tienen menos probabilidades de sufrir síntomas graves que las personas con hemoglobina normal. Los pacientes con anemia falciforme (homocigotos para el gen) tienen, de manera similar, menos probabilidades de infectarse con malaria; sin embargo, una vez infectados, tienen más probabilidades de desarrollar anemia grave y potencialmente mortal. [67] [68]
El impacto de la anemia falciforme en la inmunidad a la malaria ilustra algunas compensaciones evolutivas que se han producido debido a la malaria endémica. Aunque la menor esperanza de vida de quienes tienen la condición homocigótica tendería a desfavorecer la supervivencia del rasgo, este se conserva en las regiones propensas a la malaria debido a los beneficios que proporciona la forma heterocigótica; un ejemplo de selección natural. [69]
Debido a la ventaja adaptativa del heterocigoto, la enfermedad aún prevalece, especialmente entre personas con ascendencia reciente en áreas afectadas por la malaria, como África , el Mediterráneo , India y Medio Oriente . [70] La malaria fue históricamente endémica del sur de Europa, pero fue declarada erradicada a mediados del siglo XX, con la excepción de raros casos esporádicos. [71]
El parásito de la malaria tiene un ciclo de vida complejo y pasa parte de él en los glóbulos rojos. Hay dos mecanismos que protegen a los portadores de la enfermedad de células falciformes de la malaria. Uno es que el parásito no puede crecer ni reproducirse en los glóbulos rojos del portador; otro es que los glóbulos rojos del portador muestran signos de daño cuando se infectan y son detectados y destruidos a medida que pasan por el bazo. [72] [73]
Fisiopatología
En condiciones de baja concentración de oxígeno, la HBS se polimeriza para formar largas hebras dentro del glóbulo rojo (RBC). Estas hebras distorsionan la forma de la célula y después de unos segundos hacen que adopte una forma anormal e inflexible similar a una hoz. Este proceso se invierte cuando aumenta la concentración de oxígeno y las células recuperan su forma normal de disco bicóncavo. Si la drepanocitosis se produce en el sistema venoso, después de que la sangre haya pasado por los capilares, no tiene efecto sobre los órganos y los glóbulos rojos pueden desdoblarse cuando se oxigenan en los pulmones. El cambio repetido entre la forma falciforme y la normal daña la membrana del glóbulo rojo, de modo que finalmente se vuelve drepanocitosis permanente. [74] [75] [76]
Los glóbulos rojos normales son bastante elásticos y tienen forma de disco bicóncavo, lo que les permite deformarse para pasar a través de los capilares. En la enfermedad de células falciformes, la baja tensión de oxígeno promueve la drepanocitosis de los glóbulos rojos y los episodios repetidos de drepanocitosis dañan la membrana celular y disminuyen la elasticidad de la célula. Estas células no vuelven a su forma normal cuando se restablece la tensión de oxígeno normal. Como consecuencia, estas células sanguíneas rígidas no pueden deformarse al pasar a través de capilares estrechos, lo que conduce a la oclusión de los vasos y a la isquemia . [26]
Las células que se han vuelto falciformes se detectan cuando pasan a través del bazo y se destruyen. En los niños pequeños con anemia falciforme, la acumulación de células falciformes en el bazo puede provocar una crisis de secuestro esplénico. En este caso, el bazo se llena de sangre, lo que priva a la circulación general de células sanguíneas y provoca una anemia grave. Al principio, el bazo se hincha notablemente, pero la falta de un flujo sanguíneo saludable a través del órgano culmina en la cicatrización de los tejidos del bazo y, finalmente, la muerte del órgano, generalmente antes de los 5 años de edad. [75] [27]
La anemia propiamente dicha es causada por la hemólisis , la destrucción de los glóbulos rojos, debido a su forma. Aunque la médula ósea intenta compensar esto creando nuevos glóbulos rojos, no alcanza el ritmo de destrucción. Los glóbulos rojos sanos suelen funcionar durante 90 a 120 días, pero los drepanocitos sólo duran entre 10 y 20 días. [77] [75]
La rápida descomposición de los glóbulos rojos en la anemia drepanocítica produce la liberación de hemo libre en el torrente sanguíneo, lo que supera la capacidad de los mecanismos de protección del organismo. Aunque el hemo es un componente esencial de la hemoglobina, también es una potente molécula oxidativa. El hemo libre también es una alarma , una señal de daño tisular o infección, que desencadena respuestas defensivas en el organismo y aumenta el riesgo de inflamación y eventos vasooclusivos. [78] [79]
Diagnóstico
En la HbS, el hemograma completo revela niveles de hemoglobina en el rango de 6-8 g/dl con un alto recuento de reticulocitos (ya que la médula ósea compensa la destrucción de las células falciformes produciendo más glóbulos rojos). En otras formas de enfermedad de células falciformes, los niveles de Hb tienden a ser más altos. Un frotis de sangre puede mostrar características de hipoesplenismo ( células diana y cuerpos de Howell-Jolly ). [80]
La drepanocitosis de los glóbulos rojos en un frotis de sangre se puede inducir mediante la adición de metabisulfito de sodio . La presencia de hemoglobina drepanocítica también se puede demostrar con la "prueba de solubilidad drepanocítica" (también llamada "sickledex"). [81] Una mezcla de hemoglobina S (HbS) en una solución reductora (como el ditionito de sodio ) da un aspecto turbio, mientras que la Hb normal da una solución clara. [82]
Las formas anormales de hemoglobina se pueden detectar mediante electroforesis de hemoglobina , una forma de electroforesis en gel en la que los distintos tipos de hemoglobina se mueven a distintas velocidades. La hemoglobina falciforme (HgbS) y la hemoglobina C con drepanocitosis (HgbSC), las dos formas más comunes, se pueden identificar a partir de ahí. El diagnóstico se puede confirmar con cromatografía líquida de alto rendimiento . Rara vez se realizan pruebas genéticas , ya que otras investigaciones son altamente específicas para HbS y HbC. [83]
Asesoramiento genético
Las personas que son portadoras conocidas de la enfermedad o que corren el riesgo de tener un hijo con anemia de células falciformes pueden someterse a asesoramiento genético . Los asesores genéticos trabajan con las familias para discutir los beneficios, las limitaciones y la logística de las opciones de pruebas genéticas, así como el posible impacto de las pruebas y los resultados de las pruebas en el individuo. [84] [85] Durante el embarazo, las pruebas genéticas se pueden realizar en una muestra de sangre del feto o en una muestra de líquido amniótico . Durante el primer trimestre del embarazo, la toma de muestras de vellosidades coriónicas (CVS) también es una técnica utilizada para el diagnóstico prenatal de la anemia de células falciformes. [86] Dado que tomar una muestra de sangre de un feto tiene mayores riesgos, normalmente se utiliza esta última prueba. El cribado neonatal, a veces denominado cribado del recién nacido , no solo proporciona un método de detección temprana para las personas con enfermedad de células falciformes, sino que también permite la identificación de los grupos de personas que son portadoras del rasgo de células falciformes. [87] Los asesores genéticos pueden ayudar a las personas de color y a sus familias a abordar las disparidades raciales y étnicas que existen en la atención sanitaria. [88]
Gestión
El tratamiento implica una serie de medidas. Si bien históricamente se ha recomendado que las personas con anemia falciforme eviten el ejercicio, el ejercicio regular puede ser beneficioso para las personas. [89] Se debe evitar la deshidratación. [90] Se recomienda una dieta rica en calcio [91], pero la eficacia de los suplementos de vitamina D sigue siendo incierta. [92] La FDA respaldó el uso de L-glutamina a partir de los cinco años, ya que disminuye las complicaciones. [93]
Ácido fólico y penicilina
Desde el nacimiento hasta los cinco años de edad, se recomienda administrar penicilina diariamente, debido al sistema inmunológico inmaduro que los hace más propensos a las enfermedades de la primera infancia. [94] La OMS había recomendado anteriormente la suplementación dietética con ácido fólico . [5] Una revisión Cochrane de 2016 sobre su uso encontró que "el efecto de la suplementación sobre la anemia y cualquier síntoma de anemia sigue sin estar claro" debido a la falta de evidencia médica. [95]
Prevención de la malaria

El efecto protector del rasgo drepanocítico no se aplica a las personas con enfermedad de células falciformes; de hecho, son más vulnerables a la malaria, ya que la causa más común de crisis dolorosas en los países palúdicos es la infección por malaria. Las personas con enfermedad de células falciformes que viven en países palúdicos deben recibir medicación de por vida para la prevención . [96]
Crisis vaso-oclusiva
La mayoría de las personas con enfermedad de células falciformes tienen episodios intensamente dolorosos llamados crisis vasooclusivas. Sin embargo, la frecuencia, gravedad y duración de estas crisis varían enormemente. Las crisis dolorosas se tratan sintomáticamente con analgésicos ; el manejo del dolor requiere la administración de fármacos opioides a intervalos regulares hasta que la crisis se haya resuelto. Para las crisis más leves, un subgrupo de pacientes se maneja con AINE (como diclofenaco o naproxeno ). Para las crisis más graves, la mayoría de los pacientes requieren tratamiento hospitalario para opioides intravenosos. [97]
Los líquidos adicionales, administrados por vía oral o intravenosa, son una parte rutinaria del tratamiento de las crisis vasooclusivas, pero la evidencia sobre la vía, la cantidad y el tipo de reemplazo de líquidos más efectivos sigue siendo incierta. [98]
En 2019, Crizanlizumab , un anticuerpo monoclonal dirigido contra la p-selectina, fue aprobado en los Estados Unidos para reducir la frecuencia de crisis vasooclusivas en personas de 16 años o más. [99]
Prevención de accidentes cerebrovasculares
La ecografía Doppler transcraneal (TCD) puede detectar a niños con anemia falciforme que tienen un alto riesgo de sufrir un accidente cerebrovascular. La prueba de ultrasonido detecta los vasos sanguíneos parcialmente obstruidos por la anemia falciforme midiendo la velocidad de la sangre que ingresa al cerebro, ya que la velocidad del flujo sanguíneo está inversamente relacionada con el diámetro arterial y, en consecuencia, la alta velocidad del flujo sanguíneo se correlaciona con el estrechamiento de las arterias. [100] En 2002, el Instituto Nacional de Salud (NIH) emitió una declaración recomendando que los niños con anemia falciforme se sometan a la ecografía Doppler transcraneal anualmente, y en 2014, un panel de expertos convocado por el NIH emitió pautas que reiteraban la misma recomendación. Una revisión de registros médicos, realizada por la hematóloga Dra. Julie Kanter en la Universidad de Alabama en Birmingham, mostró que, en promedio, solo el 48,4 por ciento de los niños en los EE. UU. con anemia falciforme se someten a la prueba de ultrasonido recomendada. [101]
Un estudio de los NIH de 1994 mostró que los niños con riesgo de sufrir accidentes cerebrovasculares que recibieron transfusiones de sangre tuvieron una tasa anual de accidentes cerebrovasculares de menos del 1 por ciento, mientras que aquellos niños que no recibieron transfusiones de sangre tuvieron una tasa de accidentes cerebrovasculares del 10 por ciento por año. (Véase también el estudio de 1998 en el New England Journal of Medicine . [100] ) Además de las ecografías y las transfusiones de sangre, el fármaco genérico económico hidroxiurea puede reducir el riesgo de daño irreversible a los órganos y al cerebro. Las directrices de los NIH publicadas en 2014 establecen que todos los niños y adolescentes deben tomar hidroxiurea, al igual que los adultos con complicaciones graves o tres o más crisis de dolor en un año. [101]
Síndrome torácico agudo
El tratamiento es similar al de una crisis vasooclusiva, con la adición de antibióticos (generalmente una quinolona o un macrólido, ya que se cree que las bacterias deficientes en la pared celular ["atípicas"] contribuyen al síndrome), [102] suplementos de oxígeno para la hipoxia y observación estrecha. En ausencia de evidencia de alta calidad sobre la eficacia de los antibióticos para el síndrome torácico agudo en personas con enfermedad de células falciformes, no existe un tratamiento antibiótico estándar a partir de 2019. [103]
Si el infiltrado pulmonar empeora o aumentan los requerimientos de oxígeno, está indicada una transfusión sanguínea simple o una exanguinotransfusión . Esta última implica el intercambio de una porción significativa de la masa de glóbulos rojos de la persona por glóbulos rojos normales, lo que disminuye el nivel de hemoglobina S en la sangre del paciente. Sin embargo, actualmente hay evidencia incierta sobre los posibles beneficios o daños de la transfusión sanguínea para el síndrome torácico agudo en personas con enfermedad de células falciformes. [104]
Hidroxiurea
La hidroxiurea , también conocida como hidroxicarbamida , probablemente reduce la frecuencia de episodios dolorosos y el riesgo de enfermedad potencialmente mortal o muerte, pero actualmente no hay evidencia suficiente con respecto al riesgo de efectos adversos. [105] La hidroxiurea puede ser más efectiva que la transfusión y la quelación combinadas en términos de dolor, enfermedad potencialmente mortal y riesgo de muerte. [105]
Fue el primer fármaco aprobado para el tratamiento de la anemia de células falciformes, y se demostró que reducía el número y la gravedad de los ataques en 1995 [106] y que posiblemente aumentaba el tiempo de supervivencia en un estudio de 2003. [107] Esto se logra, en parte, reactivando la producción de hemoglobina fetal en lugar de la hemoglobina S que causa la anemia de células falciformes. La hidroxiurea se había utilizado anteriormente como agente de quimioterapia , y existe cierta preocupación de que su uso a largo plazo pueda ser perjudicial, pero este riesgo es inexistente o muy pequeño y los beneficios probablemente superen los riesgos. [19] [108]
El voxelotor fue aprobado en los Estados Unidos en 2019 para aumentar la hemoglobina en personas con enfermedad SS. [109] Sin embargo, tras un mayor riesgo de convulsiones vasooclusivas y muerte observado en registros y ensayos clínicos, la Agencia Europea de Medicamentos suspendió la autorización de comercialización del voxelotor en septiembre de 2024, tras lo cual el fabricante, Pfizer , lo retiró del mercado en todo el mundo. [110] [111]
Tratamiento de la necrosis avascular
En el tratamiento de la necrosis avascular del hueso en personas con enfermedad de células falciformes, el objetivo del tratamiento es reducir o detener el dolor y mantener la movilidad de las articulaciones . [41] Las opciones de tratamiento actuales incluyen el reposo de la articulación, la fisioterapia , los analgésicos , la cirugía de reemplazo articular o el injerto óseo . [41] Se necesitan ensayos controlados, aleatorizados y de alta calidad para evaluar la opción de tratamiento más eficaz y determinar si una combinación de fisioterapia y cirugía es más eficaz que la fisioterapia sola. [112] [113]
Terapia psicológica
Las terapias psicológicas como la educación del paciente , la terapia cognitiva , la terapia conductual y la psicoterapia psicodinámica , que tienen como objetivo complementar los tratamientos médicos actuales, requieren más investigaciones para determinar su eficacia. [114]
Transfusión de sangre
Las transfusiones de sangre se utilizan a menudo en el tratamiento de la enfermedad de células falciformes en casos agudos y para prevenir complicaciones al disminuir la cantidad de glóbulos rojos (RBC) que pueden formar células falciformes al agregar glóbulos rojos normales. [115] En los niños, se ha demostrado que la terapia de transfusión de glóbulos rojos preventiva reduce el riesgo de un primer accidente cerebrovascular o un accidente cerebrovascular silencioso cuando la ecografía Doppler transcraneal muestra un flujo sanguíneo cerebral anormal. [6] En aquellos que han sufrido un accidente cerebrovascular previo, también reduce el riesgo de accidente cerebrovascular recurrente y accidentes cerebrovasculares silenciosos adicionales. [116] [117]
Trasplante de médula ósea
Los trasplantes de médula ósea han demostrado ser eficaces en niños; son la única cura conocida para la anemia drepanocítica. [118] Sin embargo, los trasplantes de médula ósea son difíciles de obtener debido a la tipificación específica de HLA necesaria. Lo ideal sería que un pariente cercano (alogénico) donara la médula ósea necesaria para el trasplante. El pariente cercano debe tener el mismo tipo de sangre que el paciente. Se están desarrollando algunas terapias genéticas que alterarían las células madre de la médula ósea del propio paciente ex vivo, que luego se pueden trasplantar nuevamente al paciente después de que la quimioterapia elimine las células originales no modificadas. [119]
Trasplante de células madre hematopoyéticas
El trasplante de células madre hematopoyéticas (TCMH) implica reemplazar las células madre disfuncionales de una persona con enfermedad de células falciformes con células sanas de un donante compatible. [120] Encontrar al donante ideal, por lo general un donante de reserva o alguien casi compatible, es esencial para el éxito del proceso. Diferentes tipos de donantes pueden ser adecuados e incluyen sangre del cordón umbilical , parientes compatibles con antígeno leucocitario humano (HLA), donantes compatibles con HLA que no están relacionados con la persona que está siendo tratada, haploidénticos pero que se sometieron a un procedimiento mieloblativo (quimioterapia para matar las células de la médula ósea) u otras combinaciones. [120]
El TPH se utiliza para tratar a personas con enfermedad de células falciformes grave en grandes centros, sin embargo, la evidencia que sustenta la eficacia de este procedimiento considerando los riesgos no es clara. [121] No hay evidencia médica sólida para determinar los riesgos y los beneficios potenciales relacionados con el tratamiento de personas con enfermedad de células falciformes con trasplantes de células madre hematopoyéticas. [121] [122] Los riesgos asociados con el TPH pueden incluir enfermedad de injerto contra huésped, muerte, falla del injerto y otra toxicidad relacionada con el trasplante. [120]
Terapia génica
En 2023, tanto el exagamglogene autotemcel como el lovotibeglogene autotemcel fueron aprobados para el tratamiento de la anemia de células falciformes. [12] [123] El 24 de octubre de 2024, después de 44 días de tratamiento, Kendric Cromer, el primer caso comercial en recibir terapia génica, fue dado de alta del Children's National Hospital . Se sometió a esta última terapia y, según las empresas involucradas, decenas de otros pacientes están recibiendo actualmente estos tratamientos. [124]
Pronóstico
Alrededor del 90% de las personas sobreviven hasta los 20 años, y cerca del 50% sobreviven más allá de los 50 años . [125] En 2001, según un estudio realizado en Jamaica, la supervivencia media estimada para las personas con anemia drepanocítica homocigótica era de 53 años para los hombres y de 58 años para las mujeres. [126] Se desconoce la esperanza de vida en gran parte del mundo en desarrollo. [127] En 1975, alrededor del 7,3% de las personas con anemia drepanocítica morían antes de cumplir 23 años; mientras que en 1989, el 2,6% de las personas con anemia drepanocítica morían antes de cumplir 20 años. [128] : 348
Epidemiología
El gen HbS se puede encontrar en todos los grupos étnicos. [129] La frecuencia más alta de la enfermedad de células falciformes se encuentra en las regiones tropicales, particularmente en África subsahariana, las regiones tribales de la India y Oriente Medio. [130] Se cree que alrededor del 80% de los casos de enfermedad de células falciformes ocurren en África subsahariana . [14] La migración de poblaciones sustanciales de estas áreas de alta prevalencia a países de baja prevalencia en Europa ha aumentado drásticamente en las últimas décadas y en algunos países europeos, la enfermedad de células falciformes ahora ha superado condiciones genéticas más familiares como la hemofilia y la fibrosis quística . [131] En 2015, resultó en alrededor de 114.800 muertes. [132]
La enfermedad de células falciformes se presenta con mayor frecuencia entre personas cuyos antepasados vivieron en regiones subsaharianas tropicales y subtropicales donde la malaria es o fue común. En los lugares donde la malaria es común, ser portador de un solo alelo (rasgo) de la enfermedad de células falciformes confiere una ventaja heterocigótica ; los seres humanos con uno de los dos alelos de la enfermedad de células falciformes muestran síntomas menos graves cuando se infectan con malaria. [133]
Esta afección se hereda con un patrón autosómico recesivo, lo que significa que ambas copias del gen en cada célula tienen mutaciones. Cada uno de los padres es portador de una copia del gen mutado, pero por lo general no presentan signos ni síntomas de la afección. [18]
África
Tres cuartas partes de los casos de anemia falciforme se producen en África. Un informe reciente de la OMS estimó que alrededor del 2% de los recién nacidos en Nigeria estaban afectados por anemia falciforme, lo que da un total de 150.000 niños afectados nacidos cada año solo en Nigeria. La frecuencia de portadores varía entre el 10 y el 40% en África ecuatorial, disminuyendo al 1-2% en la costa norteafricana y a menos del 1% en Sudáfrica. [134] Los estudios en África muestran una disminución significativa en la tasa de mortalidad infantil, de 2 a 16 meses de edad, debido al rasgo falciforme. Esto sucedió en áreas de casos predominantes de malaria. [135]
Uganda tiene la quinta mayor carga de enfermedad de células falciformes en África. [136] Un estudio indica que 20 000 bebés por año nacen con enfermedad de células falciformes, con el rasgo de células falciformes en el 13,3% y con la enfermedad en el 0,7%. [137]
| País | Población (2020) | Subregión | % de prevalencia | Predominio | Incidencia |
| Angola | 32.866.272 | África central | 0,09375 | 3.081.213 | 14.869 |
| Camerún | 26.545.863 | África central | 0,117 | 3.105.866 | 11.826 |
| República Democrática del Congo | 89.561.403 | África central | 0,1163333333 | 10.418.977 | 65.536 |
| Ghana | 31.072.940 | África occidental | 0,09375 | 2.913.088 | 9,588 |
| Guinea | 13.132.795 | África occidental | 0,139375 | 1.830.383 | 8,907 |
| Níger | 24.206.644 | África occidental | 0,07025 | 1.700.517 | 8.756 |
| Nigeria | 206.139.589 | África occidental | 0,1286666667 | 26.523.294 | 150.000 |
| Tanzania | 59.734.218 | África Oriental | 0,0545 | 3.255.515 | 19,585 |
| Uganda | 45.741.007 | África Oriental | 0,07025 | 3.213.306 | 17.936 |
| Zambia | 18.383.955 | África Oriental | 0,082 | 1.507.484 | 9,958 |
| Argelia | 43.851.044 | África del Norte | 0,029 | 1.271.680 | 6.624 |
| Benín | 12.123.200 | África occidental | 0,1286666667 | 1.559.852 | 8,125 |
| Botsuana | 2.351.627 | África del Sur | 0,029 | 68.197 | 355 |
| Burkina Faso | 20.903.273 | África occidental | 0,07025 | 1.468.455 | 7,649 |
| Burundi | 11.890.784 | África Oriental | 0,023 | 273.488 | 1.425 |
| Cabo Verde | 555.987 | África occidental | 0,023 | 12.788 | 67 |
| República Centroafricana | 4.829.767 | África central | 0,082 | 396.041 | 2.063 |
| Chad | 16.425.864 | África central | 0,0585 | 960.913 | 5.005 |
| Comoras | 869.601 | África Oriental | 0,023 | 20.001 | 104 |
| Congo | 5.518.087 | África central | 0,1615 | 891.171 | 4.642 |
| Costa de Marfil | 26.378.274 | África occidental | 0,07025 | 1.853.074 | 9,652 |
| Yibuti | 988.000 | África Oriental | 0,023 | 22.724 | 118 |
| Egipto | 102.334.404 | África del Norte | 0,029 | 2.967.698 | 15.458 |
| Guinea Ecuatorial | 1.402.985 | África central | 0,181 | 253.940 | 1.323 |
| Eritrea | 3.546.421 | África Oriental | 0,023 | 81.568 | 425 |
| Eswatini | 1.160.164 | África del Sur | 0,023 | 26.684 | 139 |
| Etiopía | 114.963.588 | África Oriental | 0,029 | 3.333.944 | 17.366 |
| Gabón | 2.225.734 | África central | 0,181 | 402.858 | 2.098 |
| Gambia | 2.416.668 | África occidental | 0,082 | 198.167 | 1.032 |
| Guinea-Bissau | 1.968.001 | África occidental | 0,035 | 68.880 | 359 |
| Kenia | 53.771.296 | África Oriental | 0,04675 | 2.513.808 | 13.094 |
| Lesoto | 2.142.249 | África del Sur | 0,023 | 49,272 | 257 |
| Liberia | 5.057.681 | África occidental | 0,07025 | 355.302 | 1.851 |
| Libia | 6.871.292 | África del Norte | 0,029 | 199.267 | 1.038 |
| Madagascar | 27.691.018 | África Oriental | 0,04675 | 1.294.555 | 6.743 |
| Malaui | 19.129.952 | África Oriental | 0,035 | 669,548 | 3.488 |
| Malí | 20.250.833 | África occidental | 0,082 | 1.660.568 | 8.650 |
| Mauritania | 4.649.658 | África occidental | 0,04675 | 217.372 | 1.132 |
| Mauricio | 1.271.768 | África Oriental | 0,023 | 29.251 | 152 |
| Marruecos | 36.910.560 | África del Norte | 0,029 | 1.070.406 | 5,576 |
| Mozambique | 31.255.435 | África Oriental | 0,035 | 1.093.940 | 5,698 |
| Namibia | 2.540.905 | África del Sur | 0.03883333333 | 98.672 | 514 |
| Ruanda | 12.952.218 | África Oriental | 0,035 | 453.328 | 2.361 |
| Santo Tomé y Príncipe | 219.159 | África central | 0,181 | 39.668 | 207 |
| Senegal | 16.743.927 | África occidental | 0,07025 | 1.176.261 | 6,127 |
| Seychelles | 98.347 | África Oriental | 0,023 | 2.262 | 12 |
| Sierra Leona | 7.976.983 | África occidental | 0,1615 | 1.288.283 | 6.711 |
| Somalia | 15.893.222 | África Oriental | 0,029 | 460.903 | 2.401 |
| Sudáfrica | 59.308.690 | África del Sur | 0,029 | 1.719.952 | 8,959 |
| Sudán del Sur | 11.193.725 | África Oriental | 0,04675 | 523.307 | 2.726 |
| Sudán | 43.849.260 | África del Norte | 0.03883333333 | 1.702.813 | 8.870 |
| Ir | 8.278.724 | África occidental | 0,09375 | 776.130 | 4.043 |
| Túnez | 11.818.619 | África del Norte | 0,023 | 271.828 | 1.416 |
| Zimbabue | 14.862.924 | África Oriental | 0,035 | 520,202 | 2.710 |
| Total | 1.338.826.604 | África | 91.868.664 | 495.726 |
Estados Unidos
El número de personas con la enfermedad en los Estados Unidos es de aproximadamente 100.000 (una de cada 3.300), y afecta principalmente a estadounidenses de ascendencia africana subsahariana. [138] En los Estados Unidos, aproximadamente uno de cada 365 niños afroamericanos y uno de cada 16.300 niños hispanoamericanos tienen anemia de células falciformes. [139] La esperanza de vida de los hombres con anemia falciforme es de aproximadamente 42 años, mientras que las mujeres viven aproximadamente seis años más. [140] Otros 2 millones son portadores del rasgo de células falciformes. [141] La mayoría de los bebés con anemia falciforme nacidos en los Estados Unidos se identifican mediante pruebas de detección neonatal de rutina. A partir de 2016, los 50 estados incluyen la detección de la enfermedad de células falciformes como parte de su detección neonatal. [142] Se toma una muestra de sangre del recién nacido a través de un pinchazo en el talón y se envía a un laboratorio para su análisis. El bebé debe haber estado comiendo durante un mínimo de 24 horas antes de que se pueda realizar la prueba del talón. Algunos estados también exigen que se realice un segundo análisis de sangre cuando el bebé tenga dos semanas de vida para garantizar los resultados. [143]
La anemia de células falciformes es el trastorno genético más común entre los afroamericanos. Aproximadamente el 8% son portadores y 1 de cada 375 nace con la enfermedad. [144] Los defensores de los pacientes de la enfermedad de células falciformes se han quejado de que recibe menos fondos gubernamentales y privados para la investigación que enfermedades raras similares, como la fibrosis quística , y el investigador Elliott Vichinsky dice que esto muestra discriminación racial o el papel de la riqueza en la defensa de la atención médica. [145] En general, sin considerar la raza, aproximadamente el 1,5% de los bebés nacidos en los Estados Unidos son portadores de al menos una copia del gen mutante (causante de la enfermedad). [146]
Francia

Como resultado del crecimiento de la población en las regiones africanas y caribeñas de ultramar de Francia y la inmigración desde el norte de África y África subsahariana a Francia continental, la enfermedad de células falciformes se ha convertido en un importante problema de salud en Francia. [147] La SCD se ha convertido en la enfermedad genética más común en el país, con una prevalencia general al nacer de uno en 2415 en Francia metropolitana , por delante de la fenilcetonuria (uno en 10 862), el hipotiroidismo congénito (uno en 3132), la hiperplasia suprarrenal congénita (uno en 19 008) y la fibrosis quística (uno en 5014) para el mismo período de referencia. [148]

Desde el año 2000, se ha realizado un cribado neonatal de la anemia drepanocítica a nivel nacional para todos los recién nacidos definidos como "en riesgo" de padecerla según su origen étnico (definidos como aquellos nacidos de padres originarios de África subsahariana, África del Norte, la zona mediterránea (sur de Italia, Grecia y Turquía ), la península Arábiga, las islas francesas de ultramar y el subcontinente indio). [149]
Reino Unido
En el Reino Unido, se cree que entre 12.000 y 15.000 personas padecen la enfermedad de células falciformes [150] y se calcula que hay 250.000 portadores de la enfermedad solo en Inglaterra. Como el número de portadores es solo una estimación, a todos los recién nacidos en el Reino Unido se les realiza un análisis de sangre de rutina para detectar la enfermedad. [151] Debido a que muchos adultos en grupos de alto riesgo no saben si son portadores, a las mujeres embarazadas y a ambos miembros de la pareja se les ofrece la posibilidad de hacerse una prueba de detección para que puedan recibir asesoramiento si tienen el rasgo de células falciformes. [152] Además, a los donantes de sangre de aquellos en grupos de alto riesgo también se les realiza una prueba de detección para confirmar si son portadores y si su sangre se filtra correctamente. [153] A los donantes que se descubre que son portadores se les informa y su sangre, aunque a menudo se utiliza para aquellos del mismo grupo étnico, no se utiliza para aquellos con enfermedad de células falciformes que requieren una transfusión de sangre. [154]
Asia occidental
En Arabia Saudita , aproximadamente el 4,2% de la población es portadora del gen de la anemia falciforme y el 0,26% tiene la enfermedad de células falciformes. La prevalencia más alta se encuentra en la provincia oriental, donde aproximadamente el 17% de la población es portadora del gen y el 1,2% tiene la enfermedad de células falciformes. [155] En 2005, Arabia Saudita introdujo una prueba prematrimonial obligatoria que incluía la electroforesis de HB, cuyo objetivo era reducir la incidencia de la anemia falciforme y la talasemia . [156]
En Bahréin , un estudio publicado en 1998 que abarcó a unas 56.000 personas en hospitales de Bahréin encontró que el 2% de los recién nacidos tienen anemia falciforme, el 18% de las personas encuestadas tienen el rasgo de anemia falciforme y el 24% eran portadores de la mutación genética que causa la enfermedad. [157] El país comenzó a realizar pruebas de detección a todas las mujeres embarazadas en 1992, y se empezó a realizar pruebas a los recién nacidos si la madre era portadora. En 2004, se aprobó una ley que exigía que las parejas que planeaban casarse se sometieran a asesoramiento prematrimonial gratuito . Estos programas fueron acompañados de campañas de educación pública. [158]
India y Nepal
La enfermedad de células falciformes es común en algunos grupos étnicos de la India central, [159] donde la prevalencia ha oscilado entre el 9,4 y el 22,2% en las zonas endémicas de Madhya Pradesh , Rajasthan y Chhattisgarh . [160] También es endémica entre los tharu de Nepal y la India; sin embargo, tienen una tasa siete veces menor de malaria a pesar de vivir en una zona infestada de malaria. [161]
Islas del Caribe
En Jamaica , el 10% de la población es portadora del gen de la anemia falciforme, lo que lo convierte en el trastorno genético más prevalente en el país. [162]
Historia
El primer informe moderno sobre la enfermedad de células falciformes puede haber sido en 1846, donde se discutió la autopsia de un esclavo fugitivo ejecutado; el hallazgo clave fue la ausencia del bazo. [163] [164] Según se informa, los esclavos africanos en los Estados Unidos mostraron resistencia a la malaria, pero eran propensos a las úlceras en las piernas. [164] Las características anormales de los glóbulos rojos, que más tarde prestaron su nombre a la enfermedad, fueron descritas por primera vez por Ernest E. Irons (1877-1959), interno del cardiólogo de Chicago y profesor de medicina James B. Herrick (1861-1954), en 1910. Irons vio células "peculiares alargadas y en forma de hoz" en la sangre de un hombre llamado Walter Clement Noel, un estudiante de odontología de primer año de 20 años de Granada. Noel había sido ingresado en el Hospital Presbiteriano de Chicago en diciembre de 1904 con anemia. [16] [165] Noel fue readmitido varias veces durante los siguientes tres años por " reumatismo muscular " y "ataques biliosos", pero completó sus estudios y regresó a la capital de Granada (St. George's) para ejercer la odontología . Murió de neumonía en 1916 y está enterrado en el cementerio católico de Sauteurs , en el norte de Granada. [16] [17] Poco después del informe de Herrick, apareció otro caso en el Virginia Medical Semi-Monthly con el mismo título, "Peculiar Elongated and Falke-Shaped Red Blood Corpuscles in a Case of Severe Anemia". [166] Este artículo se basa en un paciente ingresado en el Hospital de la Universidad de Virginia el 15 de noviembre de 1910. [167] En la descripción posterior de Verne Mason en 1922, se utiliza por primera vez el nombre "anemia de células falciformes". [17] [168] Los problemas infantiles relacionados con la enfermedad de células falciformes no se informaron hasta la década de 1930, a pesar del hecho de que esto no puede haber sido poco común en las poblaciones afroamericanas. [164]
El médico de Memphis Lemuel Diggs , un prolífico investigador de la enfermedad de células falciformes, introdujo por primera vez la distinción entre la enfermedad de células falciformes y el rasgo en 1933, aunque hasta 1949, las características genéticas no habían sido dilucidadas por James V. Neel y EA Beet. [17] 1949 fue el año en que Linus Pauling describió el comportamiento químico inusual de la hemoglobina S y lo atribuyó a una anomalía en la propia molécula. [17] [169] El cambio molecular en HbS fue descrito en 1956 por Vernon Ingram . [170] A finales de la década de 1940 y principios de la de 1950 se comprendió mejor el vínculo entre la malaria y la enfermedad de células falciformes. En 1954, la introducción de la electroforesis de hemoglobina permitió el descubrimiento de subtipos particulares, como la enfermedad HbSC. [17]
En los años 1970 y 1980 se introdujeron estudios de historia natural a gran escala y otros estudios de intervención, lo que condujo al uso generalizado de la profilaxis contra las infecciones neumocócicas, entre otras intervenciones. La película para televisión de Bill Cosby ganadora de un Emmy en 1972, To All My Friends on Shore , describía la historia de los padres de un niño con anemia de células falciformes. [171] En los años 1990 se desarrolló la hidroxicarbamida y en 2007 aparecieron informes de curación mediante trasplante de médula ósea. [17]
Algunos textos antiguos se refieren a ella como drepanocitosis. [172]
Sociedad y cultura
Estados Unidos
La enfermedad de células falciformes se considera con frecuencia una discapacidad. [173] A partir del 15 de septiembre de 2017, la Administración del Seguro Social de los EE. UU. emitió una Resolución de Interpretación de Políticas que proporciona información de fondo sobre la enfermedad de células falciformes y una descripción de cómo el Seguro Social evalúa la enfermedad durante su proceso de adjudicación de reclamos por discapacidad. [174] [175]
En los EE. UU., existen estigmas en torno a la anemia drepanocítica que desalientan a las personas con anemia drepanocítica a recibir la atención necesaria. Estos estigmas afectan principalmente a las personas de ascendencia afroamericana y latinoamericana, según el Instituto Nacional del Corazón, los Pulmones y la Sangre. [2] Las personas con anemia drepanocítica experimentan el impacto de los estigmas de la enfermedad en múltiples aspectos de la vida, incluido el bienestar social y psicológico. Los estudios han demostrado que las personas con anemia drepanocítica con frecuencia sienten que deben mantener su diagnóstico en secreto para evitar la discriminación en el lugar de trabajo y también entre pares en las relaciones. [176] En la década de 1960, el gobierno de los EE. UU. apoyó iniciativas para la detección de enfermedades genéticas en el lugar de trabajo en un intento de proteger a las personas con anemia drepanocítica. Al realizar esta detección, se pretendía que los empleados no se encontraran en entornos que pudieran ser potencialmente dañinos y desencadenar la anemia drepanocítica. [177]
Uganda
Uganda tiene la quinta carga más alta de enfermedad de células falciformes (ECF) en el mundo. [178] En Uganda , existe un estigma social para aquellos con enfermedad de células falciformes debido a la falta de conocimiento general de la enfermedad. La brecha general en el conocimiento sobre la enfermedad de células falciformes se nota entre los adolescentes y adultos jóvenes debido al secreto culturalmente sancionado sobre la enfermedad. [178] Si bien la mayoría de las personas han oído hablar en general de la enfermedad, una gran parte de la población está relativamente mal informada sobre cómo se diagnostica o se hereda la ECF. Aquellos que están informados sobre la enfermedad se enteraron de ella por familiares o amigos y no por profesionales de la salud . El hecho de no proporcionar al público información sobre la enfermedad de células falciformes da como resultado una población con una comprensión deficiente de las causas de la enfermedad, los síntomas y las técnicas de prevención. [136] Las diferencias, físicas y sociales, que surgen en las personas con enfermedad de células falciformes, como ictericia, retraso del crecimiento físico y retraso de la madurez sexual, también pueden llevarlos a convertirse en blancos de acoso, rechazo y estigma. [178]
Tasa de enfermedad de células falciformes en Uganda
Los datos recopilados sobre la enfermedad de células falciformes en Uganda no se han actualizado desde principios de la década de 1970. La deficiencia de datos se debe a la falta de fondos gubernamentales para la investigación, a pesar de que los ugandeses mueren diariamente por anemia de células falciformes. [179] Los datos muestran que la frecuencia del rasgo de la enfermedad de células falciformes es del 20% de la población de Uganda. [179] Esto significa que 66 millones de personas corren el riesgo de tener un hijo con enfermedad de células falciformes. [179] También se estima que alrededor de 25.000 ugandeses nacen cada año con anemia de células falciformes y el 80% de esas personas no viven más allá de los cinco años. [179] La anemia de células falciformes también contribuye en un 25% a la tasa de mortalidad infantil en Uganda. [179] El pueblo bamba de Uganda, ubicado en el suroeste del país, es portador del 45% del gen, que es la frecuencia de rasgo más alta registrada en el mundo. [179] La Clínica de Anemia Falciforme en Mulago es la única clínica de enfermedad de células falciformes en el país y atiende en promedio a 200 pacientes por día. [179]
Conceptos erróneos sobre la enfermedad de células falciformes
El estigma en torno a la enfermedad es particularmente grave en las regiones del país que no están tan afectadas. Por ejemplo, los ugandeses del este tienden a tener más conocimientos sobre la enfermedad que los ugandeses del oeste, que son más propensos a creer que la anemia falciforme es el resultado de un castigo de Dios o de la brujería . [180] Otros conceptos erróneos sobre la anemia falciforme incluyen la creencia de que es causada por factores ambientales, pero, en realidad, la anemia falciforme es una enfermedad genética. [181] Se han realizado esfuerzos en toda Uganda para abordar los conceptos erróneos sociales sobre la enfermedad. En 2013, se creó la Uganda Sickle Cell Rescue Foundation para difundir la conciencia sobre la anemia falciforme y combatir el estigma social asociado a la enfermedad. [182] Además de los esfuerzos de esta organización, es necesario incluir la educación sobre la anemia falciforme en los programas de educación sanitaria comunitaria preexistentes con el fin de reducir la estigmatización de la anemia falciforme en Uganda. [136]
Aislamiento social de personas con enfermedad de células falciformes
El estigma profundamente arraigado de la anemia de células falciformes en la sociedad hace que las familias a menudo oculten el estado de enfermedad de sus familiares por miedo a ser etiquetados, maldecidos o excluidos de los eventos sociales. [183] A veces en Uganda, cuando se confirma que un miembro de la familia tiene anemia de células falciformes, se evitan las relaciones íntimas con todos los miembros de la familia. [183] La estigmatización y el aislamiento social que tienden a experimentar las personas con anemia de células falciformes es a menudo la consecuencia de conceptos erróneos populares de que las personas con anemia de células falciformes no deben socializar con personas libres de la enfermedad. Esta mentalidad priva a las personas con anemia de células falciformes del derecho a participar libremente en actividades comunitarias como todos los demás. [178] El estigma relacionado con la anemia de células falciformes y el aislamiento social en las escuelas, especialmente, pueden hacer que la vida de los jóvenes que viven con anemia de células falciformes sea extremadamente difícil. [178] Para los niños en edad escolar que viven con anemia de células falciformes, el estigma al que se enfrentan puede conducir al rechazo de los compañeros. [178] El rechazo de los compañeros implica la exclusión de grupos o reuniones sociales. Esto a menudo lleva a que el individuo excluido experimente angustia emocional y puede dar como resultado un bajo rendimiento académico, el rechazo a la escuela y un fracaso laboral más adelante en la vida. [178] Este aislamiento social también es probable que afecte negativamente la autoestima y la calidad de vida general de las personas con ECF . [178]
Las madres de niños con anemia falciforme tienden a recibir cantidades desproporcionadas de estigma por parte de sus pares y miembros de la familia. A menudo se culpa a estas mujeres por el diagnóstico de anemia falciforme de su hijo, especialmente si la anemia falciforme no está presente en generaciones anteriores, debido a la sospecha de que la mala salud del niño puede haber sido causada por el fracaso de la madre para implementar medidas de salud preventivas o promover un entorno saludable para que su hijo prospere. [181] La dependencia de teorías relacionadas con factores ambientales para culpar a la madre refleja el escaso conocimiento de muchos ugandeses sobre cómo se adquiere la enfermedad, ya que está determinada por la genética, no por el medio ambiente. [181] Las madres de niños con anemia falciforme también suelen quedarse con recursos muy limitados para salvaguardar su futuro contra el estigma de tener anemia falciforme. [181] Esta falta de acceso a los recursos es resultado de sus roles subordinados dentro de las estructuras familiares, así como de las disparidades de clase que obstaculizan la capacidad de muchas madres para satisfacer los costos y responsabilidades adicionales del cuidado infantil. [181]
Las mujeres que viven con anemia falciforme y quedan embarazadas a menudo enfrentan una discriminación extrema y desánimo en Uganda. Estas mujeres son frecuentemente tildadas por sus pares de irresponsables por tener un bebé mientras viven con enfermedad de células falciformes o incluso tener relaciones sexuales mientras viven con anemia de células falciformes. Carga del rasgo y la enfermedad de células falciformes en el Estudio de Vigilancia de la Anemia de Células Falciformes de Uganda (US3): un estudio transversal Las críticas y los juicios que reciben estas mujeres, no solo de los profesionales de la salud sino también de sus familias, a menudo las dejan sintiéndose solas, deprimidas, ansiosas, avergonzadas y con muy poco apoyo social . Carga del rasgo y la enfermedad de células falciformes en el Estudio de Vigilancia de la Anemia de Células Falciformes de Uganda (US3): un estudio transversal - The Lancet Global Health La mayoría de las mujeres embarazadas con anemia de células falciformes también se convierten en madres solteras, ya que es común que sus parejas masculinas las abandonen y aleguen que no sabían que su pareja tenía anemia de células falciformes. Padres de niños con anemia de células falciformes mal preparados y mal informados: es hora de repensar las campañas de concienciación El abandono que experimentan estas mujeres no solo les causa angustia emocional, sino que este bajo nivel de apoyo parental puede estar relacionado con síntomas depresivos y, en general, menor calidad de vida para el niño una vez nacido. [184]
Reino Unido
En 2021, se descubrió que muchos pacientes tenían miedo de visitar los hospitales, tal era el nivel de ignorancia entre el personal, por lo que compraron analgésicos para tratarse fuera del NHS. A menudo esperaban mucho tiempo para recibir el alivio del dolor y, a veces, se sospechaba que tenían un comportamiento de "búsqueda de medicamentos". Los retrasos en el tratamiento, la falta de información al equipo de hematología del hospital y el mal manejo del dolor habían causado muertes. El personal de hematología especializado prefería trabajar en hospitales docentes más grandes, lo que provocó una escasez de experiencia en otros lugares. [185] En 2021, el NHS inició su primer tratamiento nuevo en 20 años para la anemia falciforme. Esto implicó el uso de Crizanlizumab , un medicamento que se administra mediante goteo transfusional, lo que reduce el número de visitas a urgencias de los pacientes. Se puede acceder al tratamiento, a través de consultores, en cualquiera de los diez nuevos centros establecidos en todo el país. [186] Sin embargo, ese mismo año, un grupo parlamentario de todos los partidos elaboró un informe sobre la anemia falciforme y la talasemia titulado "Nadie está escuchando". [187] En parte como respuesta a esto, el 19 de junio de 2022, Día Mundial de la Anemia Falciforme, el NHS lanzó una campaña llamada "¿Puedes decir que es anemia falciforme?". La campaña tenía un doble objetivo. Uno era aumentar la conciencia de los signos y síntomas clave de este trastorno sanguíneo para que las personas estuvieran tan alertas a los signos de una crisis de anemia falciforme como a un ataque cardíaco o un derrame cerebral inminente. El segundo objetivo era establecer un nuevo programa de capacitación para ayudar a los paramédicos, el personal de accidentes y emergencias, los cuidadores y el público en general a atender de manera efectiva a los pacientes en crisis. [188]
Investigación
Terapia génica
Las enfermedades como la anemia falciforme, en las que el fenotipo o la función celular normal de una persona pueden restaurarse en las células que padecen la enfermedad mediante una copia normal del gen que está mutado, pueden ser buenas candidatas para el tratamiento con terapia génica. No se conocen los riesgos y beneficios relacionados con la terapia génica para la anemia falciforme. [189]
En 2001, se informó que la enfermedad de células falciformes había sido tratada con éxito en ratones mediante terapia génica . [190] [191] Los investigadores utilizaron un vector viral para hacer que los ratones, que tienen esencialmente el mismo defecto que causa la enfermedad de células falciformes humana, expresaran la producción de hemoglobina fetal (HbF), que un individuo normalmente deja de producir poco después del nacimiento. En humanos, se sabe que el uso de hidroxiurea para estimular la producción de HbF alivia temporalmente los síntomas de la enfermedad de células falciformes. Los investigadores demostraron que este método de terapia génica es una forma más permanente de aumentar la producción terapéutica de HbF. [192]
En 2014 se iniciaron los ensayos clínicos de fase 1 de terapia génica para la anemia falciforme en humanos. Los ensayos clínicos evaluaron la seguridad de la médula ósea modificada con vectores lentivirales para adultos con anemia falciforme grave. [193] [194] En marzo de 2017 se publicó un informe de caso de la primera persona tratada, y desde entonces se ha tratado a algunas personas más. [195] [196]
Las plataformas de edición genética como CRISPR/Cas9 se han utilizado para corregir la mutación causante de la enfermedad en células madre hematopoyéticas extraídas de una persona con la afección. [197] En julio de 2019, la herramienta de edición genética CRISPR se utilizó para editar células de la médula ósea de una persona con SCD para aumentar la hemoglobina fetal inhibiendo el gen BCL11A . [198] [199] Varios investigadores han considerado las implicaciones éticas de que la SCD sea una de las primeras aplicaciones potenciales de la tecnología CRISPR, dados los abusos históricos y el abandono de la comunidad afroamericana por parte del campo médico. [200]
En 2017, doce ensayos clínicos se centraron en la terapia génica para tratar la anemia de células falciformes. De esos 12 ensayos, cuatro de ellos reemplazaron el gen HBB mutado por uno sano. Tres ensayos utilizaron Mozobil, un medicamento utilizado para tratar tipos de cáncer, para determinar si el aumento de células madre se puede utilizar para la terapia génica. Un ensayo se centró en analizar muestras de médula ósea de pacientes con anemia de células falciformes. Otro ensayo experimentó con el uso de sangre del cordón umbilical de bebés con y sin anemia de células falciformes para desarrollar una terapia génica. [201]
En noviembre de 2023, los reguladores del Reino Unido aprobaron un tratamiento genético que utiliza la herramienta de edición genética CRISPR para el tratamiento de la anemia de células falciformes y también para el trastorno sanguíneo beta talasemia dependiente de transfusiones . [13] [123]
Trasplante de sangre del cordón umbilical
Si bien el trasplante de sangre del cordón umbilical puede curar potencialmente la enfermedad, solo el 10% de las personas tienen un donante adecuado disponible. [202] Un trasplante de sangre del cordón umbilical no está exento de riesgos graves y se estima que el 7% de las personas mueren como resultado del procedimiento de trasplante de sangre del cordón umbilical y existe el riesgo de enfermedad de injerto contra huésped . [202]
Notas
Referencias
- ^ abcde «Enfermedad de células falciformes: síntomas». Instituto Nacional del Corazón, los Pulmones y la Sangre . 20 de agosto de 2024. Consultado el 26 de octubre de 2024 .
- ^ abcdefghi "¿Qué es la enfermedad de células falciformes?". Instituto Nacional del Corazón, los Pulmones y la Sangre . 30 de septiembre de 2024. Consultado el 26 de octubre de 2024 .
- ^ abc "Enfermedad de células falciformes: causas y factores de riesgo". Instituto Nacional del Corazón, los Pulmones y la Sangre . 20 de agosto de 2024. Consultado el 26 de octubre de 2024 .
- ^ abc «Enfermedad de células falciformes: diagnóstico». Instituto Nacional del Corazón, los Pulmones y la Sangre . 9 de septiembre de 2024. Consultado el 26 de octubre de 2024 .
- ^ abcd «Hoja informativa N°308 sobre anemia falciforme y otros trastornos de la hemoglobina». Enero de 2011. Archivado desde el original el 9 de marzo de 2016 . Consultado el 8 de marzo de 2016 .
- ^ abcd «Enfermedad de células falciformes: tratamiento». Instituto Nacional del Corazón, los Pulmones y la Sangre . 30 de septiembre de 2024. Consultado el 26 de octubre de 2024 .
- ^ abc Thomson AM, McHugh TA, Oron AP, Teply C, Lonberg N, Vilchis Tella V, et al. (agosto de 2023). "Prevalencia y carga de mortalidad mundial, regional y nacional de la enfermedad de células falciformes, 2000-2021: un análisis sistemático del Estudio de la carga mundial de enfermedad 2021". The Lancet. Hematología . 10 (8): e585–e599. doi :10.1016/S2352-3026(23)00118-7. ISSN 2352-3026. PMC 10390339 . PMID 37331373.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ ab Nelson MD, Bennett DM, Lehman ME, Okonji AI (5 de diciembre de 2022). "Mareos, caídas y pérdida auditiva en adultos que viven con anemia de células falciformes". Revista Estadounidense de Audiología . 31 (4): 1178–1190. doi :10.1044/2022_AJA-22-00059. ISSN 1558-9137. PMID 36251873.
- ^ "Anemia de células falciformes: síntomas, qué es, causas y tratamiento". Cleveland Clinic . Consultado el 8 de mayo de 2024 .
- ^ "Enfermedad de células falciformes: ¿cuál es el pronóstico?". Instituto Nacional para la Excelencia en la Salud y la Atención . Julio de 2021. Consultado el 25 de octubre de 2024 .
- ^ "Enfermedad de células falciformes: cómo la enfermedad de células falciformes puede afectar su salud". www.nhlbi.nih.gov . Instituto Nacional del Corazón, los Pulmones y la Sangre. 23 de abril de 2024 . Consultado el 25 de julio de 2024 .
- ^ ab "La FDA aprueba las primeras terapias genéticas para tratar a pacientes con anemia falciforme". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 8 de diciembre de 2023. Archivado desde el original el 8 de diciembre de 2023. Consultado el 8 de diciembre de 2023 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ ab Wilkinson E (16 de noviembre de 2023). "El regulador del Reino Unido aprueba un tratamiento genético "innovador" para la anemia falciforme y la talasemia β". BMJ . 383 : 2706. doi :10.1136/bmj.p2706. ISSN 1756-1833. PMID 37973171. S2CID 265264939.
- ^ abc Rees DC, Williams TN, Gladwin MT (diciembre de 2010). "Enfermedad de células falciformes". Lancet . 376 (9757): 2018–2031. doi :10.1016/s0140-6736(10)61029-x. PMID 21131035. S2CID 29909566.
- ^ Elzouki AY (2012). Libro de texto de pediatría clínica (2.ª ed.). Berlín: Springer. p. 2950. ISBN 9783642022012.
- ^ abc Savitt TL, Goldberg MF (enero de 1989). "Informe de caso de anemia de células falciformes de Herrick de 1910. El resto de la historia". Revista de la Asociación Médica Estadounidense . 261 (2): 266–271. doi :10.1001/jama.261.2.266. PMID 2642320.
- ^ abcdefghi Serjeant GR (diciembre de 2010). "Cien años de enfermedad de células falciformes". British Journal of Haematology . 151 (5): 425–429. doi : 10.1111/j.1365-2141.2010.08419.x . PMID 20955412.
- ^ abc «Enfermedad de células falciformes: MedlinePlus Genetics». Biblioteca Nacional de Medicina . Consultado el 13 de noviembre de 2024 .
- ^ ab Yawn BP, Buchanan GR, Afenyi-Annan AN, Ballas SK, Hassell KL, James AH, et al. (septiembre de 2014). "Manejo de la enfermedad de células falciformes: resumen del informe basado en evidencia de 2014 elaborado por miembros del panel de expertos". Revista de la Asociación Médica Estadounidense . 312 (10): 1033–1048. doi :10.1001/jama.2014.10517. PMID 25203083. S2CID 37681044.
- ^ ab Gill FM, Sleeper LA, Weiner SJ, Brown AK, Bellevue R, Grover R, et al. (15 de julio de 1995). "Eventos clínicos en la primera década en una cohorte de lactantes con enfermedad de células falciformes. Estudio cooperativo de la enfermedad de células falciformes [ver comentarios]". Blood . 86 (2): 776–783. doi :10.1182/blood.v86.2.776.bloodjournal862776. ISSN 0006-4971.
- ^ "Enfermedad de células falciformes: síntomas | NHLBI, NIH". www.nhlbi.nih.gov . 30 de agosto de 2023 . Consultado el 22 de marzo de 2024 .
- ^ "Enfermedad de células falciformes". Cleveland Clinic . 3 de agosto de 2023 . Consultado el 25 de octubre de 2024 .
- ^ Olujohungbe A, Burnett AL (marzo de 2013). "Cómo manejo el priapismo debido a la enfermedad de células falciformes". British Journal of Haematology . 160 (6): 754–765. doi : 10.1111/bjh.12199 . PMID 23293942.
- ^ Glassberg J (agosto de 2011). "Manejo basado en evidencia de la enfermedad de células falciformes en el departamento de emergencias". Emergency Medicine Practice . 13 (8): 1–20, cuestionario 20. PMID 22164362.
- ^ "Enfermedad de células falciformes: síntomas". nhs.uk . 23 de octubre de 2017 . Consultado el 25 de octubre de 2024 .
- ^ ab Shah P, Khaleel M, Thuptimdang W, Sunwoo J, Veluswamy S, Chalacheva P, et al. (1 de enero de 2020). "El estrés mental provoca vasoconstricción en sujetos con anemia falciforme y en controles normales". Hematológica . 105 (1): 83–90. doi :10.3324/haematol.2018.211391. ISSN 1592-8721. PMC 6939522 . PMID 30975906.
- ^ ab Brousse V, Buffet P, Rees D (1 de julio de 2014). "El bazo y la anemia falciforme: el bazo enfermo". British Journal of Haematology . 166 (2): 165–176. doi : 10.1111/bjh.12950 . ISSN 1365-2141. PMID 24862308. S2CID 40448991.
- ^ "Crisis de secuestro esplénico | DSHS de Texas" www.dshs.texas.gov . Consultado el 28 de octubre de 2024 .
- ^ ab Kane I, Kumar A, Atalla E, Nagalli S (5 de junio de 2023), "Splenic Sequestration Crisis", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 31985957 , consultado el 28 de octubre de 2024
- ^ "Transfusiones de sangre para la anemia falciforme | HealthLink BC" www.healthlinkbc.ca . Consultado el 8 de mayo de 2024 .
- ^ Paul RN, Castro OL, Aggarwal A, Oneal PA (septiembre de 2011). "Síndrome torácico agudo: enfermedad de células falciformes". Revista Europea de Hematología . 87 (3): 191–207. doi :10.1111/j.1600-0609.2011.01647.x. PMID 21615795. S2CID 40320701.
- ^ Friend A, Settelmeyer TP, Girzadas D (25 de noviembre de 2023), "Síndrome torácico agudo", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 28722902 , consultado el 27 de octubre de 2024
- ^ Kumar V, Abbas AK, Fausto N, Aster J (28 de mayo de 2009). Robbins y Cotran Pathologic Basis of Disease (Edición profesional: Expert Consult – Online (Robbins Pathology) ed.). Elsevier Health. pp. Ubicación Kindle 33329.
- ^ "Parvovirus B19 | CDC". www.cdc.gov . 24 de agosto de 2023 . Consultado el 8 de mayo de 2024 .
- ^ Slavov SN, Kashima S, Pinto AC, Covas DT (agosto de 2011). "Parvovirus humano B19: consideraciones generales e impacto en pacientes con enfermedad de células falciformes y talasemia y en transfusiones de sangre". FEMS Inmunología y Microbiología Médica . 62 (3): 247–262. doi : 10.1111/j.1574-695X.2011.00819.x . PMID 21585562.
- ^ ab "Complications of Sickle Cell Disease" (Complicaciones de la enfermedad de células falciformes). Centros para el Control y la Prevención de Enfermedades . 22 de mayo de 2024. Consultado el 29 de octubre de 2024 .
- ^ Kavanagh PL, Sprinz PG, Vinci SR, Bauchner H, Wang CJ (diciembre de 2011). "Manejo de niños con enfermedad de células falciformes: una revisión exhaustiva de la literatura". Pediatría . 128 (6): e1552–e1574. doi :10.1542/peds.2010-3686. PMID 22123880. S2CID 14524078. Archivado desde el original el 4 de marzo de 2016.
- ^ Adams RJ, Ohene-Frempong K, Wang W (2001). "La anemia falciforme y el cerebro". Hematología. Sociedad Estadounidense de Hematología. Programa Educativo . 2001 (1): 31–46. doi : 10.1182/asheducation-2001.1.31 . PMID 11722977.
- ^ Adams RJ (noviembre de 2007). «Grandes accidentes cerebrovasculares en personas pequeñas». Archivos de neurología . 64 (11): 1567–1574. doi : 10.1001/archneur.64.11.1567 . PMID 17998439.
- ^ "Coliliiasis". Biblioteca de conceptos médicos de Lecturio . Consultado el 25 de agosto de 2021 .
- ^ abc Martí-Carvajal AJ, Solà I, Agreda-Pérez LH (diciembre de 2019). "Tratamiento de la necrosis avascular del hueso en personas con enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 2019 (12): CD004344. doi :10.1002/14651858.CD004344.pub7. PMC 6894369. PMID 31803937 .
- ^ Chrouser KL, Ajiboye OB, Oyetunji TA, Chang DC (abril de 2011). "Priapismo en los Estados Unidos: el papel cambiante de la enfermedad de células falciformes". American Journal of Surgery . 201 (4): 468–474. doi :10.1016/j.amjsurg.2010.03.017. PMID 21421100.
- ^ Powars DR, Elliott-Mills DD, Chan L, Niland J, Hiti AL, Opas LM, et al. (octubre de 1991). "Insuficiencia renal crónica en la enfermedad de células falciformes: factores de riesgo, evolución clínica y mortalidad". Anales de Medicina Interna . 115 (8): 614–620. doi :10.7326/0003-4819-115-8-614. PMID 1892333.
- ^ Saborio P, Scheinman JI (enero de 1999). "Nefropatía de células falciformes". Revista de la Sociedad Americana de Nefrología . 10 (1): 187–192. doi :10.1681/ASN.V101187. ISSN 1046-6673. PMID 9890326.
- ^ Minniti CP, Eckman J, Sebastiani P, Steinberg MH, Ballas SK (octubre de 2010). "Úlceras en las piernas en la enfermedad de células falciformes". Revista estadounidense de hematología . 85 (10): 831–833. doi :10.1002/ajh.21838. ISSN 0361-8609. PMC 2953786 . PMID 20872960.
- ^ Elagouz M, Jyothi S, Gupta B, Sivaprasad S (julio de 2010). "La enfermedad de células falciformes y el ojo: conceptos antiguos y nuevos". Encuesta de Oftalmología . 55 (4): 359–377. doi :10.1016/j.survophthal.2009.11.004. PMID 20452638.
- ^ Smith WR, Penberthy LT, Bovbjerg VE, McClish DK, Roberts JD, Dahman B, et al. (enero de 2008). "Evaluación diaria del dolor en adultos con enfermedad de células falciformes". Anales de Medicina Interna . 148 (2): 94–101. CiteSeerX 10.1.1.690.5870 . doi :10.7326/0003-4819-148-2-200801150-00004. PMID 18195334. S2CID 34924760.
- ^ Lai YC, Potoka KC, Champion HC, Mora AL, Gladwin MT (junio de 2014). "Hipertensión arterial pulmonar: el síndrome clínico". Circulation Research . 115 (1): 115–130. doi : 10.1161/CIRCRESAHA.115.301146 . PMC 4096686 . PMID 24951762.
- ^ Caughey MC, Poole C, Ataga KI, Hinderliter AL (agosto de 2015). "Presión sistólica estimada de la arteria pulmonar y enfermedad de células falciformes: un metanálisis y una revisión sistemática". British Journal of Haematology . 170 (3): 416–424. doi : 10.1111/bjh.13447 . PMID 25854714. S2CID 23920740.
- ^ Niss O, Quinn CT, Lane A, Daily J, Khoury PR, Bakeer N, et al. (marzo de 2016). "Miocardiopatía con fisiología restrictiva en la enfermedad de células falciformes". JACC. Imágenes cardiovasculares . 9 (3): 243–252. doi :10.1016/j.jcmg.2015.05.013. PMC 4788530. PMID 26897687 .
- ^ Niss O, Fleck R, Makue F, Alsaied T, Desai P, Towbin JA, et al. (julio de 2017). "Asociación entre fibrosis miocárdica difusa y disfunción diastólica en la anemia falciforme". Sangre . 130 (2): 205–213. doi : 10.1182/sangre-2017-02-767624. PMC 5510791 . PMID 28507082.
- ^ Rai P, Niss O, Malik P (noviembre de 2017). "Una reevaluación de los mecanismos subyacentes a las complicaciones cardíacas de la anemia de células falciformes". Pediatric Blood & Cancer . 64 (11): e26607. doi :10.1002/pbc.26607. PMID 28453224. S2CID 24444332.
- ^ Farid Y, Lecat P (2019), "Bioquímica, síntesis de hemoglobina", StatPearls , StatPearls Publishing, PMID 30725597 , consultado el 10 de abril de 2019
- ^ Sankaran VG, Orkin SH (enero de 2013). "El cambio de hemoglobina fetal a hemoglobina adulta". Cold Spring Harbor Perspectives in Medicine . 3 (1): a011643. doi :10.1101/cshperspect.a011643. PMC 3530042 . PMID 23209159.
- ^ ab "Hemoglobinopatías". Brigham and Women's Hospital . Abril de 2002. Consultado el 7 de noviembre de 2024 .
- ^ "Herencia de la anemia falciforme". Sickle Cell Society . Archivado desde el original el 8 de enero de 2024. Consultado el 8 de enero de 2024 .
- ^ "Enfermedad de células falciformes". NORD (Organización Nacional de Enfermedades Raras) . Consultado el 10 de junio de 2019 .
- ^ "Patrones de herencia de trastornos de un solo gen". learn.genetics.utah.edu . Archivado desde el original el 1 de julio de 2019 . Consultado el 1 de julio de 2019 .
- ^ "Enfermedad de células falciformes: causas". Servicio Nacional de Salud . 23 de octubre de 2017 . Consultado el 7 de noviembre de 2024 .
- ^ "Anemia de células falciformes: haplotipo | Aprenda ciencias en Scitable" www.nature.com . Consultado el 12 de octubre de 2023 .
- ^ Green NS, Fabry ME, Kaptue-Noche L, Nagel RL (octubre de 1993). "El haplotipo de Senegal se asocia con una HbF más alta que los haplotipos de Benin y Camerún en niños africanos con anemia de células falciformes". American Journal of Hematology . 44 (2): 145–146. doi :10.1002/ajh.2830440214. PMID 7505527. S2CID 27341091.
- ^ ab Inusa BP, Hsu LL, Kohli N, Patel A, Ominu-Evbota K, Anie KA, et al. (junio de 2019). "Enfermedad de células falciformes: genética, fisiopatología, presentación clínica y tratamiento". Revista internacional de detección neonatal . 5 (2): 20. doi : 10.3390/ijns5020020 . ISSN 2409-515X. PMC 7510211 . PMID 33072979.
- ^ Odièvre MH, Verger E, Silva-Pinto AC, Elion J (octubre de 2011). "Información fisiopatológica sobre la enfermedad de células falciformes". Revista india de investigación médica . 134 (1): 532–537. doi :10.1007/bf00168807. PMC 3237253. PMID 22089617 .
- ^ CDC (22 de mayo de 2024). "Enfermedad de células falciformes (SCD): ¿Qué es el rasgo de células falciformes?". Centros para el Control y la Prevención de Enfermedades . Consultado el 7 de noviembre de 2024 .
- ^ Pitone ML (julio de 2023). "¿Cuál es la conexión entre el rasgo de células falciformes y la malaria? (para adolescentes)". kidshealth.org . Consultado el 31 de octubre de 2024 .
- ^ Morales-Brown L (9 de febrero de 2024). "¿Cuál es la conexión entre la anemia de células falciformes y la malaria?". www.medicalnewstoday.com . Consultado el 31 de octubre de 2024 .
- ^ Uyoga S, Olupot-Olupot P, Connon R, Kiguli S, Opoka RO, Alaroker F, et al. (septiembre de 2022). "Anemia de células falciformes y malaria grave por Plasmodium falciparum: un análisis secundario del ensayo de transfusión y tratamiento de niños africanos (TRACT)". The Lancet Child & Adolescent Health . 6 (9): 606–613. doi :10.1016/s2352-4642(22)00153-5. ISSN 2352-4642. PMC 7613576 . PMID 35785794.
- ^ Luzzatto L (3 de octubre de 2012). "Anemia de células falciformes y malaria". Revista Mediterránea de Hematología y Enfermedades Infecciosas . 4 (1): e2012065. doi :10.4084/mjhid.2012.065. ISSN 2035-3006. PMC 3499995 . PMID 23170194.
- ^ "5.21: Selección natural". Biology LibreTexts . 23 de septiembre de 2016 . Consultado el 31 de octubre de 2024 .
- ^ Kwiatkowski DP (agosto de 2005). "Cómo la malaria ha afectado al genoma humano y qué nos puede enseñar la genética humana sobre la malaria". American Journal of Human Genetics . 77 (2): 171–192. doi :10.1086/432519. PMC 1224522 . PMID 16001361.
- ^ Ponçon N, Toty C, L'Ambert G, Le Goff G, Brengues C, Schaffner F, et al. (febrero de 2007). "Biología y dinámica de los vectores potenciales de la malaria en el sur de Francia". Malaria Journal . 6 (1): 18. doi : 10.1186/1475-2875-6-18 . PMC 1808464 . PMID 17313664.
- ^ Arif SH (19 de marzo de 2008). "Enfermedad de células falciformes y malaria". Indian Journal of Hematology & Blood Transfusion . 23 (3–4): 70–72. doi :10.1007/s12288-008-0001-3. PMC 3453113 . PMID 23100918.
- ^ Cao H, Antonopoulos A, Henderson S, Wassall H, Brewin J, Masson A, et al. (19 de marzo de 2021). "Mannosas de glóbulos rojos como ligandos fagocíticos que median tanto la anemia de células falciformes como la resistencia a la malaria". Nature Communications . 12 (1): 1792. Bibcode :2021NatCo..12.1792C. doi :10.1038/s41467-021-21814-z. ISSN 2041-1723. PMC 7979802 . PMID 33741926.
- ^ Padilla F, Bromberg PA, Jensen WN (1 de mayo de 1973). "El ciclo falciforme-no falciforme: una causa de fragmentación celular que conduce a células deformadas permanentemente". Sangre . 41 (5): 653–660. doi :10.1182/blood.V41.5.653.653. ISSN 0006-4971. PMID 4694082.
- ^ abc Maakaron JE (25 de septiembre de 2024). "Enfermedad de células falciformes (ECF): descripción general". Medscape .
- ^ "¿Cómo causa la enfermedad de células falciformes?". Archivado desde el original el 23 de septiembre de 2010. Consultado el 27 de noviembre de 2010 .
- ^ "Datos sobre la sangre y las células sanguíneas". Memorial Sloan Kettering Cancer Center . 17 de diciembre de 2021 . Consultado el 11 de noviembre de 2024 .
- ^ Gbotosho OT, Kapetanaki MG, Kato GJ (27 de enero de 2021). "Las peores cosas de la vida son gratis: el papel del hemo libre en la enfermedad de células falciformes". Frontiers in Immunology . 11 . doi : 10.3389/fimmu.2020.561917 . ISSN 1664-3224. PMC 7873693 . PMID 33584641.
- ^ Sundd P, Gladwin MT, Novelli EM (24 de enero de 2019). "Fisiopatología de la enfermedad de células falciformes". Revisión anual de patología: mecanismos de la enfermedad . 14 (1): 263–292. doi :10.1146/annurev-pathmechdis-012418-012838. ISSN 1553-4006. PMC 7053558. PMID 30332562 .
- ^ Kruzliak P (19 de julio de 2012), "Manifestaciones hematológicas de la enfermedad celíaca", Enfermedad celíaca: de la fisiopatología a las terapias avanzadas , InTech, doi : 10.5772/31233 , ISBN 978-953-51-0684-5
- ^ Atkinson K, Mabey D (23 de mayo de 2019). Revolucionando la medicina tropical: pruebas en el punto de atención, nuevas tecnologías de imágenes y salud digital. Wiley. p. 227. ISBN 978-1-119-28265-5.
- ^ McPherson RA, Pincus MR (2017). Henry's Clinical Diagnosis and Management by Laboratory Methods (23.ª ed.). Elsevier Health Sciences. pág. 578. ISBN 978-0-323-41315-2.
- ^ Clarke GM, Higgins TN (agosto de 2000). "Investigación de laboratorio de hemoglobinopatías y talasemias: revisión y actualización". Química clínica . 46 (8 Pt 2): 1284–1290. doi : 10.1093/clinchem/46.8.1284 . PMID 10926923. Archivado desde el original el 20 de marzo de 2008.
- ^ "Sociedad Nacional de Asesores Genéticos: Acerca de los Asesores Genéticos". www.nsgc.org . Consultado el 24 de febrero de 2021 .
- ^ "ABGC – Información para asesores genéticos certificados | ABGC". www.abgc.net . Archivado desde el original el 19 de abril de 2021 . Consultado el 23 de febrero de 2021 .
- ^ Colah, RB, Gorakshakar, AC y Nadkarni, AH (2011). Enfoques invasivos y no invasivos para el diagnóstico prenatal de hemoglobinopatías: experiencias de la India. The Indian Journal of Medical Research, 134(4), 552–560.
- ^ Lee, C., Davies, S. y Dezatoux, C. (2000). Cribado neonatal de la enfermedad de células falciformes. The Cochrane Collaboration . John Wiley & Sons, Ltd.
- ^ Stallings E (27 de julio de 2019). "Los asesores genéticos de color abordan las disparidades raciales y étnicas en la atención médica". NPR . Consultado el 23 de febrero de 2021 .
- ^ Martin C, Pialoux V, Faes C, Charrin E, Skinner S, Connes P (febrero de 2018). "¿La actividad física aumenta o disminuye el riesgo de complicaciones de la enfermedad de células falciformes?". British Journal of Sports Medicine . 52 (4): 214–218. doi :10.1136/bjsports-2015-095317. PMID 26701924. S2CID 24464344.
- ^ "Cómo mantenerse sano con la enfermedad de células falciformes - Centro de talasemia y células falciformes de Brent" www.sickle-thal.nwlh.nhs.uk . Archivado desde el original el 3 de octubre de 2019 . Consultado el 4 de octubre de 2019 .
- ^ "Nutrición para el niño con anemia falciforme". www.eatright.org . Archivado desde el original el 19 de junio de 2020 . Consultado el 5 de octubre de 2019 .
- ^ Soe HH, Abas AB, Than NN, Ni H, Singh J, Said AR, et al. (mayo de 2020). "Suplementación con vitamina D para la enfermedad de células falciformes". Base de datos Cochrane de revisiones sistemáticas . 5 (9): CD010858. doi :10.1002/14651858.CD010858.pub3. PMC 7386793. PMID 32462740 .
- ^ Oficina del Comisionado (7 de julio de 2017). «Comunicados de prensa: la FDA aprueba un nuevo tratamiento para la anemia falciforme». www.fda.gov . Archivado desde el original el 10 de julio de 2017. Consultado el 10 de julio de 2017 .
- ^ "Manejo basado en evidencia de la enfermedad de células falciformes" (PDF) . 2014. Consultado el 16 de noviembre de 2017.
Penicilina profiláctica dos veces al día comenzando en la primera infancia y continuando hasta al menos los 5 años.
- ^ Dixit R, Nettem S, Madan SS, Soe HH, Abas AB, Vance LD, et al. (marzo de 2018). "Suplementación con folato en personas con enfermedad de células falciformes". Base de datos Cochrane de revisiones sistemáticas . 3 (4): CD011130. doi :10.1002/14651858.CD011130.pub3. PMC 5440187. PMID 29546732 .
- ^ Oniyangi O, Omari AA (noviembre de 2019). "Quimioprofilaxis de la malaria en la enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 2019 (11). doi :10.1002/14651858.CD003489.pub2. PMC 6532723. PMID 31681984.
- ^ Carroll CP (enero de 2020). "Tratamiento con opioides para el dolor agudo y crónico en pacientes con enfermedad de células falciformes". Neuroscience Letters . 714 . Elsevier BV: 134534. doi :10.1016/j.neulet.2019.134534. PMID 31593753. S2CID 203667575.
- ^ Okomo U, Meremikwu MM (julio de 2017). "Terapia de reemplazo de líquidos para episodios agudos de dolor en personas con enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 7 (4): CD005406. doi :10.1002/14651858.CD005406.pub5. PMC 6483538 . PMID 28759112.
- ^ "La FDA aprueba crizanlizumab-tmca para la anemia de células falciformes". Administración de Alimentos y Medicamentos de Estados Unidos. 15 de noviembre de 2019. Consultado el 12 de diciembre de 2023 .
- ^ ab Adams RJ, McKie VC, Hsu L, Files B, Vichinsky E, Pegelow C, et al. (julio de 1998). "Prevención de un primer accidente cerebrovascular mediante transfusiones en niños con anemia de células falciformes y resultados anormales en la ecografía Doppler transcraneal". The New England Journal of Medicine . 339 (1): 5–11. doi : 10.1056/NEJM199807023390102 . PMID 9647873.
- ^ ab Kolata G (24 de mayo de 2021). "Estas hermanas con anemia falciforme sufrieron accidentes cerebrovasculares devastadores y prevenibles". The New York Times .
- ^ Aldrich TK, Nagel RL (1998). "Complicaciones pulmonares de la enfermedad de células falciformes". En Reynolds HY, Bone RC, Dantzker DR, George RB, Matthay RA (eds.). Medicina pulmonar y de cuidados intensivos (6.ª ed.). St. Louis: Mosby. págs. 1–10. ISBN 978-0-8151-1371-3.
- ^ Martí-Carvajal AJ, Conterno LO, Knight-Madden JM (septiembre de 2019). "Antibióticos para el tratamiento del síndrome torácico agudo en personas con enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 9 (4): CD006110. doi :10.1002/14651858.CD006110.pub5. PMC 6749554 . PMID 31531967.
- ^ Dolatkhah R, Dastgiri S (enero de 2020). "Transfusiones de sangre para el tratamiento del síndrome torácico agudo en personas con enfermedad de células falciformes". Base de datos Cochrane de revisiones sistemáticas . 1 (1): CD007843. doi : 10.1002/14651858.CD007843.pub4. PMC 6984655. PMID 31942751.
- ^ ab Rankine-Mullings AE, Nevitt SJ (septiembre de 2022). "Hidroxiurea (hidroxicarbamida) para la anemia de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 2022 (10): CD002202. doi : 10.1002/14651858.CD002202.pub3. PMC 9435593. PMID 36047926.
- ^ Charache S , Terrin ML, Moore RD, Dover GJ, Barton FB, Eckert SV, et al. (mayo de 1995). "Efecto de la hidroxiurea en la frecuencia de crisis dolorosas en la anemia de células falciformes. Investigadores del estudio multicéntrico de la hidroxiurea en la anemia de células falciformes". The New England Journal of Medicine . 332 (20): 1317–1322. doi : 10.1056/NEJM199505183322001 . PMID 7715639.
- ^ Steinberg MH, Barton F, Castro O, Pegelow CH, Ballas SK, Kutlar A, et al. (abril de 2003). "Efecto de la hidroxiurea en la mortalidad y la morbilidad en la anemia de células falciformes en adultos: riesgos y beneficios hasta 9 años de tratamiento". The Journal of the American Medical Association . 289 (13): 1645–1651. doi : 10.1001/jama.289.13.1645 . PMID 12672732.
- ^ Platt OS (marzo de 2008). "Hidroxiurea para el tratamiento de la anemia de células falciformes". The New England Journal of Medicine . 358 (13): 1362–1369. doi :10.1056/NEJMct0708272. PMID 18367739. S2CID 351061.
- ^ Centro de Evaluación e Investigación de Medicamentos (25 de noviembre de 2019). «La FDA aprueba el voxelotor para la enfermedad de células falciformes». FDA . Consultado el 9 de diciembre de 2019 .
- ^ "EMA recomienda la suspensión del medicamento Oxbryta para la anemia falciforme | Agencia Europea de Medicamentos (EMA)". www.ema.europa.eu . 26 de septiembre de 2024 . Consultado el 11 de octubre de 2024 .
- ^ Research Cf (26 de septiembre de 2024). "La FDA está alertando a los pacientes y a los profesionales de la salud sobre la retirada voluntaria de Oxbryta del mercado debido a problemas de seguridad". FDA .
- ^ Callaway D, Chawla A, Sprinz P (noviembre de 2020). "Fisioterapia en pacientes pediátricos y adultos jóvenes con enfermedad de células falciformes: evaluación de posibles beneficios y barreras". Journal of Pediatric Hematology/Oncology . 42 (8): 463–466. doi :10.1097/MPH.0000000000001888. ISSN 1536-3678. PMID 32815878.
- ^ Zanoni CT, Galvão F, Maria RM, Zulli R, Ricciardi JB, Cliquet a J, et al. (2020). "Efectividad de un programa de ejercicios terapéuticos en el hogar sobre el dolor lumbar y la funcionalidad en pacientes con enfermedad de células falciformes (ECF)". Hematología, transfusión y terapia celular . 43 (3): 268–279. doi :10.1016/j.htct.2020.05.004. PMC 8446254 . PMID 32680757.
- ^ Anie KA, Green J (mayo de 2015). "Terapias psicológicas para la enfermedad de células falciformes y el dolor". Base de datos Cochrane de revisiones sistemáticas . 2015 (5): CD001916. doi :10.1002/14651858.CD001916.pub3. PMC 7063720. PMID 25966336 .
- ^ Drasar E, Igbineweka N, Vasavda N, Free M, Awogbade M, Allman M, et al. (marzo de 2011). "Uso de transfusiones de sangre entre adultos con enfermedad de células falciformes: la experiencia de una única institución durante diez años". British Journal of Haematology . 152 (6): 766–770. doi : 10.1111/j.1365-2141.2010.08451.x . PMID 21275951. S2CID 44562296.
- ^ Gyang E, Yeom K, Hoppe C, Partap S, Jeng M (enero de 2011). "Efecto de la terapia de transfusión crónica de glóbulos rojos en las vasculopatías y los infartos silenciosos en pacientes con enfermedad de células falciformes". American Journal of Hematology . 86 (1): 104–106. doi : 10.1002/ajh.21901 . PMID 21117059.
- ^ Mirre E, Brousse V, Berteloot L, Lambot-Juhan K, Verlhac S, Boulat C, et al. (marzo de 2010). "Viabilidad y eficacia de la transfusión crónica para la prevención del ictus en niños con enfermedad de células falciformes". Revista Europea de Hematología . 84 (3): 259–265. doi :10.1111/j.1600-0609.2009.01379.x. PMID 19912310. S2CID 24316310.
- ^ Walters MC, Patience M, Leisenring W, Eckman JR, Scott JP, Mentzer WC, et al. (agosto de 1996). "Trasplante de médula ósea para la enfermedad de células falciformes". The New England Journal of Medicine . 335 (6): 369–376. doi : 10.1056/NEJM199608083350601 . PMID 8663884. S2CID 25256772.
- ^ Kaiser J (5 de diciembre de 2020). "CRISPR y otra estrategia genética corrigen defectos celulares en dos trastornos sanguíneos comunes". ScienceMag.org . Science . Consultado el 7 de diciembre de 2020 .
... equipos informan que dos estrategias para reparar directamente células sanguíneas defectuosas han mejorado drásticamente la salud de un puñado de personas con estas enfermedades genéticas.
- ^ abc Rotin LE, Viswabandya A, Kumar R, Patriquin CJ, Kuo KH (31 de diciembre de 2023). "Una revisión sistemática que compara el trasplante alogénico de células madre hematopoyéticas con la terapia génica en la enfermedad de células falciformes". Hematología . 28 (1). doi : 10.1080/16078454.2022.2163357 . ISSN 1607-8454. PMID 36728286.
- ^ ab Oringanje C, Nemecek E, Oniyangi O (julio de 2020). "Trasplante de células madre hematopoyéticas para personas con enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 2020 ( 7): CD007001. doi :10.1002/14651858.CD007001.pub5. PMC 7390490. PMID 32617981.
- ^ Dovern E, Aydin M, DeBaun MR, Alizade K, Biemond BJ, Nur E (2024). "Efecto del trasplante alogénico de células madre hematopoyéticas en las complicaciones orgánicas relacionadas con la enfermedad de células falciformes: una revisión sistemática y un metanálisis". American Journal of Hematology . 99 (6): 1129–1141. doi : 10.1002/ajh.27297 . ISSN 1096-8652. PMID 38517255.
- ^ ab "La MHRA autoriza la primera terapia génica del mundo que tiene como objetivo curar la anemia falciforme y la beta-talasemia dependiente de transfusiones". Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) (Nota de prensa). 16 de noviembre de 2023. Archivado desde el original el 25 de noviembre de 2023 . Consultado el 8 de diciembre de 2023 .
- ^ "Una vida sin anemia falciforme atrae a un niño que completó una terapia genética". The New York Times .
- ^ Kumar V, Abbas AK, Fausto N, Aster J (28 de mayo de 2009). Robbins y Cotran Pathologic Basis of Disease (Edición profesional: Expert Consult – Online (Robbins Pathology) ed.). Elsevier Health. pp. Ubicaciones de Kindle 33530–33531.
- ^ Wierenga KJ, Hambleton IR, Lewis NA (marzo de 2001). "Estimaciones de supervivencia para pacientes con enfermedad de células falciformes homocigótica en Jamaica: un estudio de población basado en la clínica". Lancet . 357 (9257): 680–683. doi :10.1016/s0140-6736(00)04132-5. PMID 11247552. S2CID 37012133.
- ^ Costa FF, Conran N (2016). Anemia de células falciformes: de la ciencia básica a la práctica clínica. Springer. pág. 35. ISBN 9783319067131. Recuperado el 8 de mayo de 2016 .
- ^ Prabhakar H, Haywood C, Molokie R (mayo de 2010). "Enfermedad de células falciformes en los Estados Unidos: una mirada hacia atrás y hacia adelante a 100 años de progreso en el tratamiento y la supervivencia". American Journal of Hematology . 85 (5): 346–353. doi : 10.1002/ajh.21676 . PMID 20425797.
- ^ Academias Nacionales de Ciencias, Ingeniería y Medicina, División de Salud y Medicina, Junta de Salud de la Población y Práctica de Salud Pública, Comité para el Abordaje de la Anemia Falciforme (2020). Abordar la Anemia Falciforme: Un Plan Estratégico y un Plan de Acción. Washington: National Academies Press. p. 1. ISBN 978-0-309-66960-3.
- ^ Weatherall DJ, Clegg JB (2001). "Trastornos hereditarios de la hemoglobina: un problema de salud mundial en aumento". Boletín de la Organización Mundial de la Salud . 79 (8): 704–712. PMC 2566499 . PMID 11545326.
- ^ Roberts I, de Montalembert M (julio de 2007). "La enfermedad de células falciformes como paradigma de la hematología de la inmigración: nuevos retos para los hematólogos en Europa". Haematologica . 92 (7): 865–871. doi : 10.3324/haematol.11474 . PMID 17606434.
- ^ Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (Colaboradores de GBD 2015 Mortality and Causes of Death) (octubre de 2016). "Esperanza de vida global, regional y nacional, mortalidad por todas las causas y mortalidad por causas específicas para 249 causas de muerte, 1980-2015: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2015". Lancet . 388 (10053): 1459–1544. doi :10.1016/S0140-6736(16)31012-1. PMC 5388903 . PMID 27733281.
- ^ Wellems TE, Hayton K, Fairhurst RM (septiembre de 2009). "El impacto del parasitismo de la malaria: de los corpúsculos a las comunidades". The Journal of Clinical Investigation . 119 (9): 2496–2505. doi :10.1172/JCI38307. PMC 2735907 . PMID 19729847.
- ^ OMS. «Anemia falciforme – Informe de la Secretaría» (PDF) . Archivado desde el original (PDF) el 4 de enero de 2011. Consultado el 27 de noviembre de 2010 .
- ^ Aidoo M, Terlouw DJ, Kolczak MS, McElroy PD, ter Kuile FO, Kariuki S, et al. (abril de 2002). "Efectos protectores del gen de la anemia falciforme contra la morbilidad y la mortalidad por malaria". Lancet . 359 (9314): 1311–1312. doi :10.1016/S0140-6736(02)08273-9. PMID 11965279. S2CID 37952036.
- ^ abc Tusuubira SK, Nakayinga R, Mwambi B, Odda J, Kiconco S, Komuhangi A (abril de 2018). "Conocimientos, percepción y prácticas sobre la anemia de células falciformes: una encuesta comunitaria entre adultos en la división de Lubaga, Kampala Uganda". Salud Pública de BMC . 18 (1): 561. doi : 10.1186/s12889-018-5496-4 . PMC 5924488 . PMID 29703184.
- ^ Ndeezi G, Kiyaga C, Hernandez AG, Munube D, Howard TA, Ssewanyana I, et al. (Marzo de 2016). "Carga del rasgo y la enfermedad de células falciformes en el estudio de vigilancia de la anemia falciforme de Uganda (US3): un estudio transversal". La lanceta. Salud Global . 4 (3): e195–e200. doi : 10.1016/S2214-109X(15)00288-0 . PMID 26833239.
- ^ Instituto Nacional del Corazón, los Pulmones y la Sangre. «Anemia falciforme: puntos clave». Archivado desde el original el 2 de diciembre de 2010. Consultado el 27 de noviembre de 2010 .
- ^ "Datos y estadísticas sobre la enfermedad de células falciformes | CDC". Centros para el Control y la Prevención de Enfermedades . 31 de agosto de 2016 . Consultado el 13 de diciembre de 2019 .
- ^ "Septiembre es el mes de concientización sobre la anemia falciforme". CDC. Archivado desde el original el 27 de septiembre de 2010. Consultado el 6 de febrero de 2011 .
- ^ "Rasgo de células falciformes". Sociedad Estadounidense de Hematología . 8 de septiembre de 2017. Consultado el 13 de diciembre de 2019 .
- ^ "Nombre del trastorno: anemia falciforme". Evaluación del recién nacido. Archivado desde el original el 28 de septiembre de 2016. Consultado el 11 de octubre de 2016 .
- ^ "predeterminado – Stanford Children's Health". www.stanfordchildrens.org . Consultado el 14 de marzo de 2020 .
- ^ Edwards QT, Seibert D, Macri C, Covington C, Tilghman J (noviembre de 2004). "Evaluación de la etnicidad en el asesoramiento previo a la concepción: genética: lo que los profesionales de enfermería deben saber". Revista de la Academia Estadounidense de Enfermeras Profesionales . 16 (11): 472–480. doi :10.1111/j.1745-7599.2004.tb00426.x. PMID 15617360. S2CID 7644129.
- ^ "Los pacientes con anemia falciforme sufren discriminación, mala atención y vidas más cortas". NPR.org . 4 de noviembre de 2017 . Consultado el 12 de noviembre de 2017 .
- ^ Vlachadis N, Vrachnis N (15 de noviembre de 2022). "Una revisión de la enfermedad de células falciformes". JAMA . 328 (19): 1979. doi :10.1001/jama.2022.16732. ISSN 0098-7484. PMID 36378213.
- ^ Bardakdjian J, Wajcman H (septiembre de 2004). «[Epidemiología de la anemia de células falciformes]». La Revue du Praticien (en francés). 54 (14): 1531–1533. PMID 15558961.
- ^ Beillat M, Durand-Zaleski I, Pirenne F, Bénard S, Chillotti L, Galacteros F (21 de septiembre de 2023). "Prevalencia y costo de la anemia falciforme en Francia: análisis del mundo real utilizando datos del Echantillon Généraliste des Bénéficiaires". Fronteras en Salud Pública . 11 : 1215605. doi : 10.3389/fpubh.2023.1215605 . PMC 10552641 . PMID 37808997.
- ^ Thuret I, Sarles J, Merono F, Suzineau E, Collomb J, Lena-Russo D, et al. (junio de 2010). "Cribado neonatal de la enfermedad de células falciformes en Francia: evaluación del proceso selectivo". Journal of Clinical Pathology . 63 (6): 548–551. doi :10.1136/jcp.2009.068874. PMID 20498028. S2CID 22391674.
- ^ "Heredar la anemia de células falciformes – Viva bien – Opciones del NHS". www.nhs.uk . 23 de octubre de 2017. Archivado desde el original el 2 de diciembre de 2014.
- ^ "Anemia de células falciformes: opciones del NHS". www.nhs.uk . 23 de octubre de 2017. Archivado desde el original el 13 de diciembre de 2011.
- ^ "¿A quién se le ofrece la prueba de detección y cuándo?". screening.nhs.uk . Archivado desde el original el 31 de diciembre de 2014.
- ^ "Donar sangre – Recursos – Anemia falciforme y donación de sangre". Donar sangre . Archivado desde el original el 31 de diciembre de 2014.
- ^ "¿Por qué la sangre de donantes afrocaribeños es especial?". sicklecellsociety.org . Archivado desde el original el 30 de diciembre de 2014.
- ^ Jastaniah W (2011). "Epidemiología de la enfermedad de células falciformes en Arabia Saudita". Anales de Medicina Saudita . 31 (3): 289–293. doi : 10.4103/0256-4947.81540 . PMC 3119971 . PMID 21623060.
- ^ Memish ZA, Saeedi MY (2011). "Resultados de seis años del programa nacional de detección prematrimonial y asesoramiento genético para la anemia de células falciformes y la β-talasemia en Arabia Saudita". Anales de Medicina Saudita . 31 (3): 229–235. doi : 10.4103/0256-4947.81527 . PMC 3119961 . PMID 21623050.
- ^ Al Arrayed S (1995). "Características de la enfermedad de células falciformes en Bahréin". Revista de Salud del Mediterráneo Oriental . 1 (1). Archivado desde el original el 8 de octubre de 2016.
- ^ Al Arrayed S, Al Hajeri A (2010). "Concienciación pública sobre la enfermedad de células falciformes en Bahréin". Anales de Medicina Saudita . 30 (4): 284–288. doi : 10.4103/0256-4947.65256 . PMC 2931779 . PMID 20622345.
- ^ "Anemia de células falciformes". Sociedad Estadounidense de Hematología . 16 de diciembre de 2014. Archivado desde el original el 25 de junio de 2017. Consultado el 1 de mayo de 2017 .
- ^ Awasthy N, Aggarwal KC, Goyal PC, Prasad MS, Saluja S, Sharma M (2008). "Enfermedad de células falciformes: experiencia de un centro de atención terciaria en un área no endémica". Anales de Medicina Tropical y Salud Pública . 1 (1): 1–4. doi : 10.4103/1755-6783.43069 (inactivo el 1 de noviembre de 2024).
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace ) - ^ "La vida con anemia falciforme – Nation – Nepali Times". Archivado desde el original el 24 de junio de 2015.
- ^ Asnani MR, McCaw-Binns AM, Reid ME (2011). "Riesgo excesivo de muerte materna por enfermedad de células falciformes en Jamaica: 1998-2007". PLOS ONE . 6 (10): e26281. Bibcode :2011PLoSO...626281A. doi : 10.1371/journal.pone.0026281 . PMC 3200316 . PMID 22039456.
- ^ Lebby R (1846). "Caso de ausencia del bazo". Southern J of Med Pharmacol . 1 : 481–3.
- ^ abc Ballas SK, Gupta K, Adams-Graves P (noviembre de 2012). "Dolor de células falciformes: una reevaluación crítica". Blood . 120 (18): 3647–3656. doi : 10.1182/blood-2012-04-383430 . PMID 22923496.
- ^ Herrick JB (1 de noviembre de 1910). "Glóbulos rojos peculiares, alargados y con forma de hoz en un caso de anemia grave". Archivos de Medicina Interna . 6 (5): 179–184. doi :10.1001/archinte.1910.00050330050003.; reimpreso como Herrick JB (2001). "Glóbulos rojos peculiares, alargados y con forma de hoz en un caso de anemia grave. 1910". The Yale Journal of Biology and Medicine . 74 (3): 179–184. PMC 2588723 . PMID 11501714.
- ^ Washburn RE (1911). "Glóbulos rojos peculiares, alargados y con forma de hoz en un caso de anemia grave". The Virginia Medical Semi-Monthly . 15 (21): 490–493.
- ^ "El Hospital de la Universidad de Virginia celebra su centenario". Universidad de Virginia. Archivado desde el original el 31 de enero de 2015. Consultado el 28 de enero de 2015 .
- ^ Mason VR (1922). "Anemia de células falciformes". Revista de la Asociación Médica Estadounidense . 79 (16): 1318–1320. doi :10.1001/jama.1922.02640160038012.Reimpreso en Mason VR (octubre de 1985). "Artículo emblemático del 14 de octubre de 1922: anemia de células falciformes. Por VR Mason". Revista de la Asociación Médica Estadounidense . 254 (14): 1955–1957. doi :10.1001/jama.254.14.1955. PMID 3900438.
- ^ Pauling L, Itano HA (noviembre de 1949). "La anemia de células falciformes es una enfermedad molecular". Science . 110 (2865): 543–548. Bibcode :1949Sci...110..543P. doi :10.1126/science.110.2865.543. PMID 15395398. S2CID 31674765.
- ^ Ingram VM (octubre de 1956). "Una diferencia química específica entre las globinas de la hemoglobina humana normal y la de la anemia de células falciformes". Nature . 178 (4537): 792–794. Bibcode :1956Natur.178..792I. doi :10.1038/178792a0. PMID 13369537. S2CID 4167855.
- ^ "Foster, Gloria". Base de datos de datos históricos de Facts On File . Archivado desde el original el 5 de marzo de 2016. Consultado el 25 de febrero de 2015 .
- ^ Richard-Lenoble D, Toublanc JE, Zinsou RD, Kombila M, Carme B (1980). "[Resultados de un estudio sistemático de la drepanocitosis en 1.500 gaboneses mediante electroforesis de hemoglobina]" [Resultados de un estudio sistemático de la drepanocitosis en 1.500 gaboneses mediante electroforesis de hemoglobina]. Bulletin de la Société de Pathologie Exotique et de ses Filiales (en francés). 73 (2): 200–206. PMID 7460122.
- ^ Srikanthan S (2023). "Discapacidad controvertida: enfermedad de células falciformes". Salud y trabajo social . 48 (3): 209–216. doi :10.1093/hsw/hlad014. PMID 37315205.
- ^ "Sentencia de la Seguridad Social: SSR 2017-3p". Administración de la Seguridad Social de Estados Unidos . Consultado el 15 de enero de 2018 .
- ^ "Federal Register, Volumen 82, número 178 (viernes 15 de septiembre de 2017)". Oficina de Publicaciones del Gobierno de Estados Unidos (GPO) . Consultado el 15 de enero de 2018 .
- ^ Bulgin D, Tanabe P, Jenerette C (agosto de 2018). "Estigma de la enfermedad de células falciformes: una revisión sistemática". Problemas en enfermería de salud mental . 39 (8): 675–686. doi :10.1080/01612840.2018.1443530. PMC 6186193 . PMID 29652215.
- ^ Washington HA (2006). Apartheid médico: la oscura historia de la experimentación médica con los afroamericanos desde la época colonial hasta el presente (1.ª edición de bolsillo). Nueva York: Harlem Moon. ISBN 978-0-7679-1547-2.OCLC 192050177 .
- ^ abcdefgh Tusuubira SK, Naggawa T, Nakamoga V (octubre de 2019). "¿Unirse o no unirse? Un caso de clubes de células falciformes, estigma y discriminación en las escuelas secundarias del distrito de Butambala, Uganda". Salud, Medicina y Terapéutica del Adolescente . 10 : 145-152. doi : 10.2147/AHMT.S223956 . PMC 6778728 . PMID 31632168.
- ^ abcdefg «Asociación de células falciformes de Uganda». Asociación de células falciformes de Uganda . Consultado el 7 de abril de 2021 .
- ^ Okwi AL, Byarugaba W, Ndugwa CM, Parkes A, Ocaido M, Tumwine JK (septiembre de 2009). "Carencias de conocimiento, actitudes y creencias de las comunidades sobre la anemia de células falciformes en el este y el oeste de Uganda". Revista médica de África Oriental . 86 (9): 442–449. doi : 10.4314/eamj.v86i9.54167 . PMID 21644415.
- ^ abcde Marsh VM, Kamuya DM, Molyneux SS (agosto de 2011). "'Todos sus hijos nacen así': experiencias de género del estigma en familias afectadas por el trastorno de células falciformes en la Kenia rural". Ethnicity & Health . 16 (4–5): 343–359. doi :10.1080/13557858.2010.541903. PMC 3534410 . PMID 21797722.
- ^ "Nuestra visión y misión: Fundación Uganda para el rescate de la enfermedad de células falciformes". 13 de mayo de 2017. Consultado el 6 de abril de 2021 .
- ^ ab "Antecedentes: Fundación Uganda para el Rescate de Células Falciformes". 13 de mayo de 2017. Consultado el 6 de abril de 2021 .
- ^ Sehlo MG, Kamfar HZ (abril de 2015). "Depresión y calidad de vida en niños con enfermedad de células falciformes: el efecto del apoyo social". BMC Psychiatry . 15 (1): 78. doi : 10.1186/s12888-015-0461-6 . PMC 4394397 . PMID 25880537.
- ^ "London Eye: no debería necesitar un programa de mejora". Health Service Journal . 27 de julio de 2022 . Consultado el 28 de septiembre de 2022 .
- ^ "Mejor protección y apoyo para las personas con enfermedad de células falciformes". The Voice . Octubre de 2022. págs. 16-17 . Consultado el 7 de octubre de 2022 .
- ^ Rylatt A (7 de octubre de 2022). "Nadie está escuchando" (PDF) .
- ^ "El NHS lanza una campaña para salvar vidas contra la anemia falciforme". 7 de octubre de 2022.
- ^ Olowoyeye A, Okwundu CI (noviembre de 2020). "Terapia génica para la enfermedad de células falciformes". Base de Datos Cochrane de Revisiones Sistemáticas . 2020 (11): CD007652. doi :10.1002/14651858.CD007652.pub7. PMC 8275984. PMID 33251574 .
- ^ Pawliuk R, Westerman KA, Fabry ME, Payen E, Tighe R, Bouhassira EE, et al. (Diciembre de 2001). "Corrección de la anemia de células falciformes en modelos de ratones transgénicos mediante terapia génica". Ciencia . 294 (5550): 2368–2371. Código bibliográfico : 2001 Ciencia... 294.2368P. doi : 10.1126/ciencia.1065806. PMID 11743206. S2CID 25607771.
- ^ Wilson JF (18 de marzo de 2002). «La terapia génica murina corrige los síntomas de la anemia falciforme». The Scientist – Revista de ciencias de la vida . Consultado el 17 de diciembre de 2014 .
- ^ St. Jude Children's Research Hospital (4 de diciembre de 2008). "La terapia genética corrige la anemia falciforme en un estudio de laboratorio". ScienceDaily. Archivado desde el original el 13 de diciembre de 2014. Consultado el 17 de diciembre de 2014 .
- ^ Número de ensayo clínico NCT02247843 para "Terapia génica con células madre para la enfermedad de células falciformes" en ClinicalTrials.gov
- ^ Número de ensayo clínico NCT00012545 para "Recolección y almacenamiento de células madre del cordón umbilical para el tratamiento de la enfermedad de células falciformes" en ClinicalTrials.gov
- ^ Ribeil JA, Hacein-Bey-Abina S, Payen E, Magnani A, Semeraro M, Magrin E, et al. (marzo de 2017). "Terapia génica en un paciente con enfermedad de células falciformes". The New England Journal of Medicine . 376 (9): 848–855. doi : 10.1056/NEJMoa1609677 . PMID 28249145. S2CID 5128871.
- ^ Kolata G (27 de enero de 2019). «Estos pacientes padecían anemia falciforme. Las terapias experimentales podrían haberlos curado». The New York Times . Consultado el 28 de enero de 2019 .
- ^ Dever DP, Bak RO, Reinisch A, Camarena J, Washington G, Nicolas CE, et al. (noviembre de 2016). "Focalización del gen de la β-globina mediante CRISPR/Cas9 en células madre hematopoyéticas humanas". Nature . 539 (7629): 384–389. Bibcode :2016Natur.539..384D. doi :10.1038/nature20134. PMC 5898607 . PMID 27820943.
- ^ "Por primera vez, médicos estadounidenses utilizan la herramienta CRISPR para tratar a pacientes con trastornos genéticos". NPR . Consultado el 31 de julio de 2019 .
- ^ Zipkin M (6 de diciembre de 2019). "El "momento magnífico" de CRISPR en la clínica". Nature Biotechnology . doi :10.1038/d41587-019-00035-2. PMID 33277639. S2CID 213060203.
- ^ Persaud A, Desine S, Blizinsky K, Bonham VL (agosto de 2019). "Un enfoque CRISPR sobre las actitudes y creencias hacia la edición del genoma somático de las partes interesadas dentro de la comunidad de la enfermedad de células falciformes". Genética en Medicina . 21 (8): 1726–1734. doi :10.1038/s41436-018-0409-6. PMC 6606394 . PMID 30581191.
- ^ Walker M (15 de enero de 2018). "Gene Therapy". Sickle Cell Disease News . Consultado el 14 de marzo de 2020 .
- ^ ab Kassim AA, Sharma D (diciembre de 2017). "Trasplante de células madre hematopoyéticas para la enfermedad de células falciformes: el panorama cambiante". Hematología/Oncología y Terapia con Células Madre . 10 (4): 259–266. doi : 10.1016/j.hemonc.2017.05.008 . PMID 28641096.
Lectura adicional
- Brown RT, ed. (2006). Manual completo sobre el cáncer infantil y la enfermedad de células falciformes: un enfoque biopsicosocial. Oxford University Press. ISBN 978-0-19-516985-0.
- Hill SA (2003). Manejo de la enfermedad de células falciformes en familias de bajos ingresos. Temple University Press. ISBN 978-1-59213-195-2.
- Sargento GR, Sargento BE (2001). Enfermedad de células falciformes. Oxford University Press. ISBN 978-0-19-263036-0.
- Tapper M (1999). En la sangre: anemia de células falciformes y la política racial . University of Pennsylvania Press. ISBN 978-0-8122-3471-8.

