Finerenona
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Kerendia |
| Otros nombres | BAHÍA 94-8862 |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a621038 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Oral |
| Clase de droga | Diurético ahorrador de potasio |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| Química biológica |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.247.614 |
| Datos químicos y físicos | |
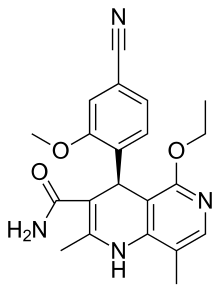
| Fórmula | C21H22N4O3 |
| Masa molar | 378,432 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
Finerenona , comercializada bajo la marca Kerendia 10 o 20 mg entre otras, es un medicamento utilizado para reducir el riesgo de deterioro de la función renal, insuficiencia renal , muerte cardiovascular, ataques cardíacos no fatales y hospitalización por insuficiencia cardíaca en adultos con enfermedad renal crónica asociada con diabetes tipo 2. [8] Finerenona es un antagonista del receptor de mineralocorticoides no esteroideo (MRA). [7] Se toma por vía oral (tragado por la boca).
Los efectos secundarios comunes incluyen hipercalemia (niveles altos de potasio) (normal 3,5-5,5 mg/dl), hipotensión (presión arterial baja) e hiponatremia (niveles bajos de sodio). [8]
La finerenona fue aprobada para uso médico en los Estados Unidos en julio de 2021, [8] [10] y en la Unión Europea en febrero de 2022. [9] La Administración de Alimentos y Medicamentos de los Estados Unidos la considera un medicamento de primera clase . [11]
Usos médicos
En los Estados Unidos, la finerenona está indicada para reducir el riesgo de deterioro de la función renal, insuficiencia renal, muerte cardiovascular, ataques cardíacos no fatales y hospitalización por insuficiencia cardíaca en adultos con enfermedad renal crónica asociada con diabetes tipo 2. [8]
En la Unión Europea, la finerenona está indicada para el tratamiento de la enfermedad renal crónica (estadio 3 y 4 con albuminuria) asociada con la diabetes tipo 2 en adultos. [9]
Farmacología
La finerenona tiene menos afinidad relativa con otros receptores de hormonas esteroides que los antagonistas de la aldosterona actualmente disponibles, como la eplerenona y la espironolactona , lo que debería producir menos efectos adversos como ginecomastia , impotencia y baja libido . [12] [13]
En esta tabla se comparan las concentraciones inhibidoras (bloqueantes) ( CI 50 , unidad: nM ) de tres antimineralocorticoides. La inhibición del receptor de mineralocorticoides es responsable de la acción deseada de los fármacos, mientras que la inhibición de los otros receptores potencialmente conduce a efectos secundarios. Los valores más bajos significan una inhibición más fuerte. [14]
| Espironolactona | Eplerenona | Finerenona | |
|---|---|---|---|
| Receptor de mineralocorticoides | 24 | 990 | 18 |
| Receptor de glucocorticoides | 2400 | 22.000 | >10.000 |
| Receptor de andrógenos | 77 | 21.200 | >10.000 |
| Receptor de progesterona | 740 | 31.200 | >10.000 |
La finerenona actúa como antagonista de los receptores de mineralocorticoides que albergan la mutación S810L, a diferencia de otros inhibidores tradicionales de MR como la espironolactona y la eplerenona que incidentalmente actúan como agonistas. [15]
Un metanálisis de datos de siete ensayos controlados aleatorios (13.783 participantes) encontró un beneficio en el uso de finerenona en personas con enfermedad renal diabética y proteinuria manifiesta. [16]
Efectos adversos
La finerenona puede provocar desequilibrios electrolíticos. [17] Los síntomas que se correlacionan con niveles elevados de potasio incluyen náuseas, debilidad, dolor en el pecho y pérdida de movimiento. [17] Las personas con niveles más bajos de sodio pueden experimentar dolores de cabeza, confusión, debilidad y sensación de desequilibrio. [17]
Historia
La eficacia de finerenona para mejorar los resultados renales y cardíacos se evaluó en un estudio aleatorizado, multicéntrico, doble ciego y controlado con placebo en adultos con enfermedad renal crónica asociada con diabetes tipo 2. [8] En este estudio, 5.674 participantes fueron asignados aleatoriamente para recibir finerenona o un placebo. [8]
El estudio comparó los dos grupos en cuanto al número de participantes cuya enfermedad progresó hasta un punto final compuesto (o combinado) que incluía al menos una reducción del 40% en la función renal, progresión a insuficiencia renal o muerte renal. [8] Los resultados mostraron que 504 de los 2.833 participantes que recibieron finerenona tuvieron al menos uno de los eventos en el punto final compuesto en comparación con 600 de los 2.841 participantes que recibieron un placebo. [8]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) otorgó la solicitud de revisión prioritaria y designaciones de vía rápida de finerenona . [8] La FDA otorgó la aprobación de Kerendia a Bayer Healthcare. [8]
Sociedad y cultura
Estatus legal
En diciembre de 2021, el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Kerendia, destinado al tratamiento de la enfermedad renal crónica asociada a la diabetes tipo 2 en adultos. [18] El solicitante de este medicamento es Bayer AG. [18] La finerenona fue aprobada para uso médico en la Unión Europea en febrero de 2022. [9] [19]
Nombres de marca
La finerenona se vende bajo las marcas Kerendia y Firialta. [20]
Investigación
En el estudio de fase II ARTS-DN, finerenona redujo de forma dosis-dependiente la relación albúmina-creatinina en orina en pacientes con enfermedad renal diabética . [21] Con base en estos hallazgos, finerenona se está estudiando en los grandes estudios de resultados de fase III FIDELIO y FIGARO diseñados para evaluar si finerenona reduce el riesgo de progresión de la ERC y eventos cardiovasculares adversos en pacientes con enfermedad renal crónica y diabetes tipo 2. Estos ensayos han inscrito a más de 13 000 pacientes y se prevé que finalicen primariamente FIDELIO en 2020 y FIGARO en 2021. [22] [ cita completa requerida ] [23] [ cita completa requerida ]
Referencias
- ^ "Actualizaciones de la base de datos de prescripción de medicamentos durante el embarazo". Therapeutic Goods Administration (TGA) . 12 de mayo de 2022. Consultado el 13 de mayo de 2022 .
- ^ ab "Kerendia APMDS". Administración de Productos Terapéuticos (TGA) . 9 de diciembre de 2021. Consultado el 12 de junio de 2022 .
- ^ "AusPAR: Finerenone". Administración de Productos Terapéuticos (TGA) . 31 de mayo de 2022. Consultado el 12 de junio de 2022 .[ enlace muerto permanente ]
- ^ "Información del producto Kerendia". Health Canada . 25 de abril de 2012. Consultado el 2 de enero de 2023 .
- ^ "Resumen de la base de la decisión de Kerendia". Salud Canadá . 23 de octubre de 2014 . Consultado el 10 de marzo de 2023 .[ enlace muerto permanente ]
- ^ "Detalles de: Kerendia". Health Canada . 22 de noviembre de 2022 . Consultado el 3 de marzo de 2024 .
- ^ ab "Kerendia-comprimido recubierto de finerenona". DailyMed . Consultado el 20 de agosto de 2021 .
- ^ abcdefghijk «La FDA aprueba un fármaco para la enfermedad renal crónica». Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 9 de julio de 2021. Consultado el 9 de julio de 2021 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ abcd "Kerendia EPAR". Agencia Europea de Medicamentos (EMA) . 14 de diciembre de 2021 . Consultado el 11 de marzo de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Kerendia (finerenona) de Bayer recibe la aprobación de la FDA de EE. UU. para el tratamiento de pacientes con enfermedad renal crónica asociada con diabetes tipo 2" (Comunicado de prensa). Bayer. 9 de julio de 2021. Consultado el 9 de julio de 2021 – vía Business Wire.
- ^ Promoción de la salud mediante la innovación: aprobaciones de nuevos tratamientos farmacológicos en 2021 (PDF) . Administración de Alimentos y Medicamentos de Estados Unidos (FDA) (informe). 13 de mayo de 2022. Archivado desde el original el 6 de diciembre de 2022 . Consultado el 22 de enero de 2023 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Ruilope LM, Tamargo J (abril de 2017). "Bloqueo del sistema renina-angiotensina: Finerenone". Nephrologie & Therapeutique . 13 (Supl 1): S47–S53. doi :10.1016/j.nephro.2017.02.003. PMID 28577743.
- ^ Pitt B, Anker SD, Böhm M, Gheorghiade M, Køber L, Krum H, et al. (febrero de 2015). "Fundamento y diseño del estudio de tolerabilidad de antagonistas del receptor de mineros alocorticoides en pacientes con insuficiencia cardíaca (ARTS-HF): un estudio aleatorizado de finerenona frente a eplerenona en pacientes con insuficiencia cardíaca crónica que empeora con diabetes o enfermedad renal crónica" (PDF) . Revista Europea de Insuficiencia Cardíaca . 17 (2): 224–32. doi :10.1002/ejhf.218. hdl : 2027.42/110733 . PMID 25678098. S2CID 205781715.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Bärfacker L, Kuhl A, Hillisch A, Grosser R, Figueroa-Pérez S, Heckroth H, et al. (agosto de 2012). "Descubrimiento de BAY 94-8862: un antagonista no esteroide del receptor de mineralocorticoides para el tratamiento de enfermedades cardiorrenales". ChemMedChem . 7 (8): 1385–1403. doi :10.1002/cmdc.201200081. PMID 22791416. S2CID 36084480.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Amazit L, Le Billan F, Kolkhof P, Lamribet K, Viengchareun S, Fay MR, et al. (septiembre de 2015). "La finerenona impide la importación nuclear dependiente de aldosterona del receptor de mineralocorticoides y previene el reclutamiento genómico del coactivador-1 del receptor de esteroides". The Journal of Biological Chemistry . 290 (36): 21876–89. doi : 10.1074/jbc.M115.657957 . PMC 4571943 . PMID 26203193.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Dutta D, Surana V, Bhattacharya S, Aggarwal S, Sharma M (mayo-junio de 2022). "Eficacia y seguridad del nuevo antagonista del receptor de mineralocorticoides no esteroideos finerenona en el tratamiento de la enfermedad renal diabética: un metanálisis". Metab indio J Endocrinol . 26 (3): 198–205. doi : 10.4103/ijem.ijem_376_21 . PMC 9555385 . PMID 36248038.
- ^ abc "Usos, efectos secundarios y advertencias de la finerenona". Drugs.com . Consultado el 11 de junio de 2022 .
- ^ ab «Kerendia: pendiente de decisión de la CE». Agencia Europea de Medicamentos (EMA) . 16 de diciembre de 2021. Archivado desde el original el 28 de octubre de 2022. Consultado el 18 de diciembre de 2021 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Información del producto Kerendia". Registro de medicamentos de la Unión . Consultado el 3 de marzo de 2023 .
- ^ "La finerenona cumple el criterio de valoración principal en el estudio de resultados cardiovasculares de fase III FINEARTS-HF en pacientes con insuficiencia cardíaca con fracción de eyección levemente reducida o preservada". Bayer (Nota de prensa). 5 de agosto de 2024. Consultado el 15 de octubre de 2024 .
- ^ Bakris GL, Agarwal R, Chan JC, Cooper ME, Gansevoort RT, Haller H, et al. (septiembre de 2015). "Efecto de la finerenona sobre la albuminuria en pacientes con nefropatía diabética: un ensayo clínico aleatorizado". JAMA . 314 (9): 884–94. doi : 10.1001/jama.2015.10081 . PMID 26325557.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Número de ensayo clínico NCT02540993 para "Eficacia y seguridad de finerenona en sujetos con diabetes mellitus tipo 2 y enfermedad renal diabética (FIDELIO-DKD)" en ClinicalTrials.gov
- ^ Número de ensayo clínico NCT02545049 para "Eficacia y seguridad de finerenona en sujetos con diabetes mellitus tipo 2 y diagnóstico clínico de enfermedad renal diabética (FIGARO-DKD)" en ClinicalTrials.gov
Lectura adicional
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, et al. (diciembre de 2020). "Efecto de la finerenona sobre los resultados de la enfermedad renal crónica en la diabetes tipo 2". N Inglés J Med . 383 (23): 2219–2229. doi : 10.1056/NEJMoa2025845 . hdl : 2445/195806 . PMID 33264825.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace )
