Dofetilida
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Tikosyn |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a601235 |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 96% (oral) |
| Unión de proteínas | 60% -70% |
| Vida media de eliminación | 10 horas |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.166.441 |
| Datos químicos y físicos | |
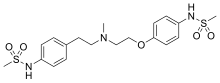
| Fórmula | C19H27N3O5S2 |
| Masa molar | 441,56 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La dofetilida es un agente antiarrítmico de clase III . [2] Se comercializa bajo el nombre comercial Tikosyn por Pfizer y está disponible en los Estados Unidos en cápsulas que contienen 125, 250 y 500 μg de dofetilida. No está disponible en Europa [3] ni en Australia. [4]
Usos médicos
La dofetilida se utiliza para el mantenimiento del ritmo sinusal en individuos propensos a la aparición de fibrilación auricular y arritmias de aleteo , y para la cardioversión química al ritmo sinusal desde la fibrilación auricular y el aleteo . [5] [6]
Con base en los resultados del estudio de Investigaciones Danesas de Arritmias y Mortalidad en Dofetilida ("DIAMOND"), [7] la dofetilida no afecta la mortalidad en el tratamiento de pacientes post- infarto de miocardio con disfunción ventricular izquierda , sin embargo se demostró que disminuye los reingresos por cualquier causa así como los reingresos relacionados con ICC . [7] Debido a los resultados del estudio DIAMOND, algunos médicos usan dofetilida en la supresión de la fibrilación auricular en individuos con disfunción ventricular izquierda, sin embargo su uso parece limitado: después de recibir inicialmente la aprobación para su comercialización en Europa en 1999, Pfizer retiró voluntariamente esta aprobación en 2004 por razones comerciales [3] y no está registrado en otros países del primer mundo.
Tiene ventajas clínicas sobre otros antiarrítmicos de clase III en la cardioversión química de la fibrilación auricular y el mantenimiento del ritmo sinusal, y no tiene la hepatotoxicidad o toxicidad pulmonar de la amiodarona, sin embargo, la fibrilación auricular generalmente no se considera potencialmente mortal, y la dofetilida causa una mayor tasa de arritmias potencialmente mortales en comparación con otras terapias. [8]
Contraindicaciones
Antes de administrar la primera dosis, se debe determinar el intervalo QT corregido (QTc). Si el QTc es mayor de 440 ms (o 500 ms en pacientes con anomalías de la conducción ventricular ), la dofetilida está contraindicada. Si la frecuencia cardíaca es menor de 60 lpm, se debe utilizar el intervalo QT no corregido . Después de cada dosis posterior de dofetilida, se debe determinar el QTc y ajustar la dosis.
Si en cualquier momento después de la segunda dosis de dofetilida el QTc es mayor a 500 ms (550 ms en pacientes con anomalías de la conducción ventricular), se debe suspender la dofetilida. [9]
Efectos adversos
La torsade de pointes es el efecto secundario más grave del tratamiento con dofetilida. La incidencia de torsades de pointes es del 0,3 al 10,5 % y está relacionada con la dosis, con una mayor incidencia asociada con dosis más altas. La mayoría de los episodios de torsades de pointes se han producido en los tres primeros días de la dosis inicial. Los pacientes deben ser hospitalizados y controlados durante los tres primeros días después de iniciar el tratamiento con dofetilida. [7]
El riesgo de inducir torsades de pointes se puede reducir tomando precauciones al iniciar la terapia, como hospitalizar a los individuos durante un mínimo de tres días para realizar mediciones seriadas de creatinina , monitoreo telemétrico continuo y disponibilidad de reanimación cardíaca.
Farmacología
Mecanismo de acción
La dofetilida actúa bloqueando selectivamente el componente rápido de la corriente de potasio saliente del rectificador retardado (I Kr ). [10]
Esto provoca que el período refractario del tejido auricular aumente, de ahí su eficacia en el tratamiento de la fibrilación auricular y el aleteo auricular.
La dofetilida no afecta el dV/dT máx (la pendiente de la carrera ascendente de la despolarización de fase 0), la velocidad de conducción ni el potencial de membrana en reposo.

Existe un aumento dependiente de la dosis en el intervalo QT y el intervalo QT corregido (QTc). Debido a esto, muchos médicos iniciarán el tratamiento con dofetilida solo en pacientes bajo monitoreo telemétrico o si se pueden realizar mediciones seriadas de QT y QTc mediante ECG.
Farmacocinética
Las concentraciones plasmáticas máximas se observan entre dos y tres horas después de la administración oral en ayunas . La dofetilida se absorbe bien en su forma oral, con una biodisponibilidad de >90%. La administración intravenosa de dofetilida no está disponible en los Estados Unidos. [11]
La semivida de eliminación de la dofetilida es de aproximadamente 10 horas; sin embargo, varía en función de muchos factores fisiológicos (el más importante, el aclaramiento de creatinina ) y oscila entre 4,8 y 13,5 horas. Debido al importante nivel de eliminación renal (80 % sin cambios, 20 % metabolitos), la dosis de dofetilida debe ajustarse para prevenir la toxicidad debido al deterioro de la función renal. [12]
La dofetilida se metaboliza principalmente por las enzimas CYP3A4 en el hígado y el tracto gastrointestinal . Esto significa que es probable que interactúe con medicamentos que inhiben la CYP3A4, como la eritromicina , la claritromicina o el ketoconazol , lo que da como resultado niveles más altos y potencialmente tóxicos de dofetilida. [13]
Metabolismo
Se alcanza un nivel plasmático estable de dofetilida en 2 a 3 días.
El 80% de la dofetilida se excreta por los riñones , por lo que la dosis de dofetilida debe ajustarse en individuos con enfermedad renal crónica , en función del aclaramiento de creatinina .
En los riñones, la dofetilida se elimina a través del intercambio de cationes (secreción). Los agentes que interfieren con el sistema de intercambio de cationes renales, como verapamilo , cimetidina , hidroclorotiazida , itraconazol , ketoconazol , proclorperazina y trimetoprima , no deben administrarse a personas que toman dofetilida.
Aproximadamente el 20 por ciento de la dofetilida se metaboliza en el hígado a través de la isoenzima CYP3A4 del sistema enzimático del citocromo P450 . Los medicamentos que interfieren con la actividad de la isoenzima CYP3A4 pueden aumentar los niveles séricos de dofetilida. Si se interfiere con el sistema de intercambio catiónico renal (como sucede con los medicamentos mencionados anteriormente), un porcentaje mayor de dofetilida se elimina a través del sistema de isoenzimas CYP3A4 .
Historia
Después de su aprobación inicial por la FDA de EE. UU., debido a su potencial proarrítmico, solo se puso a disposición de hospitales y prescriptores que habían recibido educación y capacitación específica sobre los riesgos del tratamiento con dofetilida; sin embargo, esta restricción se eliminó posteriormente en 2016. [14]
Véase también
Referencias
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ Lenz TL, Hilleman DE (julio de 2000). "Dofetilida, un nuevo agente antiarrítmico de clase III". Farmacoterapia . 20 (7): 776–786. doi :10.1592/phco.20.9.776.35208. PMID 10907968. S2CID 19897963.
- ^ ab Wathion N (13 de abril de 2004). "Declaración pública sobre Tikosyn (dofetilida): retirada voluntaria de la autorización de comercialización en la Unión Europea" (PDF) . Agencia Europea para la Evaluación de Medicamentos . Archivado desde el original (PDF) el 13 de octubre de 2017 . Consultado el 3 de enero de 2015 .
- ^ Manual australiano de medicamentos 2014
- ^ Banchs JE, Wolbrette DL, Samii SM, Penny-Peterson ED, Patel PP, Young SK, et al. (noviembre de 2008). "Eficacia y seguridad de la dofetilida en pacientes con fibrilación auricular y aleteo auricular". Journal of Interventional Cardiac Electrophysiology . 23 (2): 111–115. doi :10.1007/s10840-008-9290-6. PMID 18688699. S2CID 25162347.
- ^ Lenz TL, Hilleman DE (noviembre de 2000). "Dofetilida: un nuevo agente antiarrítmico aprobado para la conversión y/o el mantenimiento de la fibrilación auricular/aleteo auricular". Drugs of Today . 36 (11): 759–771. doi :10.1358/dot.2000.36.11.601530. PMID 12845335.
- ^ abc Torp-Pedersen C, Møller M, Bloch-Thomsen PE, Køber L, Sandøe E, Egstrup K, et al. (septiembre de 1999). "Dofetilida en pacientes con insuficiencia cardíaca congestiva y disfunción ventricular izquierda. Grupo de estudio de investigaciones danesas sobre arritmia y mortalidad en pacientes con dofetilida". The New England Journal of Medicine . 341 (12): 857–865. doi : 10.1056/NEJM199909163411201 . PMID 10486417.
- ^ Evaluaciones de medicamentos de Micromedex Drugdex micromedex.com
- ^ "TIKOSYN® (dofetilida)". Pfizer.
- ^ Roukoz H, Saliba W (enero de 2007). "Dofetilida: un nuevo agente antiarrítmico de clase III". Expert Review of Cardiovascular Therapy . 5 (1): 9–19. doi :10.1586/14779072.5.1.9. PMID 17187453. S2CID 11255636.
- ^ Rasmussen HS, Allen MJ, Blackburn KJ, Butrous GS, Dalrymple HW (1992). "Dofetilida, un nuevo agente antiarrítmico de clase III". Journal of Cardiovascular Pharmacology . 20 (Supl. 2): S96–105. doi :10.1097/00005344-199220002-00015. PMID 1279316.
- ^ "Dofetilida". Lexicomp. Wulters Kluwer Health, sin fecha. Web. <online.lexi.com>.
- ^ Walker DK, Alabaster CT, Congrave GS, Hargreaves MB, Hyland R, Jones BC, et al. (abril de 1996). "Importancia del metabolismo en la disposición y acción del fármaco antiarrítmico dofetilida. Estudios in vitro y correlación con datos in vivo". Metabolismo y disposición de fármacos . 24 (4): 447–455. PMID 8801060.
- ^ "Información sobre Tikosyn (dofetilida)". Administración de Alimentos y Medicamentos de Estados Unidos . 2016-03-09.
