Aspergilosis
| Aspergilosis | |
|---|---|
_invasive_type.jpg/440px-Pulmonary_aspergillosis_(1)_invasive_type.jpg) | |
| Aspergilosis pulmonar invasiva en una persona con neumonía intersticial (material de autopsia), utilizando tinción de plata metenamina de Grocott | |
| Pronunciación | |
| Especialidad | Enfermedad infecciosa |
| Complicaciones | Sangrado, infección sistémica [1] |
| Causas | Infección por hongos Aspergillus |
| Frecuencia | 14 millones |
La aspergilosis es una infección fúngica que afecta generalmente a los pulmones, [2] causada por el género Aspergillus , un moho común que se inhala con frecuencia en el aire, pero que no suele afectar a la mayoría de las personas. [3] [4] Generalmente se presenta en personas con enfermedades pulmonares como asma , fibrosis quística o tuberculosis , o en aquellas personas inmunodeprimidas como aquellas que han tenido un trasplante de células madre u órganos o aquellas que toman medicamentos como esteroides y algunos tratamientos contra el cáncer que suprimen el sistema inmunológico. [2] [5] En raras ocasiones, puede afectar la piel. [5] [6]
La aspergilosis se presenta en humanos, aves y otros animales. La aspergilosis se presenta en formas crónicas o agudas que son clínicamente muy distintas. La mayoría de los casos de aspergilosis aguda se presentan en personas con sistemas inmunológicos gravemente comprometidos, como aquellos sometidos a trasplante de médula ósea . [7] La colonización o infección crónica puede causar complicaciones en personas con enfermedades respiratorias subyacentes, como asma , [8] fibrosis quística , [9] sarcoidosis , [10] tuberculosis o enfermedad pulmonar obstructiva crónica . [11] Lo más común es que la aspergilosis se presente en forma de aspergilosis pulmonar crónica (APC), aspergiloma o aspergilosis broncopulmonar alérgica (ABPA). [12] Algunas formas están entrelazadas; por ejemplo, la ABPA y el aspergiloma simple pueden progresar a APC.
Otras manifestaciones no invasivas incluyen la sinusitis fúngica (tanto de naturaleza alérgica como con hongos), la otomicosis (infección del oído), la queratitis (infección ocular) y la onicomicosis (infección de las uñas). En la mayoría de los casos, son menos graves y curables con un tratamiento antimicótico eficaz .
Los patógenos identificados con mayor frecuencia son Aspergillus fumigatus y Aspergillus flavus , organismos ubicuos capaces de vivir bajo un estrés ambiental extenso. Se cree que la mayoría de las personas inhalan miles de esporas de Aspergillus diariamente, pero sin efecto debido a una respuesta inmune eficiente. La aspergilosis invasiva tiene una mortalidad del 20% a los 6 meses. [13] Las principales formas crónicas, invasivas y alérgicas de aspergilosis son responsables de alrededor de 600.000 muertes al año en todo el mundo. [10] [14] [15] [16] [17]
Signos y síntomas
Una bola de hongo en los pulmones puede no causar síntomas y puede descubrirse solo con una radiografía de tórax, o puede causar tos con sangre repetida , dolor en el pecho y, ocasionalmente, sangrado grave, incluso fatal. [2] Una infección por Aspergillus rápidamente invasiva en los pulmones a menudo causa tos, fiebre, dolor en el pecho y dificultad para respirar. [ cita requerida ]
La aspergilosis mal controlada puede diseminarse a través de la sangre y causar daño generalizado a los órganos. [2] Los síntomas incluyen fiebre, escalofríos, shock, delirio, convulsiones y coágulos de sangre. La persona puede desarrollar insuficiencia renal , insuficiencia hepática (que causa ictericia ) y dificultades respiratorias. [2] La muerte puede sobrevenir rápidamente.
La aspergilosis del conducto auditivo externo provoca picazón y, en ocasiones, dolor. El líquido que drena del oído durante la noche puede dejar una mancha en la almohada. La aspergilosis de los senos paranasales provoca una sensación de congestión y, en ocasiones, dolor o secreción. Puede extenderse más allá de los senos paranasales. [18]
Causa

La aspergilosis es causada por Aspergillus , un moho común , que tiende a afectar a personas que ya tienen una enfermedad pulmonar como fibrosis quística o asma , o que no pueden combatir la infección por sí mismos . [3] La especie causal más común es Aspergillus fumigatus . [19]
Factores de riesgo
Las personas inmunodeprimidas (como los pacientes sometidos a trasplante de células madre hematopoyéticas , quimioterapia para la leucemia o SIDA ) tienen un mayor riesgo de infecciones invasivas por aspergilosis. Estas personas pueden tener neutropenia o inmunosupresión inducida por corticosteroides como resultado de tratamientos médicos. La neutropenia a menudo es causada por medicamentos extremadamente citotóxicos como la ciclofosfamida. La ciclofosfamida interfiere con la replicación celular, incluida la de los glóbulos blancos, como los neutrófilos . Un recuento reducido de neutrófilos inhibe la capacidad del cuerpo para generar respuestas inmunitarias contra los patógenos . Aunque se produce el factor de necrosis tumoral alfa (TNF-α), una molécula de señalización relacionada con las respuestas inflamatorias agudas, el número anormalmente bajo de neutrófilos presente en pacientes neutropénicos conduce a una respuesta inflamatoria deprimida. Si la neutropenia subyacente no se corrige, se producirá un crecimiento rápido e incontrolado de hifas de los hongos invasores y dará lugar a resultados negativos para la salud. [20] Además de la disminución de la desgranulación de neutrófilos, la respuesta antiviral contra los virus de la gripe y el SARS-CoV-2 , mediada por el interferón tipo I y tipo II , se ve disminuida conjuntamente con la respuesta inmune antifúngica local medida en los pulmones de pacientes con IAPA (Aspergilosis Pulmonar Asociada a la Influenza) y CAPA ( Aspergilosis Pulmonar Asociada a la COVID -19). [21] Los pacientes con COVID-19 con bronquiectasias preexistentes o recién diagnosticadas tienen un riesgo particular de desarrollar aspergilosis pulmonar. [22]
Normalmente, el mecanismo de depuración mucociliar de las vías respiratorias de los pulmones elimina las partículas inhaladas. Sin embargo, en aquellas personas con enfermedades pulmonares subyacentes, como la fibrosis quística o la bronquiectasia , este mecanismo de depuración mucociliar está alterado y las esporas de Aspergillus (que tienen un diámetro de 2 a 5 μm) pueden colonizar las vías respiratorias y los senos paranasales. [13]
Diagnóstico

En la radiografía de tórax y la TC, la aspergilosis pulmonar se manifiesta clásicamente como un signo del halo y, más tarde, un signo de medialuna aérea . [24] En pacientes hematológicos con aspergilosis invasiva, la prueba de galactomanano puede realizar el diagnóstico de forma no invasiva. El galactomanano es un componente de la pared fúngica. [13] Se han encontrado pruebas de galactomanano de Aspergillus con resultados falsos positivos en pacientes en tratamiento intravenoso con algunos antibióticos o líquidos que contienen gluconato o ácido cítrico, como algunas plaquetas de transfusión, nutrición parenteral o PlasmaLyte. [25] [26]
En el microscopio , las especies de Aspergillus se demuestran de manera confiable mediante tinciones de plata , por ejemplo, tinción de Gridley o metenamina-plata de Gomori . [27] Estas dan a las paredes de los hongos un color gris-negro. Las hifas de las especies de Aspergillus varían en diámetro de 2,5 a 4,5 μm. Tienen hifas septadas , [28] pero estas no siempre son evidentes, y en tales casos pueden confundirse con Zygomycota . [27] Las hifas de Aspergillus tienden a tener una ramificación dicotómica que es progresiva y principalmente en ángulos agudos de alrededor de 45°. [27]
En aquellos con sospecha de aspergilosis pulmonar, se puede realizar un lavado broncoalveolar para recolectar líquido de las vías respiratorias de los pulmones para su análisis. Esto implica la exploración de las vías respiratorias con un broncoscopio y luego la introducción de una pequeña cantidad de líquido en las vías respiratorias que luego se recolecta para su análisis. Este análisis puede incluir la evaluación de células, pruebas de galactomanano, tinción y cultivo de hongos, así como la evaluación de la reacción en cadena de la polimerasa (PCR). [13] La PCR tiene una sensibilidad del 85% y una especificidad del 76% para el diagnóstico de aspergilosis, la sensibilidad aumenta cuando la prueba se combina con la prueba de galactomanano. [13]
La aspergilosis broncopulmonar alérgica (ABPA) se diagnostica estableciendo una sensibilización inmunitaria a la aspergilosis, lo que se puede hacer midiendo los niveles totales de eosinófilos , inmunoglobulina E (IgE) total y los niveles de IgE e IgG específicos de Aspergillus . Las elevaciones de estos marcadores, combinadas con hallazgos clínicos y radiológicos que sugieran una infección, se utilizan para confirmar la ABPA. [13]
- Aspergilosis pulmonar angioinvasiva
- Aspergilosis pulmonar angioinvasiva (primer plano)
- Vesícula de Aspergillus (tinción HE)
Prevención
La prevención de la aspergilosis implica la reducción de la exposición al moho mediante el control de las infecciones ambientales. Se puede administrar profilaxis antimicótica a los pacientes de alto riesgo. El posaconazol se suele administrar como profilaxis en pacientes con inmunodeficiencia grave. [29]
Cribado
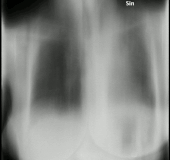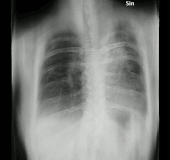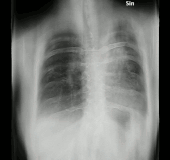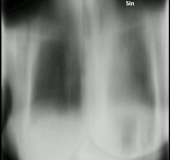
Una revisión sistemática ha evaluado la precisión diagnóstica de las pruebas de reacción en cadena de la polimerasa (PCR) en personas con sistemas inmunológicos defectuosos debido a tratamientos médicos como la quimioterapia. [30] La evidencia sugiere que las pruebas de PCR tienen una precisión diagnóstica moderada cuando se utilizan para la detección de aspergilosis invasiva en grupos de alto riesgo. [30] La TC y la RMN son vitales para el diagnóstico, sin embargo, siempre es muy recomendable realizar una biopsia del área para confirmar el diagnóstico. [31] [32] [33]
Tratamiento
Los tratamientos médicos actuales para la aspergilosis invasiva agresiva incluyen voriconazol y anfotericina B liposomal en combinación con desbridamiento quirúrgico . [34] Para la aspergilosis broncopulmonar alérgica menos agresiva, los hallazgos sugieren el uso de esteroides orales durante un período prolongado de tiempo, preferiblemente durante 6 a 9 meses en la aspergilosis alérgica de los pulmones. El itraconazol se administra con los esteroides, ya que se considera que tiene un efecto "ahorrador de esteroides", lo que hace que los esteroides sean más efectivos, lo que permite una dosis más baja. [35] Otros medicamentos utilizados, como la anfotericina B , la caspofungina (solo en terapia combinada), la flucitosina (solo en terapia combinada) o el itraconazol, [36] [37] se utilizan para tratar esta infección fúngica . Sin embargo, una proporción creciente de infecciones son resistentes a los triazoles. [38] A. fumigatus , la especie más comúnmente infectante, es intrínsecamente resistente al fluconazol . [39]
Epidemiología
Se cree que la aspergilosis afecta a más de 14 millones de personas en todo el mundo, con aspergilosis broncopulmonar alérgica (ABPA) infectando a aproximadamente 4 millones, asma grave con sensibilización fúngica que afecta a aproximadamente 6,5 millones y aspergilosis pulmonar crónica (CPA) infectando a aproximadamente 3 millones de personas, considerablemente más que la aspergilosis invasiva que afecta a aproximadamente 300.000 personas. [40] Otras afecciones comunes incluyen bronquitis por Aspergillus , rinosinusitis por Aspergillus u otitis externa . [41] [42]
Sociedad y cultura
Durante la pandemia de COVID-19 2020/21 , se informó de aspergilosis pulmonar asociada a COVID-19 en algunas personas que habían sido ingresadas en el hospital y recibieron tratamiento con esteroides a largo plazo. [43]
Animales
Aunque es relativamente poco frecuente en los seres humanos, la aspergilosis es una infección común y peligrosa en las aves, en particular en los loros domésticos . Los patos silvestres y otros patos son especialmente susceptibles, ya que a menudo recurren a fuentes de alimentación deficientes cuando el tiempo es malo. Las aves rapaces cautivas, como los halcones y los gavilanes, son susceptibles a esta enfermedad si se las mantiene en malas condiciones y, especialmente, si se las alimenta con palomas, que a menudo son portadoras del "asper". Puede ser aguda en los polluelos, pero crónica en las aves adultas. [ cita requerida ]
En los Estados Unidos, la aspergilosis ha sido la culpable de varias muertes rápidas de aves acuáticas. Desde el 8 de diciembre hasta el 14 de diciembre de 2006, más de 2.000 patos silvestres murieron cerca de Burley, Idaho , una comunidad agrícola a unas 150 millas al sureste de Boise . Se sospecha que la fuente son los residuos de cereales mohosos de las tierras de cultivo y los corrales de engorde de la zona. Un brote similar de aspergilosis causado por cereales mohosos mató a 500 patos silvestres en Iowa en 2005. [ cita requerida ]
Si bien no se ha encontrado ninguna conexión entre la aspergilosis y la cepa H5N1 de la influenza aviar (comúnmente llamada "gripe aviar"), las muertes rápidas causadas por la aspergilosis pueden generar temores de brotes de gripe aviar. El análisis de laboratorio es la única forma de distinguir la gripe aviar de la aspergilosis. [ cita requerida ]
En los perros, la aspergilosis es una enfermedad poco común que afecta típicamente solo los conductos nasales (aspergilosis nasal). Es mucho más común en las razas dolicocéfalas . También puede propagarse al resto del cuerpo; se denomina aspergilosis diseminada y es poco común; suele afectar a individuos con trastornos inmunológicos subyacentes. [ cita requerida ]
En 2019, un brote de aspergilosis afectó al raro kākāpō , un gran loro no volador endémico de Nueva Zelanda. En junio, la enfermedad había matado a siete de las aves, cuya población total en ese momento era de solo 142 adultos y 72 polluelos. Una quinta parte de la población estaba infectada con la enfermedad y se consideró que toda la especie estaba en peligro de extinción. [44]
Véase también
- Otras formas en que el Aspergillus puede causar enfermedades en los mamíferos:
Referencias
- ^ "Aspergilosis". mayoclinic.org . Mayo Clinic . Consultado el 5 de junio de 2022 .
- ^ abcde Thornton CR (2020). "1. Detección de los 'cinco grandes' hongos que matan a los humanos: Aspergillus, Fusarium, Lomentospora, Scedosporium y Mucormycetes". En Gadd GM , Sariaslani S (eds.). Avances en microbiología aplicada. Academic Press. págs. 4–22. ISBN 978-0-12-820703-1.
- ^ ab «CIE-11 - CIE-11 para estadísticas de mortalidad y morbilidad». Organización Mundial de la Salud . Consultado el 29 de mayo de 2021 .
- ^ "Aspergilosis | Acerca de". www.cdc.gov . 10 de mayo de 2021 . Consultado el 1 de junio de 2021 .
- ^ ab Kutzner H, Kempf W, Feit J, Sangueza O (2021). "2. Infecciones fúngicas". Atlas de dermatopatología clínica: dermatosis infecciosas y parasitarias . Hoboken: Wiley Blackwell. pág. 103-104. ISBN 978-1-119-64706-5.
- ^ Johnstone RB (2017). "25. Micosis e infecciones por algas". Fundamentos de patología cutánea de Weedon (2.ª ed.). Elsevier. pág. 463. ISBN 978-0-7020-6830-0.
- ^ "Aspergilosis pulmonar invasiva | Sitio web de Aspergillus y aspergilosis". Sitio web de Aspergillus . Archivado desde el original el 26 de julio de 2020. Consultado el 28 de junio de 2019 .
- ^ Denning DW, Pashley C, Hartl D, Wardlaw A, Godet C, Del Giacco S, et al. (15 de abril de 2014). "Alergia fúngica en el asma: estado del arte y necesidades de investigación". Alergia clínica y traslacional . 4 (1): 14. doi : 10.1186/2045-7022-4-14 . PMC 4005466. PMID 24735832 .
- ^ Warris A, Bercusson A, Armstrong-James D (abril de 2019). "Colonización por Aspergillus e inmunidad antifúngica en pacientes con fibrosis quística". Medical Mycology . 57 (Suplemento_2): S118–S126. doi : 10.1093/mmy/myy074 . hdl : 2164/13751 . PMID 30816976.
- ^ ab Denning DW, Pleuvry A, Cole DC (marzo de 2013). "Carga mundial de aspergilosis pulmonar crónica que complica la sarcoidosis". The European Respiratory Journal . 41 (3): 621–626. doi : 10.1183/09031936.00226911 . PMID 22743676. S2CID 8823691.
- ^ Smith NL, Denning DW (abril de 2011). "Condiciones subyacentes en la aspergilosis pulmonar crónica, incluido el aspergiloma simple". The European Respiratory Journal . 37 (4): 865–872. doi : 10.1183/09031936.00054810 . PMID 20595150. S2CID 18292691.
- ^ Goel A. "Aspergilosis pulmonar". Mediconotebook . Consultado el 29 de mayo de 2015 .
- ^ abcdef Thompson, George R.; Young, Jo-Anne H. (14 de octubre de 2021). "Infecciones por Aspergillus". New England Journal of Medicine . 385 (16): 1496–1509. doi :10.1056/NEJMra2027424. PMID 34644473.
- ^ Guinea J, Torres-Narbona M, Gijón P, Muñoz P, Pozo F, Peláez T, et al. (julio de 2010). "Aspergilosis pulmonar en pacientes con enfermedad pulmonar obstructiva crónica: incidencia, factores de riesgo y evolución". Microbiología clínica e infecciones . 16 (7): 870–877. doi : 10.1111/j.1469-0691.2009.03015.x . PMID 19906275.
- ^ Chen J, Yang Q, Huang J, Li L (septiembre de 2013). "Factores de riesgo de aspergilosis pulmonar invasiva y mortalidad hospitalaria en pacientes con insuficiencia hepática crónica aguda: un estudio de cohorte retrospectivo". Revista internacional de ciencias médicas . 10 (12): 1625–1631. doi :10.7150/ijms.6824. PMC 3804788 . PMID 24151434.
- ^ Garcia-Vidal C, Upton A, Kirby KA, Marr KA (octubre de 2008). "Epidemiología de las infecciones invasivas por mohos en los receptores de trasplantes de células madre alogénicos: factores de riesgo biológicos de infección según el tiempo después del trasplante". Clinical Infectious Diseases . 47 (8): 1041–1050. doi :10.1086/591969. PMC 2668264 . PMID 18781877.
- ^ Nam HS, Jeon K, Um SW, Suh GY, Chung MP, Kim H, et al. (junio de 2010). "Características clínicas y resultados del tratamiento de la aspergilosis pulmonar necrosante crónica: una revisión de 43 casos". Revista internacional de enfermedades infecciosas . 14 (6): e479–e482. doi : 10.1016/j.ijid.2009.07.011 . PMID 19910234.
- ^ Ederies A, Chen J, Aviv RI, Pirouzmand F, Bilbao JM, Thompson AL, Symons SP (mayo de 2010). "Aspergilosis del ápice petroso y la cueva de Meckel". Base del cráneo . 20 (3): 189–192. doi :10.1055/s-0029-1246229. PMC 3037105 . PMID 21318037.
- ^ Willinger G (2019). "1. ¿Cuál es el objetivo? Micología clínica y diagnóstico". En Presterl E (ed.). Micosis clínicamente relevantes: un enfoque práctico. Springer. págs. 3–19. ISBN 978-3-319-92299-7.
- ^ Dagenais TR, Keller NP (julio de 2009). "Patogénesis de Aspergillus fumigatus en la aspergilosis invasiva". Clinical Microbiology Reviews . 22 (3): 447–465. doi :10.1128/CMR.00055-08. PMC 2708386 . PMID 19597008.
- ^ Feys S, Gonçalves SM, Khan M, Choi S, Boeckx B, Chatelain D, et al. (agosto de 2022). "Inmunidad innata epitelial y mieloide pulmonar en la aspergilosis pulmonar asociada a la influenza o a la COVID-19: un estudio observacional". The Lancet Respiratory Medicine . 10 (12): 1147–1159. doi :10.1016/S2213-2600(22)00259-4. PMC 9401975 . PMID 36029799.
- ^ Baratella, Elisa; Roman-Pognuz, Erik; Zerbato, Verena; Minelli, Pierluca; Cavallaro, Marco Francesco María; Cova, María Asunta; Luzzati, Roberto; Lucangelo, Umberto; Sansón, Gianfranco; Friso, Federica; Bussani, Rossana; Pinamonti, Mauricio; Busetti, Marina; Salton, Francisco; Confalonieri, Marco (30 de diciembre de 2021). "Posibles vínculos entre la aspergilosis pulmonar asociada a COVID-19 y las bronquiectasias detectadas mediante tomografía computarizada de alta resolución". Fronteras en Biociencia-Hito . 26 (12): 1607-1612. doi : 10.52586/5053 . hdl : 11368/3004919 . ISSN 2768-6701. Número de modelo: PMID34994174.
- ^ Snoeckx A, Reyntiens P, Desbuquoit D, Spinhoven MJ, Van Schil PE, van Meerbeeck JP, Parizel PM (febrero de 2018). "Evaluación del nódulo pulmonar solitario: el tamaño importa, pero no ignore el poder de la morfología". Insights into Imaging . 9 (1): 73–86. doi :10.1007/s13244-017-0581-2. PMC 5825309 . PMID 29143191.
- ^ Curtis AM, Smith GJ, Ravin CE (octubre de 1979). "Signo de medialuna aérea de la aspergilosis invasiva". Radiología . 133 (1): 17–21. doi :10.1148/133.1.17. PMID 472287.
- ^ Fortún J, Martín-Dávila P, Alvarez ME, Norman F, Sánchez-Sousa A, Gajate L, et al. (Enero de 2009). "Resultados falsos positivos de la antigenemia de Aspergillus galactomanano en receptores de trasplante de hígado". Trasplante . 87 (2): 256–260. doi : 10.1097/TP.0b013e31819288d5 . PMID 19155981. S2CID 40438193.
- ^ Martín-Rabadán P, Gijón P, Alonso Fernández R, Ballesteros M, Anguita J, Bouza E (agosto de 2012). "Antigenemia de Aspergillus falso positivo debido a líquidos acondicionadores de productos sanguíneos". Enfermedades Infecciosas Clínicas . 55 (4): e22-e27. doi : 10.1093/cid/cis493 . PMID 22610929.
- ^ abc Kradin RL, Mark EJ (abril de 2008). "La patología de los trastornos pulmonares debidos a Aspergillus spp". Archivos de patología y medicina de laboratorio . 132 (4): 606–614. doi :10.5858/2008-132-606-TPOPDD. PMID 18384212.
- ^ "Micosis: aspergilosis". Mycology Online . Archivado desde el original el 7 de diciembre de 2008. Consultado el 10 de diciembre de 2008 .
- ^ Cornely OA, Maertens J, Winston DJ, Perfect J, Ullmann AJ, Walsh TJ, et al. (enero de 2007). "Profilaxis con posaconazol frente a fluconazol o itraconazol en pacientes con neutropenia". The New England Journal of Medicine . 356 (4): 348–359. doi : 10.1056/NEJMoa061094 . PMID 17251531. S2CID 40335480.
- ^ ab Cruciani M, Mengoli C, Barnes R, Donnelly JP, Loeffler J, Jones BL, et al. (septiembre de 2019). "Pruebas sanguíneas de reacción en cadena de la polimerasa para el diagnóstico de aspergilosis invasiva en personas inmunocomprometidas". Base de Datos Cochrane de Revisiones Sistemáticas . 2019 (9): CD009551. doi :10.1002/14651858.cd009551.pub4. PMC 6719256. PMID 31478559 .
- ^ Harris GJ, Will BR (1989). "Aspergilosis orbitaria. Desbridamiento conservador e irrigación local con anfotericina". Cirugía Plástica y Reconstructiva Oftálmica . 5 (3): 207–211. doi :10.1097/00002341-198909000-00012. PMID 2487225.
- ^ Kopp W, Fotter R, Steiner H, Beaufort F, Stammberger H (septiembre de 1985). "Aspergilosis de los senos paranasales". Radiología . 156 (3): 715–716. doi :10.1148/radiology.156.3.4023231. PMID 4023231.
- ^ Hutnik CM, Nicolle DA, Muñoz DG (diciembre de 1997). "Aspergilosis orbitaria. Un enmascarador fatal". Revista de Neurooftalmología . 17 (4): 257–261. doi :10.1097/00041327-199712000-00009. PMID 9427179.
- ^ Kontoyiannis DP , Lionakis MS, Lewis RE, Chamilos G, Healy M, Perego C, et al. (abril de 2005). "Zigomicosis en un centro de atención terciaria para el cáncer en la era de la terapia antimicótica activa frente a Aspergillus: un estudio observacional de casos y controles de 27 casos recientes". The Journal of Infectious Diseases . 191 (8): 1350–1360. doi : 10.1086/428780 . PMID 15776383.
- ^ Walsh TJ, Anaissie EJ, Denning DW, Herbrecht R, Kontoyiannis DP, Marr KA, et al. (febrero de 2008). "Tratamiento de la aspergilosis: pautas de práctica clínica de la Sociedad de Enfermedades Infecciosas de Estados Unidos". Clinical Infectious Diseases . 46 (3): 327–360. doi : 10.1086/525258 . PMID 18177225.
- ^ Herbrecht R, Denning DW, Patterson TF, Bennett JE, Greene RE, Oestmann JW, et al. (agosto de 2002). "Voriconazol frente a anfotericina B para la terapia primaria de la aspergilosis invasiva". The New England Journal of Medicine . 347 (6). Grupo de Infecciones Fúngicas Invasivas de la Organización Europea para la Investigación y el Tratamiento del Cáncer y el Grupo de Estudio Global sobre Aspergillus.: 408–415. doi :10.1056/NEJMoa020191. hdl : 2066/185528 . PMID 12167683.
- ^ Cornely OA, Maertens J, Bresnik M, Ebrahimi R, Ullmann AJ, Bouza E, et al. (mayo de 2007). "Anfotericina B liposomal como terapia inicial para la infección por moho invasivo: un ensayo aleatorizado que compara un régimen de dosis de carga alta con una dosis estándar (ensayo AmBiLoad)". Enfermedades infecciosas clínicas . 44 (10): 1289–1297. doi : 10.1086/514341 . PMID 17443465.
- ^ Denning DW, Park S, Lass-Florl C, Fraczek MG, Kirwan M, Gore R, et al. (mayo de 2011). "Resistencia a triazol de alta frecuencia encontrada en Aspergillus fumigatus no cultivable de pulmones de pacientes con enfermedad fúngica crónica". Enfermedades infecciosas clínicas . 52 (9): 1123–1129. doi :10.1093/cid/cir179. PMC 3106268 . PMID 21467016.
- ^ Perea S, Patterson TF (noviembre de 2002). "Resistencia a los antifúngicos en hongos patógenos". Enfermedades infecciosas clínicas . 35 (9): 1073–1080. doi : 10.1086/344058 . PMID 12384841.
- ^ Bongomin F, Gago S, Oladele RO, Denning DW (octubre de 2017). "Prevalencia global y multinacional de enfermedades fúngicas: estimación de la precisión". Journal of Fungi . 3 (4): 57. doi : 10.3390/jof3040057 . PMC 5753159 . PMID 29371573.
- ^ Bongomin F, Batac CR, Richardson MD, Denning DW (junio de 2018). "Una revisión de la onicomicosis debida a especies de Aspergillus". Mycopathologia . 183 (3): 485–493. doi :10.1007/s11046-017-0222-9. PMC 5958150 . PMID 29147866.
- ^ "Bronquitis por Aspergillus | Sitio web sobre Aspergillus y aspergilosis". www.aspergillus.org.uk .
- ^ Machado M, Valerio M, Álvarez-Uría A, Olmedo M, Veintimilla C, Padilla B, et al. (febrero de 2021). "Aspergilosis pulmonar invasiva en la era COVID-19: una nueva entidad esperada". Micosis . 64 (2): 132-143. doi :10.1111/myc.13213. PMC 7753705 . PMID 33210776.
- ^ Anderson C (13 de junio de 2019). «El loro más gordo del mundo, el kākāpō, en peligro de extinción, podría ser aniquilado por una infección fúngica». The Guardian . ISSN 0261-3077 . Consultado el 13 de junio de 2019 .
Enlaces externos
- Aspergilosis, MedlinePlus, Biblioteca Nacional de Medicina de EE. UU.
- Sitio web sobre Aspergillus y aspergilosis
- Centro Nacional de Aspergilosis, Manchester, Reino Unido

_invasive_type.jpg/440px-Pulmonary_aspergillosis_(2)_invasive_type.jpg)
