Isoleucina
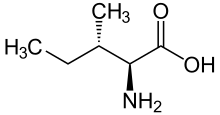 Fórmula esquelética de la L -isoleucina | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Isoleucina | |||
| Otros nombres Ácido (2 S ,3 S )-2-amino-3-metilpentanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.726 | ||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C6H13NO2 | |||
| Masa molar | 131,175 g·mol −1 | ||
| −84,9·10 −6 cm3 / mol | |||
| Página de datos complementarios | |||
| Isoleucina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La isoleucina (símbolo Ile o I ) [1] es un α-aminoácido que se utiliza en la biosíntesis de proteínas . Contiene un grupo α-amino (que está en la forma protonada −NH + 3 en condiciones biológicas), un grupo de ácido α-carboxílico (que está en la forma desprotonada −COO − en condiciones biológicas), y una cadena lateral de hidrocarburo con una ramificación (un átomo de carbono central unido a otros tres átomos de carbono). Se clasifica como un aminoácido alifático de cadena ramificada, no polar, sin carga (a pH fisiológico) . Es esencial en los seres humanos, lo que significa que el cuerpo no puede sintetizarlo. Los aminoácidos esenciales son necesarios en la dieta humana. En las plantas, la isoleucina se puede sintetizar a partir de treonina y metionina. [2] En plantas y bacterias, la isoleucina se sintetiza a partir de piruvato empleando enzimas de biosíntesis de leucina. [3] Está codificado por los codones AUU, AUC y AUA.
Metabolismo
Biosíntesis
En plantas y microorganismos, la isoleucina se sintetiza a partir del piruvato y el alfa-cetobutirato . Esta vía no está presente en los seres humanos. Las enzimas implicadas en esta biosíntesis incluyen: [4]
- Acetolactato sintasa (también conocida como acetohidroxiácido sintasa)
- Acetohidroxiácido isomeroreductasa
- Dihidroxiácido deshidratasa
- Valina aminotransferasa
Catabolismo
La isoleucina es un aminoácido glucogénico y cetogénico . [4] Después de la transaminación con alfa-cetoglutarato , el esqueleto carbonado se oxida y se divide en propionil-CoA y acetil-CoA . El propionil-CoA se convierte en succinil-CoA , un intermediario del ciclo del TCA que puede convertirse en oxaloacetato para la gluconeogénesis (de ahí su carácter glucogénico). En los mamíferos, el acetil-CoA no puede convertirse en carbohidrato, pero puede introducirse en el ciclo del TCA mediante la condensación con oxaloacetato para formar citrato o utilizarse en la síntesis de cuerpos cetónicos (de ahí su carácter cetogénico) o ácidos grasos . [5]
Enfermedades metabólicas
La degradación de la isoleucina se ve afectada en las siguientes enfermedades metabólicas :
- Aciduria combinada malónica y metilmalónica (CMAMMA)
- Enfermedad de la orina con olor a jarabe de arce (MSUD)
- Acidemia metilmalónica
- Acidemia propiónica
Resistencia a la insulina
La isoleucina, al igual que otros aminoácidos de cadena ramificada , está asociada con la resistencia a la insulina: se observan niveles más altos de isoleucina en la sangre de ratones, ratas y humanos diabéticos. [6] En ratones obesos y resistentes a la insulina inducidos por la dieta, una dieta con niveles reducidos de isoleucina (con o sin los otros aminoácidos de cadena ramificada) da como resultado una adiposidad reducida y una sensibilidad a la insulina mejorada. [7] [8] Se requieren niveles dietéticos reducidos de isoleucina para los efectos metabólicos beneficiosos de una dieta baja en proteínas . [8] En los humanos, una dieta restringida en proteínas reduce los niveles sanguíneos de isoleucina y disminuye los niveles de glucosa en sangre en ayunas. [9] Los ratones alimentados con una dieta baja en isoleucina son más delgados, viven más tiempo y son menos frágiles. [10] En los humanos, los niveles dietéticos más altos de isoleucina se asocian con un mayor índice de masa corporal . [8]
Funciones y requisitos
La Junta de Alimentos y Nutrición (FNB) del Instituto de Medicina de los Estados Unidos ha establecido las Ingestas Dietéticas Recomendadas (IDR) de aminoácidos esenciales en 2002. Para los adultos de 19 años o más, se requieren 19 mg de isoleucina/kg de peso corporal por día. [11]
Además de su función biológica como nutriente, la isoleucina también participa en la regulación del metabolismo de la glucosa . [5] La isoleucina es un componente esencial de muchas proteínas. Como aminoácido esencial, la isoleucina debe ingerirse o se interrumpirá la producción de proteínas en la célula. La hemoglobina fetal es una de las muchas proteínas que requieren isoleucina. [12] La isoleucina está presente en la cadena gamma de la hemoglobina fetal y debe estar presente para que se forme la proteína. [12]
Las enfermedades genéticas pueden cambiar los requerimientos de consumo de isoleucina. Los aminoácidos no se pueden almacenar en el cuerpo. La acumulación de un exceso de aminoácidos provocará una acumulación de moléculas tóxicas, por lo que los humanos tienen muchas vías para degradar cada aminoácido cuando se ha satisfecho la necesidad de síntesis de proteínas. [13] Las mutaciones en las enzimas que degradan la isoleucina pueden provocar una acumulación peligrosa de isoleucina y su derivado tóxico. Un ejemplo es la enfermedad de la orina con olor a jarabe de arce (MSUD) , un trastorno que deja a las personas incapaces de descomponer la isoleucina, la valina y la leucina . [14] Las personas con MSUD controlan su enfermedad mediante una ingesta reducida de los tres aminoácidos junto con medicamentos que ayudan a excretar las toxinas acumuladas. [15]
Muchos animales y plantas son fuentes dietéticas de isoleucina como componente de las proteínas. [5] Los alimentos que tienen altas cantidades de isoleucina incluyen huevos , proteína de soja , algas marinas , pavo, pollo , cordero, queso y pescado .
Síntesis
Existen numerosas vías para obtener isoleucina. Un procedimiento común de varios pasos comienza con 2-bromobutano y dietilmalonato . [16] La isoleucina sintética fue descrita por primera vez en 1905 por los químicos franceses Bouveault y Locquin. [17]
Descubrimiento
El químico alemán Felix Ehrlich descubrió la isoleucina mientras estudiaba la composición de la melaza de remolacha en 1903. [18] En 1907, Ehrlich realizó estudios adicionales sobre la fibrina, la albúmina de huevo, el gluten y el músculo vacuno. Estos estudios verificaron la composición natural de la isoleucina. [18] Ehrlich publicó su propia síntesis de isoleucina en 1908. [19]
Véase también
- Aloisoleucina , el diastereómero de la isoleucina
- Alimentos con bajo contenido proteico de isoleucina
Referencias
- ^ "IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). Nomenclatura y simbolismo para aminoácidos y péptidos. Recomendaciones 1983". The Biochemical Journal . 219 (2): 345–373. Abril de 1984. doi :10.1042/bj2190345. PMC 1153490 . PMID 6743224.
- ^ Joshi V, Joung JG, Fei Z, Jander G (octubre de 2010). "Interdependencia del metabolismo de treonina, metionina e isoleucina en plantas: acumulación y regulación transcripcional bajo estrés abiótico". Amino Acids . 39 (4): 933–947. doi :10.1007/s00726-010-0505-7. PMID 20186554. S2CID 22641155.
- ^ Kisumi M, Komatsubara S, Chibata I (julio de 1977). "Vía de formación de isoleucina a partir de piruvato por enzimas biosintéticas de leucina en revertientes de isoleucina que acumulan leucina de Serratia marcescens". Journal of Biochemistry . 82 (1): 95–103. doi :10.1093/oxfordjournals.jbchem.a131698. PMID 142769.
- ^ ab Lehninger AL, Nelson DL, Cox MM (2000). Principios de bioquímica de Lehninger (3.ª ed.). Nueva York: Worth Publishers. ISBN 1-57259-153-6.OCLC 42619569 .
- ^ abc Rajendram R, Preedy VR, Patel VB (2015). Aminoácidos de cadena ramificada en nutrición clínica . Vol. 1. Nueva York, Nueva York: Humana. ISBN 978-1-4939-1923-9.OCLC 898999904 .
- ^ Lynch CJ, Adams SH (diciembre de 2014). "Aminoácidos de cadena ramificada en la señalización metabólica y la resistencia a la insulina". Nature Reviews. Endocrinology . 10 (12): 723–736. doi :10.1038/nrendo.2014.171. PMC 4424797 . PMID 25287287.
- ^ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, et al. (febrero de 2018). "Restauración de la salud metabólica mediante la disminución del consumo de aminoácidos de cadena ramificada". The Journal of Physiology . 596 (4): 623–645. doi :10.1113/JP275075. PMC 5813603 . PMID 29266268.
- ^ abc Yu D, Richardson NE, Green CL, Spicer AB, Murphy ME, Flores V, et al. (mayo de 2021). "Los efectos metabólicos adversos de los aminoácidos de cadena ramificada están mediados por la isoleucina y la valina". Metabolismo celular . 33 (5): 905–922.e6. doi :10.1016/j.cmet.2021.03.025. PMC 8102360 . PMID 33887198.
- ^ Fontana L, Cummings NE, Arriola Apelo SI, Neuman JC, Kasza I, Schmidt BA, et al. (julio de 2016). "La disminución del consumo de aminoácidos de cadena ramificada mejora la salud metabólica". Cell Reports . 16 (2): 520–530. doi :10.1016/j.celrep.2016.05.092. PMC 4947548 . PMID 27346343.
- ^ Green CL, Trautman ME, Chaiyakul K, Jain R, Alam YH, Babygirija R, et al. (noviembre de 2023). "La restricción dietética de isoleucina aumenta la longevidad y la salud de ratones genéticamente heterogéneos". Metabolismo celular . 35 (11): 1976–1995.e6. doi :10.1016/j.cmet.2023.10.005. PMC 10655617. PMID 37939658.
- ^ Instituto de Medicina. Panel sobre Macronutrientes, Instituto de Medicina. Comité Permanente sobre la Evaluación Científica de las Ingestas Dietéticas de Referencia (2005). Ingestas dietéticas de referencia para energía, carbohidratos, fibra, grasas, ácidos grasos, colesterol, proteínas y aminoácidos. Washington, DC: National Academies Press. ISBN 0-309-08537-3.OCLC 57373786 .
- ^ ab Honig GR (noviembre de 1967). "Inhibición de la síntesis de hemoglobina fetal por un análogo de isoleucina". The Journal of Clinical Investigation . 46 (11): 1778–1784. doi :10.1172/JCI105668. PMC 292928 . PMID 4964832.
- ^ Korman SH (diciembre de 2006). "Errores innatos de la degradación de isoleucina: una revisión". Genética molecular y metabolismo . 89 (4): 289–299. doi :10.1016/j.ymgme.2006.07.010. PMID 16950638.
- ^ Hassan SA, Gupta V (2023). "Enfermedad de la orina con olor a jarabe de arce". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 32491705 . Consultado el 16 de abril de 2023 .
- ^ Brunetti-Pierri N, Lanpher B, Erez A, Ananieva EA, Islam M, Marini JC, et al. (febrero de 2011). "Terapia con fenilbutirato para la enfermedad de la orina con olor a jarabe de arce". Human Molecular Genetics . 20 (4): 631–640. doi :10.1093/hmg/ddq507. PMC 3024040 . PMID 21098507.
- ^ Marvel CS (1941). Bachmann WE, Holmes DW (eds.). "dl-Isoleucina". Síntesis orgánicas . 21 : 60. doi :10.15227/orgsyn.021.0060. ISSN 0078-6209.
- ^ Bouvealt L, Locquin R (1905). "Sur la synthése d'une nouvelle leucine". compt. Desgarrar. (141): 115-117.
- ^ ab Vickery HB, Schmidt CL (octubre de 1931). "La historia del descubrimiento de los aminoácidos". Chemical Reviews . 9 (2): 169–318. doi :10.1021/cr60033a001. ISSN 0009-2665.
- ^ Ehrlich F (1908). "Über eine Synthese des Isoleucins". Chemische Berichte . 41 (1): 1453-1458. doi :10.1002/cber.190804101266. ISSN 0365-9496.
Enlaces externos
- Degradación de la isoleucina
- Biosíntesis de isoleucina




