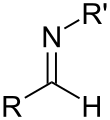
Imina

En química orgánica , una imina ( / ɪ ˈ m iː n / o / ˈ ɪ m ɪ n / ) es un grupo funcional o compuesto orgánico que contiene un doble enlace carbono - nitrógeno ( C=N ). El átomo de nitrógeno puede estar unido a un hidrógeno o a un grupo orgánico (R). El átomo de carbono tiene dos enlaces simples adicionales . [1] [2] Las iminas son comunes en compuestos sintéticos y naturales y participan en muchas reacciones. [3]
A veces se hace una distinción entre aldiminas y cetiminas, derivadas de aldehídos y cetonas, respectivamente.
Estructura
En las iminas, los cinco átomos centrales (C 2 C=NX, cetimina; y C(H)C=NX, aldimina; X = H o C) son coplanares. La planaridad resulta de la hibridación sp 2 de los átomos de carbono y nitrógeno unidos por doble enlace mutuo. La distancia C=N es de 1,29–1,31 Å para las iminas no conjugadas y de 1,35 Å para las iminas conjugadas. Por el contrario, las distancias C−N en las aminas y los nitrilos son de 1,47 y 1,16 Å respectivamente. [4] La rotación alrededor del enlace C=N es lenta. Mediante espectroscopia de RMN , se han detectado isómeros E y Z de las aldiminas. Debido a los efectos estéricos, se favorece el isómero E. [5]
Nomenclatura y clasificación
El término "imina" fue acuñado en 1883 por el químico alemán Albert Ladenburg . [6]
Por lo general, las iminas se refieren a compuestos con la fórmula general R 2 C=NR, como se analiza a continuación. [7] En la literatura más antigua, imina se refiere al análogo aza de un epóxido . Por lo tanto, la etilenimina es la especie de anillo de tres miembros aziridina C 2 H 4 NH. [8] La relación de las iminas con las aminas que tienen enlaces dobles y simples se puede correlacionar con imidas y amidas , como en succinimida vs acetamida .
Las iminas están relacionadas con las cetonas y los aldehídos mediante la sustitución del oxígeno por un grupo NR. Cuando R = H, el compuesto es una imina primaria, cuando R es hidrocarbilo , el compuesto es una imina secundaria. Si este grupo no es un átomo de hidrógeno, entonces el compuesto a veces puede denominarse base de Schiff . [9] Cuando R 3 es OH, la imina se llama oxima , y cuando R 3 es NH 2 la imina se llama hidrazona .
Una imina primaria en la que C está unido a un hidrocarbilo y a un H (derivado de un aldehído) se denomina aldimina primaria ; una imina secundaria con tales grupos se denomina aldimina secundaria . [10] Una imina primaria en la que C está unido a dos hidrocarbilos (derivados de una cetona) se denomina cetimina primaria ; una imina secundaria con tales grupos se denomina cetimina secundaria . [11]
- Aldimina primaria, isómero E
- Aldimina secundaria, isómero E
- Ketimina primaria
- Ketimina secundaria
Las N-sulfinil iminas son una clase especial de iminas que tienen un grupo sulfinilo unido al átomo de nitrógeno.
Síntesis de iminas
Condensación de carbonilamina
Las iminas se preparan típicamente por la condensación de aminas primarias y aldehídos. [12] [13] Las cetonas experimentan reacciones similares, pero con menos frecuencia que los aldehídos. En términos de mecanismo, tales reacciones proceden a través de la adición nucleofílica dando un intermedio hemiaminal -C(OH)(NHR)-, seguido de una eliminación de agua para producir la imina (ver alquilimino-de-oxo-bisustitución para un mecanismo detallado). El equilibrio en esta reacción generalmente favorece al compuesto carbonílico y la amina, de modo que se requiere una destilación azeotrópica o el uso de un agente deshidratante, como tamices moleculares o sulfato de magnesio , para favorecer la formación de imina. En los últimos años, se ha demostrado que varios reactivos como Tris(2,2,2-trifluoroetil)borato [B(OCH 2 CF 3 ) 3 ], [14] pirrolidina [15] o etóxido de titanio [Ti(OEt) 4 ] [16] catalizan la formación de imina.
Más raro que las aminas primarias es el uso de amoníaco para dar una imina primaria. [17] En el caso de la hexafluoroacetona, se puede aislar el intermediario hemiaminal . [18]
De nitrilos
Las cetiminas primarias se pueden sintetizar mediante una reacción de Grignard con un nitrilo . Este método se conoce como síntesis de cetiminas de Moureu-Mignonac. [19] [20] [21] Por ejemplo, la imina de benzofenona también se puede sintetizar mediante la adición de bromuro de fenilmagnesio al benzonitrilo seguida de una hidrólisis cuidadosa (para que la imina no se hidrolice): [22]
- C6H5CN + C6H5MgBr → ( C6H5 ) 2C = NMgBr
- (C6H5 ) 2C = NMgBr + H2O → ( C6H5 ) 2C = NH + MgBr ( OH )
Métodos especializados
Existen otros métodos para la síntesis de iminas.
- Reacción de azidas orgánicas con carbenoides metálicos (producidos a partir de compuestos diazocarbonílicos). [23]
- La reacción de iminofosforanos y azidas orgánicas en una reacción de Aza-Wittig.
- Condensación de ácidos carbonosos con compuestos nitrosados .
- El reordenamiento de tritil N-haloaminas en el reordenamiento de Stieglitz .
- Por reacción de alquenos con ácido hidrazoico en la reacción de Schmidt .
- Por reacción de un nitrilo, ácido clorhídrico y un areno en la reacción de Hoesch .
- Síntesis multicomponente de 3-tiazolinas en la reacción de Asinger .
- Descomposición térmica de oximas . [24]
Reacciones

Hidrólisis
La principal reacción de las iminas, a menudo indeseable, es su hidrólisis para dar lugar a la amina y al precursor carbonilo.
- R2C =NR'+H2O ⇌ R2C = O + R'NH2
Precursores de heterociclos
Las iminas se utilizan ampliamente como intermedios en la síntesis de heterociclos.
- Las iminas aromáticas reaccionan con un éter enólico para formar una quinolina en la reacción de Povarov .
- Las iminas reaccionan, térmicamente, con cetenos en cicloadiciones [2+2] para formar β-lactamas en la síntesis de Staudinger . [25] Se han descrito varias variantes. [26] [27]
- La imina reacciona con dienos en la reacción de imina Diels-Alder para formar una tetrahidropiridina.
- Las tosiliminas reaccionan con compuestos carbonílicos α,β-insaturados para dar aminas alílicas en la reacción Aza-Baylis-Hillman .
Reacciones ácido-base
De manera similar a las aminas originales, las iminas son ligeramente básicas y se protonan reversiblemente para dar sales de iminio :
- R2C =NR' + H + [ R2C = NHR'] +
Alternativamente, las iminas primarias son suficientemente ácidas para permitir la N-alquilación, como se ilustra con la imina de benzofenona : [28]
- (C 6 H 5 ) 2 C=NH + CH 3 Li → (C 6 H 5 ) 2 C=NLi + CH 4
- ( C6H5 ) 2C = NLi + CH3I → ( C6H5 ) 2C = NCH3 + LiI
Reacciones ácido-base de Lewis
Las iminas son ligandos comunes en la química de coordinación . Se encuentran ejemplos particularmente populares con ligandos de base de Schiff derivados del salicilaldehído , los ligandos salen . Las reacciones de iminas catalizadas por metales se llevan a cabo a través de estos complejos. En los complejos de coordinación clásicos , las iminas se unen a los metales a través del nitrógeno. Para metales de baja valencia, se observan ligandos η 2 -imina.
Adiciones nucleofílicas
De forma muy análoga a las cetonas y los aldehídos, las iminas primarias son susceptibles al ataque de los equivalentes de carbanión. El método permite la síntesis de aminas secundarias: [29] [30]
- R 2 C=NR' + R"Li → R 2 R"CN(Li)R'
- R2R " CN(Li)R' + H2O → R2R " CNHR' + LiOH
Esto se puede ampliar para incluir carbonos enolizables en la reacción de Mannich , que es un enfoque sencillo y comúnmente utilizado para producir compuestos de β-amino-carbonilo. [31]
Reducciones de iminas
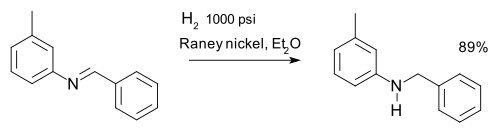
Las iminas se reducen mediante aminación reductora . Una imina se puede reducir a amina mediante hidrogenación , por ejemplo, en una síntesis de m -tolilbencilamina: [32]
Otros agentes reductores son el hidruro de litio y aluminio y el borohidruro de sodio . [33]
La reducción asimétrica de iminas se ha logrado mediante hidrosililación utilizando un catalizador de rodio- DIOP . [34] Desde entonces se han investigado muchos sistemas. [35] [36]
Debido a su electrofilicidad mejorada, los derivados de iminio son particularmente susceptibles a la reducción a aminas. Dichas reducciones se pueden lograr mediante hidrogenación por transferencia o por la acción estequiométrica del cianoborohidruro de sodio . Dado que las iminas derivadas de cetonas asimétricas son proquirales , su reducción define una ruta hacia las aminas quirales.
Polimerización
Las aldiminas no impedidas tienden a ciclarse, como lo ilustra la condensación de metilamina y formaldehído , que da la hexahidro-1,3,5-triazina .
Los polímeros de imina ( poliiminas ) se pueden sintetizar a partir de aldehídos y aminas multivalentes . [37] La reacción de polimerización se produce directamente cuando los monómeros de aldehído y amina se mezclan a temperatura ambiente. En la mayoría de los casos, todavía pueden requerirse (pequeñas) cantidades de disolvente. Las poliiminas son materiales particularmente interesantes debido a su aplicación como vitrómeros . Debido a la naturaleza covalente dinámica de los enlaces de imina, las poliiminas se pueden reciclar con relativa facilidad. Además, las poliiminas son conocidas por su comportamiento de autocuración. [38] [39]
Reacciones diversas
Al igual que los acoplamientos de pinacol , las iminas son susceptibles al acoplamiento reductivo que conduce a 1,2- diaminas . [40]
Las iminas se oxidan con ácido metacloroperoxibenzoico (mCPBA) para dar oxaziridinas .
Las iminas son intermediarios en la alquilación de aminas con ácido fórmico en la reacción de Eschweiler-Clarke .
Un reordenamiento en la química de los carbohidratos que involucra una imina es el reordenamiento de Amadori .
Una reacción de transferencia de metileno de una imina por un iluro de sulfonio no estabilizado puede dar un sistema de aziridina . La imina reacciona con el fosfito de dialquilo en la reacción de Pudovik y la reacción de Kabachnik-Fields
Papel biológico
Las iminas son comunes en la naturaleza. [41] [42] Las enzimas dependientes del fosfato de piridoxal (enzimas PLP) catalizan una gran cantidad de reacciones que involucran aldiminas (o bases de Schiff). [43] Las iminas cíclicas también son sustratos para muchas enzimas imina reductasas . [44]

Véase también
- Enamina
- Base de Schiff
- Carboximidato
- Oxazolidina
- Otros grupos funcionales con doble enlace C=N: oximas , hidrazonas
- Otros grupos funcionales con un triple enlace CN: nitrilos , isonitrilos
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "iminas". doi :10.1351/goldbook.I02957
- ^ March, Jerry (1985). Reacciones, mecanismos y estructura de la química orgánica avanzada (3.ª ed.). Nueva York: Wiley, Inc. ISBN 0-471-85472-7.OCLC 642506595 .
- ^ Saul Patai, ed. (1970). Enlaces dobles carbono-nitrógeno. Química de grupos funcionales de PATai. John Wiley & Sons. doi :10.1002/9780470771204. ISBN 9780471669425.OCLC 639112179 .
- ^ C. Sandorfy (1970). "Aspectos generales y teóricos". En Saul Patai (ed.). Enlaces dobles carbono-nitrógeno . PATai's Chemistry of Functional Groups. John Wiley & Sons. págs. 1–60. doi :10.1002/9780470771204.ch1. ISBN 9780470771204.
- ^ Bjørgo, Johannes; Boyd, Derek R.; Watson, Christopher G.; Jennings, W. Brian; Jerina, Donald M. (1974). " Isomería E–Z en aldiminas". J. Chem. Soc., Perkin Trans. 2 (9): 1081–1084. doi :10.1039/P29740001081.
- ^ Ladenburg, A. (1883). "Ueber die Imine" [Acerca de imines]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 16 : 1149-1152. doi :10.1002/cber.188301601259.
De la pág. 1150: Denn offenbar gehört auch das Piperidin in die Klasse der von mir gesuchten Verbindungen, für welche der Name Imine durch die bestehende Nomenklatur angezeigt ist.
[Porque, obviamente, la piperidina también pertenece a la clase de compuestos que busco, para los cuales el nombre "iminas" está indicado en la nomenclatura predominante.] - ^ "Aminas e iminas". Nomenclatura de compuestos orgánicos. Avances en química. Vol. 126. Sociedad Química Estadounidense. 1974. págs. 180-188. doi :10.1021/ba-1974-0126.ch023. ISBN . 9780841201910.OCLC 922539 .
- ^ "Etilenimina". Síntesis orgánicas . 30 : 38. 1950. doi :10.15227/orgsyn.030.0038.
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Base de Schiff". doi :10.1351/goldbook.S05498
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "aldiminas". doi :10.1351/goldbook.A00209.html
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "ketiminas". doi :10.1351/goldbook.K03381.html
- ^ G. Wittig, A. Hesse (1970). "Condensaciones aldólicas dirigidas: b-fenilcinamaldehído". Organic Syntheses . 50 : 66. doi :10.15227/orgsyn.050.0066.
- ^ Bigelow, Lucius A.; Eatough, Harry (1928). "Benzalanilina". Síntesis orgánicas . 8 : 22. doi :10.15227/orgsyn.008.0022.
- ^ Reeves, Jonathan T.; Visco, Michael D.; Marsini, Mauricio A.; Grinberg, Nelu; Busacca, Carl A.; Mattson, Anita E.; Senanayake, Chris H. (15 de mayo de 2015). "Un método general para la formación de iminas utilizando B (OCH 2 CF 3 ) 3 ". Cartas Orgánicas . 17 (10): 2442–2445. doi : 10.1021/acs.orglett.5b00949. ISSN 1523-7060. PMID 25906082.
- ^ Morales, Sara; Guijarro, Fernando G.; García Ruano, José Luis; Cid, M. Belén (22 de enero de 2014). "Un método aminocatalítico general para la síntesis de aldiminas". Revista de la Sociedad Química Estadounidense . 136 (3): 1082-1089. doi :10.1021/ja4111418. ISSN 0002-7863. PMID 24359453.
- ^ Collados, Juan F.; Toledano, Estefanía; Guijarro, David; Yus, Miguel (6 de julio de 2012). "Síntesis sin disolventes asistida por microondas de N-(terc-butilsulfinil)iminas enantioméricamente puras". Revista de Química Orgánica . 77 (13): 5744–5750. doi :10.1021/jo300919x. ISSN 0022-3263. PMID 22694241.
- ^ Verardo, G.; Giumanini, AG; Strazzolini, P.; Poiana, M. (1988). "Cetiminas de cetonas y amoníaco". Comunicaciones sintéticas . 18 (13): 1501-1511. doi :10.1080/00397918808081307.
- ^ ab Middleton, WJ; Carlson, HD (1970). "Hexafluoroacetona imina". Org. Síntesis . 50 : 81–3. doi :10.15227/orgsyn.050.0081.
- ^ "Síntesis de cetimina de Moureau-Mignonac". Reacciones y reactivos de nombres orgánicos completos . Hoboken, NJ, EE. UU.: John Wiley & Sons, Inc. 15 de septiembre de 2010. págs. 1988-1990. doi :10.1002/9780470638859.conrr446. ISBN 9780470638859.
- ^ Koos, Miroslav; Mosher, Harry S. (1993). "α-Amino-α-trifluorometil-fenilacetonitrilo: Un reactivo potencial para la determinación por RMN de la pureza enantiomérica de los ácidos". Tetrahedron . 49 (8): 1541–1546. doi :10.1016/S0040-4020(01)80341-0.
- ^ Moureu, Charles; Mignonac, Georges (1920). "Les Cétimines". Anales de Chimié . 9 (13): 322–359 . Consultado el 18 de junio de 2014 .
- ^ Pickard, PL; Tolbert, TL (diciembre de 1961). "Un método mejorado de síntesis de cetimina". The Journal of Organic Chemistry . 26 (12): 4886–4888. doi :10.1021/jo01070a025. ISSN 0022-3263.
- ^ Mandler, Michael; Truong, Phong; Zavalij, Peter; Doyle, Michael (14 de enero de 2014). "Conversión catalítica de compuestos diazocarbonílicos en iminas: aplicaciones a la síntesis de tetrahidropirimidinas y β-lactáminas". Organic Letters . 16 (3): 740–743. doi :10.1021/ol403427s. PMID 24423056.
- ^ Arthur Lachman (1930). "Clorhidrato de imina de difenilmetano". Organic Syntheses . 10 : 28. doi :10.15227/orgsyn.010.0028.
- ^ Hubschwerlen, Christian; Specklin, Jean-Luc (1995). "(3S,4S)-3-Amino-1-(3,4-Dimetoxibencil)-4-[(R)-2,2-Dimetil-1,3-Dioxolan-4-Yl]-2-Azetidinona". Síntesis orgánicas . 72 : 14. doi :10.15227/orgsyn.072.0014.
- ^ Hegedus, Lous S.; McGuire, Michael A.; Schultze, Lisa M. (1987). "1,3-Dimetil-3-Metoxi-4-Fenilazetidinona". Síntesis orgánicas . 65 : 140. doi :10.15227/orgsyn.065.0140.
- ^ Ian P. Andrews y Ohyun Kwon (2011). "ANULACIÓN [3 + 2] CATALIZADA POR FOSFINA: SÍNTESIS DE 5-(terc-BUTILO)-2-FENIL-1-TOSIL-3-PIRROLINA-3-CARBOXILATO DE ETILO". Organic Syntheses . 88 : 138. doi : 10.15227/orgsyn.088.0138 .
- ^ Nottingham, Chris; Lloyd-Jones, Guy C. (2018). "Trimetilsilildiazo[13C]metano: un reactivo versátil para el marcado con 13C". Organic Syntheses . 95 : 374–402. doi : 10.15227/orgsyn.095.0374 . hdl : 20.500.11820/c801073c-6b4b-4a85-be68-2c4313b6e53d .
- ^ Hu, Anjing; Zhang, Zhan-Ming; Xiao, Yuanjing; Zhang, Junliang (2020). "Síntesis estereoselectiva de ligandos de monofosfina de sulfinamida quirales (Ming-Phos)(S, Rs)-M". Síntesis orgánicas . 97 : 262–273. doi : 10.15227/orgsyn.097.0262 . S2CID 235020219.
- ^ Vincent Rodeschini, Nigel S. Simpkins y Fengzhi Zhang (2007). "Desimetrización de una imida fusionada con anillo con una base de amida de litio quiral: formación de éster metílico del ácido (3aS,7aS)-2[2-(3,4-dimetoxifenil)-etil]-1,3-dioxo-octahidro-isoindol-3a-carboxílico". Organic Syntheses . 84 : 306. doi :10.15227/orgsyn.084.0306.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Arend, Michael; Westermann, Bernhard; Risch, Nikolaus (4 de mayo de 1998). "Variantes modernas de la reacción de Mannich". Edición internacional Angewandte Chemie . 37 (8): 1044-1070. doi :10.1002/(SICI)1521-3773(19980504)37:8<1044::AID-ANIE1044>3.0.CO;2-E.
- ^ CFH Allen y James VanAllan (1955). "m-Tolilbencilamina". Síntesis orgánicas : 827; Volúmenes recopilados , vol. 3.
- ^ Por ejemplo: Ieva R. Politzer y AI Meyers (1988). "Aldehídos de 2-bencil-4,4,6-trimetil-5,6-dihidro-1,3(4H)-oxazina: 1-fenilciclopentanocarboxaldehído". Síntesis orgánicas; Volúmenes recopilados , vol. 6, pág. 905.
- ^ Langlois, N (1973). "Síntesis de aminas asimétricas por hidrosililación de iminas catalíticas por un complejo quiral de rodio". Tetraedro Lett. 14 (49): 4865–4868. doi :10.1016/S0040-4039(01)87358-5.
- ^ Kobayashi, Shū; Ishitani, Haruro (1999). "Adición enantioselectiva catalítica a iminas". Chem. Rev. 99 (5): 1069–94. doi :10.1021/cr980414z. PMID 11749440.
- ^ J. Martens: Reducción de grupos imino (C = N) en (G. Helmchen, RW Hoffmann, J. Mulzer, E. Schaumann) Síntesis estereoselectiva Houben-Weyl, Workbench Edition E21 Volumen 7, S. 4199-4238, Thieme Editorial Stuttgart, 1996, ISBN 3-13-106124-3 .
- ^ Schoustra, Sybren K.; Groeneveld, Timo; Smulders, Maarten MJ (2021). "El efecto de la polaridad en la dinámica de intercambio molecular en redes adaptables covalentes basadas en iminas". Química de polímeros . 12 (11): 1635–1642. doi : 10.1039/D0PY01555E .
- ^ Schoustra, Sybren K.; Dijksman, Joshua A.; Zuilhof, Han; Smulders, Maarten MJ (2021). "Control molecular sobre mecánicas similares a vitrimer: motivos dinámicos ajustables basados en la ecuación de Hammett en materiales de poliimina". Chemical Science . 12 (1): 293–302. doi :10.1039/d0sc05458e. ISSN 2041-6520. PMC 8178953 . PMID 34163597.
- ^ Zhu, Jiaqi (2020). "Un elastómero de polidimetilsiloxano transparente autorreparable basado en enlaces imínicos". European Polymer Journal . 123 : 109382. Bibcode :2020EurPJ.12309382W. doi :10.1016/j.eurpolymj.2019.109382. S2CID 214199868.
- ^ Alexakis, Alex; Aujard, Isabelle; Kanger, Tonis; Mangeney, Pierre (1999). "( R,R )- y ( S,S )-N,N'-Dimetil-1,2-Difeniletileno-1,2-Diamina". Síntesis orgánicas . 76 : 23. doi :10.15227/orgsyn.076.0023.
- ^ "Los investigadores recurren a la naturaleza para descubrir los secretos de la escisión de las iminas cíclicas". EurekAlert! . Consultado el 22 de julio de 2021 .
- ^ Borchert, Andrew J.; Ernst, Dustin C.; Downs, Diana M. (2019). "Enaminas e iminas reactivas in vivo: lecciones del paradigma RidA". Tendencias en ciencias bioquímicas . 44 (10): 849–860. doi :10.1016/j.tibs.2019.04.011. ISSN 0968-0004. PMC 6760865 . PMID 31103411.
- ^ Eliot, Andrew C.; Kirsch, Jack F. (2004). "Enzimas de fosfato de piridoxal: consideraciones mecanicistas, estructurales y evolutivas". Revisión anual de bioquímica . 73 : 383–415. doi :10.1146/annurev.biochem.73.011303.074021. PMID 15189147.
- ^ Mangas-Sanchez, Juan; France, Scott P; Montgomery, Sarah L; Aleku, Godwin A; Man, Henry; Sharma, Mahima; Ramsden, Jeremy I; Grogan, Gideon; Turner, Nicholas J (2017). "Imina reductasas (IREDs)". Current Opinion in Chemical Biology . 37 : 19–25. doi :10.1016/j.cbpa.2016.11.022. PMID 28038349.