Imida

En química orgánica , una imida es un grupo funcional que consiste en dos grupos acilo unidos al nitrógeno . [1] Los compuestos están estructuralmente relacionados con los anhídridos de ácido , aunque las imidas son más resistentes a la hidrólisis. En términos de aplicaciones comerciales, las imidas son más conocidas como componentes de polímeros de alta resistencia, llamados poliimidas . Las imidas inorgánicas también se conocen como compuestos en estado sólido o gaseosos, y el grupo imido (=NH) también puede actuar como ligando .
Nomenclatura
La mayoría de las imidas son compuestos cíclicos derivados de ácidos dicarboxílicos , y sus nombres reflejan el ácido original. [2] Algunos ejemplos son la succinimida , derivada del ácido succínico , y la ftalimida , derivada del ácido ftálico . Para las imidas derivadas de aminas (a diferencia del amoníaco), el sustituyente N se indica con un prefijo. Por ejemplo, la N-etilsuccinimida se deriva del ácido succínico y la etilamina . Las isoimidas son isoméricas con las imidas normales y tienen la fórmula RC(O)OC(NR′)R″. A menudo son intermediarios que se convierten en las imidas más simétricas. Los compuestos orgánicos llamados carbodiimidas tienen la fórmula RN=C=NR. No están relacionados con las imidas.
Imidas de ácidos dicarboxílicos
Los enlaces de PubChem brindan acceso a más información sobre los compuestos, incluidos otros nombres, identificadores, toxicidad y seguridad.
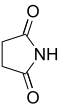
norte Nombre común Nombre sistemático Estructura PubChem ácido parental estructura 2 Succinimida Pirrolidin-2,5-diona 
11439 Ácido succínico 
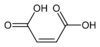
2, enlaces dobles carbono-carbono cis insaturados Maleimida Pirrol-2,5-diona 
10935 Ácido maleico 
3 Glutarimida Piperidina-2,6-diona 
70726 Ácido glutárico 
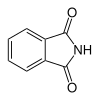
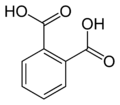
6 Ftalimida Isoindol-1,3-diona 
6809 Ácido ftálico 
Propiedades
Al ser altamente polares, las imidas exhiben una buena solubilidad en medios polares. El centro N–H de las imidas derivadas del amoníaco es ácido y puede participar en la formación de puentes de hidrógeno . A diferencia de los anhídridos de ácido estructuralmente relacionados, resisten la hidrólisis y algunas incluso pueden recristalizarse en agua hirviendo.
Ocurrencia y aplicaciones
Muchos polímeros de alta resistencia o eléctricamente conductores contienen subunidades imidas, es decir, las poliimidas . Un ejemplo es Kapton donde la unidad repetida consiste en dos grupos imida derivados de ácidos tetracarboxílicos aromáticos. [3] Otro ejemplo de poliimidas es la poliglutarimida típicamente hecha de polimetilmetacrilato (PMMA) y amoníaco o una amina primaria por aminolisis y ciclización del PMMA a alta temperatura y presión, típicamente en una extrusora. Esta técnica se llama extrusión reactiva. Un producto comercial de poliglutarimida basado en el derivado de metilamina de PMMA, llamado Kamax, fue producido por la compañía Rohm and Haas. La tenacidad de estos materiales refleja la rigidez del grupo funcional imida.
El interés por la bioactividad de los compuestos que contienen imida surgió a raíz del descubrimiento temprano de la alta bioactividad de la cicloheximida como inhibidor de la biosíntesis de proteínas en ciertos organismos. La talidomida , famosa por sus efectos adversos, es uno de los resultados de esta investigación. Varios fungicidas y herbicidas contienen la funcionalidad imida. Algunos ejemplos son el captan , que se considera cancerígeno en algunas condiciones, y la procimidona . [4]

En el siglo XXI surgió un nuevo interés en los efectos inmunomoduladores de la talidomida, lo que dio lugar a la clase de inmunomoduladores conocidos como fármacos imida inmunomoduladores (IMiD).
Preparación
Las imidas más comunes se preparan calentando ácidos dicarboxílicos o sus anhídridos y amoníaco o aminas primarias . El resultado es una reacción de condensación : [5]
- (RCO) 2O +R′NH2 → (RCO) 2NR ′ + H2O
Estas reacciones se producen por intermedio de amidas . La reacción intramolecular de un ácido carboxílico con una amida es mucho más rápida que la reacción intermolecular, que rara vez se observa.
También pueden producirse a través de la oxidación de amidas , particularmente cuando se parte de lactamas . [6]
- R(CO)NHCH2 R ' + 2 [O] → R(CO)N(CO)R' + H2O
Ciertas imidas también pueden prepararse mediante la transposición de Mumm de isoimida a imida .
Reacciones
En el caso de las imidas derivadas del amoníaco, el centro N–H es débilmente ácido. Por lo tanto, las sales de metales alcalinos de las imidas se pueden preparar con bases convencionales como el hidróxido de potasio. La base conjugada de la ftalimida es la ftalimida de potasio . Estos aniones se pueden alquilar para dar N -alquilimidas, que a su vez se pueden degradar para liberar la amina primaria. En la etapa de liberación se utilizan nucleófilos fuertes, como el hidróxido de potasio o la hidrazina .
El tratamiento de las imidas con halógenos y bases da lugar a los derivados N -halo. Ejemplos que son útiles en la síntesis orgánica son la N -clorosuccinimida y la N - bromosuccinimida , que sirven respectivamente como fuentes de "Cl + " y "Br + " en la síntesis orgánica .
Referencias
- ^ "Imidas". Compendio de terminología química de la IUPAC . 2009. doi :10.1351/goldbook.I02948. ISBN 978-0-9678550-9-7.
- ^ Martynov, AV (6 de diciembre de 2005). "Nuevo enfoque para la síntesis de imidas de ácido trans-aconítico". ChemInform . 36 (49): no. doi :10.1002/chin.200549068. ISSN 1522-2667.
- ^ Walter W. Wright y Michael Hallden-Abberton "Poliimidas" en Ullmann's Encyclopedia of Industrial Chemistry , 2002, Wiley-VCH, Weinheim. doi :10.1002/14356007.a21_253
- ^ Peter Ackermann, Paul Margot, Franz Müller "Fungicidas agrícolas" en Ullmann's Encyclopedia of Industrial Chemistry , 2002, Wiley-VCH, Weinheim. doi :10.1002/14356007.a12_085
- ^ Vincent Rodeschini, Nigel S. Simpkins y Fengzhi Zhangi (2009). "Formación ilustrativa de imida a partir de amina y anhídrido". Síntesis orgánicas
{{cite journal}}: CS1 maint: multiple names: authors list (link); Volúmenes recopilados , vol. 11, pág. 1028. - ^ Sperry, Jonathan (27 de septiembre de 2011). "La oxidación de amidas a imidas: una poderosa transformación sintética". Síntesis . 2011 (22): 3569–3580. doi :10.1055/s-0030-1260237.
Enlaces externos
- IUPAC: imidas