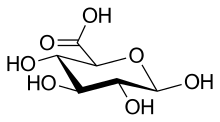
Ácido glucurónico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Ácido β- D -glucopiranurónico | |
| Nombre sistemático de la IUPAC Ácido ( 2S , 3S , 4S , 5R ,6R ) -3,4,5,6-tetrahidroxioxano-2-carboxílico | |
| Otros nombres Ácido β- D -glucurónico, GlcA | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.026.807 |
| BARRIL | |
| Malla | Ácido glucurónico+ |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C6H10O7 | |
| Masa molar | 194,139 g·mol −1 |
| Punto de fusión | 159 a 161 °C (318 a 322 °F; 432 a 434 K) [1] |
| Compuestos relacionados | |
Ácidos urónicos relacionados | Ácido alurónico, Ácido altrurónico, Ácido arabinurónico, Ácido fructurónico , Ácido galacturónico , Ácido gulurónico , Ácido idurónico, Ácido lixurónico , Ácido manurónico , Ácido psicurónico, Ácido riburónico, Ácido ribulurónico, Ácido sorburónico, Ácido tagaturónico, Ácido talurónico, Ácido xilurónico, Ácido xilurónico |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido glucurónico (del griego γλεῦκος " vino dulce, mosto " y οὖρον " orina ") es un ácido urónico que se aisló por primera vez de la orina (de ahí el nombre "ácido urónico"). Se encuentra en muchas gomas como la goma arábiga ( aproximadamente un 18 %), la goma xantana y el té de kombucha y es importante para el metabolismo de microorganismos, plantas y animales.
Propiedades
This section needs additional citations for verification. (March 2023) |

El ácido glucurónico es un ácido de azúcar derivado de la glucosa , con su sexto átomo de carbono oxidado a un ácido carboxílico. En los seres vivos, esta oxidación primaria se produce con la UDP-α -D -glucosa (UDPG), no con el azúcar libre.
El ácido glucurónico, al igual que su precursor glucosa , puede existir como una aldohexosa lineal (carboxo-) (<1%), o como un hemiacetal cíclico ( furanosa o piranosa ). Las aldohexosas como la D -glucosa son capaces de formar dos formas de furanosa (α y β) y dos formas de piranosa (α y β). Por la convención de Fischer , el ácido glucurónico tiene dos estereoisómeros ( enantiómeros ), ácido D- y L -glucurónico, dependiendo de su configuración en C-5. La mayoría de los azúcares fisiológicos son de configuración D. Debido al cierre del anillo, los azúcares cíclicos tienen otro átomo de carbono asimétrico (C-1), lo que resulta en dos estereoisómeros más, llamados anómeros . Dependiendo de la configuración en C-1, hay dos anómeros de ácido glucurónico, forma α y β. En el ácido β- D -glucurónico, el grupo hidroxi C-1 se encuentra en el mismo lado del anillo de piranosa que el grupo carboxilo. En el ácido de azúcar libre, predomina la forma β (~64 %), mientras que en el organismo predomina la forma α del ácido UDP-α- D -glucurónico (UDPGA).
Los estereoisómeros de carbohidratos, que difieren en configuración en solo un (otro) átomo de C asimétrico, se denominan epímeros . Por ejemplo, el ácido D -manurónico (C-2), el D-alurónico (C-3), el D -galacturónico (C-4) y el L -idurónico (C-5) son epímeros del ácido glucurónico.
Los anillos de piranosa no planos pueden adoptar la conformación de silla (en dos variantes) o de barco. La conformación preferida depende de la interferencia espacial u otras interacciones de los sustituyentes. La forma de piranosa de la D -glucosa y su derivado, el ácido D -glucurónico, prefiere la conformación de silla 4 C 1 .
La oxidación adicional en C-1 hasta el nivel carboxilo produce el ácido glucárico dicarboxílico . La glucuronolactona es el autoéster ( lactona ) del ácido glucurónico.
La oxidación directa de una aldosa afecta primero al grupo aldehído. Una síntesis de laboratorio de un ácido urónico a partir de una aldosa requiere proteger los grupos aldehído e hidroxi de la oxidación, por ejemplo mediante la conversión a acetales cíclicos (por ejemplo, acetónidos ).
El glucuronato de sodio se puede producir mediante la oxidación directa del almidón con ácido nítrico concentrado. En esta preparación, la baja disponibilidad de agua evita que los polímeros de almidón se hidrolicen y solo oxida los hidroxilos libres, de la misma manera que el dióxido de nitrógeno oxidaría el almidón. Una vez que se completa esta reacción y la mezcla de almidón y ácido nítrico se vuelve transparente (después de desprender gas de dióxido de nitrógeno), la solución se puede diluir e hidrolizar con otro ácido mineral. Luego, la oxidación se extingue lentamente con hidróxido de sodio (o bicarbonato de sodio), formando glucuronato de sodio, que se puede cristalizar en la solución. Con metales de transición, forma complejos como glucuronato de hierro (III), glucuronato de hierro (II) y glucuronato de cobre (II).
Funciones
Proteoglicanos
El ácido glucurónico es un componente básico común de los proteoglicanos y los glicoglicerolípidos: [ cita requerida ]
- La heparina es un inhibidor de la coagulación sanguínea y se encuentra en los mastocitos, los pulmones y el hígado.
- El sulfato de condroitina se encuentra en grandes cantidades en el cartílago, la aorta, el tejido conectivo, los huesos y la piel.
- El sulfato de dermatán es un proteoglicano presente en la piel, el corazón y los vasos sanguíneos.
- El sulfato de queratán se encuentra en la córnea, el cartílago y el hueso.
- El ácido hialurónico se encuentra en grandes cantidades en los tejidos conectivos, la piel, el cartílago y el líquido sinovial.
- Los glicoglicerolípidos de los ácidos glucurónico o galacturónico forman las paredes celulares de las bacterias.
Glucuronidación

El ácido UDP-α- D -glucurónico (UDPGA) a menudo participa en el metabolismo de fase II ( conjugación ) de xenobióticos y endobióticos lipofílicos . Estos enlaces implican enlaces glucosídicos con grupos tiol, amina e hidroxi, o esterificación con los grupos carboxilo e hidroxilo. Este proceso de enlace se conoce como glucuronidación (o conjugación de glucurónido). La glucuronidación ocurre principalmente en el hígado, aunque las enzimas responsables de su catálisis, las UDP-glucuroniltransferasas (UDP-GT), se han encontrado en todos los órganos corporales principales, por ejemplo, intestino, riñones, cerebro, glándula suprarrenal, bazo y timo. [2] [3] Ocurren reacciones análogas con otros ácidos UDP - urónicos (por ejemplo, ácido D -galacturónico ).
Los glucósidos resultantes de la glucuronidación se denominan β- D -glucurónidos, sus sales y ésteres se denominan glucuronatos. El cuerpo humano utiliza la glucuronidación para hacer que los alcoholes , fenoles , ácidos carboxílicos , mercaptanos , aminas alifáticas primarias y secundarias y carbamatos sean más solubles en agua y, de esta manera, permite su posterior eliminación del cuerpo a través de la orina o las heces (a través de la bilis del hígado) a una velocidad significativamente mayor. El grupo carboxilo se ioniza a pH fisiológico, lo que hace que el compuesto conjugado sea soluble en agua. Los compuestos con masas moleculares > 60.000 son demasiado grandes para la excreción renal y se excretarán con la bilis en el intestino. Los neonatos son deficientes en este sistema de conjugación, lo que los hace particularmente vulnerables a medicamentos como el cloranfenicol , que se inactiva mediante la adición de ácido glucurónico, lo que resulta en el síndrome del bebé gris . La bilirrubina se excreta en la bilis como diglucurónido de bilirrubina (80%), glucurónido de bilirrubina (20%) y bilirrubina no conjugada (<1%). En el síndrome de Crigler-Najjar y el síndrome de Gilbert , la actividad de UDPGT se reduce o casi desaparece debido a mutaciones, lo que provoca ictericia .
Es posible agotar el suministro de ácido glucurónico del cuerpo mediante la combinación de múltiples fármacos/sustancias cuyo metabolismo y excreción dependen principalmente o totalmente de la glucuronidación. Aunque la mayoría de estas sustancias tienen rutas metabólicas secundarias que se vuelven prominentes después del agotamiento de GCA, la tasa de metabolismo se reduce lo suficiente como para producir una marcada acumulación de todos los sustratos de GCA en el sistema; esto a menudo aumenta las concentraciones de fármaco en la sangre en cantidades médicamente relevantes. En los casos más graves, se sabe que ocurren daños permanentes y debilitantes en los órganos (en particular, el hígado, los riñones, el corazón y el cerebro), e incluso la muerte. El etanol , la morfina , el paracetamol (acetaminofén) , los inhibidores de la ciclooxigenasa ( AINE ), los esteroides endógenos y ciertas benzodiazepinas son capaces de contribuir al agotamiento de GCA, siendo el etanol y el acetaminofén las sustancias implicadas más comúnmente en casos de sobredosis accidentales que se han atribuido positivamente al agotamiento de ácido glucurónico.
Las cantidades excesivas de GCA también pueden ser peligrosas para la salud [ cita requerida ] . Se sabe que el humo del tabaco, la mayoría de los barbitúricos y algunos carbamatos estimulan la producción de GCA. El aumento de la actividad de GCA da como resultado una disminución de la concentración y la vida media metabólica de los sustratos de ácido glucurónico, lo que hace que los niveles plasmáticos de los fármacos glucuronizados caigan por debajo de su umbral terapéutico. La glucuronidación excesiva de los sustratos puede dar como resultado una respuesta inadecuada a las dosis tradicionales de los medicamentos afectados y, a menos que el fármaco tenga un índice terapéutico muy amplio, generalmente dará como resultado el fracaso agudo de la farmacoterapia y requerirá la transición de uno o más fármacos implicados a un régimen equivalente de alternativas no glucuronizadas. Un número selecto de antidepresivos y una amplia gama de agentes antipsicóticos son ligandos de glucuronidación, pero debido a su mecanismo de acción retardado y sus propiedades farmacocinéticas, la disminución de sus concentraciones plasmáticas puede no ser inmediatamente aparente y tiende a presentarse como una recaída repentina e intensa de los síntomas en lugar de una regresión gradual a los comportamientos y patrones de pensamiento exhibidos por el paciente antes del inicio de su tratamiento farmacológico.
Los glucurónidos pueden ser hidrolizados por la β-glucuronidasa presente en la microflora intestinal hasta la aglicona respectiva, que puede ser reabsorbida desde el intestino y transportada de nuevo al hígado con la sangre. El ciclo resultante se denomina circulación enterohepática . Los compuestos que pasan por la circulación enterohepática se excretan lentamente y suelen tener una vida media más larga en el organismo.
Ciertos glucurónidos son electrofílicos y pueden funcionar en procesos de intoxicación . Se sabe que la unión covalente de las porciones agliconas de varios glucurónidos de ácidos carboxílicos (ésteres) se produce con sitios nucleofílicos en la albúmina sérica a través de reacciones de transacilación , por ejemplo. [4]
Los fenoles , metabolitos derivados de P450 de hidrocarburos aromáticos cuantitativamente importantes, son sustratos tanto para UDP-GT como para sulfotransferasas . Los glucurónidos predominan con fenol o un precursor de fenol ( benceno ) en mamíferos porque la formación de sulfato es un sistema de alta afinidad y baja capacidad (debido al agotamiento del sulfato), mientras que la glucuronidación es un sistema de baja afinidad y alta capacidad (aunque todavía agotable). [4]
Papel en la enfermedad
El ácido glucurónico, así como el metabolito glucuronizado del etanol , el etil glucurónido (ETG), actúan sobre el receptor tipo Toll 4 para agravar las afecciones inflamatorias agudas y crónicas, así como para aumentar la severidad percibida del dolor en pacientes con afecciones de dolor crónico, a través de la regulación positiva de la producción y liberación de moléculas de señalización inflamatoria endógena dentro del cuerpo. El agonismo a largo plazo del receptor TLR4 (como el que ocurre con GCA, ETG y opiáceos ) da como resultado que las afecciones crónicamente dolorosas se perciban como considerablemente más graves de lo que se percibían anteriormente, mientras que las actividades preexistentes tolerables pero ocasionalmente dolorosas pueden volverse más dolorosas que antes y comenzarán a agravarse con actividades más breves y menos exigentes físicamente. También puede causar respuestas igualmente dolorosas a estímulos cada vez menos nocivos (irritantes), lo que finalmente resulta en una agonía considerable a partir de estímulos que no causarían ninguna cantidad de dolor a la mayoría de las personas. [5]
Usar
Determinación de esteroides urinarios y de conjugados de esteroides en sangre. El etil glucurónido y el etil sulfato se excretan en la orina como metabolitos del etanol y se utilizan para controlar el consumo o la dependencia del alcohol.
El ácido glucurónico y el ácido glucónico son productos de fermentación presentes en el té Kombucha . [6]
El ácido glucurónico es un precursor del ácido ascórbico ( vitamina C , anteriormente llamado ácido L-hexurónico). El ascorbato puede ser biosintetizado por plantas superiores, algas, levaduras y la mayoría de los animales. Una cabra adulta produce ~13 g de vitamina C por día. Esta capacidad falta en algunos mamíferos (incluidos los humanos y los conejillos de indias) y también en insectos, invertebrados y la mayoría de los peces. Estas especies requieren un suministro externo de ascorbato, porque carecen de la enzima biosintética L - gulonolactona oxidasa . [7]
El glucurónido 4-metilumbeliferil-β- D -glucurónido (MUG) se utiliza para detectar la presencia de Escherichia coli . E. coli produce la enzima β-glucuronidasa, que hidroliza la molécula de MUG a un producto fluorescente que es detectable bajo luz ultravioleta .
Véase también
Referencias
- ^ Ácido D-glucurónico en Sigma-Aldrich
- ^ Ohno S, Nakajin, Shizuo (6 de octubre de 2008). "Determinación de la expresión de ARNm de UDP-glucuronosiltransferasas humanas y aplicación para la localización en diversos tejidos humanos mediante reacción en cadena de polimerasa-transcriptasa inversa en tiempo real". Metabolismo y disposición de fármacos . 37 (1). Sociedad Estadounidense de Farmacología y Terapéutica Experimental : 32–40. doi :10.1124/dmd.108.023598. PMID 18838504. S2CID 5150289 . Consultado el 7 de noviembre de 2010 .
- ^ Bock K, Köhle C (2005). "UDP-glucuronosiltransferasa 1A6: aspectos estructurales, funcionales y reguladores". Enzimas de conjugación de fase II y sistemas de transporte . Métodos en enzimología. Vol. 400. págs. 57–75. doi :10.1016/S0076-6879(05)00004-2. ISBN 978-0-12-182805-9. Número de identificación personal 16399343.
- ^ de Tanya C McCarthy, Christopher J Sinal (2005), "Biotransformación", Enciclopedia de toxicología , vol. 1 (2.ª ed.), Elsevier, págs. 299-312, ISBN 0-12-745354-7
- ^ Lewis SS, Hutchinson MR, Zhang Y, Hund DK, Maier SF, Rice KC, Watkins LR (2013). "El ácido glucurónico y el metabolito del etanol, etil-glucurónido, provocan la activación del receptor tipo Toll 4 y un aumento del dolor". Cerebro, comportamiento e inmunidad . 30 : 24–32. doi :10.1016/j.bbi.2013.01.005. PMC 3641160 . PMID 23348028.
- ^ Blanc P (febrero de 1996). "Caracterización de los metabolitos del hongo del té". Biotechnology Letters . 18 (2): 139–142. doi :10.1007/BF00128667. S2CID 34822312.
- ^ Gerhard Michal, Dietmar Schomburg (2012), Vías bioquímicas: un atlas de bioquímica y biología molecular (2.ª ed.), Wiley, pág. 145a, ISBN 978-0-470-14684-2



