Forona
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 2,6-Dimetilhepta-2,5-dien-4-ona | |
| Otros nombres Forona Diisopropilideno acetona | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Química biológica |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.007.261 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1993 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
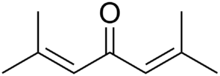
| ((CH3 ) 2C = CH) 2C =O | |
| Masa molar | 138,210 g·mol −1 |
| Apariencia | Cristales amarillos |
| Olor | Geranio |
| Densidad | 0,885 g/ cm3 |
| Punto de fusión | 28 °C (82 °F; 301 K) |
| Punto de ebullición | 198 a 199 °C (388 a 390 °F; 471 a 472 K) |
| Peligros | |
| punto de inflamabilidad | 79 °C (174 °F; 352 K) |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La forona , o diisopropilideno acetona , es una sustancia cristalina de color amarillo con olor a geranio , con fórmula C 9 H 14 O o ((CH 3 ) 2 C=CH) 2 C=O .
Preparación
Fue obtenido por primera vez en 1837 en forma impura por el químico francés Auguste Laurent , quien lo llamó «alcanforilo». [1] En 1849, el químico francés Charles Frédéric Gerhardt y su alumno Jean Pierre Liès-Bodart lo prepararon en estado puro y lo llamaron «forona». [2] En ambas ocasiones se produjo por cetonización a través de la destilación seca de la sal de calcio del ácido alcanfórico . [3] [4]
- CaC 10 H 14 O 4 → C 9 H 14 O + CaCO 3
En la actualidad, se obtiene típicamente mediante la condensación aldólica doble catalizada por ácido de tres moléculas de acetona . El óxido de mesitilo se obtiene como intermedio y se puede aislar. [5]

La forona cruda se puede purificar mediante recristalización repetida en etanol o éter, en los que es soluble.
Reacciones
La forona puede condensarse con amoníaco para formar triacetona amina .
Véase también
Referencias
- Índice Merck , 11.a edición, 7307 .
- ^ Laurent, Auguste (1837). "Sur les acides pinique et sylvique, et sur le camphoryle" [Sobre los ácidos pínico y silvico y sobre el alcanforilo]. Annales de Chimie et de Physique . 2da serie (en francés). 65 : 324–332.; ver "Camphoryle", págs. 329–330.
- ^ Ver:
- Gerhardt, Charles (1849) Comptes rendus des travaux de chimie (París, Francia: Masson, 1849), p. 385. (en francés)
- Gerhardt; Liès-Bodart (1849). "Trockne Destillation des camphorsauren Kalks" [Destilación en seco de alcanforato de calcio]. Annalen der Chemie und Pharmacie (en alemán). 72 (3): 293–294. doi :10.1002/jlac.18490720327.De la pág. 293: " Dieses Oel, welches Gerhardt und Lies-Bodart mit dem Namen Phoron bezeichnen, …" (Este aceite, que Gerhardt y Liès-Bodart designan con el nombre de "phorone",... )
- ^ Watts, Henry, Un diccionario de química y ramas afines de otras ciencias (Londres, Inglaterra: Longmans, Green, and Co., 1863), vol. 1, "Camphorone", pág. 733.
- ^ Kekulé, agosto (1866). Lehrbuch der organischen Chemie [ Libro de texto de química orgánica ] (en alemán). vol. 2do vol. Erlangen, (Alemania): Ferdinand Enke. pag. 463.
- ^ Hardo Siegel; Manfred Eggersdorfer (2005). "Cetonas". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a15_077. ISBN 978-3-527-30673-2.
Enlaces externos
- Fichas internacionales de seguridad química


