Farmacogenómica
Este artículo puede resultar demasiado técnico para que la mayoría de los lectores lo comprendan . ( Mayo de 2024 ) |
| Parte de una serie sobre |
| Genética |
|---|
 |
La farmacogenómica , a menudo abreviada como "PGx", es el estudio del papel del genoma en la respuesta a los fármacos . Su nombre ( farmacogenómica + genómica ) refleja su combinación de farmacología y genómica . La farmacogenómica analiza cómo la composición genética de un paciente afecta su respuesta a los fármacos. [1] Se ocupa de la influencia de la variación genética adquirida y heredada en la respuesta a los fármacos, correlacionando las mutaciones del ADN (incluidas las mutaciones puntuales , las variaciones del número de copias y las variaciones estructurales ) con la farmacocinética ( absorción , distribución , metabolismo y eliminación de fármacos ), la farmacodinámica (efectos mediados por los objetivos biológicos de un fármaco ) y/o los puntos finales inmunogénicos . [2] [3] [4]
La farmacogenómica tiene como objetivo desarrollar medios racionales para optimizar la terapia farmacológica , con respecto al genotipo de los pacientes , para lograr la máxima eficiencia con los mínimos efectos adversos . [5] Se espera que mediante el uso de la farmacogenómica, los tratamientos farmacológicos farmacéuticos puedan desviarse de lo que se denomina el enfoque de "dosis única para todos". La farmacogenómica también intenta eliminar el ensayo y error en la prescripción, permitiendo a los médicos tener en cuenta los genes de sus pacientes, la funcionalidad de estos genes y cómo esto puede afectar la efectividad de los tratamientos actuales o futuros del paciente (y cuando corresponda, proporcionar una explicación del fracaso de los tratamientos pasados). [6] [7] Estos enfoques prometen el advenimiento de la medicina de precisión e incluso la medicina personalizada , en la que los medicamentos y las combinaciones de medicamentos se optimizan para subconjuntos estrechos de pacientes o incluso para la composición genética única de cada individuo. [8] [9]
Ya sea que se utilice para explicar la respuesta de un paciente (o la falta de ella) a un tratamiento, o para actuar como una herramienta predictiva, se espera lograr mejores resultados del tratamiento y una mayor eficacia, y reducir las toxicidades de los medicamentos y las reacciones adversas a los medicamentos (RAM). Para los pacientes que no responden a un tratamiento, se pueden prescribir terapias alternativas que se adapten mejor a sus necesidades. Para proporcionar recomendaciones farmacogenómicas para un medicamento determinado, se pueden utilizar dos tipos posibles de entrada: genotipificación o secuenciación del exoma o del genoma completo . [10] La secuenciación proporciona muchos más puntos de datos, incluida la detección de mutaciones que terminan prematuramente la proteína sintetizada ( codón de terminación temprana ). [10]
Farmacogenética vs. farmacogenómica
El término farmacogenómica se utiliza a menudo indistintamente con farmacogenética . Aunque ambos términos se relacionan con la respuesta a los fármacos en función de las influencias genéticas, existen diferencias entre los dos. La farmacogenética se limita a los fenotipos monogénicos (es decir, interacciones entre un único gen y un fármaco). La farmacogenómica se refiere a los fenotipos de respuesta a fármacos poligénicos y abarca la transcriptómica , la proteómica y la metabolómica .
Mecanismos de interacciones farmacogenéticas
Farmacocinética
La farmacocinética implica la absorción, distribución, metabolismo y eliminación de los fármacos. Estos procesos suelen ser facilitados por enzimas como los transportadores de fármacos o las enzimas metabolizadoras de fármacos (que se analizan en profundidad a continuación). La variación en los loci de ADN responsables de producir estas enzimas puede alterar su expresión o actividad, de modo que su estado funcional cambia. Un aumento, disminución o pérdida de la función de los transportadores o enzimas metabolizadoras puede, en última instancia, alterar la cantidad de medicamento en el cuerpo y en el sitio de acción. Esto puede provocar una desviación de la ventana terapéutica del medicamento y provocar toxicidad o pérdida de eficacia.
Enzimas metabolizadoras de fármacos
La mayoría de la variación farmacogenética clínicamente accionable ocurre en genes que codifican enzimas metabolizadoras de fármacos, incluidas las involucradas en el metabolismo de fase I y fase II . La familia de enzimas del citocromo P450 es responsable del metabolismo del 70-80% de todos los medicamentos utilizados clínicamente. [11] CYP3A4 , CYP2C9 , CYP2C19 y CYP2D6 son las principales enzimas CYP involucradas en el metabolismo de fármacos y se sabe que todas son altamente polimórficas. [11] Otras enzimas metabolizadoras de fármacos que han sido implicadas en interacciones farmacogenéticas incluyen UGT1A1 (una UDP-glucuronosiltransferasa ), DPYD y TPMT . [12]
Transportadores de drogas
Muchos medicamentos dependen de transportadores que atraviesan las membranas celulares para moverse entre los compartimentos de fluidos corporales, como la sangre, el lumen intestinal, la bilis, la orina, el cerebro y el líquido cefalorraquídeo. [13] Los principales transportadores incluyen el transportador de soluto , el casete de unión a ATP y los transportadores de aniones orgánicos . [13] Los transportadores que han demostrado influir en la respuesta a los medicamentos incluyen OATP1B1 ( SLCO1B1 ) y la proteína de resistencia al cáncer de mama (BCRP) ( ABCG2 ). [14]
Farmacodinamia
La farmacodinamia se refiere al impacto que tiene un medicamento en el cuerpo o su mecanismo de acción.
Objetivos de los fármacos
Los objetivos farmacológicos son los sitios específicos donde un medicamento lleva a cabo su actividad farmacológica. La interacción entre el fármaco y este sitio da como resultado una modificación del objetivo que puede incluir inhibición o potenciación. [15] La mayoría de las interacciones farmacogenéticas que involucran objetivos farmacológicos se encuentran dentro del campo de la oncología e incluyen terapias dirigidas diseñadas para abordar mutaciones somáticas (ver también Farmacogenómica del cáncer ). Por ejemplo, los inhibidores de EGFR como gefitinib (Iressa) o erlotinib (Tarceva) solo están indicados en pacientes portadores de mutaciones específicas de EGFR . [16] [17]
Las mutaciones de la línea germinal en dianas farmacológicas también pueden influir en la respuesta a los medicamentos, aunque este es un subcampo emergente dentro de la farmacogenómica. Una interacción gen-fármaco bien establecida que implica una mutación de la línea germinal en una diana farmacológica es la warfarina (Coumadin) y VKORC1 , que codifica la vitamina K epóxido reductasa (VKOR) . La warfarina se une a la VKOR y la inhibe, que es una enzima importante en el ciclo de la vitamina K. [18] La inhibición de la VKOR previene la reducción de la vitamina K , que es un cofactor necesario en la formación de los factores de coagulación II , VII , IX y X , y de los inhibidores de las proteínas C y S. [18] [19]
Sitios fuera del objetivo
Los medicamentos pueden tener efectos no deseados (normalmente desfavorables) que surgen de una interacción entre el medicamento y/o sus metabolitos y un sitio distinto del objetivo previsto. [20] La variación genética en los sitios no deseados puede influir en esta interacción. El principal ejemplo de este tipo de interacción farmacogenómica es la glucosa-6-fosfato-deshidrogenasa (G6PD) . La G6PD es la enzima implicada en el primer paso de la vía de las pentosas fosfato que genera NADPH (a partir de NADP). El NADPH es necesario para la producción de glutatión reducido en los eritrocitos y es esencial para la función de la catalasa . [21] El glutatión y la catalasa protegen a las células del estrés oxidativo que, de otro modo, daría lugar a la lisis celular . Ciertas variantes de la G6PD dan lugar a una deficiencia de G6PD , en la que las células son más susceptibles al estrés oxidativo. Cuando se administran medicamentos que tienen un efecto oxidativo significativo a personas con deficiencia de G6PD, corren un mayor riesgo de lisis de eritrocitos que se presenta como anemia hemolítica . [22]
Inmunológico
El sistema del antígeno leucocitario humano (HLA), también conocido como complejo mayor de histocompatibilidad (CMH), es un complejo de genes importantes para el sistema inmunitario adaptativo . Las mutaciones en el complejo HLA se han asociado con un mayor riesgo de desarrollar reacciones de hipersensibilidad en respuesta a ciertos medicamentos. [23]
Recursos de farmacogenómica clínica
Consorcio de Implementación de Farmacogenética Clínica (CPIC)
El Consorcio de Implementación de Farmacogenética Clínica (CPIC) es "un consorcio internacional de voluntarios individuales y un pequeño equipo dedicado que están interesados en facilitar el uso de pruebas farmacogenéticas para el cuidado de los pacientes. El objetivo del CPIC es abordar las barreras a la implementación clínica de pruebas farmacogenéticas mediante la creación, la curaduría y la publicación de pautas de práctica clínica de genes/fármacos detalladas, actualizadas, basadas en evidencia y revisadas por pares y de libre acceso. Las pautas del CPIC siguen formatos estandarizados, incluyen una calificación sistemática de la evidencia y recomendaciones clínicas, utilizan terminología estandarizada, son revisadas por pares y se publican en una revista (en asociación con Clinical Pharmacology and Therapeutics) con una publicación simultánea en cpicpgx.org, donde se actualizan periódicamente". [12]
Las directrices del CPIC están "diseñadas para ayudar a los médicos a entender CÓMO se deben utilizar los resultados de las pruebas genéticas disponibles para optimizar la terapia farmacológica, en lugar de SI se deben solicitar pruebas. Un supuesto clave que subyace a las directrices del CPIC es que la genotipificación clínica de alto rendimiento y preventiva (antes de la prescripción) se generalizará, y que los médicos se enfrentarán a la necesidad de disponer de los genotipos de los pacientes incluso si no han solicitado explícitamente una prueba con un fármaco específico en mente. Las directrices, los procesos y los proyectos del CPIC han sido avalados por varias sociedades profesionales". [12]
Administración de Alimentos y Medicamentos de Estados Unidos
Tabla de asociaciones farmacogenéticas
En febrero de 2020, la FDA publicó la Tabla de asociaciones farmacogenéticas. [24] Para los pares de genes y fármacos incluidos en la tabla, "la FDA ha evaluado y cree que hay suficiente evidencia científica para sugerir que es probable que los subgrupos de pacientes con ciertas variantes genéticas o fenotipos inferidos por variantes genéticas (como el subgrupo afectado en la tabla a continuación) tengan un metabolismo de fármacos alterado y, en ciertos casos, efectos terapéuticos diferenciales, incluidas diferencias en los riesgos de eventos adversos". [25]
"La información de esta tabla está destinada principalmente a los médicos que prescriben medicamentos, y los pacientes no deben ajustar sus medicamentos sin consultar con su médico. Esta versión de la tabla se limita a las asociaciones farmacogenéticas relacionadas con las variantes de genes de enzimas metabolizadoras de fármacos, variantes de genes transportadores de fármacos y variantes de genes que se han relacionado con una predisposición a ciertos eventos adversos. La FDA reconoce que existen otras asociaciones farmacogenéticas que no se enumeran aquí, y esta tabla se actualizará periódicamente con asociaciones farmacogenéticas adicionales respaldadas por evidencia científica suficiente". [25]
Tabla de biomarcadores farmacogenómicos en el etiquetado de medicamentos
La Tabla de biomarcadores farmacogenómicos en el etiquetado de medicamentos de la FDA enumera los medicamentos aprobados por la FDA con información farmacogenómica que se encuentra en el etiquetado del medicamento. "Los biomarcadores de la tabla incluyen, entre otros, variantes de genes somáticos o de línea germinal (polimorfismos, mutaciones), deficiencias funcionales con una etiología genética, diferencias en la expresión genética y anomalías cromosómicas; también se incluyen biomarcadores proteicos seleccionados que se utilizan para seleccionar tratamientos para los pacientes". [26]
Farmacia GKB
La base de conocimientos sobre farmacogenómica (PharmGKB) es un " recurso financiado por el NIH que proporciona información sobre cómo la variación genética humana afecta la respuesta a los medicamentos. PharmGKB recopila, conserva y difunde conocimientos sobre asociaciones entre genes y fármacos y relaciones genotipo-fenotipo que pueden aplicarse desde el punto de vista clínico". [27]
Laboratorios comerciales de pruebas farmacogenéticas
Existen muchos laboratorios comerciales en todo el mundo que ofrecen pruebas farmacogenómicas como una prueba desarrollada en laboratorio (LDT, por sus siglas en inglés) . Las pruebas que se ofrecen pueden variar significativamente de un laboratorio a otro, incluidos los genes y alelos analizados, la asignación de fenotipos y cualquier anotación clínica proporcionada. Con la excepción de unas pocas pruebas directas al consumidor, todas las pruebas farmacogenéticas requieren una orden de un profesional de la salud autorizado. Para que los resultados se puedan utilizar en un entorno clínico en los Estados Unidos , el laboratorio que realiza la prueba debe estar certificado por CLIA . Otras regulaciones pueden variar según el país y el estado.

Pruebas farmacogenéticas directas al consumidor
Las pruebas farmacogenéticas directas al consumidor (DTC) permiten a los consumidores obtener pruebas farmacogenéticas sin una orden de un médico. Las pruebas farmacogenéticas DTC generalmente son revisadas por la FDA para determinar la validez de las afirmaciones de las pruebas. [28] La FDA mantiene una lista de pruebas genéticas DTC que han sido aprobadas.
Nomenclatura farmacogenómica específica común
Genotipo
Existen múltiples formas de representar un genotipo farmacogenómico . Un sistema de nomenclatura comúnmente utilizado es informar los haplotipos utilizando un alelo de asterisco (*) (p. ej., CYP2C19 *1/*2). Los polimorfismos de un solo nucleótido (SNP) pueden describirse utilizando su ID de grupo de SNP de referencia de asignación (rsID) o en función de la ubicación del par de bases o aminoácido afectado. [29]
Fenotipo
En 2017, el CPIC publicó los resultados de una encuesta de expertos para estandarizar los términos relacionados con los resultados de las pruebas farmacogenéticas clínicas. [30] Se llegó a un consenso sobre los términos para describir el estado funcional de los alelos, el fenotipo de las enzimas metabolizadoras de fármacos, el fenotipo de los transportadores de fármacos y el fenotipo del estado del genotipo de alto riesgo.
Aplicaciones
La siguiente lista proporciona algunas de las aplicaciones más conocidas de la farmacogenómica: [31]
- Mejorar la seguridad de los medicamentos y reducir las reacciones adversas;
- Adaptar los tratamientos a la predisposición genética única de los pacientes, identificando la dosis óptima;
- Mejorar el descubrimiento de fármacos orientados a las enfermedades humanas; y
- Mejorar la prueba de principio para los ensayos de eficacia.
La farmacogenómica se puede aplicar en varias áreas de la medicina, como el tratamiento del dolor , la cardiología , la oncología y la psiquiatría . También puede existir un lugar en la patología forense , en la que la farmacogenómica se puede utilizar para determinar la causa de muerte en muertes relacionadas con medicamentos en las que no se obtienen resultados mediante la autopsia . [ cita requerida ]
En el tratamiento del cáncer , las pruebas farmacogenómicas se utilizan para identificar qué pacientes tienen más probabilidades de responder a determinados medicamentos contra el cáncer . En la salud conductual, las pruebas farmacogenómicas proporcionan herramientas para que los médicos y los cuidadores gestionen mejor la selección de medicamentos y la mejora de los efectos secundarios. La farmacogenómica también se conoce como diagnóstico complementario, lo que significa que las pruebas se combinan con los medicamentos. Los ejemplos incluyen la prueba KRAS con cetuximab y la prueba EGFR con gefitinib . Además de la eficacia, la farmacogenética de la línea germinal puede ayudar a identificar a los pacientes que probablemente sufran toxicidades graves cuando se les administran citotóxicos que muestran una desintoxicación deteriorada en relación con el polimorfismo genético, como el 5-FU canónico. [32] En particular, las desregulaciones genéticas que afectan a los genes que codifican DPD , UGT1A1 , TPMT , CDA y CYP2D6 ahora se consideran problemas críticos para los pacientes tratados con 5-FU/capecitabina, irinotecán, mercaptopurina/azatioprina, gemcitabina/capecitabina/AraC y tamoxifeno, respectivamente. [33]
En los trastornos cardiovasculares , la principal preocupación es la respuesta a medicamentos como warfarina , clopidogrel , betabloqueantes y estatinas . [10] En pacientes con CYP2C19, que toman clopidogrel, el riesgo cardiovascular es elevado, lo que lleva a las autoridades reguladoras a actualizar los prospectos de los medicamentos . [34] En pacientes con diabetes tipo 2 , la genotipificación de la haptoglobina (Hp) muestra un efecto sobre la enfermedad cardiovascular, con Hp2-2 en mayor riesgo y la vitamina E suplementaria reduciendo el riesgo al afectar el HDL . [35]
En psiquiatría, a partir de 2010, la investigación se ha centrado especialmente en 5-HTTLPR y DRD2 . [36]
Implementación clínica
Las iniciativas para estimular la adopción por parte de los médicos incluyen el programa Ubiquitous Pharmacogenomics (U-PGx) en Europa y el Consorcio de Implementación de Farmacogenética Clínica (CPIC) en los Estados Unidos. [37] En una encuesta de 2017 a médicos europeos, en el año anterior dos tercios no habían ordenado una prueba farmacogenética. [38]
En 2010, el Centro Médico de la Universidad de Vanderbilt lanzó el Recurso Farmacogenómico para Mejorar las Decisiones en Atención y Tratamiento (PREDICT); [39] en una encuesta de 2015, dos tercios de los médicos habían solicitado una prueba farmacogenética. [40]
En 2019, la aseguradora de salud privada más grande, UnitedHealthcare , anunció que pagaría pruebas genéticas para predecir la respuesta a los medicamentos psiquiátricos. [41]
En 2020, la cuarta aseguradora de salud y odontología más grande de Canadá , Green Shield Canada , anunció que pagaría las pruebas farmacogenéticas y el software de apoyo a la toma de decisiones clínicas asociado para optimizar y personalizar las prescripciones de salud mental. [42]
Reducción de la polifarmacia
Un posible papel de la farmacogenómica es reducir la incidencia de polifarmacia : se cree que con tratamientos farmacológicos personalizados, los pacientes no necesitarán tomar varios medicamentos para tratar la misma afección. Por lo tanto, podrían reducir potencialmente la incidencia de reacciones adversas a los medicamentos , mejorar los resultados del tratamiento y ahorrar costos al evitar la compra de algunos medicamentos. Por ejemplo, tal vez debido a una prescripción inadecuada, los pacientes psiquiátricos tienden a recibir más medicamentos que los pacientes no psiquiátricos de la misma edad. [43]
La necesidad de terapias farmacológicas adaptadas a la farmacogenómica puede resultar más evidente en una encuesta realizada por el Slone Epidemiology Center de la Universidad de Boston entre febrero de 1998 y abril de 2007. El estudio reveló que un promedio del 82% de los adultos en los Estados Unidos están tomando al menos un medicamento (medicamento recetado o de venta libre, vitaminas/minerales, suplementos herbales/naturales), y el 29% están tomando cinco o más. El estudio sugirió que las personas de 65 años o más siguen siendo los mayores consumidores de medicamentos, con un 17-19% en este grupo de edad que toma al menos diez medicamentos en una semana determinada. También se ha demostrado que la polifarmacia ha aumentado desde el año 2000 del 23% al 29%. [44]
Ejemplos de estudios de casos
Caso A – Reacción adversa a los antipsicóticos [45]
El paciente A padece esquizofrenia. Su tratamiento incluía una combinación de ziprasidona, olanzapina, trazodona y benztropina . El paciente experimentó mareos y sedación, por lo que se le redujo gradualmente la dosis de ziprasidona y olanzapina y se pasó a quetiapina. Se interrumpió la trazodona. El paciente experimentó sudoración excesiva, taquicardia y dolor de cuello, ganó peso considerablemente y tuvo alucinaciones. Cinco meses después, se redujo gradualmente la dosis de quetiapina y se interrumpió, y se reintrodujo ziprasidona en su tratamiento, debido al aumento excesivo de peso. Aunque el paciente perdió el peso excesivo que había ganado, luego desarrolló rigidez muscular, marcha en rueda dentada , temblores y sudores nocturnos. Cuando se agregó benztropina, experimentó visión borrosa. Después de otros cinco meses, el paciente cambió de ziprasidona a aripiprazol. En el transcurso de 8 meses, el paciente A experimentó gradualmente un mayor aumento de peso y sedación, y desarrolló dificultad para caminar, rigidez, marcha en rueda dentada y movimientos oculares discinéticos. Una prueba farmacogenómica posterior demostró que el paciente tenía un CYP2D6 *1/*41, que tiene un fenotipo previsto de IM y un CYP2C19 *1/*2 con un fenotipo previsto también de IM.
Caso B – Manejo del dolor [46]
La paciente B es una mujer que dio a luz por cesárea. Su médico le recetó codeína para el dolor poscesárea. Tomó la dosis estándar prescrita, pero experimentó náuseas y mareos mientras tomaba codeína. También notó que su bebé amamantado estaba letárgico y se alimentaba mal. Cuando la paciente mencionó estos síntomas a su médico, le recomendaron que suspendiera el uso de codeína. En pocos días, los síntomas tanto de la paciente como de su bebé ya no estaban presentes. Se supone que si la paciente se hubiera sometido a una prueba farmacogenómica, habría revelado que podría haber tenido una duplicación del gen CYP2D6, lo que la ubicaría en la categoría de metabolizador ultrarrápido (UM), lo que explicaría sus reacciones al uso de codeína.
Caso C – Advertencia de la FDA sobre sobredosis de codeína en bebés [47]
El 20 de febrero de 2013, la FDA publicó una declaración en la que abordaba una preocupación grave con respecto a la conexión entre los niños que se conocen como UM CYP2D6 y las reacciones fatales a la codeína después de una amigdalectomía y/o adenoidectomía (cirugía para extirpar las amígdalas y/o los adenoides). Publicaron su advertencia enmarcada más enérgica para aclarar los peligros de que los UM CYP2D6 consuman codeína. La codeína se convierte en morfina por acción del CYP2D6, y quienes tienen fenotipos UM corren el riesgo de producir grandes cantidades de morfina debido al aumento de la función del gen. La morfina puede elevarse a cantidades potencialmente mortales o fatales, como se hizo evidente con la muerte de tres niños en agosto de 2012.
Desafíos
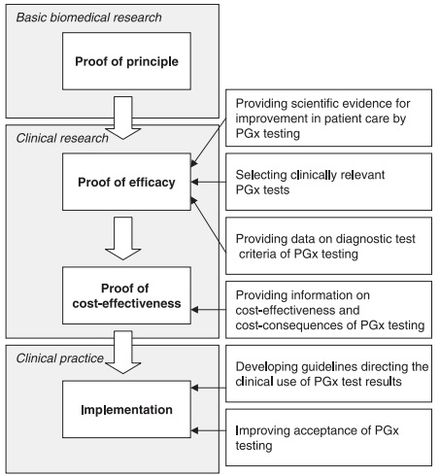
Aunque parece haber una aceptación general del principio básico de la farmacogenómica entre los médicos y los profesionales de la salud, [49] existen varios desafíos que retrasan la adopción, implementación y estandarización de la farmacogenómica. Algunas de las inquietudes planteadas por los médicos incluyen: [50] [49] [51]
- Limitación en la forma de aplicar la prueba en las prácticas clínicas y el tratamiento;
- Una sensación general de falta de disponibilidad de la prueba;
- La comprensión e interpretación de la investigación basada en evidencia;
- Combinar los resultados de las pruebas con otros datos del paciente para optimizar la prescripción; y
- Cuestiones éticas, legales y sociales.
Las cuestiones relacionadas con la disponibilidad de la prueba incluyen: [48]
- La falta de disponibilidad de datos científicos : aunque hay un número considerable de enzimas metabolizadoras de fármacos implicadas en las vías metabólicas de los fármacos, sólo una fracción tiene datos científicos suficientes para validar su uso en un entorno clínico; y
- Demostración de la relación coste-efectividad de la farmacogenómica : las publicaciones sobre la farmacoeconomía de la farmacogenómica son escasas, por lo que en este momento no existe evidencia suficiente para validar la relación coste-efectividad y las consecuencias en función de los costos de la prueba.
Aunque otros factores contribuyen a la lenta progresión de la farmacogenómica (como el desarrollo de directrices para el uso clínico), los factores antes mencionados parecen ser los más frecuentes. La evidencia cada vez más sustancial y las directrices de los organismos de la industria para el uso clínico de la farmacogenética la han convertido en un enfoque poblacional para la medicina de precisión. El costo, el reembolso, la educación y la facilidad de uso en el punto de atención siguen siendo barreras importantes para la adopción a gran escala.
Controversias
Medicina basada en la raza
Se ha pedido que se deje de lado la raza y la etnicidad en la medicina y, en su lugar, se utilice la ascendencia genética como una forma de categorizar a los pacientes. [52] Se ha demostrado que algunos alelos que varían en frecuencia entre poblaciones específicas están asociados con respuestas diferenciales a medicamentos específicos . Como resultado, algunas pautas específicas de enfermedades solo recomiendan pruebas farmacogenéticas para poblaciones donde los alelos de alto riesgo son más comunes [53] y, de manera similar, ciertas compañías de seguros solo pagarán las pruebas farmacogenéticas para los beneficiarios de poblaciones de alto riesgo. [54]
Excepcionalismo genético
A principios de la década de 2000, la consideración de la información genética como algo excepcional, incluidas las protecciones legales o reglamentarias, cosechó un fuerte apoyo. Se sostuvo que la información genómica podría necesitar políticas y prácticas especiales de protección en el contexto de los registros médicos electrónicos (EHR). [55] En 2008, se promulgó la Ley de No Discriminación por Información Genética (GINA, por sus siglas en inglés) para proteger a los pacientes de las compañías de seguros médicos que discriminaban a un individuo en función de su información genética. [56] [57]
Más recientemente, se ha argumentado que el excepcionalismo genético ha pasado su fecha de caducidad a medida que avanzamos hacia una era de medicina combinada de genómica y big data, pero las prácticas de excepcionalismo continúan permeando la atención médica clínica actual. [58] [59] Garrison et al. recientemente transmitieron un llamado a la acción para actualizar el lenguaje del excepcionalismo genético al contextualismo genómico en el sentido de que reconocemos una dualidad fundamental de la información genética. [60] Esto deja espacio en el argumento para que los diferentes tipos de información genética se manejen de manera diferente, al tiempo que se reconoce que la información genómica es similar y, sin embargo, distinta de otra información relacionada con la salud. [60] El contextualismo genómico permitiría un análisis caso por caso de la tecnología y el contexto de su uso (por ejemplo, práctica clínica, investigación, hallazgos secundarios).
Otros sostienen que la información genética es, en efecto, distinta de otra información relacionada con la salud, pero no hasta el punto de requerir protecciones legales o reglamentarias, de manera similar a otros datos sensibles relacionados con la salud, como el estado serológico respecto del VIH. [61] Además, Evans et al. sostienen que el EHR tiene estándares de privacidad suficientes para albergar otra información sensible, como los números de la seguridad social, y que la naturaleza fundamental de un EHR es albergar información altamente personal. [58] De manera similar, una revisión sistemática informó que el público tenía preocupación por la privacidad de la información genética, y el 60% estuvo de acuerdo en que mantener la privacidad no era posible; sin embargo, el 96% estuvo de acuerdo en que una empresa de pruebas directas al consumidor había protegido su privacidad, y el 74% dijo que su información estaría protegida de manera similar o mejor en un EHR. Con las crecientes capacidades tecnológicas en los EHR, es posible enmascarar u ocultar datos genéticos de subconjuntos de proveedores y no hay consenso sobre cómo, cuándo o de quién se debe enmascarar la información genética. [55] [62] Se sostiene que la protección rigurosa y el enmascaramiento de la información genética impiden un mayor progreso científico y su traducción clínica a prácticas clínicas rutinarias. [63]
Historia
La farmacogenómica fue reconocida por primera vez por Pitágoras alrededor del 510 a. C. cuando hizo una conexión entre los peligros de la ingestión de habas con la anemia hemolítica y el estrés oxidativo . En la década de 1950 , esta identificación fue validada y atribuida a la deficiencia de G6PD y se llama favismo . [64] [65] Aunque la primera publicación oficial no fue hasta 1961, [66] los inicios no oficiales de esta ciencia fueron alrededor de la década de 1950. Los informes de parálisis prolongada y reacciones fatales vinculadas a variantes genéticas en pacientes que carecían de butirilcolinesterasa ('pseudocolinesterasa') después de la inyección de succinilcolina durante la anestesia se informaron por primera vez en 1956. [2] [67] El término farmacogenética fue acuñado por primera vez en 1959 por Friedrich Vogel de Heidelberg , Alemania (aunque algunos artículos sugieren que fue en 1957 o 1958). [68] A fines de la década de 1960, los estudios con gemelos respaldaron la inferencia de la participación genética en el metabolismo de los fármacos: los gemelos idénticos compartían similitudes notables en la respuesta a los fármacos en comparación con los gemelos fraternos. [69] El término farmacogenómica comenzó a aparecer alrededor de la década de 1990. [64]
La primera aprobación de la FDA de una prueba farmacogenética fue en 2005 [9] (para alelos en CYP2D6 y CYP2C19 ).
Futuro
Los avances computacionales han permitido una secuenciación más barata y rápida. [70] La investigación se ha centrado en la química combinatoria , [71] la minería genómica, las tecnologías ómicas y el cribado de alto rendimiento .
A medida que el coste de cada prueba genética disminuye, aumentará el desarrollo de terapias farmacológicas personalizadas. [72] La tecnología ahora permite el análisis genético de cientos de genes objetivo involucrados en el metabolismo y la respuesta a los medicamentos en menos de 24 horas por menos de $1,000. Este es un gran paso hacia la incorporación de la tecnología farmacogenética a las decisiones médicas cotidianas. Del mismo modo, empresas como deCODE Genetics , MD Labs Pharmacogenetics, Navigenics y 23andMe ofrecen escaneos genómicos. Las empresas utilizan los mismos chips de genotipado que se utilizan en los estudios GWAS y brindan a los clientes un informe del riesgo individual para varios rasgos y enfermedades y pruebas para 500,000 SNP conocidos. Los costos varían de $995 a $2500 e incluyen actualizaciones con nuevos datos de los estudios a medida que están disponibles. Los paquetes más caros incluso incluían una sesión telefónica con un asesor genético para discutir los resultados. [73]
Ética
La farmacogenética se ha convertido en un tema controvertido en el área de la bioética . La privacidad y la confidencialidad son preocupaciones importantes. [74] La evidencia de beneficio o riesgo de una prueba genética puede ser solo sugerente, lo que podría causar dilemas para los proveedores. [74] : 145 El desarrollo de medicamentos puede verse afectado, y es posible que las variantes genéticas raras reciban menos investigación. [74] El acceso y la autonomía del paciente también están abiertos a discusión. [75] : 680
Recursos basados en la web
| Fuente de datos | Uso principal | Citación |
|---|---|---|
| Farmacia Var | Un repositorio central para la variación farmacogénica que se centra en la estructura del haplotipo y la variación alélica | [78] |
| Herramienta bioinformática SuperCYP | Contiene 1170 fármacos con más de 3800 interacciones y aproximadamente 2000 SNP conocidos. Estos SNP se enumeran y ordenan según su efecto sobre la expresión y/o actividad. | [79] |
| Farmacia GKB | La Base de conocimientos sobre farmacogenómica (PharmGKB) es una herramienta interactiva para investigadores que investigan cómo la variación genética afecta la respuesta a los medicamentos. | [80] |
| Base de datos dbSNP | Un repositorio de SNP y otras variantes que se han notificado después del descubrimiento, se han recopilado y se han nombrado oficialmente. Se trata de SNP de todos los tipos. | [81] [82] |
| Base de búsqueda | Repositorio de frecuencias alélicas de marcadores farmacogenéticos en diferentes poblaciones | [83] |
| Biomarcadores farmacogenómicos en el etiquetado de medicamentos | Una tabla que identifica qué medicamentos aprobados por la FDA tienen etiquetas de advertencia relacionadas con la farmacogenómica | [84] |
| SNPedia | Una base de datos bioinformática de SNP basada en wiki | [85] [86] |
| Red de Investigación en Farmacogenómica (PGRN) | La PGRN alberga recursos e información para estimular la investigación colaborativa en farmacogenómica y medicina de precisión. | [87] |
Véase también
- Genómica
- Metabolómica
- Farmacovigilancia
- Grupos poblacionales en biomedicina
- Toxgnósticos
- Terminología médica
- HL7
Referencias
- ^ Ermak G (2015). Tecnologías médicas emergentes . World Scientific. ISBN 978-981-4675-80-2.
- ^ ab Johnson JA (noviembre de 2003). "Farmacogenética: potencial para la terapia farmacológica individualizada a través de la genética". Tendencias en genética . 19 (11): 660–666. doi :10.1016/j.tig.2003.09.008. PMID 14585618. S2CID 15195039.
- ^ "Centro de farmacogenómica y terapia individualizada". Facultad de farmacia Unc Eshelman . Consultado el 25 de junio de 2014 .
- ^ "Descripción general de la farmacogenómica". Actualizado. 16 de mayo de 2014. Consultado el 25 de junio de 2014 .
- ^ Becquemont L (junio de 2009). "Farmacogenómica de las reacciones adversas a medicamentos: aplicaciones prácticas y perspectivas". Pharmacogenomics . 10 (6): 961–969. doi :10.2217/pgs.09.37. PMID 19530963.
- ^ Sheffield LJ, Phillimore HE (mayo de 2009). "Uso clínico de pruebas farmacogenómicas en 2009". The Clinical Biochemist. Reseñas . 30 (2): 55–65. PMC 2702214. PMID 19565025 .
- ^ Hauser AS, Chavali S, Masuho I, Jahn LJ, Martemyanov KA, Gloriam DE, Babu MM (enero de 2018). "Farmacogenómica de objetivos farmacológicos de GPCR". Celúla . 172 (1–2): 41–54.e19. doi :10.1016/j.cell.2017.11.033. PMC 5766829 . PMID 29249361.
- ^ "Guía para la presentación de datos farmacogenómicos a la industria" (PDF) . Administración de Alimentos y Medicamentos de los Estados Unidos . Marzo de 2005 . Consultado el 27 de agosto de 2008 .
- ^ ab Squassina A, Manchia M, Manolopoulos VG, Artac M, Lappa-Manakou C, Karkabouna S, et al. (agosto de 2010). "Realidades y expectativas de la farmacogenómica y la medicina personalizada: impacto de la traducción del conocimiento genético a la práctica clínica". Farmacogenómica . 11 (8): 1149–1167. doi :10.2217/pgs.10.97. PMID 20712531.
- ^ abc Huser V, Cimino JJ (2013). "Proporcionar apoyo a la toma de decisiones clínicas en farmacogenómica utilizando datos de secuenciación del genoma completo como entrada". Actas de las Cumbres Conjuntas de la AMIA sobre Ciencia Traslacional. Cumbres Conjuntas de la AMIA sobre Ciencia Traslacional . 2013 : 81. PMID 24303303.
- ^ ab Zanger, Ulrich M.; Schwab, Matthias (1 de abril de 2013). "Enzimas del citocromo P450 en el metabolismo de fármacos: regulación de la expresión génica, actividades enzimáticas e impacto de la variación genética". Farmacología y terapéutica . 138 (1): 103–141. doi : 10.1016/j.pharmthera.2012.12.007 . ISSN 0163-7258. PMID 23333322.
- ^ abc "Consorcio de Implementación de Farmacogenética Clínica". cpicpgx.org . Consultado el 13 de diciembre de 2022 .
- ^ ab Nigam SK (enero de 2015). "¿Qué hacen realmente los transportadores de fármacos?". Nature Reviews. Drug Discovery . 14 (1): 29–44. doi :10.1038/nrd4461. PMC 4750486. PMID 25475361 .
- ^ Cooper-DeHoff, Rhonda M.; Niemi, Mikko; Ramsey, Laura B.; Luzum, Jasmine A.; Tarkiainen, E. Katriina; Straka, Robert J.; Gong, Li; Tuteja, Sony; Wilke, Russell A.; Wadelius, Mia; Larson, Eric A.; Roden, Dan M.; Klein, Teri E.; Yee, Sook Wah; Krauss, Ronald M. (mayo de 2022). "Guía del Consorcio de Implementación de Farmacogenética Clínica para los genotipos SLCO1B1, ABCG2 y CYP2C9 y los síntomas musculoesqueléticos asociados a las estatinas". Farmacología clínica y terapéutica . 111 (5): 1007–1021. doi :10.1002/cpt.2557. ISSN 1532-6535. Número de modelo : PMID 35152405.
- ^ Zanders, Edward D. (21 de marzo de 2011). "Introducción a los fármacos y a los objetivos farmacológicos". La ciencia y el negocio del descubrimiento de fármacos . págs. 11–27. doi :10.1007/978-1-4419-9902-3_2. ISBN 978-1-4419-9901-6. Número de pieza 7120710 .
- ^ Iressa [prospecto]. Wilmington, DE: Astra Zeneca; 2021.
- ^ Tarceva [prospecto]. Northbrook, Illinois: OSI Pharmaceuticals, LLC; 2016. https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/021743s025lbl.pdf
- ^ ab Oldenburg, Johannes; Marinova, Milka; Müller-Reible, Clemens; Watzka, Matthias (2008). "El ciclo de la vitamina K". Vitaminas y hormonas . 78 : 35–62. doi :10.1016/S0083-6729(07)00003-9. ISBN 9780123741134. ISSN 0083-6729. PMID 18374189.
- ^ Mijares, YO; Nagy, E.; Guerrero, B.; Arocha-Piñango, CL (septiembre de 1998). "[Vitamina K: bioquímica, función y deficiencia. Revisión]". Clínica Investigación . 39 (3): 213–229. ISSN 0535-5133. PMID 9780555.
- ^ Rudmann, Daniel G. (febrero de 2013). "Efectos toxicológicos en el objetivo y fuera del objetivo". Toxicologic Pathology . 41 (2): 310–314. doi :10.1177/0192623312464311. ISSN 1533-1601. PMID 23085982. S2CID 11858945.
- ^ Recht, Judith; Chansamouth, Vilada; White, Nicholas J.; Ashley, Elizabeth A. (3 de mayo de 2022). "Nitrofurantoína y deficiencia de glucosa-6-fosfato deshidrogenasa: una revisión de seguridad". JAC-Antimicrobial Resistance . 4 (3): dlac045. doi :10.1093/jacamr/dlac045. ISSN 2632-1823. PMC 9070801 . PMID 35529053.
- ^ Gammal, Roseann S.; Pirmohamed, Munir; Somogyi, Andrew A.; Morris, Sarah A.; Formea, Christine M.; Elchynski, Amanda L.; Oshikoya, Kazeem A.; McLeod, Howard L.; Haidar, Cyrine E.; Whirl-Carrillo, Michelle; Klein, Teri E.; Caudle, Kelly E.; Relling, Mary V. (mayo de 2023). "Guía ampliada del consorcio de implementación de farmacogenética clínica para el uso de medicamentos en el contexto del genotipo G6PD". Farmacología clínica y terapéutica . 113 (5): 973–985. doi :10.1002/cpt.2735. ISSN 0009-9236. PMC 10281211 . PMID 36049896.
- ^ Pavlos R, Mallal S, Phillips E (agosto de 2012). "HLA y farmacogenética de la hipersensibilidad a fármacos". Farmacogenómica . 13 (11): 1285–1306. doi :10.2217/pgs.12.108. PMID 22920398.
- ^ Oficina del Comisionado (24 de marzo de 2020). "La FDA anuncia una revisión colaborativa de la evidencia científica para respaldar las asociaciones entre la información genética y medicamentos específicos". FDA . Consultado el 13 de diciembre de 2022 .
- ^ ab Centro de Dispositivos y Salud Radiológica (2022-10-26). "Tabla de asociaciones farmacogenéticas". FDA .
- ^ Centro de Evaluación e Investigación de Medicamentos (11 de agosto de 2022). "Tabla de biomarcadores farmacogenómicos en el etiquetado de medicamentos". FDA .
- ^ "PharmGKB". PharmGKB . Consultado el 13 de diciembre de 2022 .
- ^ Centro de Evaluación e Investigación de Medicamentos (25 de junio de 2021). "Pruebas directas al consumidor". FDA .
- ^ Poo DC, Cai S, Mah JT (noviembre de 2011). "UASIS: Sistema universal de identificación automática de SNP". BMC Genomics . 12 (Supl 3): S9. doi : 10.1186/1471-2164-12-S3-S9 . PMC 3333510 . PMID 22369494.
- ^ Caudle KE, Dunnenberger HM, Freimuth RR, Peterson JF, Burlison JD, Whirl-Carrillo M, et al. (febrero de 2017). "Estandarización de los términos para los resultados de pruebas farmacogenéticas clínicas: términos de consenso del Consorcio de Implementación de Farmacogenética Clínica (CPIC)". Genética en Medicina . 19 (2): 215–223. doi :10.1038/gim.2016.87. PMC 5253119 . PMID 27441996.
- ^ Cohen N (noviembre de 2008). Farmacogenómica y medicina personalizada (Métodos en farmacología y toxicología) . Totowa, NJ: Humana Press. p. 6. ISBN 978-1934115046.
- ^ Ciccolini J, Gross E, Dahan L, Lacarelle B, Mercier C (octubre de 2010). "Pruebas de rutina de dihidropirimidina deshidrogenasa para anticipar toxicidades graves relacionadas con el 5-fluorouracilo: ¿exageración o esperanza?". Clinical Colorectal Cancer . 9 (4): 224–228. doi :10.3816/CCC.2010.n.033. PMID 20920994.
- ^ Yang CG, Ciccolini J, Blesius A, Dahan L, Bagarry-Liegey D, Brunet C, et al. (enero de 2011). "Dosis adaptativa basada en DPD de 5-FU en pacientes con cáncer de cabeza y cuello: impacto en la eficacia y toxicidad del tratamiento". Quimioterapia y farmacología del cáncer . 67 (1): 49–56. doi :10.1007/s00280-010-1282-4. PMID 20204365. S2CID 25362813.
- ^ Dean L (2012). "Terapia con clopidogrel y genotipo CYP2C19". En Pratt VM, McLeod HL, Rubinstein WS, et al. (eds.). Resúmenes de genética médica. Centro Nacional de Información Biotecnológica (NCBI). PMID 28520346. Identificación de biblioteca: NBK84114.
- ^ Bale BF, Doneen AL, Vigerust DJ (2018). "Atención médica de precisión para pacientes con diabetes tipo 2 mediante la implementación de la genotipificación de la haptoglobina". Frontiers in Cardiovascular Medicine . 5 : 141. doi : 10.3389/fcvm.2018.00141 . PMC 6198642 . PMID 30386783.
- ^ Malhotra AK (2010). "El estado de la farmacogenética". Psychiatr Times . 27 (4): 38–41, 62.
- ^ Williams MS (agosto de 2019). "Lecciones tempranas de la implementación de programas de medicina genómica". Revisión anual de genómica y genética humana . 20 (1): 389–411. doi : 10.1146/annurev-genom-083118-014924 . PMID 30811224. S2CID 73460688.
- ^ Just KS, Steffens M, Swen JJ, Patrinos GP, Guchelaar HJ, Stingl JC (octubre de 2017). "Educación médica en farmacogenómica: resultados de una encuesta sobre conocimientos farmacogenéticos en profesionales sanitarios en el marco del proyecto europeo de implementación clínica de farmacogenómica Ubiquitous Pharmacogenomics (U-PGx)". Revista Europea de Farmacología Clínica . 73 (10): 1247–1252. doi :10.1007/s00228-017-2292-5. PMC 5599468 . PMID 28669097.
- ^ Carlson B (2012). "Vanderbilt es pionero en la genética en la cama del paciente". Biotechnology Healthcare . 9 (2): 31–32. PMC 3411230 . PMID 22876213.
- ^ Peterson JF, Field JR, Shi Y, Schildcrout JS, Denny JC, McGregor TL, et al. (agosto de 2016). "Actitudes de los médicos tras la implementación de la farmacogenómica a gran escala". The Pharmacogenomics Journal . 16 (4): 393–398. doi :10.1038/tpj.2015.57. PMC 4751074 . PMID 26261062.
- ^ "Los fabricantes de pruebas farmacogenéticas aplauden la cobertura de UnitedHealth. Otros pagadores aún no han llegado a ese punto". MedTech Dive . Consultado el 29 de diciembre de 2019 .
- ^ "Tratamiento farmacológico personalizado mediante farmacogenética".
- ^ Ritsner M (2013). Polifarmacia en la práctica psiquiátrica, volumen I. Estrategias de medicación múltiple . Dordrecht: Springer Science and Business Media. ISBN 978-94-007-5804-9.
- ^ "Patrones de uso de medicamentos en los Estados Unidos". Universidad de Boston, Slone Epidemiology Center. 2006.
- ^ Foster A, Wang Z, Usman M, Stirewalt E, Buckley P (diciembre de 2007). "Farmacogenética de los efectos adversos de los antipsicóticos: estudios de casos y una revisión de la literatura para médicos". Enfermedades neuropsiquiátricas y tratamiento . 3 (6): 965–973. doi : 10.2147/ndt.s1752 . PMC 2656342 . PMID 19300635.
- ^ "Farmacogenética: aumentar la seguridad y la eficacia de la terapia farmacológica [Folleto]" (PDF) . Asociación Médica Estadounidense. 2011.
- ^ "Comunicado de seguridad de medicamentos de la FDA: Actualización de la revisión de seguridad del uso de codeína en niños; nueva advertencia y contraindicación para el uso después de una amigdalectomía y/o adenoidectomía". Administración de Alimentos y Medicamentos de los Estados Unidos. 20 de febrero de 2013.
- ^ ab Swen JJ, Huizinga TW, Gelderblom H, de Vries EG, Assendelft WJ, Kirchheiner J, Guchelaar HJ (agosto de 2007). "Traducir la farmacogenómica: desafíos en el camino hacia la clínica". Más Medicina . 4 (8): e209. doi : 10.1371/journal.pmed.0040209 . PMC 1945038 . PMID 17696640.
- ^ ab Stanek EJ, Sanders CL, Taber KA, Khalid M, Patel A, Verbrugge RR, et al. (marzo de 2012). "Adopción de pruebas farmacogenómicas por médicos estadounidenses: resultados de una encuesta a nivel nacional". Farmacología clínica y terapéutica . 91 (3): 450–458. doi :10.1038/clpt.2011.306. PMID 22278335. S2CID 21366195.
- ^ "Centro de Educación Genética".[ enlace muerto permanente ]
- ^ Ma JD, Lee KC, Kuo GM (agosto de 2012). "Aplicación clínica de la farmacogenómica". Journal of Pharmacy Practice . 25 (4): 417–427. doi :10.1177/0897190012448309. PMID 22689709. S2CID 1212666.
- ^ Borrell LN, Elhawary JR, Fuentes-Afflick E, Witonsky J, Bhakta N, Wu AH, et al. (febrero de 2021). "Raza y ascendencia genética en medicina: un momento para afrontar el racismo". The New England Journal of Medicine . 384 (5): 474–480. doi :10.1056/NEJMms2029562. PMC 8979367 . PMID 33406325.
- ^ FitzGerald JD, Dalbeth N, Mikuls T, Brignardello-Petersen R, Guyatt G, Abeles AM, et al. (junio de 2020). "Directriz del Colegio Americano de Reumatología de 2020 para el tratamiento de la gota". Atención e investigación de la artritis . 72 (6): 744–760. doi :10.1002/acr.24180. hdl : 2027.42/155497 . PMC 10563586 . PMID 32391934. S2CID 218583019.
- ^ "LCD - Procedimientos de patología molecular (L35000)". www.cms.gov . Consultado el 13 de diciembre de 2022 .
- ^ ab McGuire AL, Fisher R, Cusenza P, Hudson K, Rothstein MA, McGraw D, et al. (julio de 2008). "Confidencialidad, privacidad y seguridad de la información de pruebas genéticas y genómicas en registros médicos electrónicos: puntos a considerar". Genética en Medicina . 10 (7): 495–499. doi : 10.1097/gim.0b013e31817a8aaa . PMID 18580687. S2CID 29833634.
- ^ "Ley de no discriminación por información genética de 2008". EEOC de EE. UU . . Consultado el 13 de diciembre de 2022 .
- ^ Dressler LG, Terry SF (noviembre de 2009). "¿Cómo influirá la GINA en la participación en la investigación farmacogenómica y las pruebas clínicas?". Clinical Pharmacology and Therapeutics . 86 (5): 472–475. doi :10.1038/clpt.2009.146. PMID 19844223. S2CID 205121202.
- ^ ab Evans JP, Burke W (julio de 2008). "Excepcionalismo genético. ¿Demasiado de algo bueno?". Genetics in Medicine . 10 (7): 500–501. doi : 10.1097/GIM.0b013e31817f280a . PMID 18580684. S2CID 32998031.
- ^ Murray TH (enero de 2019). "¿El excepcionalismo genético ha pasado su fecha de caducidad? Sobre los diarios genómicos, el contexto y el contenido". The American Journal of Bioethics . 19 (1): 13–15. doi : 10.1080/15265161.2018.1552038 . PMID 30676900. S2CID 59250873.
- ^ ab Garrison NA, Brothers KB, Goldenberg AJ, Lynch JA (enero de 2019). "Contextualismo genómico: cambiando la retórica del excepcionalismo genético". The American Journal of Bioethics . 19 (1): 51–63. doi :10.1080/15265161.2018.1544304. PMC 6397766 . PMID 30676903.
- ^ Sulmasy DP (mayo de 2015). "Cuerpos desnudos, genomas desnudos: la naturaleza especial (pero no excepcional) de la información genómica". Genética en Medicina . 17 (5): 331–336. doi : 10.1038/gim.2014.111 . PMID 25232853. S2CID 34092673.
- ^ Caraballo PJ, Sutton JA, Giri J, Wright JA, Nicholson WT, Kullo IJ, et al. (enero de 2020). "Integración de la farmacogenómica en la historia clínica electrónica mediante la implementación de indicadores genómicos". Revista de la Asociación Estadounidense de Informática Médica . 27 (1): 154-158. doi :10.1093/jamia/ocz177. PMC 6913212 . PMID 31591640.
- ^ Martani A, Geneviève LD, Pauli-Magnus C, McLennan S, Elger BS (2019-12-20). "Regulación del uso secundario de datos para la investigación: argumentos contra el excepcionalismo genético". Frontiers in Genetics . 10 : 1254. doi : 10.3389/fgene.2019.01254 . PMC 6951399 . PMID 31956328.
- ^ ab Pirmohamed M (octubre de 2001). "Farmacogenética y farmacogenómica". British Journal of Clinical Pharmacology . 52 (4): 345–347. doi :10.1046/j.0306-5251.2001.01498.x. PMC 2014592 . PMID 11678777.
- ^ Prasad K (enero de 2009). "El papel de las agencias reguladoras en la aplicación de la farmacogenética a la práctica clínica". Casos clínicos en el metabolismo mineral y óseo . 6 (1): 29–34. PMC 2781218. PMID 22461095 .
- ^ Evans DA, Clarke CA (septiembre de 1961). "Farmacogenética". British Medical Bulletin . 17 (3): 234–240. doi :10.1093/oxfordjournals.bmb.a069915. PMID 13697554.
- ^ Kalow W (2006). "Farmacogenética y farmacogenómica: origen, estado y la esperanza de una medicina personalizada". The Pharmacogenomics Journal . 6 (3): 162–165. doi :10.1038/sj.tpj.6500361. PMID 16415920. S2CID 21761285.
- ^ Vogel F (1959). "Moderne probleme der humangenetik" [Problemas modernos de genética humana]. Ergebnisse der Inneren Medizin und Kinderheilkunde [ Resultados de medicina interna y pediatría ] (en alemán). Berlín, Heidelberg: Springer: 52–125.
- ^ Motulsky AG, Qi M (febrero de 2006). "Farmacogenética, farmacogenómica y ecogenética". Revista de la Universidad de Zhejiang. Science. B . 7 (2): 169–170. doi :10.1631/jzus.2006.B0169. PMC 1363768 . PMID 16421980.
- ^ Kalow W (2005). Farmacogenómica . Nueva York: Taylor & Francis. págs. 552-553. ISBN. 978-1-57444-878-8.
- ^ Thorpe DS (2001). "Química combinatoria: comenzando la segunda década". The Pharmacogenomics Journal . 1 (4): 229–232. doi :10.1038/sj.tpj.6500045. PMID 11908762. S2CID 1740692.
- ^ Paul NW, Fangerau H (diciembre de 2006). "¿Por qué deberíamos molestarnos? Cuestiones éticas y sociales en la medicina individualizada". Current Drug Targets . 7 (12): 1721–1727. doi :10.2174/138945006779025428. PMID 17168846.
- ^ Topol E (2012). La destrucción creativa de la medicina: cómo la revolución digital creará una mejor atención sanitaria . Nueva York: Basic Books. ISBN 978-0-465-02550-3.
- ^ abc Corrigan OP (marzo de 2005). "Farmacogenética, cuestiones éticas: revisión del Informe del Consejo Nuffield sobre Bioética". Revista de Ética Médica . 31 (3): 144–148. doi :10.1136/jme.2004.007229. PMC 1734105 . PMID 15738433.
- ^ Breckenridge A, Lindpaintner K, Lipton P, McLeod H, Rothstein M, Wallace H (septiembre de 2004). "Farmacogenética: problemas éticos y soluciones". Nature Reviews. Genética . 5 (9): 676–680. doi :10.1038/nrg1431. PMID 15372090. S2CID 6149591.
- ^ Barh D, Dhawan D, Ganguly NK (2013). Barh D, Dhawan D, Ganguly NK (eds.). Ómicas para la Medicina Personalizada. India: Springer Media. doi :10.1007/978-81-322-1184-6. ISBN 978-81-322-1183-9. Número de identificación del sujeto 46120003.
- ^ Stram D (2014). "Análisis post-GWAS". Diseño, análisis e interpretación de exploraciones de asociación de todo el genoma . Estadísticas para la biología y la salud. Los Ángeles: Springer Science and Business Media. págs. 285–327. doi :10.1007/978-1-4614-9443-0_8. ISBN . 978-1-4614-9442-3.
- ^ Gaedigk A, Ingelman-Sundberg M, Miller NA, Leeder JS, Whirl-Carrillo M, Klein TE (marzo de 2018). "El consorcio de variación farmacogénica (PharmVar): incorporación de la base de datos de nomenclatura de alelos del citocromo P450 (CYP) humano". Farmacología clínica y terapéutica . 103 (3): 399–401. doi :10.1002/cpt.910. PMC 5836850 . PMID 29134625.
- ^ Preissner S, Kroll K, Dunkel M, Senger C, Goldsobel G, Kuzman D, et al. (enero de 2010). "SuperCYP: una base de datos completa sobre las enzimas del citocromo P450 que incluye una herramienta para el análisis de las interacciones entre el CYP y los fármacos". Nucleic Acids Research . 38 (número de la base de datos): D237–D243. doi :10.1093/nar/gkp970. PMC 2808967 . PMID 19934256.
- ^ Thorn CF, Klein TE, Altman RB (2013). "PharmGKB: La base de conocimientos de farmacogenómica". Farmacogenómica . Métodos en biología molecular. Vol. 1015. Clifton, NJ págs. 311–20. doi :10.1007/978-1-62703-435-7_20. ISBN 978-1-62703-434-0. PMC 4084821 . PMID 23824865.
{{cite book}}: CS1 maint: location missing publisher (link) - ^ "Página de inicio del DBSNP". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Smigielski EM, Sirotkin K, Ward M, Sherry ST (enero de 2000). "dbSNP: una base de datos de polimorfismos de un solo nucleótido". Nucleic Acids Research . 28 (1): 352–355. doi :10.1093/nar/28.1.352. PMC 102496 . PMID 10592272.
- ^ Papadopoulos P, Viennas E, Gkantouna V, Pavlidis C, Bartsakoulia M, Ioannou ZM, et al. (enero de 2014). "Desarrollos en la base de datos mundial FINDbase para frecuencias de alelos de variación genómica clínicamente relevantes". Nucleic Acids Research . 42 (número de la base de datos): D1020–D1026. doi :10.1093/nar/gkt1125. PMC 3964978 . PMID 24234438.
- ^ "Tabla de biomarcadores farmacogenómicos en el etiquetado de medicamentos". FDA . 18 de agosto de 2021.
- ^ "SNPedia".
- ^ Cariaso M, Lennon G (enero de 2012). "SNPedia: una wiki que apoya la anotación, interpretación y análisis del genoma personal". Nucleic Acids Research . 40 (número de la base de datos): D1308–D1312. doi :10.1093/nar/gkr798. PMC 3245045 . PMID 22140107.
- ^ "Red de Investigación en Farmacogenómica PGRN".
Lectura adicional
- Katsnelson A (agosto de 2005). "Un medicamento que podamos llamar nuestro: ¿la medicina finalmente se volverá personal?". Scientific American .
- Karczewski KJ, Daneshjou R, Altman RB (2012). "Capítulo 7: Farmacogenómica". PLOS Computational Biology . 8 (12): e1002817. Bibcode :2012PLSCB...8E2817K. doi : 10.1371/journal.pcbi.1002817 . PMC 3531317 . PMID 23300409.
Enlaces externos
- "Ficha técnica sobre farmacogenómica". Centro Nacional de Información Biotecnológica (NCBI), Biblioteca Nacional de Medicina de EE. UU . . Consultado el 11 de julio de 2011. Una
breve introducción a los medicamentos personalizados
- "Iniciativas de educación en farmacogenómica". Administración de Alimentos y Medicamentos de Estados Unidos. 24 de septiembre de 2010. Consultado el 11 de julio de 2011 .
- "Medicina personalizada (farmacogenética)". Centro de aprendizaje de ciencias genéticas de la Universidad de Utah. Archivado desde el original el 19 de mayo de 2011. Consultado el 11 de julio de 2011 .
- "Centro de farmacogenómica y terapia individualizada". Centro de farmacogenómica y terapia individualizada de la Universidad de Carolina del Norte en Chapel Hill. Archivado desde el original el 6 de agosto de 2014. Consultado el 25 de junio de 2014 .
Revistas:





