Butadieno
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Buta-1,3-dieno [1] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 605258 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.138 | ||
| Número CE |
| ||
| 25198 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1010 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades [4] | |||
| C4H6CH2 = CH - CH = CH2 | |||
| Masa molar | 54,0916 g/mol | ||
| Apariencia | Gas incoloro o líquido refrigerado | ||
| Olor | Ligeramente aromático o parecido a la gasolina. | ||
| Densidad |
| ||
| Punto de fusión | -108,91 °C (-164,04 °F; 164,24 K) | ||
| Punto de ebullición | -4,41 °C (24,06 °F; 268,74 K) | ||
| 1,3 g/L a 5 °C, 735 mg/L a 20 °C | |||
| Solubilidad | |||
| Presión de vapor | 2,4 atm (20 °C) [3] | ||
Índice de refracción ( n D ) | 1.4292 | ||
| Viscosidad | 0,25 cP a 0 ° C | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Inflamable, irritante, cancerígeno. | ||
| Etiquetado SGA : [7] | |||
   | |||
| Peligro | |||
| H220 , H280 , H340 , H350 | |||
| P202 , P210 , P280 , P308+P313 , P377 , P381 , P403 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Punto de inflamación del líquido: -85 °C (-121 °F; 188 K) [3] | ||
| 414 °C (777 °F; 687 K) [6] | |||
| Límites de explosividad | 2–12% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 548 mg/kg (rata, oral) | ||
LC 50 ( concentración media ) |
| ||
LC Lo ( valor más bajo publicado ) | 250.000 ppm (conejo, 30 min) [5] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 1 ppm TWA 5 ppm [3] | ||
REL (recomendado) | Posible carcinógeno ocupacional [3] | ||
IDLH (Peligro inmediato) | 2000 ppm [3] | ||
| Ficha de datos de seguridad (FDS) | CECA 0017 | ||
| Compuestos relacionados | |||
| Isopreno Cloropreno | |||
Compuestos relacionados | Butano | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
1,3-Butadieno ( / ˌ b juː t ə ˈ d aɪ iː n / ) [8] es el compuesto orgánico con la fórmula CH 2 =CH-CH=CH 2 . Es un gas incoloro que se condensa fácilmente a líquido. Es importante industrialmente como precursor del caucho sintético . [9] La molécula puede verse como la unión de dos grupos vinilo . Es el dieno conjugado más simple .
Aunque el butadieno se descompone rápidamente en la atmósfera, se encuentra sin embargo en el aire ambiente en áreas urbanas y suburbanas como consecuencia de su emisión constante por parte de los vehículos de motor . [10]
El nombre butadieno también puede referirse al isómero 1,2-butadieno , que es un dieno acumulado con estructura H 2 C=C=CH−CH 3 . Este aleno no tiene importancia industrial.
Historia
En 1863, el químico francés E. Caventou aisló el butadieno a partir de la pirólisis del alcohol amílico . [11] Este hidrocarburo fue identificado como butadieno en 1886, después de que Henry Edward Armstrong lo aislara de entre los productos de pirólisis del petróleo. [12] En 1910, el químico ruso Sergei Lebedev polimerizó el butadieno y obtuvo un material con propiedades similares al caucho. Sin embargo, se descubrió que este polímero era demasiado blando para reemplazar al caucho natural en muchas aplicaciones, en particular en los neumáticos de automóviles.
La industria del butadieno se originó en los años previos a la Segunda Guerra Mundial. Muchas de las naciones beligerantes se dieron cuenta de que en caso de guerra, podrían quedar aisladas de las plantaciones de caucho controladas por el Imperio Británico y buscaron reducir su dependencia del caucho natural. [13] En 1929, Eduard Tschunker y Walter Bock , que trabajaban para IG Farben en Alemania, fabricaron un copolímero de estireno y butadieno que podría usarse en neumáticos de automóviles. La producción mundial se produjo rápidamente, y el butadieno se produjo a partir de alcohol de grano en la Unión Soviética y los Estados Unidos, y a partir de acetileno derivado del carbón en Alemania.
Producción
Se estima que en 2020 se produjeron 14,2 millones de toneladas. [14]
Extracción de C4hidrocarburos
En Estados Unidos, Europa occidental y Japón, el butadieno se produce como subproducto del proceso de craqueo a vapor utilizado para producir etileno y otros alquenos . Cuando se mezclan con vapor y se calientan brevemente a temperaturas muy altas (a menudo superiores a 900 °C), los hidrocarburos alifáticos ceden hidrógeno para producir una mezcla compleja de hidrocarburos insaturados, incluido el butadieno. La cantidad de butadieno producido depende de los hidrocarburos utilizados como alimentación. Las alimentaciones ligeras, como el etano , dan principalmente etileno cuando se craquean, pero las alimentaciones más pesadas favorecen la formación de olefinas más pesadas, butadieno e hidrocarburos aromáticos .
El butadieno se aísla típicamente de los otros hidrocarburos de cuatro carbonos producidos en el craqueo a vapor mediante destilación extractiva utilizando un solvente aprótico polar como acetonitrilo , N -metil-2-pirrolidona , furfural o dimetilformamida , del cual luego se separa por destilación . [15]
A partir de la deshidrogenación denorte-butano
El butadieno también se puede producir mediante la deshidrogenación catalítica del butano normal ( n -butano). La primera planta comercial de posguerra de este tipo, que producía 65.000 toneladas de butadieno al año, comenzó a funcionar en 1957 en Houston , Texas. [16] Antes de eso, en la década de 1940, la Rubber Reserve Company , una parte del gobierno de los Estados Unidos, construyó varias plantas en Borger, Texas , Toledo, Ohio y El Segundo, California , para producir caucho sintético para el esfuerzo bélico como parte del Programa de Caucho Sintético de los Estados Unidos. [17] La capacidad total era de 68 KMTA (kilotoneladas métricas por año).
En la actualidad, el butadieno a partir de n -butano se produce comercialmente mediante el proceso Houdry Catadiene , que se desarrolló durante la Segunda Guerra Mundial. Este proceso implica tratar el butano sobre alúmina y cromia a altas temperaturas. [18]
Del etanol
En otras partes del mundo, como Sudamérica, Europa del Este, China e India, el butadieno también se produce a partir de etanol . Si bien no es competitivo con el craqueo a vapor para producir grandes volúmenes de butadieno, los menores costos de capital hacen que la producción a partir de etanol sea una opción viable para plantas de menor capacidad. Se utilizaban dos procesos.
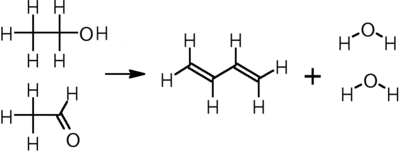
En el proceso de un solo paso desarrollado por Sergei Lebedev , el etanol se convierte en butadieno, hidrógeno y agua a 400–450 °C sobre cualquiera de una variedad de catalizadores de óxido metálico: [19]
Este proceso fue la base de la industria del caucho sintético en la Unión Soviética durante y después de la Segunda Guerra Mundial, y se mantuvo en uso limitado en Rusia y otras partes de Europa del Este hasta finales de la década de 1970. Al mismo tiempo, este tipo de fabricación se canceló en Brasil. A partir de 2017, no se produjo butadieno industrialmente a partir de etanol.
En el otro proceso de dos pasos, desarrollado por el químico emigrado ruso Ivan Ostromislensky , el etanol se oxida a acetaldehído , que reacciona con etanol adicional sobre un catalizador de sílice poroso promovido con tantalio a 325–350 °C para producir butadieno: [19]
Este proceso fue uno de los tres utilizados en Estados Unidos para producir "caucho gubernamental" durante la Segunda Guerra Mundial, aunque es menos económico que las rutas del butano o buteno para los grandes volúmenes. Aun así, se construyeron tres plantas con una capacidad total de 200.000 toneladas por año en Estados Unidos ( Institute, West Virginia , Louisville, Kentucky y Kobuta, Pennsylvania ) con puestas en marcha completadas en 1943. La planta de Louisville inicialmente creó butadieno a partir del acetileno generado por una planta asociada de carburo de calcio. El proceso sigue utilizándose hoy en día en China y la India.
De butenos
El 1,3-butadieno también se puede producir por deshidrogenación catalítica de butenos normales . Este método también fue utilizado por el Programa de Caucho Sintético de los Estados Unidos (US Synthetic Rubber Program, USSRP) durante la Segunda Guerra Mundial . El proceso era mucho más económico que la ruta del alcohol o el n-butano, pero competía con la gasolina de aviación por las moléculas de buteno disponibles (los butenos eran abundantes gracias al craqueo catalítico ). El URSSP construyó varias plantas en Baton Rouge y Lake Charles, Luisiana ; Houston , Baytown y Port Neches, Texas ; y Torrance, California . [17] La producción anual total fue de 275 KMTA.
En la década de 1960, una empresa de Houston conocida como "Petro-Tex" patentó un proceso para producir butadieno a partir de butenos normales mediante deshidrogenación oxidativa utilizando un catalizador patentado. No está claro si esta tecnología se utiliza comercialmente. [20]
Después de la Segunda Guerra Mundial, la producción de butenos se convirtió en el principal tipo de producción en la URSS.
Para uso en laboratorio
El 1,3-butadieno es un producto poco práctico para su uso en el laboratorio porque es un gas. Se han optimizado los procedimientos de laboratorio para su generación a partir de precursores no gaseosos. Se puede producir mediante la reacción de retrodiels-Alder del ciclohexeno . [21] El sulfoleno es una fuente sólida y conveniente de 1,3-butadieno que se puede almacenar en el laboratorio. Libera el dieno y el dióxido de azufre al calentarse.
Usos
La mayor parte del butadieno (75% del 1,3-butadieno fabricado [9] ) se utiliza para fabricar cauchos sintéticos para la fabricación de neumáticos y componentes de muchos artículos de consumo.
La conversión de butadieno en cauchos sintéticos se denomina polimerización , un proceso por el cual moléculas pequeñas (monómeros) se unen para formar otras grandes (polímeros). La mera polimerización de butadieno da polibutadieno , que es un material muy blando, casi líquido. La polimerización de butadieno y otros monómeros da copolímeros , que son más valorados. La polimerización de butadieno y estireno y/o acrilonitrilo , como acrilonitrilo butadieno estireno (ABS), nitrilo-butadieno (NBR) y estireno-butadieno (SBR). Estos copolímeros son tenaces y/o elásticos dependiendo de la proporción de los monómeros utilizados en su preparación. SBR es el material más comúnmente utilizado para la producción de neumáticos de automóviles. Los precursores de otros cauchos sintéticos se preparan a partir de butadieno. Uno de ellos es el cloropreno . [18]
Se utilizan cantidades más pequeñas de butadieno para fabricar adiponitrilo , un precursor de algunos nailones. La conversión de butadieno en adiponitrilo implica la adición de cianuro de hidrógeno a cada uno de los enlaces dobles del butadieno. El proceso se denomina hidrocianación .
El butadieno se utiliza para fabricar el disolvente sulfolano .
El butadieno también es útil en la síntesis de cicloalcanos y cicloalquenos , ya que reacciona con enlaces carbono-carbono dobles y triples a través de reacciones de Diels-Alder . Las reacciones de este tipo más utilizadas implican reacciones del butadieno con una o dos moléculas más de butadieno, es decir, dimerización y trimerización respectivamente. A través de la dimerización, el butadieno se convierte en 4-vinilciclohexeno y ciclooctadieno . De hecho, el vinilciclohexeno es una impureza común que se acumula cuando se almacena el butadieno. A través de la trimerización, el butadieno se convierte en ciclododecatrieno . Algunos de estos procesos emplean catalizadores que contienen níquel o titanio. [22]
El butadieno también es un precursor del 1-octeno a través de la telomerización catalizada por paladio con metanol. Esta reacción produce 1-metoxi-2,7-octadieno como intermediario. [14]
Estructura, conformación y estabilidad

El confórmero más estable del 1,3-butadieno es la conformación s - trans , en la que la molécula es plana, con los dos pares de dobles enlaces orientados en direcciones opuestas. Esta conformación es la más estable porque se maximiza la superposición orbital entre los dobles enlaces, lo que permite una conjugación máxima, mientras que se minimizan los efectos estéricos. Convencionalmente, se considera que la conformación s-trans tiene un ángulo diedro C2 - C3 de 180°. En contraste, la conformación s - cis , en la que el ángulo diedro es de 0°, con el par de dobles enlaces orientados en la misma dirección, es aproximadamente 16,5 kJ/mol (3,9 kcal/mol) más alta en energía, debido al impedimento estérico. Esta geometría es un máximo de energía local, por lo que, a diferencia de la geometría s-trans , no es un confórmero. La geometría gauche , en la que los dobles enlaces de la geometría s-cis se tuercen para dar un ángulo diedro de alrededor de 38°, es un segundo confórmero que tiene alrededor de 12,0 kJ/mol (2,9 kcal/mol) más energía que el confórmero s-trans . En general, existe una barrera de 24,8 kJ/mol (5,9 kcal/mol) para la isomerización entre los dos confórmeros. [23] Esta mayor barrera rotacional y fuerte preferencia general por una geometría casi plana es evidencia de un sistema π deslocalizado y un pequeño grado de carácter de doble enlace parcial en el enlace simple C–C, de acuerdo con la teoría de resonancia.
A pesar de la alta energía de la conformación s-cis , el 1,3-butadieno necesita asumir esta conformación (o una muy similar) antes de poder participar como componente de cuatro electrones en reacciones de cicloadición concertada como la reacción de Diels-Alder .
De manera similar, un estudio experimental y computacional combinado ha descubierto que el doble enlace del s-trans- butadieno tiene una longitud de 133,8 pm, mientras que el del etileno tiene una longitud de 133,0 pm. Esto se tomó como evidencia de un enlace π debilitado y alargado por deslocalización, como se muestra en las estructuras de resonancia que se muestran a continuación. [24]

Se obtiene fácilmente una imagen cualitativa de los orbitales moleculares del 1,3-butadieno aplicando la teoría de Hückel. (El artículo sobre la teoría de Hückel proporciona una derivación para los orbitales del butadieno.)
El 1,3-butadieno también está estabilizado termodinámicamente. Mientras que un doble enlace monosustituido libera alrededor de 30,3 kcal/mol de calor tras la hidrogenación, el 1,3-butadieno libera un poco menos (57,1 kcal/mol) que el doble de esta energía (60,6 kcal/mol), esperada para dos dobles enlaces aislados. Eso implica una energía de estabilización de 3,5 kcal/mol. [25] De manera similar, la hidrogenación del doble enlace terminal del 1,4-pentadieno libera 30,1 kcal/mol de calor, mientras que la hidrogenación del doble enlace terminal del ( E )-1,3-pentadieno conjugado libera solo 26,5 kcal/mol, lo que implica un valor muy similar de 3,6 kcal/mol para la energía de estabilización. [26] La diferencia de ~3,5 kcal/mol en estos calores de hidrogenación puede tomarse como la energía de resonancia de un dieno conjugado.
Reacciones

Los usos industriales ilustran la tendencia del butadieno a polimerizarse. Su susceptibilidad a las reacciones de adición 1,4 se ilustra mediante su hidrocianación. Como muchos dienos, sufre reacciones catalizadas por Pd que proceden a través de complejos alílicos. [28] Es un socio en las reacciones de Diels-Alder , por ejemplo con anhídrido maleico para dar anhídrido tetrahidroftálico . [29]
Al igual que otros dienos, el butadieno es un ligando para complejos metálicos de baja valencia, por ejemplo, los derivados Fe(butadieno)(CO) 3 y Mo(butadieno) 3 .
Salud y seguridad ambiental

El butadieno tiene una toxicidad aguda baja. La CL50 es de 12,5 a 11,5 % en volumen por inhalación en ratas y ratones. [18]
La exposición prolongada se ha asociado con enfermedades cardiovasculares. Existe una asociación constante con la leucemia, así como una asociación significativa con otros tipos de cáncer. [30]
La IARC ha designado al 1,3-butadieno como un carcinógeno del Grupo 1 ("carcinógeno para los humanos"), [31] y la Agencia para el Registro de Enfermedades por Sustancias Tóxicas y la EPA de EE. UU. también incluyen al químico como carcinógeno. [32] [33] La Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) incluye al químico como un carcinógeno sospechoso. [33] El Consejo de Defensa de los Recursos Naturales (NRDC) incluye algunos grupos de enfermedades que se sospecha que están asociados con este químico. [34] Algunos investigadores han concluido que es el carcinógeno más potente en el humo del cigarrillo , dos veces más potente que el acrilonitrilo, que le sigue en la lista [35].
El 1,3-butadieno también es un teratógeno humano sospechoso . [36] [37] [38] La exposición prolongada y excesiva puede afectar muchas áreas del cuerpo humano; se ha demostrado que la sangre, el cerebro, los ojos, el corazón, los riñones, los pulmones, la nariz y la garganta reaccionan a la presencia excesiva de 1,3-butadieno. [39] Los datos animales sugieren que las mujeres tienen una mayor sensibilidad a los posibles efectos cancerígenos del butadieno que los hombres cuando se exponen a la sustancia química. Esto puede deberse a los impactos en los receptores de estrógeno. Si bien estos datos revelan implicaciones importantes para los riesgos de la exposición humana al butadieno, se necesitan más datos para realizar evaluaciones de riesgo concluyentes. También hay una falta de datos humanos sobre los efectos del butadieno en la reproducción y el desarrollo que se han demostrado en ratones, pero los estudios animales han demostrado que respirar butadieno durante el embarazo puede aumentar el número de defectos de nacimiento, y los humanos tienen los mismos sistemas hormonales que los animales. [40]
El 1,3-butadieno es reconocido como un compuesto orgánico volátil altamente reactivo (COVAR) por su potencial para formar ozono fácilmente y, como tal, las emisiones de la sustancia química están altamente reguladas por la TCEQ en partes del Área de No Cumplimiento de Ozono de Houston-Brazoria-Galveston . [41]
Ficha de datos
| Propiedades | |
|---|---|
| Comportamiento de fase | |
| Punto triple | 164,2 K (-109,0 °C) ? bar |
| Punto crítico | 425 K (152 °C) 43,2 bares |
| Estructura | |
| Grupo de simetría | C 2 horas |
| Propiedades del gas | |
| Δ fH 0 | 110,2 kJ/mol |
| C p | 79,5 J/mol·K |
| Propiedades del liquido | |
| Δ fH 0 | 90,5 kJ/mol |
| El 0 | 199,0 J/mol·K |
| C p | 123,6 J/mol·K |
| Densidad del líquido | 0,64 × 103 kg / m3 |
Véase también
Referencias
- ^ "Presentación preliminar". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. p. 374. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ Haynes, William M. (2016). Manual de química y física del CRC (97.ª edición). Boca Raton: CRC Press. pág. 3-76. ISBN 978-1-4987-5429-3.
- ^ abcde Guía de bolsillo del NIOSH sobre peligros químicos. "#0067". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "1,3-Butadieno". Libro web de química del NIST .
- ^ ab "1,3-butadieno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "1,3-Butadieno". INCHEM . Programa Internacional de Seguridad Química (IPCS).
- ^ Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud en el Trabajo
- ^ "BUTADIENO | Significado y definición para inglés británico". Lexico.com. Archivado desde el original el 20 de agosto de 2020. Consultado el 24 de agosto de 2022 .
- ^ abc PubChem. "1,3-Butadieno". pubchem.ncbi.nlm.nih.gov . Consultado el 8 de mayo de 2024 .
- ^ "1,3-Butadieno". Agencia de Protección Ambiental de Estados Unidos US EPA . Consultado el 2 de septiembre de 2014 .
- ^ Caventou, E. (1863). "Ueber eine mit dem zweifach-gebromten Brombutylen isomere Verbindung und über die bromhaltigen Derivate des Brombutylens". Justus Liebigs Annalen der Chemie . 127 : 93–97. doi :10.1002/jlac.18631270112.
- ^ Armstrong, HE; Miller, AK (1886). "La descomposición y génesis de hidrocarburos a altas temperaturas. I. Los productos de la fabricación de gas a partir del petróleo". J. Chem. Soc . 49 : 74–93. doi :10.1039/CT8864900074.
- ^ Las cosas simples no salvarán la Tierra, J. Robert Hunter
- ^ ab Yang, Ji; Wang, Peng; Neumann, Helfried; Jackstell, Ralf; Beller, Matthias (2023). "Transformaciones relevantes y aplicadas industrialmente de 1,3-butadieno utilizando catalizadores homogéneos". Química industrial y materiales . 1 (2): 155–174. doi : 10.1039/D3IM00009E . S2CID 258122761.
- ^ Sun, HP Wristers, JP (1992). Butadieno. En JI Kroschwitz (Ed.), Enciclopedia de tecnología química, 4.ª ed. , vol. 4, págs. 663–690. Nueva York: John Wiley & Sons.
- ^ Beychok, MR y Brack, WJ, "Primera planta de butadieno de posguerra", Petroleum Refiner , junio de 1957.
- ^ ab Herbert, Vernon (1985). Caucho sintético: un proyecto que tenía que triunfar . Greenwood Press. ISBN 0-313-24634-3.
- ^ abc Grub, J.; Löser, E. (2012). "Butadieno". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a04_431.pub2. ISBN 978-3527306732.
- ^ ab Kirshenbaum, I. (1978). "Butadieno". En Grayson, M. (ed.). Enciclopedia de tecnología química . Vol. 4 (3.ª ed.). Nueva York: John Wiley & Sons. págs. 313–337.
- ^ Welch, L. Marshall; Croce, Louis; Christmann, Harold (noviembre de 1978). "BUTADIENO A TRAVÉS DE LA DESHIDROGENACIÓN OXIDATIVA". Procesamiento de hidrocarburos . 57 (11): 131–136 . Consultado el 1 de junio de 2019 – a través de ResearchGate.
- ^ Hershberg, EB; Ruhoff, John R. (1937). "1,3-Butadieno". Org. Synth . 17 : 25. doi :10.15227/orgsyn.017.0025.
- ^ 4-Vinilciclohexeno (PDF) . IARC. ISBN 9789283212607. Consultado el 19 de abril de 2009 .
- ^ Feller, David; Craig, Norman C. (26 de febrero de 2009). "Energías y estructuras ab initio de alto nivel para los rotámeros de 1,3-butadieno". The Journal of Physical Chemistry A . 113 (8): 1601–1607. Bibcode :2009JPCA..113.1601F. doi :10.1021/jp8095709. ISSN 1089-5639. PMID 19199679.
- ^ Craig, Norman C.; Groner, Peter; McKean, Donald C. (1 de junio de 2006). "Estructuras de equilibrio para butadieno y etileno: evidencia convincente de deslocalización del electrón Π en butadieno". The Journal of Physical Chemistry A . 110 (23): 7461–7469. Bibcode :2006JPCA..110.7461C. doi :10.1021/jp060695b. ISSN 1089-5639. PMID 16759136.
- ^ Vollhardt, K. Peter C.; Schore, Neil Eric (2007). Química orgánica: estructura y función (5.ª ed.). Nueva York: WH Freeman. ISBN 978-0716799498.OCLC 61448218 .
- ^ Carey, Francis A. (2002). Química orgánica (5.ª ed.). Londres: McGraw-Hill. ISBN 978-0071151498.OCLC 49907089 .
- ^ Reiss, Guido J. (2010). "Redeterminación de (η4-s-cis-1,3-butadieno)tricarboniliron(0)". Acta Crystallographica Sección E . 66 (11): m1369. Código Bibliográfico :2010AcCrE..66m1369R. doi :10.1107/S1600536810039218. PMC 3009352 . PMID 21588810.
- ^ Nyström, JE; Rein, T.; Bäckvall, JE (1989). "1,4-Funcionalización de 1,3-dienos mediante cloroacetoxilación catalizada por paladio y aminación alílica: 1-acetoxi-4-dietilamino-2-buteno y 1-acetoxi-4-bencilamino-2-buteno". Org. Synth . 67 : 105. doi :10.15227/orgsyn.067.0105.
- ^ Cope, Arthur C.; Herrick, Elbert C. (1950). "Anhídrido cis-Δ4-tetrahidroftálico". Org. Synth . 50 : 93. doi :10.15227/orgsyn.030.0093.
- ^ "Hoja de NPI". Archivado desde el original el 22 de diciembre de 2003. Consultado el 10 de enero de 2006 .
- ^ Grosse, Yann; Baan, Robert; Straif, Kurt; Secretan, Béatrice; El Ghissassi, Fatiha; Bouvard, Véronique; Altieri, Andrea; Cogliano, Vicente (2008). "Carcinogenicidad del 1,3-butadieno, óxido de etileno, cloruro de vinilo, fluoruro de vinilo y bromuro de vinilo". Oncología de The Lancet . 8 (8): 679–680. doi :10.1016/S1470-2045(07)70235-8. ISSN 1470-2045. PMID 17726789.
- ^ "1,3-Butadieno". Portal de Sustancias Tóxicas . Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR). Archivado desde el original el 9 de junio de 2012.
- ^ ab "1,3-Butadieno: efectos sobre la salud". Administración de Seguridad y Salud Ocupacional.
- ^ "Los grupos de enfermedades ponen de relieve la necesidad de proteger a las personas de los productos químicos tóxicos". NRDC. 10 de mayo de 2011.
- ^ Fowles, J.; Dybing, E. (4 de septiembre de 2003). "Aplicación de los principios de evaluación de riesgos toxicológicos a los componentes químicos del humo del cigarrillo". Instituto de Ciencia e Investigación Ambiental . 12 (4): 424–430. doi :10.1136/tc.12.4.424. PMC 1747794 . PMID 14660781.
- ^ Landrigan, PJ (1990). "Evaluación crítica de estudios epidemiológicos sobre la carcinogenicidad humana del 1,3-butadieno". Environmental Health Perspectives . 86 : 143–147. doi :10.1289/ehp.9086143. PMC 1567758 . PMID 2205484.
- ^ "1,3-Butadieno CAS No. 106-99-0" (PDF) . Informe sobre carcinógenos (11.ª ed.). Archivado (PDF) desde el original el 8 de mayo de 2009.
- ^ Melnick, Ronald L.; Kohn, Michael C. (1995). "Los datos mecanísticos indican que el 1,3-butadieno es un carcinógeno humano". Carcinogénesis . 16 (2): 157–163. doi :10.1093/carcin/16.2.157. PMID 7859343.
- ^ "Environment Agency - 1,3-Butadiene". Archivado desde el original el 3 de febrero de 2011. Consultado el 20 de agosto de 2010 .
- ^ "1,3-Butadieno". Sitio web sobre sustancias tóxicas del aire de la Red de transferencia de tecnología . EPA. Archivado desde el original el 11 de mayo de 2012.
- ^ "Control de emisiones de COV de alto riesgo". Comisión de Calidad Ambiental de Texas.
Enlaces externos
- 1,3-butadieno – Agencia para Sustancias Tóxicas y el Registro de Enfermedades
- 1,3-butadieno: guía de bolsillo de los CDC y NIOSH sobre peligros químicos
- Inventario Nacional de Contaminantes – 1,3-Butadieno