Canal de sodio epitelial
| Canal de sodio epitelial | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
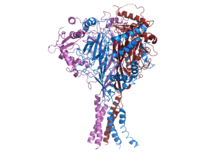 Estructura del ENaC humano. [1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | CSA | ||||||||||
| Pfam | PF00858 | ||||||||||
| Interprofesional | IPR001873 | ||||||||||
| PROSITIO | PDOC00926 | ||||||||||
| SCOP2 | 6BQN / ALCANCE / SUPFAM | ||||||||||
| Base de datos de datos termodinámica | 1.A.6 | ||||||||||
| Superfamilia OPM | 181 | ||||||||||
| Proteína OPM | 4fz1 | ||||||||||
| |||||||||||
El canal de sodio epitelial (ENaC) , (también conocido como canal de sodio sensible a amilorida ) es un canal iónico unido a la membrana que es selectivamente permeable a los iones de sodio ( Na + ). Se ensambla como un heterotrímero compuesto por tres subunidades homólogas α o δ, β y γ, [2] Estas subunidades están codificadas por cuatro genes: SCNN1A , SCNN1B , SCNN1G y SCNN1D . El ENaC está involucrado principalmente en la reabsorción de iones de sodio en los conductos colectores de las nefronas del riñón . Además de estar implicado en enfermedades en las que se altera el equilibrio de líquidos a través de las membranas epiteliales, incluido el edema pulmonar, la fibrosis quística, la EPOC y la COVID-19, las formas proteolizadas de ENaC funcionan como el receptor del gusto por la sal humana. [3]
Las membranas apicales de muchos epitelios apretados contienen canales de sodio que se caracterizan principalmente por su alta afinidad por el bloqueador diurético amilorida . [2] [4] [5] [6] Estos canales median el primer paso de la reabsorción activa de sodio esencial para el mantenimiento de la homeostasis de sal y agua corporal. [4] En los vertebrados , los canales controlan la reabsorción de sodio en los riñones, colon, pulmones y glándulas sudoríparas; también juegan un papel en la percepción del gusto.
Los canales de sodio epiteliales están relacionados estructuralmente y probablemente evolutivamente con los purinorreceptores P2X , receptores del dolor que se activan cuando detectan ATP.
Función
ENaC se encuentra en la membrana apical de las células epiteliales polarizadas , en particular en el riñón (principalmente en el túbulo colector), el pulmón , la piel, [7] los tractos reproductivos masculino y femenino y el colon . [2] [8] [9]
Regulación del equilibrio de sodio
Riñón y colon
Los canales de sodio epiteliales facilitan la reabsorción de Na⁺ a través de las membranas apicales de los epitelios en la nefrona distal , los tractos respiratorio y reproductivo y las glándulas exocrinas . Dado que la concentración de iones Na⁺ es un determinante principal de la osmolaridad del líquido extracelular , los cambios en la concentración de Na⁺ afectan el movimiento de los líquidos y, en consecuencia, el volumen de líquido y la presión arterial.
La aldosterona aumenta la inserción de ENaC en las membranas apicales del riñón [10] : 358 así como en el colon. [ cita requerida ] En el riñón, es inhibida por el péptido natriurético auricular , lo que causa natriuresis y diuresis.
Puede bloquearse con triamtereno o amilorida , que se utilizan médicamente para actuar como diuréticos .
Cerebro
Los canales epiteliales de Na+ (ENaC) en el cerebro desempeñan un papel importante en la regulación de la presión arterial. [11] Las neuronas de vasopresina (VP) desempeñan un papel fundamental en la coordinación de las respuestas neuroendocrinas y autónomas para mantener la homeostasis cardiovascular. La ingesta elevada de sal en la dieta provoca un aumento de la expresión y la actividad de ENaC, lo que da lugar a la despolarización en estado estacionario de las neuronas VP. [11] Este es uno de los mecanismos subyacentes a la forma en que la ingesta de sal en la dieta afecta a la actividad de las neuronas VP a través de la actividad de ENaC. Los canales de ENaC en el cerebro están implicados en la respuesta de la presión arterial al sodio en la dieta.
Epitelio ciliar
Los estudios de inmunofluorescencia de alta resolución revelaron que en el tracto respiratorio y el tracto reproductivo femenino, ENaC se encuentra a lo largo de toda la longitud de los cilios que cubren la superficie de las células multiciliadas. [8] Por lo tanto, en estos epitelios con cilios móviles, ENaC funciona como un regulador de la osmolaridad del líquido periciliar, y su función es esencial para mantener el volumen de líquido a una profundidad necesaria para la motilidad de los cilios. En el tracto respiratorio, este movimiento es esencial para limpiar la superficie de la mucosa , y en el tracto reproductivo femenino, la motilidad de los cilios es esencial para el movimiento de los ovocitos. [8]
A diferencia del ENaC, el CFTR que regula el transporte de iones de cloruro no se encuentra en los cilios. Estos hallazgos contradicen una hipótesis previa de que el ENaC se regula negativamente por la interacción directa con el CFTR. En pacientes con fibrosis quística (FQ), el CFTR no puede regular negativamente el ENaC, lo que provoca hiperabsorción en los pulmones e infecciones pulmonares recurrentes. Se ha sugerido que puede ser un canal iónico controlado por ligando . [12]
Piel
En las capas epidérmicas de la piel, ENaC se expresa en los queratinocitos, las glándulas sebáceas y las células del músculo liso. [7] En estas células, ENaC se encuentra principalmente en el citoplasma. [7]
En las glándulas sudoríparas ecrinas, el ENaC se encuentra predominantemente en la membrana apical que mira hacia el lumen de los conductos sudoríparos. [7] La función principal del ENaC en estos conductos es la recaptación de iones Na⁺ que se excretan en el sudor. En pacientes con mutaciones del ENaC que causan pseudohipoaldosteronismo sistémico tipo I, los pacientes pueden perder una cantidad significativa de iones Na⁺, especialmente en climas cálidos.
Tocar
Los homólogos de los canales iónicos sensibles al ácido (ASIC) de la familia ENaC median la sensación táctil en los invertebrados (incluido el organismo modelo C. elegans ) y también se pensaba que eran responsables de las corrientes de membrana mecanoactivadas en animales superiores. Los ASIC se expresan abundantemente en las neuronas de los ganglios sensoriales de los animales superiores, y la sensación de tacto y dolor se altera pero no se elimina en los animales que carecen de ASIC, lo que sugiere que los canales modulan la transducción sensorial sin ser la base de la activación del mecanorreceptor en sí en los animales superiores (ahora se piensa que esto lo lleva a cabo PIEZO2 ). [13]
Gusto
El ENaC está presente en las membranas celulares apicales de los receptores del gusto , donde probablemente participa en la detección de la salinidad y la acidez . [10] : 677 En los roedores, prácticamente todo el sabor salado está mediado por el ENaC, mientras que parece desempeñar un papel menos significativo en los seres humanos: alrededor del 20 por ciento puede atribuirse al canal de sodio epitelial. [ cita requerida ]
Las variantes proteolizadas de ENaC también funcionan como receptores humanos del gusto por la sal. Esta función se confirmó por primera vez mediante estudios sensoriales en humanos para evaluar el efecto del 4-propilfenil 2-furoato en la percepción del sabor salado de la sal de mesa, el cloruro de sodio (NaCl). Se descubrió que el 4-propilfenil 2-furoato es un compuesto que activa el ENaC proteolizado. [14]
Bioquímica
Selectividad iónica
Los estudios muestran que el canal ENaC es permeable a los iones Na + y Li + , pero tiene muy poca permeabilidad a los iones K + , Cs + o Rb + . [15] [16]
Estructura

ENaC consta de tres subunidades diferentes: α, β, γ. [2] [17] Las tres subunidades son esenciales para el transporte al ensamblaje de la membrana de canales funcionales en la membrana. [18] El extremo C de cada subunidad de ENaC contiene un motivo PPXY que cuando se muta o se elimina en la subunidad β o γ-ENaC conduce al síndrome de Liddle, una forma autosómica dominante humana de hipertensión. La estructura cryoEM de ENaC indica que el canal es una proteína heterotrimérica como el canal iónico sensor de ácido 1 (ASIC1) , que pertenece a la misma familia. [19] [20] Cada una de las subunidades consta de dos hélices transmembrana y un bucle extracelular. Los extremos amino y carboxi de los tres polipéptidos se encuentran en el citosol .
La estructura cristalina de ASIC1 y los estudios de mutagénesis dirigida al sitio sugieren que ENaC tiene un canal iónico central ubicado a lo largo del eje de simetría central entre las tres subunidades. [16] [21]
En términos de estructura, las proteínas que pertenecen a esta familia constan de entre 510 y 920 residuos de aminoácidos. Están formadas por una región intracelular N-terminal seguida de un dominio transmembrana, un gran bucle extracelular, un segundo segmento transmembrana y una cola intracelular C-terminal. [22]
subunidad δ
Además, existe una cuarta subunidad, denominada δ, que comparte una considerable similitud de secuencia con la subunidad α y puede formar un canal iónico funcional junto con las subunidades β y γ. Estas ENaC δ, β y γ aparecen en el páncreas , los testículos , los pulmones y los ovarios . Su función aún se desconoce.
Familias
La familia de canales epiteliales de sodio ( Na + ) (ENaC) pertenece a la superfamilia ENaC/P2X. [23] Los receptores ENaC y P2X tienen estructuras tridimensionales similares y son homólogos. [24]
Los miembros de la familia de canales epiteliales de Na + (ENaC) se dividen en cuatro subfamilias, denominadas alfa, beta, gamma y delta. [5] Las proteínas presentan la misma topología aparente, cada una con dos segmentos transmembrana (TM) que abarcan la membrana (TMS), separados por un gran bucle extracelular. En la mayoría de las proteínas ENaC estudiadas hasta la fecha, los dominios extracelulares están altamente conservados y contienen numerosos residuos de cisteína, con regiones TM anfipáticas C-terminales flanqueantes, que se postula que contribuyen a la formación de los poros hidrófilos de los complejos proteicos de los canales oligoméricos. Se cree que los dominios extracelulares bien conservados sirven como receptores para controlar las actividades de los canales.
Las proteínas ENaC de vertebrados de las células epiteliales se agrupan estrechamente en el árbol filogenético; también se encuentran homólogos de ENaC insensibles al voltaje en el cerebro. Las numerosas proteínas secuenciadas de C. elegans, incluidas las degenerinas del gusano, están lejanamente relacionadas con las proteínas de vertebrados, así como entre sí. Las proteínas ENaC de vertebrados son similares a las degenerinas de Caenorhabditis elegans : [22] deg-1, del-1, mec-4, mec-10 y unc-8. Estas proteínas pueden mutarse para causar degradación neuronal y también se cree que forman canales de sodio.
Genética
La arquitectura exón-intrón de los tres genes que codifican las tres subunidades de ENaC se ha mantenido altamente conservada a pesar de la divergencia de sus secuencias. [25]
Hay cuatro canales de sodio sensibles a la amilorida relacionados:
Importancia clínica

La interacción de ENaC con CFTR tiene una relevancia fisiopatológica importante en la fibrosis quística . CFTR es un canal transmembrana responsable del transporte de cloruro y los defectos en esta proteína causan fibrosis quística, en parte a través de la regulación positiva del canal ENaC en ausencia de CFTR funcional.
En las vías respiratorias, el CFTR permite la secreción de cloruro, y los iones de sodio y agua lo siguen pasivamente. Sin embargo, en ausencia de CFTR funcional, el canal ENaC se regula positivamente y disminuye aún más la secreción de sal y agua al reabsorber iones de sodio. Por lo tanto, las complicaciones respiratorias en la fibrosis quística no son causadas únicamente por la falta de secreción de cloruro, sino por el aumento de la reabsorción de sodio y agua. Esto da como resultado la deposición de moco espeso y deshidratado, que se acumula en el tracto respiratorio, lo que interfiere con el intercambio de gases y permite la acumulación de bacterias. [26] Sin embargo, una regulación positiva del CFTR no corrige la influencia del ENaC de alta actividad. [27] Probablemente, otras proteínas interactuantes son necesarias para mantener una homeostasis iónica funcional en el tejido epitelial del pulmón, como los canales de potasio, las acuaporinas o la Na/K-ATPasa. [28]
En las glándulas sudoríparas, el CFTR es responsable de la reabsorción de cloruro en el conducto sudoríparo. Los iones de sodio siguen pasivamente a través del ENaC como resultado del gradiente electroquímico causado por el flujo de cloruro. Esto reduce la pérdida de sal y agua. En ausencia de flujo de cloruro en la fibrosis quística, los iones de sodio no fluyen a través del ENaC, lo que conduce a una mayor pérdida de sal y agua. (Esto es cierto a pesar de la regulación positiva del canal ENaC, ya que el flujo en los conductos sudoríparos está limitado por el gradiente electroquímico establecido por el flujo de cloruro a través del CFTR). Como tal, la piel de los pacientes tiene un sabor salado, y esto se usa comúnmente para ayudar a diagnosticar la enfermedad, tanto en el pasado como en la actualidad mediante pruebas eléctricas modernas. [29]
Las mutaciones de ganancia de función en las subunidades β y γ están asociadas con el síndrome de Liddle . [30]
La amilorida y el triamtereno son diuréticos ahorradores de potasio que actúan como bloqueadores de los canales de sodio epiteliales .
Biotecnología
La expresión de ENaC en cultivos de células de mamíferos es citotóxica, lo que provoca la absorción de sodio, la hinchazón y la muerte celular, lo que complica la producción de líneas celulares estables para estudiar ENaC. La tecnología Chromovert permitió la producción de una línea celular estable de ENaC utilizando sondas de señalización fluorogénica y citometría de flujo para escanear numerosas células y aislar clones raros capaces de una expresión funcional, estable y viable de ENaC. [31]
Referencias
- ^ Noreng S, Bharadwaj A, Posert R, Yoshioka C, Baconguis I (septiembre de 2018). "Estructura del canal de sodio epitelial humano mediante criomicroscopía electrónica". eLife . 7 : e39340. doi : 10.7554/eLife.39340 . PMC 6197857 . PMID 30251954.
- ^ abcd Hanukoglu I, Hanukoglu A (abril de 2016). "Familia de canales de sodio epiteliales (ENaC): filogenia, estructura-función, distribución tisular y enfermedades hereditarias asociadas". Gene . 579 (2): 95–132. doi :10.1016/j.gene.2015.12.061. PMC 4756657 . PMID 26772908.
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (marzo de 2021). "Método de ingeniería celular utilizando sondas de señalización de oligonucleótidos fluorogénicos y citometría de flujo". Biotechnology Letters . 43 (5): 949–958. doi :10.1007/s10529-021-03101-5. PMC 7937778 . PMID 33683511.
- ^ ab Garty H (mayo de 1994). "Propiedades moleculares de los canales de Na+ epiteliales bloqueables por amilorida". FASEB Journal . 8 (8): 522–8. doi : 10.1096/fasebj.8.8.8181670 . PMID 8181670. S2CID 173677.
- ^ ab Le T, Saier MH (1996). "Caracterización filogenética de la familia de canales de Na+ epiteliales (ENaC)". Biología molecular de membranas . 13 (3): 149–57. doi :10.3109/09687689609160591. PMID 8905643.
- ^ Waldmann R, Champigny G, Bassilana F, Voilley N, Lazdunski M (noviembre de 1995). "Clonación molecular y expresión funcional de un nuevo canal de Na+ sensible a amilorida". The Journal of Biological Chemistry . 270 (46): 27411–4. doi : 10.1074/jbc.270.46.27411 . PMID 7499195.
- ^ abcd Hanukoglu I, Boggula VR, Vaknine H, Sharma S, Kleyman T, Hanukoglu A (junio de 2017). "Expresión del canal de sodio epitelial (ENaC) y CFTR en la epidermis humana y apéndices epidérmicos". Histoquímica y biología celular . 147 (6): 733–748. doi :10.1007/s00418-016-1535-3. PMID 28130590. S2CID 8504408.
- ^ abc Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A (marzo de 2012). "Los canales de sodio epiteliales (ENaC) se distribuyen uniformemente en los cilios móviles del oviducto y las vías respiratorias". Histoquímica y biología celular . 137 (3): 339–53. doi :10.1007/s00418-011-0904-1. PMID 22207244. S2CID 15178940.
- ^ Sharma S, Hanukoglu A, Hanukoglu I (abril de 2018). "Localización del canal de sodio epitelial (ENaC) y CFTR en el epitelio germinal del testículo, células de Sertoli y espermatozoides". Journal of Molecular Histology . 49 (2): 195–208. doi :10.1007/s10735-018-9759-2. PMID 29453757. S2CID 3761720.
- ^ ab Hall, John E.; Hall, Michael E.; Guyton, Arthur C. (2021). Guyton and Hall Textbook of Medical Physiology (14.ª ed.). Filadelfia, Pensilvania: Elsevier. ISBN 978-0-323-59712-8.
- ^ ab Sharma K, Haque M, Guidry R, Ueta Y, Teruyama R (septiembre de 2017). "Efecto de la ingesta de sal en la dieta sobre los canales epiteliales de Na+ (ENaC) en las neuronas neurosecretoras magnocelulares de vasopresina en el núcleo supraóptico de la rata". The Journal of Physiology . 595 (17): 5857–5874. doi :10.1113/JP274856. PMC 5577521 . PMID 28714095.
- ^ Horisberger JD, Chraïbi A (2004). "Canal de sodio epitelial: ¿un canal controlado por ligando?". Fisiología de la nefrona . 96 (2): 37–41. doi :10.1159/000076406. PMID 14988660. S2CID 24608792.
- ^ Koeppen, Bruce M.; Stanton, Bruce A.; Swiatecka-Urban, Agnieszka, eds. (2024). Fisiología de Berna y Levy (8ª ed.). Filadelfia, PA: Elsevier. ISBN 978-0-323-84790-2.
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (marzo de 2021). "Método de ingeniería celular utilizando sondas de señalización de oligonucleótidos fluorogénicos y citometría de flujo". Biotechnology Letters . 43 (5): 949–958. doi :10.1007/s10529-021-03101-5. PMC 7937778 . PMID 33683511.
- ^ Happle R (octubre de 1990). "Pticotropismo como característica cutánea del síndrome CHILD". Revista de la Academia Americana de Dermatología . 23 (4 Pt 1): 763–6. doi :10.1016/0190-9622(90)70285-p. PMID 2229513.
- ^ ab Hanukoglu I (febrero de 2017). "Canales de sodio de tipo ASIC y ENaC: estados conformacionales y estructuras de los filtros de selectividad iónica". The FEBS Journal . 284 (4): 525–545. doi :10.1111/febs.13840. PMID 27580245. S2CID 24402104.
- ^ Loffing J, Schild L (noviembre de 2005). "Dominios funcionales del canal de sodio epitelial". Revista de la Sociedad Americana de Nefrología . 16 (11): 3175–81. doi : 10.1681/ASN.2005050456 . PMID 16192417.
- ^ Edelheit O, Hanukoglu I, Dascal N, Hanukoglu A (abril de 2011). "Identificación de las funciones de los residuos cargados conservados en el dominio extracelular de una subunidad del canal de sodio epitelial (ENaC) mediante mutagénesis de alanina". Revista estadounidense de fisiología. Fisiología renal . 300 (4): F887-97. doi :10.1152/ajprenal.00648.2010. PMID 21209000. S2CID 869654.
- ^ Noreng S, Bharadwaj A, Posert R, Yoshioka C, Baconguis I (septiembre de 2018). "Estructura del canal de sodio epitelial humano mediante criomicroscopía electrónica". eLife . 7 : e39340. doi : 10.7554/eLife.39340 . PMC 6197857 . PMID 30251954.
- ^ Jasti J, Furukawa H, Gonzales EB, Gouaux E (septiembre de 2007). "Estructura del canal iónico 1 sensible al ácido con una resolución de 1,9 A y un pH bajo". Nature . 449 (7160): 316–23. Bibcode :2007Natur.449..316J. doi :10.1038/nature06163. PMID 17882215.
- ^ Edelheit O, Ben-Shahar R, Dascal N, Hanukoglu A, Hanukoglu I (abril de 2014). "Residuos cargados conservados en la superficie y la interfaz de las subunidades del canal de sodio epitelial: funciones en la expresión de la superficie celular y la respuesta de autoinhibición del sodio". The FEBS Journal . 281 (8): 2097–111. doi : 10.1111/febs.12765 . PMID 24571549. S2CID 5807500.
- ^ ab Snyder PM, McDonald FJ, Stokes JB, Welsh MJ (septiembre de 1994). "Topología de membrana del canal de sodio epitelial sensible a amilorida". The Journal of Biological Chemistry . 269 (39): 24379–83. doi : 10.1016/S0021-9258(19)51094-8 . PMID 7929098.
- ^ "Familia de canales catiónicos del receptor P2X dependientes de ATP (receptor P2X)". Clasificación funcional y filogenética de las proteínas de transporte de membrana . Grupo de laboratorio Saier, UCSD y SDSC.
- ^ Chen JS, Reddy V, Chen JH, Shlykov MA, Zheng WH, Cho J, et al. (2011). "Caracterización filogenética de las superfamilias de proteínas de transporte: superioridad de los programas SuperfamilyTree sobre los basados en alineamientos múltiples". Journal of Molecular Microbiology and Biotechnology . 21 (3–4): 83–96. doi :10.1159/000334611. PMC 3290041 . PMID 22286036.
- ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A (noviembre de 1998). "Estructura genética de la subunidad beta del canal de sodio epitelial sensible a amilorida humana". Comunicaciones de investigación bioquímica y biofísica . 252 (1): 208–13. doi :10.1006/bbrc.1998.9625. PMID 9813171.
- ^ Mall M, Grubb BR, Harkema JR, O'Neal WK, Boucher RC (mayo de 2004). "El aumento de la absorción de Na+ en el epitelio de las vías respiratorias produce una enfermedad pulmonar similar a la fibrosis quística en ratones". Nature Medicine . 10 (5): 487–93. doi :10.1038/nm1028. PMID 15077107. S2CID 45366866.
- ^ Grubb BR, O'Neal WK, Ostrowski LE, Kreda SM, Button B, Boucher RC (enero de 2012). "La expresión de hCFTR transgénico no corrige la enfermedad pulmonar en ratones β-ENaC". American Journal of Physiology. Fisiología molecular y celular pulmonar . 302 (2): L238-47. doi :10.1152/ajplung.00083.2011. PMC 3349361. PMID 22003093 .
- ^ Toczyłowska-Mamińska R, Dołowy K (febrero de 2012). "Proteínas transportadoras de iones del epitelio bronquial humano". Journal of Cellular Biochemistry . 113 (2): 426–32. doi : 10.1002/jcb.23393 . PMID 21975871. S2CID 31970069.
- ^ Berdiev BK, Qadri YJ, Benos DJ (febrero de 2009). "Evaluación de la asociación CFTR y ENaC". Molecular BioSystems . 5 (2): 123–7. doi :10.1039/B810471A. PMC 2666849 . PMID 19156256.
- ^ Enfermedades de los canales iónicos
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (marzo de 2021). "Método de ingeniería celular utilizando sondas de señalización de oligonucleótidos fluorogénicos y citometría de flujo". Biotechnology Letters . 43 (5): 949–958. doi :10.1007/s10529-021-03101-5. PMC 7937778 . PMID 33683511.
Enlaces externos
- Canal de sodio epitelial en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.