Propileno
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Propeno [1] [2] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 1696878 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.693 | ||
| Número CE |
| ||
| 852 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1077 En Gas licuado de petróleo : 1075 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C3H6 | |||
| Masa molar | 42,081 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Densidad | 1,81 kg/m 3 , gas (1,013 bar, 15 °C) 1,745 kg/m 3 , gas (1,013 bar, 25 °C) 613,9 kg/m 3 , líquido | ||
| Punto de fusión | -185,2 °C (-301,4 °F; 88,0 K) | ||
| Punto de ebullición | -47,6 °C (-53,7 °F; 225,6 K) | ||
| 0,61 g/ m3 | |||
| -31,5·10 −6 cm3 / mol | |||
| Viscosidad | 8,34 µPa·s a 16,7 °C | ||
| Estructura | |||
| 0,366 D (gas) | |||
| Peligros | |||
| Etiquetado SGA : [3] | |||
  | |||
| Peligro | |||
| H220 | |||
| P210 , P377 , P381 , P403 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -108 °C (-162 °F; 165 K) | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Compuestos relacionados | |||
Alquenos relacionados ; grupos relacionados | Etileno , Isómeros de Butileno ; Alilo , Propenilo | ||
Compuestos relacionados | Propano , Propino , Propadieno , 1-Propanol, 2-Propanol | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
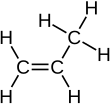
El propileno , también conocido como propeno , es un compuesto orgánico insaturado con la fórmula química CH3CH =CH2 . Tiene un doble enlace y es el segundo miembro más simple de la clase de hidrocarburos de los alquenos . Es un gas incoloro con un ligero olor a petróleo. [4]
El propileno es un producto de la combustión de los incendios forestales, el humo del cigarrillo y los gases de escape de los vehículos de motor y de los aviones. [5] Fue descubierto en 1850 por el capitán estudiante de A. W. von Hoffman (más tarde mayor general [6] ) John Williams Reynolds como el único producto gaseoso de la descomposición térmica del alcohol amílico que reacciona con el cloro y el bromo. [7]
Producción
Craqueo por vapor
La tecnología dominante para producir propileno es el craqueo a vapor , utilizando propano como materia prima . El craqueo de propano produce una mezcla de etileno , propileno, metano , gas hidrógeno y otros compuestos relacionados. El rendimiento de propileno es de alrededor del 15%. La otra materia prima principal es la nafta, especialmente en Oriente Medio y Asia. [8] El propileno se puede separar por destilación fraccionada de las mezclas de hidrocarburos obtenidas del craqueo y otros procesos de refinación; el propeno de grado de refinería representa alrededor del 50 al 70%. [9] En los Estados Unidos, el gas de esquisto es una fuente importante de propano.
Tecnología de conversión de olefinas
En la tecnología de conversión de olefinas o triolefinas de Phillips , el propileno se interconvierte con etileno y 2-butenos . Se utilizan catalizadores de renio y molibdeno : [10]
La tecnología se basa en una reacción de metátesis de olefinas descubierta en Phillips Petroleum Company . [11] [12] Se logran rendimientos de propileno de aproximadamente el 90 % en peso.
Un proceso relacionado es el de conversión de metanol en olefinas y metanol en propeno . Este proceso convierte el gas de síntesis (syngas) en metanol y, a continuación, convierte el metanol en etileno o propeno . El proceso produce agua como subproducto. El gas de síntesis se produce a partir de la reformación del gas natural o mediante la reformación inducida por vapor de productos derivados del petróleo, como la nafta, o mediante la gasificación del carbón o el gas natural.
Craqueo catalítico fluido
El craqueo catalítico de fluidos (FCC) de alta severidad utiliza la tecnología tradicional de FCC en condiciones severas (mayores relaciones catalizador-petróleo, mayores tasas de inyección de vapor, temperaturas más altas, etc.) para maximizar la cantidad de propeno y otros productos livianos. Una unidad de FCC de alta severidad generalmente se alimenta con gasóleos (parafinas) y residuos, y produce alrededor de un 20-25% (en masa) de propeno en la materia prima junto con mayores volúmenes de gasolina para motores y subproductos destilados. Estos procesos de alta temperatura son costosos y tienen una alta huella de carbono. Por estas razones, las rutas alternativas al propileno continúan atrayendo la atención. [13]
Otros métodos comercializados
A lo largo del siglo XX se desarrollaron tecnologías de producción de propileno a propósito. De ellas, las tecnologías de deshidrogenación de propano, como los procesos CATOFIN y OLEFLEX, se han vuelto comunes, aunque todavía constituyen una minoría del mercado, ya que la mayor parte de la olefina se obtiene a partir de las tecnologías de craqueo mencionadas anteriormente. Los catalizadores de platino, cromo y vanadio son comunes en los procesos de deshidrogenación de propano.
Mercado
La producción de propeno se ha mantenido estática en alrededor de 35 millones de toneladas (sólo en Europa y América del Norte) entre 2000 y 2008, pero ha ido aumentando en el este de Asia, sobre todo en Singapur y China. [14] La producción mundial total de propeno es actualmente aproximadamente la mitad de la de etileno.
Investigación
Se ha explorado el uso de enzimas modificadas genéticamente , pero no se ha comercializado. [15]
Actualmente se están realizando investigaciones sobre el uso de catalizadores portadores de oxígeno para la deshidrogenación oxidativa del propano. Esto presenta varias ventajas, ya que este mecanismo de reacción puede ocurrir a temperaturas más bajas que la deshidrogenación convencional y puede no estar limitado por el equilibrio porque se utiliza oxígeno para quemar el subproducto de hidrógeno. [16]
Usos
El propeno es el segundo producto de partida más importante en la industria petroquímica después del etileno . Es la materia prima para una amplia variedad de productos. Los fabricantes de polipropileno consumen casi dos tercios de la producción mundial. [17] Los usos finales del polipropileno incluyen películas, fibras, contenedores, embalajes y tapas y cierres. El propeno también se utiliza para la producción de productos químicos importantes como óxido de propileno , acrilonitrilo , cumeno , butiraldehído y ácido acrílico . En el año 2013 se procesaron alrededor de 85 millones de toneladas de propeno en todo el mundo. [17]
El propeno y el benceno se convierten en acetona y fenol a través del proceso del cumeno .
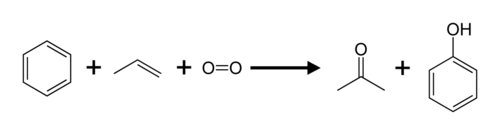
El propeno también se utiliza para producir alcohol isopropílico (propan-2-ol), acrilonitrilo , óxido de propileno y epiclorhidrina . [18] La producción industrial de ácido acrílico implica la oxidación parcial catalítica del propeno. [19] El propileno es un intermediario en la oxidación del ácido acrílico.
En la industria y en los talleres, el propeno se utiliza como combustible alternativo al acetileno en la soldadura y el corte con oxicombustible , la soldadura fuerte y el calentamiento de metales con el fin de doblarlos. Se ha convertido en un estándar en los productos BernzOmatic y otros sustitutos del MAPP, [20] ahora que el verdadero gas MAPP ya no está disponible.
Reacciones
El propeno se parece a otros alquenos en que experimenta reacciones de adición con relativa facilidad a temperatura ambiente. La relativa debilidad de su doble enlace explica su tendencia a reaccionar con sustancias que pueden lograr esta transformación. Las reacciones de los alquenos incluyen: 1) polimerización , 2) oxidación , 3) halogenación e hidrohalogenación , 4) alquilación , 5) hidratación , 6) oligomerización y 7) hidroformilación .
Complejos de metales de transición
Los complejos metal-propileno , que son intermediarios en estos procesos, son fundamentales para la hidroformilación, la metátesis de alquenos y la polimerización . El propileno es proquiral , lo que significa que la unión de un reactivo (como un electrófilo metálico) al grupo C=C produce uno de dos enantiómeros .
Polimerización
La mayor parte del propeno se utiliza para formar polipropileno, un termoplástico muy importante , mediante polimerización por crecimiento en cadena . [17] En presencia de un catalizador adecuado (normalmente un catalizador Ziegler-Natta ), el propeno se polimerizará. Existen múltiples formas de lograrlo, como usar altas presiones para suspender el catalizador en una solución de propeno líquido o hacer pasar propeno gaseoso por un reactor de lecho fluidizado . [21]
Dimerización
En presencia de catalizadores , el propileno se dimeriza para dar 2,3-dimetil-1-buteno y/o 2,3-dimetil-2-buteno . [22]
Seguridad ambiental
El propeno es un producto de la combustión de los incendios forestales, el humo de los cigarrillos y los gases de escape de los vehículos de motor y de las aeronaves. [5] Es una impureza presente en algunos gases de calefacción. Las concentraciones observadas han oscilado entre 0,1 y 4,8 partes por mil millones ( ppb ) en el aire rural, entre 4 y 10,5 ppb en el aire urbano y entre 7 y 260 ppb en muestras de aire industrial. [9]
En los Estados Unidos y algunos países europeos se estableció un valor límite de 500 partes por millón ( ppm ) para la exposición ocupacional ( promedio ponderado en el tiempo de 8 horas ). Se considera un compuesto orgánico volátil (COV) y muchos gobiernos regulan sus emisiones, pero la Agencia de Protección Ambiental de los Estados Unidos (EPA) no lo incluye en la lista de contaminantes atmosféricos peligrosos de la Ley de Aire Limpio . Con una vida media relativamente corta, no se espera que se bioacumule. [9]
El propeno tiene una baja toxicidad aguda por inhalación y no se considera cancerígeno. Los estudios de toxicidad crónica en ratones no arrojaron evidencia significativa que sugiera efectos adversos. Los seres humanos expuestos brevemente a 4000 ppm no experimentaron ningún efecto notable. [23] El propeno es peligroso por su potencial para desplazar el oxígeno como gas asfixiante y por su alto riesgo de inflamabilidad/explosión.
El biopropileno es el propileno de origen biológico . [24] [25] Se ha examinado, motivado por diversos intereses como la huella de carbono . Se ha considerado la producción a partir de glucosa . [26] Las formas más avanzadas de abordar estas cuestiones se centran en las alternativas de electrificación al craqueo a vapor .
Almacenamiento y manipulación
El propeno es inflamable. Normalmente se almacena en forma líquida bajo presión, aunque también es posible almacenarlo de forma segura en forma de gas a temperatura ambiente en contenedores aprobados. [27]
Ocurrencia en la naturaleza
El propeno se detecta en el medio interestelar mediante espectroscopia de microondas. [28] El 30 de septiembre de 2013, la NASA también anunció que la nave espacial Cassini, parte de la misión Cassini-Huygens , había descubierto pequeñas cantidades de propeno de origen natural en la atmósfera de Titán mediante espectroscopia. [29] [30]
Véase también
- Desastre de Los Alfaques
- Abuso de inhalantes
- Explosiones de gas en Kaohsiung en 2014
- Explosión en Houston en 2020
Referencias
- ^ "Principios generales, reglas y convenciones". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. p. 31. doi :10.1039/9781849733069-00001. ISBN . 978-0-85404-182-4.
- ^ Moss, GP (versión web). "P-14.3 Localizadores". Nomenclatura de la química orgánica. Recomendaciones y nombres preferidos de la IUPAC 2013. Londres: Queen Mary University. Sección P-14.3.4.2 (d) . Consultado el 23 de agosto de 2024 .
- ^ "Propileno". pubchem.ncbi.nlm.nih.gov . Consultado el 14 de diciembre de 2021 .
- ^ "Propileno".
- ^ ab Morgott, David (4 de enero de 2018). "Potencial de exposición humana a las emisiones de propileno al medio ambiente". Revista internacional de investigación ambiental y salud pública . 15 (1): 66. doi : 10.3390/ijerph15010066 . ISSN 1660-4601. PMC 5800165 . PMID 29300328.
- ^ "Mayor general John Williams Reynolds, FCS". geni_family_tree . 1816-12-25 . Consultado el 2023-12-30 .
- ^ Rasmussen, Seth C. (2018), Rasmussen, Seth C. (ed.), "Introducción", Acetileno y sus polímeros: más de 150 años de historia , SpringerBriefs in Molecular Science, Cham: Springer International Publishing, págs. 1–19, doi :10.1007/978-3-319-95489-9_1, ISBN 978-3-319-95489-9, consultado el 30 de diciembre de 2023
- ^ Diccionario Ashford de productos químicos industriales, tercera edición, 2011, ISBN 978-0-9522674-3-0 , páginas 7766-9
- ^ abc "Evaluación de seguridad del producto (PSA): propileno". Dow Chemical Co. Archivado desde el original el 28 de agosto de 2013. Consultado el 11 de julio de 2011 .
- ^ Ghashghaee, Mohammad (2018). "Catalizadores heterogéneos para la conversión en fase gaseosa de etileno en olefinas superiores". Rev. Chem. Eng . 34 (5): 595–655. doi :10.1515/revce-2017-0003. S2CID 103664623.
- ^ Banks, RL; Bailey, GC (1964). "Desproporción de olefinas. Un nuevo proceso catalítico". Investigación y desarrollo de productos químicos industriales y de ingeniería . 3 (3): 170–173. doi :10.1021/i360011a002.
- ^ Lionel Delaude; Alfred F. Noels (2005). "Metátesis". Enciclopedia Kirk-Othmer de Tecnología Química . Weinheim: Wiley-VCH. doi :10.1002/0471238961.metanoel.a01. ISBN 978-0-471-23896-6.
- ^ Schiffer, Zachary J.; Manthiram, Karthish (2017). "Electrificación y descarbonización de la industria química". Joule . 1 : 10–14. doi :10.1016/j.joule.2017.07.008. hdl : 1721.1/124019 . S2CID 117360588.
- ^ Amghizar, Ismaël; Vandewalle, Laurien A.; Van Geem, Kevin M.; Marín, Guy B. (2017). "Nuevas tendencias en la producción de olefinas". Ingeniería . 3 (2): 171–178. doi : 10.1016/J.ENG.2017.02.006 .
- ^ de Guzman, Doris (12 de octubre de 2012). "Bioenergías globales en biopropileno". Green Chemicals Blog .
- ^ Wu, Tianwei; Yu, Qingbo; Roghair; et al. (2020). "Deshidrogenación oxidativa de propano mediante bucle químico: un estudio comparativo de portadores de oxígeno basados en Ga, Mo y V". Ingeniería química y procesamiento - Intensificación de procesos . 157 : 108137. Bibcode :2020CEPPI.15708137W. doi : 10.1016/j.cep.2020.108137 . ISSN 0255-2701.
- ^ abc "Estudio de mercado: propileno (2.ª edición), Ceresana, diciembre de 2014". ceresana.com . Consultado el 3 de febrero de 2015 .
- ^ Budavari, Susan, ed. (1996). "8034. Propileno". The Merck Index, duodécima edición . Nueva Jersey: Merck & Co., págs. 1348-1349.
- ^ JGL, Fierro (Ed.) (2006). Óxidos metálicos, química y aplicaciones . CRC Press. págs. 414–455.
- ^ Por ejemplo, "MAPP-Pro"
- ^ Heggs, T. Geoffrey (15 de octubre de 2011), "Polipropileno", en Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann's Encyclopedia of Industrial Chemistry , Weinheim, Alemania: Wiley-VCH Verlag GmbH & Co. KGaA, págs. o21_o04, doi :10.1002/14356007.o21_o04, ISBN 978-3-527-30673-2, consultado el 9 de julio de 2021
- ^ Olivier-Bourbigou, H.; Breuil, PAR; Magna, L.; Michel, T.; Espada Pastor, M. Fernández; Delcroix, D. (2020). "Oligomerización y dimerización de olefinas catalizadas por níquel" (PDF) . Reseñas químicas . 120 (15): 7919–7983. doi : 10.1021/acs.chemrev.0c00076. PMID 32786672. S2CID 221124789.
- ^ PubChem. «Banco de datos de sustancias peligrosas (HSDB): 175». pubchem.ncbi.nlm.nih.gov . Consultado el 9 de julio de 2021 .
- ^ Depósitos de base biológica, depósitos inteligentes y productos químicos especializados
- ^ Duurzame bioplásticos en base a van hernieuwbare grondstoffen
- ^ Guzmán, Doris de (12 de octubre de 2012). "Bioenergías globales en biopropileno". Green Chemicals Blog . Consultado el 9 de julio de 2021 .
- ^ Enciclopedia de tecnología química, cuarta edición, 1996, ISBN 0471-52689-4 (v.20), página 261
- ^ Marcelino, N.; Cernicharo, J.; Agúndez, M.; et al. (10 de agosto de 2007). "Descubrimiento del propileno interestelar (CH2CHCH3): eslabones perdidos en la química interestelar en fase gaseosa". The Astrophysical Journal . 665 (2). IOP: L127–L130. arXiv : 0707.1308 . Bibcode :2007ApJ...665L.127M. doi : 10.1086/521398 . S2CID 15832967.
- ^ "Una sonda espacial encuentra propileno en la luna Titán de Saturno". UPI.com. 2013-09-30 . Consultado el 2013-11-12 .
- ^ "Cassini encuentra un componente de plástico doméstico en una luna de Saturno". Spacedaily.com . Consultado el 12 de noviembre de 2013 .







![{\displaystyle {\ce {CH2=CH2{}+CH3CH=CHCH3->[][{\text{Re, Mo}} \sobre {\text{catalizador}}]2CH2=CHCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/acdd4b00da58144bb78872e0663521fe689b07b1)
