Carcinoma de células renales
Este artículo necesita referencias médicas más confiables para su verificación o depende demasiado de fuentes primarias . ( abril de 2021 ) |
| Carcinoma de células renales | |
|---|---|
 | |
| Micrografía del tipo más común de carcinoma de células renales (células claras): a la derecha de la imagen; el riñón sin tumor está a la izquierda de la imagen. Muestra de nefrectomía. Tinción H&E | |
| Especialidad | Oncología |
El carcinoma de células renales ( CCR ) es un cáncer de riñón que se origina en el revestimiento del túbulo contorneado proximal , una parte de los tubos muy pequeños del riñón que transportan la orina primaria. El CCR es el tipo más común de cáncer de riñón en adultos, responsable de aproximadamente el 90-95% de los casos. [1] Es más común en hombres (con una proporción hombre-mujer de hasta 2:1). [2] Se diagnostica con mayor frecuencia en ancianos (especialmente en personas mayores de 75 años). [3]
El tratamiento inicial suele ser la extirpación parcial o completa del riñón o los riñones afectados. [4] Cuando el cáncer no ha hecho metástasis (se ha propagado a otros órganos) ni se ha infiltrado más profundamente en los tejidos del riñón, la tasa de supervivencia a cinco años es del 65 al 90 %, [5] pero esta se reduce considerablemente cuando el cáncer se ha propagado.
El cuerpo es notablemente bueno para ocultar los síntomas y, como resultado, las personas con CCR a menudo tienen una enfermedad avanzada en el momento en que se descubre. [6] Los síntomas iniciales del CCR a menudo incluyen sangre en la orina (que ocurre en el 40% de las personas afectadas en el momento en que buscan atención médica por primera vez), dolor en el flanco (40%), una masa en el abdomen o el flanco (25%), pérdida de peso (33%), fiebre (20%), presión arterial alta (20%), sudores nocturnos y malestar general . [1] Cuando el CCR hace metástasis, lo más común es que se propague a los ganglios linfáticos , los pulmones , el hígado , las glándulas suprarrenales , el cerebro o los huesos. [7] La inmunoterapia y la terapia dirigida han mejorado las perspectivas del CCR metastásico. [8] [9]
El CCR también se asocia con una serie de síndromes paraneoplásicos (SPN), que son afecciones causadas por las hormonas producidas por el tumor o por el ataque del cuerpo al tumor y están presentes en aproximadamente el 20 % de las personas con CCR. [1] Estos síndromes afectan con mayor frecuencia a los tejidos que no han sido invadidos por el cáncer. [1] Los SPN más comunes que se observan en personas con CCR son: niveles altos de calcio en sangre , recuento alto de glóbulos rojos , recuento alto de plaquetas y amiloidosis secundaria . [7]
Signos y síntomas
Históricamente, los médicos esperaban que una persona presentara tres hallazgos. Esta tríada clásica [10] es 1: hematuria , que es cuando hay sangre presente en la orina, 2: dolor en el flanco, que es dolor en el costado del cuerpo entre la cadera y las costillas, y 3: una masa abdominal, similar a la hinchazón pero más grande. Ahora se sabe que esta tríada clásica de síntomas solo ocurre en el 10-15% de los casos, y generalmente es indicativa de que el carcinoma de células renales (CCR) está en una etapa avanzada. [10] Hoy en día, el carcinoma de células renales (CCR) a menudo es asintomático, lo que significa que no presenta síntomas, y comúnmente se detecta incidentalmente durante exámenes por afecciones médicas no relacionadas. El porcentaje de casos de CCR asintomáticos y diagnosticados incidentalmente, particularmente tumores más pequeños, ha seguido aumentando en los últimos años. [11]
Otros signos y síntomas pueden incluir hematuria ; [10] dolor lumbar; [10] masa abdominal; [12] malestar , que es una sensación general de malestar; [12] pérdida de peso y/o pérdida de apetito; [13] anemia resultante de la depresión de la eritropoyetina ; [10] eritrocitosis (aumento de la producción de glóbulos rojos ) debido al aumento de la secreción de eritropoyetina; [10] varicocele , que se observa en los hombres como un agrandamiento del plexo pampiniforme de las venas que drenan el testículo (más a menudo el testículo izquierdo) [12] hipertensión (presión arterial alta) resultante de la secreción de renina por el tumor; [14] hipercalcemia , que es la elevación de los niveles de calcio en la sangre; [15] alteración del sueño o sudores nocturnos; [13] fiebres recurrentes ; [13] y fatiga crónica. [16]
Factores de riesgo
Estilo de vida
Los mayores factores de riesgo para el CCR están relacionados con el estilo de vida: se ha estimado que el tabaquismo, la obesidad y la hipertensión (presión arterial alta) representan hasta el 50% de los casos. [17] La exposición ocupacional a algunas sustancias químicas como el amianto, el cadmio, el plomo, los disolventes clorados, los petroquímicos y los HAP ( hidrocarburos aromáticos policíclicos ) ha sido examinada por múltiples estudios con resultados no concluyentes. [18] [19] [20] Otro factor de riesgo sospechoso es el uso a largo plazo de medicamentos antiinflamatorios no esteroideos (AINE). [21]
Por último, los estudios han demostrado que las mujeres que se han sometido a una histerectomía tienen más del doble de riesgo de desarrollar CCR que aquellas que no se la han sometido. [22] Por otra parte, se ha demostrado que el consumo moderado de alcohol tiene un efecto protector. [23]
Genética
Los factores hereditarios tienen un impacto menor en la susceptibilidad individual, ya que los familiares inmediatos de las personas con CCR tienen un riesgo dos a cuatro veces mayor de desarrollar la enfermedad. [24] Otras afecciones vinculadas genéticamente también aumentan el riesgo de CCR, incluido el carcinoma renal papilar hereditario, la leiomiomatosis hereditaria , el síndrome de Birt-Hogg-Dube , el síndrome de hiperparatiroidismo-tumor mandibular, el carcinoma papilar tiroideo familiar , la enfermedad de von Hippel-Lindau [25] y la enfermedad de células falciformes . [26]
Sin embargo, la enfermedad más importante que afecta el riesgo no está vinculada genéticamente: los pacientes con enfermedad quística adquirida del riñón que requiere diálisis tienen 30 veces más probabilidades que la población general de desarrollar CCR. [27]
Fisiopatología
El tumor surge de las células del epitelio tubular renal proximal . [1] Se considera un adenocarcinoma . [7] Hay dos subtipos: esporádico (es decir, no hereditario) y hereditario. [1] Ambos subtipos están asociados con mutaciones en el brazo corto del cromosoma 3 , y los genes implicados son genes supresores de tumores ( VHL y TSC ) u oncogenes (como c-Met ). [1]
Diagnóstico
Los primeros pasos que se dan para diagnosticar esta afección son la consideración de los signos y síntomas, y una historia clínica (la revisión médica detallada del estado de salud anterior) para evaluar los factores de riesgo. En función de los síntomas presentados, también se puede considerar una serie de pruebas bioquímicas (utilizando muestras de sangre y/o orina) como parte del proceso de detección para proporcionar un análisis cuantitativo suficiente de cualquier diferencia en los electrolitos , la función renal y hepática y los tiempos de coagulación de la sangre. [26] En el examen físico, la palpación del abdomen puede revelar la presencia de una masa o un agrandamiento de un órgano. [28]
Aunque esta enfermedad carece de caracterización en las primeras etapas del desarrollo tumoral, son importantes las consideraciones basadas en las diversas manifestaciones clínicas, así como la resistencia a la radiación y la quimioterapia . Las principales herramientas diagnósticas para detectar el carcinoma de células renales son la ecografía , la tomografía computarizada (TC) y la resonancia magnética (RM) de los riñones. [29]
Clasificación
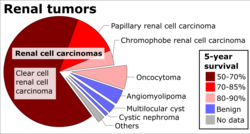
El carcinoma de células renales (CCR) no es una entidad única, sino más bien un conjunto de diferentes tipos de tumores , cada uno derivado de las diversas partes de la nefrona ( epitelio o túbulos renales ) y que posee características genéticas, características histológicas y, en cierta medida, fenotipos clínicos distintos . [26]
| Clasificación de los subtipos histológicos comunes del carcinoma de células renales [26] | |||
|---|---|---|---|
| Subtipo de carcinoma de células renales | Frecuencia | Anormalidades genéticas | Características |
Carcinoma de células renales de células claras (CCRCC) _Nephrectomy.jpg/440px-Renal_clear_cell_ca_(1)_Nephrectomy.jpg) | 60–70% |
|
|
Carcinoma de células renales papilares (CCPR) | 10–15% |
|
|
Carcinoma de células renales cromófobo (ChRCC) | 3–5% |
|
|
| Características clínicas, patológicas y genéticas de los subtipos poco comunes de CCR incluidos en la clasificación de patología del CCR de la OMS de 2004 [31] [34] | ||||
|---|---|---|---|---|
| Subtipo RCC | Características clínicas | Características de las células y los tejidos | Genética | Pronóstico |
| CCR quístico multilocular |
| Citoplasma claro , núcleos pequeños y oscuros. | Deleción 3p observada en CCRCC |
|
| Carcinoma de los conductos colectores de Bellini |
| Células tumorales de alto grado con citoplasma eosinofílico | Resultados variables: LOH en los cromosomas 1q, 6p, 8p, 9p, 13q, 19q32 y 21q; amplificación de c-erB2 asociada con un resultado desfavorable |
|
| Carcinoma medular |
| Hemorragia y necrosis , células tumorales de alto grado con citoplasma eosinofílico. | No está bien definido |
|
| Carcinoma por translocación Xp11.2 |
|
| Translocación cromosómica que afecta al gen TFE3 en Xp11.2 que da como resultado la sobreexpresión de la proteína TFE3 |
|
| Carcinoma fusocelular tubular mucinoso |
| Túbulos, mucina extracelular y células fusiformes | No bien definido; se han reportado pérdidas que involucran los cromosomas 1, 4, 6, 8, 9, 11, 13, 14, 15, 18, 22; alteraciones 3p y ganancia del cromosoma 7 y 17 no presentes |
|
| Carcinoma de células renales post-neuroblastoma |
| Células eosinofílicas con características oncocitoides (igual que el CCRCC) | No bien definido; se observa pérdida de múltiples loci cromosómicos | Similar a otros subtipos comunes de RCC |
El cariotipo basado en matrices se puede utilizar para identificar aberraciones cromosómicas características en tumores renales con morfología desafiante. [35] [36] El cariotipo basado en matrices funciona bien en tumores incluidos en parafina [37] y es apto para uso clínico de rutina. Consulte también Virtual Karyotype para laboratorios certificados por CLIA que ofrecen cariotipo basado en matrices de tumores sólidos.
La clasificación de tumores genitourinarios de la Organización Mundial de la Salud (OMS) de 2004 reconoce más de 40 subtipos de neoplasias renales . Desde la publicación de la última versión de la clasificación de la OMS en 2004, se han descrito varios subtipos nuevos de tumores renales: [38]
- Carcinoma renal de células claras papilar y carcinoma renal de células claras con estroma de músculo liso [39]
- Carcinoma de células fusiformes y tubulares mucinosos (CMTS) [38]
- Carcinoma renal de células claras quístico multilocular [38]
- Carcinoma de células renales tubuloquísticas
- Carcinoma folicular de células renales de tipo tiroideo
- Carcinoma de células renales asociado a enfermedad renal quística adquirida
- Carcinoma de células renales con translocación t(6;11) (TFEB)
- Oncocitoma híbrido/carcinoma de células renales cromófobo
- Leiomiomatosis hereditaria y carcinoma de células renales (HLRCC)
Pruebas de laboratorio
Las pruebas de laboratorio se realizan generalmente cuando el paciente presenta signos y síntomas que pueden ser característicos de una insuficiencia renal. No se utilizan principalmente para diagnosticar el cáncer de riñón, debido a su naturaleza asintomática y generalmente se detectan de manera incidental durante pruebas para otras enfermedades como la enfermedad de la vesícula biliar . [40] En otras palabras, estos cánceres no se detectan generalmente porque no causan dolor o malestar cuando se descubren. El análisis de laboratorio puede proporcionar una evaluación sobre la salud general del paciente y puede proporcionar información para determinar la estadificación y el grado de metástasis a otras partes del cuerpo (si se ha identificado una lesión renal ) antes de administrar el tratamiento. [ cita requerida ]
Análisis de orina
La presencia de sangre en la orina es un signo presuntivo común de carcinoma de células renales. La hemoglobina de la sangre hace que la orina tenga un color oxidado, marrón o rojo. Alternativamente, el análisis de orina puede detectar azúcar , proteínas y bacterias que también pueden servir como indicadores de cáncer . Un hemograma completo también puede proporcionar información adicional sobre la gravedad y la propagación del cáncer. [41]
Recuento sanguíneo completo
El hemograma completo proporciona una medida cuantificada de las diferentes células presentes en la muestra de sangre completa del paciente. Entre las células que se examinan en esta prueba se encuentran los glóbulos rojos ( eritrocitos ), los glóbulos blancos ( leucocitos ) y las plaquetas ( trombocitos ). Un signo común del carcinoma de células renales es la anemia , en la que el paciente presenta deficiencia de glóbulos rojos. [42] Las pruebas de hemograma completo son vitales como herramienta de detección para examinar la salud del paciente antes de la cirugía. Las inconsistencias en el recuento de plaquetas también son comunes entre estos pacientes con cáncer y se deben considerar otras pruebas de coagulación, incluida la velocidad de sedimentación globular (VSG), el tiempo de protrombina (TP) y el tiempo de tromboplastina parcial activada (TTPA). [ cita requerida ]
Química sanguínea
Si se sospecha la presencia de un carcinoma de células renales, se realizan pruebas de química sanguínea, ya que el cáncer tiene el potencial de elevar los niveles de determinadas sustancias químicas en la sangre. Por ejemplo, se encuentran niveles anormalmente altos de enzimas hepáticas como la aspartato aminotransferasa (AST) y la alanina aminotransferasa (ALT). [43] La estadificación del cáncer también se puede determinar por niveles anormalmente elevados de calcio, lo que sugiere que el cáncer puede haber hecho metástasis en los huesos. [44] En este caso, se debe solicitar al médico una tomografía computarizada. Las pruebas de química sanguínea también evalúan la función general de los riñones y pueden permitir al médico decidir si se deben realizar más pruebas radiológicas. [ cita requerida ]
Radiología
El aspecto característico del carcinoma de células renales (CCR) es una lesión renal sólida que altera el contorno renal. Con frecuencia tendrá un margen irregular o lobulado y puede verse como un bulto en la región pélvica inferior o abdominal. Tradicionalmente, entre el 85 y el 90 % de las masas renales sólidas resultarán ser CCR, pero las masas renales quísticas también pueden deberse a CCR. [45] Sin embargo, los avances de las modalidades de diagnóstico permiten diagnosticar incidentalmente una gran proporción de pacientes con lesiones renales que pueden parecer pequeñas en tamaño y de estado benigno. El diez por ciento de los CCR contendrán calcificaciones y algunos contienen grasa macroscópica (probablemente debido a la invasión y encapsulamiento de la grasa perirrenal). [46]
Decidir sobre la naturaleza benigna o maligna de la masa renal sobre la base de su tamaño localizado es un problema ya que el carcinoma de células renales también puede ser quístico. Como hay varias lesiones renales quísticas benignas (quiste renal simple, quiste renal hemorrágico , nefroma quístico multilocular , enfermedad renal poliquística ), en ocasiones puede ser difícil para el radiólogo diferenciar una lesión quística benigna de una maligna. [47] El sistema de clasificación de Bosniak para lesiones renales quísticas las clasifica en grupos que son benignas y aquellas que necesitan resección quirúrgica , según características de imagen específicas. [48]
Las principales pruebas de imagen que se realizan para identificar el carcinoma de células renales son la tomografía computarizada pélvica y abdominal, las pruebas de ultrasonido de los riñones (ultrasonografía), las exploraciones de resonancia magnética, la pielografía intravenosa (PIV) o la angiografía renal. [49] Entre estas principales pruebas diagnósticas, otras pruebas radiológicas como la urografía excretora , la tomografía por emisión de positrones (PET), la ecografía , la arteriografía , la venografía y la gammagrafía ósea también se pueden utilizar para ayudar en la evaluación de la estadificación de las masas renales y para diferenciar los tumores no malignos de los malignos. [ cita requerida ]
Tomografía computarizada
La tomografía computarizada (TC) con contraste se utiliza de forma rutinaria para determinar el estadio del carcinoma de células renales en las regiones abdominal y pélvica . Las tomografías computarizadas tienen el potencial de distinguir masas sólidas de masas quísticas y pueden proporcionar información sobre la localización, el estadio o la propagación del cáncer a otros órganos del paciente. Las partes clave del cuerpo humano que se examinan para detectar la afectación metastásica del carcinoma de células renales pueden incluir la vena renal , el ganglio linfático y la afectación de la vena cava inferior . [50] Según un estudio realizado por Sauk et al., las características de las imágenes de TC con detectores múltiples tienen aplicaciones en el diagnóstico de pacientes con carcinoma de células renales claras al representar las diferencias de estas células a nivel citogénico. [51]
Ultrasonido
El examen ecográfico puede ser útil para evaluar tumores renales asintomáticos cuestionables y lesiones renales quísticas si la tomografía computarizada no es concluyente. Este procedimiento radiológico seguro y no invasivo utiliza ondas sonoras de alta frecuencia para generar una imagen del interior del cuerpo en un monitor de computadora. La imagen generada por la ecografía puede ayudar a diagnosticar el carcinoma de células renales basándose en las diferencias de los reflejos del sonido en la superficie de los órganos y las masas de tejido anormales. Esencialmente, las pruebas de ecografía pueden determinar si la composición de la masa renal es principalmente sólida o está llena de líquido. [49]
Un radiólogo puede realizar una biopsia percutánea mediante ecografía o tomografía computarizada para guiar la toma de muestras del tumor con el fin de realizar un diagnóstico anatomopatológico . Sin embargo, esto no se realiza de manera rutinaria porque cuando están presentes las características de imagen típicas del carcinoma de células renales, la posibilidad de un resultado incorrectamente negativo junto con el riesgo de una complicación médica para el paciente puede hacer que sea desfavorable desde una perspectiva de riesgo-beneficio. [52] Sin embargo, las pruebas de biopsia para el análisis molecular con el fin de distinguir los tumores renales benignos de los malignos son de interés investigativo. [52]
Imágenes por resonancia magnética
Las imágenes por resonancia magnética (IRM) proporcionan una imagen de los tejidos blandos del cuerpo mediante ondas de radio e imanes potentes. La IRM se puede utilizar en lugar de la TC si el paciente presenta alergia al medio de contraste administrado para la prueba. [53] [54] A veces, antes de la IRM, se administra una inyección intravenosa de un material de contraste llamado gadolinio para permitir una imagen más detallada. Los pacientes en diálisis o aquellos que tienen insuficiencia renal deben evitar este material de contraste, ya que puede inducir un efecto secundario raro, pero grave, conocido como fibrosis sistémica nefrogénica. [55] No se realiza de forma rutinaria una gammagrafía ósea o imágenes cerebrales a menos que los signos o síntomas sugieran una posible afectación metastásica de estas áreas. Las IRM también deben considerarse para evaluar la extensión del tumor que ha crecido en los vasos sanguíneos principales, incluida la vena cava , en el abdomen. La IRM se puede utilizar para observar la posible propagación del cáncer al cerebro o la médula espinal si el paciente presenta síntomas que sugieran que este podría ser el caso. [ cita requerida ]
Pielograma intravenoso
La pielografía intravenosa (PIV) es un procedimiento útil para detectar la presencia de masas renales anormales en el tracto urinario . Este procedimiento implica la inyección de un medio de contraste en el brazo del paciente. El medio de contraste viaja desde el torrente sanguíneo hasta los riñones, que con el tiempo pasan a los riñones y la vejiga. Esta prueba no es necesaria si se ha realizado una tomografía computarizada o una resonancia magnética. [56]
Angiografía renal
La angiografía renal utiliza el mismo principio que la PIV, ya que este tipo de rayos X también utiliza un medio de contraste. Esta prueba radiológica es importante para diagnosticar el carcinoma de células renales como ayuda para examinar los vasos sanguíneos en los riñones. Esta prueba diagnóstica se basa en el agente de contraste que se inyecta en la arteria renal para que sea absorbido por las células cancerosas. [57] El medio de contraste proporciona un contorno más claro de los vasos sanguíneos con orientación anormal que se cree que están involucrados con el tumor. Esto es imperativo para los cirujanos ya que permite mapear los vasos sanguíneos del paciente antes de la operación. [50]
Puesta en escena
La estadificación del carcinoma de células renales es el factor más importante para predecir su pronóstico. [58] La estadificación puede seguir el sistema de estadificación TNM , donde el tamaño y la extensión del tumor (T), la afectación de los ganglios linfáticos (N) y las metástasis (M) se clasifican por separado. Además, puede utilizar la agrupación general de estadios en estadios I a IV, con la revisión de 1997 del AJCC que se describe a continuación: [58]
| Etapa I | Tumor de un diámetro de 7 cm (aproximadamente 2 3⁄4 pulgadas) o menor, limitado al riñón. Sin afectación de ganglios linfáticos ni metástasis a órganos distantes. |
| Estadio II | Tumor mayor de 7,0 cm pero limitado al riñón. No hay afectación de ganglios linfáticos ni metástasis a órganos distantes. |
| Estadio III cualquiera de los siguientes | Tumor de cualquier tamaño que afecta un ganglio linfático cercano pero sin metástasis a órganos distantes. El tumor de esta etapa puede propagarse o no al tejido graso que rodea el riñón, o a las venas grandes que van del riñón al corazón. |
| Tumor con diseminación al tejido graso alrededor del riñón y/o diseminación a las venas grandes que van del riñón al corazón, pero sin diseminación a ningún ganglio linfático ni a otros órganos. | |
| Estadio IV cualquiera de los siguientes | Tumor que se ha propagado directamente a través del tejido graso y del tejido ligamentoso fascial que rodea el riñón. |
| Afectación de más de un ganglio linfático cerca del riñón | |
| Afectación de cualquier ganglio linfático que no esté cerca del riñón. | |
| Metástasis a distancia, como en los pulmones, los huesos o el cerebro. |
En el momento del diagnóstico, el 30% de los carcinomas de células renales se han diseminado a la vena renal ipsilateral y entre el 5 y el 10% han continuado hacia la vena cava inferior. [59]
Histopatología
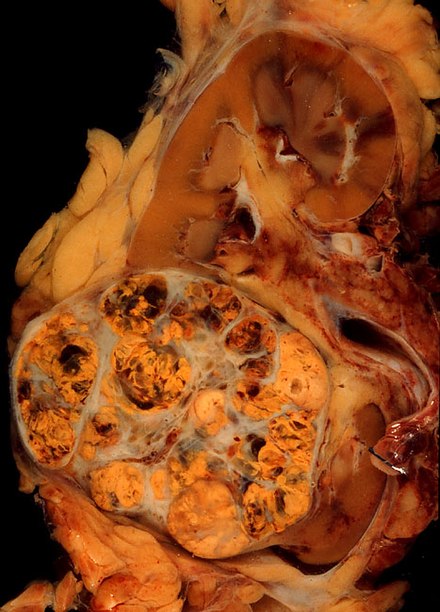

El aspecto macroscópico y microscópico de los carcinomas de células renales es muy variable. El carcinoma de células renales puede presentar áreas enrojecidas donde los vasos sanguíneos han sangrado y quistes que contienen líquidos acuosos. [60] El cuerpo del tumor muestra grandes vasos sanguíneos que tienen paredes compuestas de células cancerosas. El examen macroscópico a menudo muestra un tumor multilobulado amarillento en la corteza renal , que frecuentemente contiene zonas de necrosis , hemorragia y cicatrización . En un contexto microscópico, hay cuatro subtipos histológicos principales de cáncer de células renales: células claras (RCC convencional, 75%), papilar (15%), cromófobo (5%) y conducto colector (2%). Los cambios sarcomatoides (morfología y patrones de IHC que imitan al sarcoma, células fusiformes) se pueden observar dentro de cualquier subtipo de RCC y se asocian con un curso clínico más agresivo y un peor pronóstico. Al microscopio óptico, estas células tumorales pueden presentar papilas , túbulos o nidos y son bastante grandes, atípicas y poligonales. [ cita requerida ]
Estudios recientes han llamado la atención sobre la estrecha asociación del tipo de células cancerosas con la agresividad de la enfermedad. Algunos estudios sugieren que estas células cancerosas acumulan glucógeno y lípidos, su citoplasma aparece "transparente", los núcleos permanecen en el medio de las células y la membrana celular es evidente. [61] Algunas células pueden ser más pequeñas, con citoplasma eosinófilo, asemejándose a las células tubulares normales. El estroma está reducido, pero bien vascularizado. El tumor comprime el parénquima circundante , produciendo una pseudocápsula. [62]
El tipo celular más común que se presenta en el carcinoma de células renales es el de células claras , que recibe su nombre por la disolución del alto contenido lipídico de las células en el citoplasma. Se cree que las células claras son las que tienen menos probabilidades de propagarse y suelen responder de forma más favorable al tratamiento. Sin embargo, la mayoría de los tumores contienen una mezcla de células. Se cree que la etapa más agresiva del cáncer renal es aquella en la que el tumor es mixto, y contiene tanto células claras como granulares. [63]
El sistema de clasificación histológica recomendado para el carcinoma renal es el sistema Fuhrman (1982), que es una evaluación basada en la morfología microscópica de una neoplasia con hematoxilina y eosina (tinción H&E). Este sistema clasifica el carcinoma de células renales en grados 1, 2, 3 y 4 según las características nucleares. Los detalles del sistema de clasificación Fuhrman para el carcinoma renal se muestran a continuación: [64]
| Nivel de grado | Características nucleares |
|---|---|
| Grado I | Los núcleos aparecen redondos y uniformes, de 10 μm; los nucléolos son discretos o están ausentes. |
| Grado II | Los núcleos tienen un aspecto irregular con signos de formación de lóbulos, 15 μm; los nucléolos son evidentes. |
| Grado III | Los núcleos parecen muy irregulares, 20 μm; los nucléolos son grandes y prominentes. |
| Grado IV | Los núcleos parecen extraños y multilobulados, de 20 μm o más; los nucléolos son prominentes. |
Se cree que el grado nuclear es uno de los factores pronósticos más importantes en pacientes con carcinoma de células renales. [26] Sin embargo, un estudio de Delahunt et al. (2007) ha demostrado que la clasificación de Fuhrman es ideal para el carcinoma de células claras, pero puede no ser apropiada para los carcinomas de células renales cromófobos y que la estadificación del cáncer (realizada mediante tomografía computarizada) es un predictor más favorable del pronóstico de esta enfermedad. [65] En relación con la estadificación del cáncer renal, el sistema de clasificación de Heidelberg de tumores renales se introdujo en 1976 como un medio para correlacionar de forma más completa las características histopatológicas con los defectos genéticos identificados. [66]
Prevención
El riesgo de carcinoma de células renales se puede reducir manteniendo un peso corporal normal. [67]
Gestión

El tipo de tratamiento depende de múltiples factores y del individuo, algunos de los cuales incluyen el estadio del carcinoma de células renales (órganos y partes del cuerpo afectados/no afectados), el tipo de carcinoma de células renales, las condiciones preexistentes o comórbidas y la salud general y la edad de la persona. [10] [68] Cada forma de tratamiento tiene riesgos y beneficios; un profesional de la salud brindará las mejores opciones que se adapten a las circunstancias individuales.
Si se ha propagado fuera de los riñones, a menudo a los ganglios linfáticos , los pulmones o la vena principal del riñón, se utilizan múltiples terapias, incluidas la cirugía y los medicamentos. El CCR es resistente a la quimioterapia y la radioterapia en la mayoría de los casos, pero responde bien a la inmunoterapia con interleucina-2 o interferón alfa, a los fármacos biológicos o a la terapia dirigida. En los casos en etapa temprana, la crioterapia y la cirugía son las opciones preferidas.
Vigilancia activa
La vigilancia activa o "espera vigilante" se está volviendo más común a medida que se detectan pequeñas masas renales o tumores y también entre las generaciones mayores cuando la cirugía no siempre es adecuada. [69] La vigilancia activa implica completar varios procedimientos de diagnóstico, pruebas y diagnóstico por imágenes para monitorear la progresión del CCR antes de embarcarse en una opción de tratamiento de mayor riesgo como la cirugía. [69] En los ancianos, los pacientes con comorbilidades y en los malos candidatos quirúrgicos, esto es especialmente útil.
Cirugía
Dependiendo de las circunstancias, pueden resultar más apropiados distintos procedimientos.
El tratamiento recomendado para el cáncer de células renales puede ser la nefrectomía o la nefrectomía parcial , la extirpación quirúrgica de todo o parte del riñón. [4] Esto puede incluir algunos de los órganos o tejidos circundantes o ganglios linfáticos. Si el cáncer está solo en los riñones, lo que ocurre en aproximadamente el 60 % de los casos, se puede curar aproximadamente el 90 % de las veces con cirugía .
Los tumores renales pequeños (< 4 cm) se tratan cada vez más mediante nefrectomía parcial cuando es posible. [70] [71] [72] La mayoría de estas pequeñas masas renales manifiestan un comportamiento biológico indolente con un pronóstico excelente. [73] La nefrectomía parcial con conservación de nefronas se utiliza cuando el tumor es pequeño (menos de 4 cm de diámetro) o cuando el paciente tiene otros problemas médicos como diabetes o hipertensión . [10] La nefrectomía parcial implica la extirpación del tejido afectado únicamente, preservando el resto del riñón, la fascia de Gerota y los ganglios linfáticos regionales. Esto permite una mayor preservación renal en comparación con la nefrectomía radical, y puede tener beneficios positivos para la salud a largo plazo. [74] Los tumores más grandes y complejos también pueden tratarse con nefrectomía parcial por cirujanos con mucha experiencia en cirugía renal. [75]
La nefrectomía quirúrgica puede ser "radical" si el procedimiento extirpa todo el riñón afectado, incluida la fascia de Gerota , la glándula suprarrenal que está del mismo lado que el riñón afectado y los ganglios linfáticos retroperitoneales regionales, todo al mismo tiempo. [10] Este método, aunque severo, es efectivo. Pero no siempre es apropiado, ya que es una cirugía mayor que contiene el riesgo de complicaciones tanto durante como después de la cirugía y puede tener un tiempo de recuperación más largo. [76] Es importante tener en cuenta que el otro riñón debe ser completamente funcional, y esta técnica se utiliza con mayor frecuencia cuando hay un tumor grande presente en un solo riñón.

En los casos en que el tumor se ha diseminado a la vena renal, la vena cava inferior y posiblemente la aurícula derecha, esta porción del tumor también se puede extirpar quirúrgicamente. Cuando el tumor afecta la vena cava inferior, es importante clasificar qué partes de la vena cava están involucradas y planificar en consecuencia, ya que a veces la resección completa implicará una incisión en el tórax con mayor morbilidad. Por esta razón, el Dr. Gaetano Ciancio adaptó las técnicas de movilización hepática del trasplante de hígado para abordar el trombo retrohepático o incluso suprahepático de la vena cava inferior asociado con tumores renales. [77] Con esta técnica, se puede movilizar toda la vena cava inferior abdominal. Esto facilita el ordeño del tumor por debajo de las venas hepáticas principales con los dedos del cirujano, evitando la necesidad de una incisión toracoabdominal o una derivación cardiopulmonar . [78] En casos de metástasis conocidas, la resección quirúrgica del riñón ("nefrectomía citorreductora") puede mejorar la supervivencia, [79] así como la resección de una lesión metastásica solitaria. A veces se embolizan los riñones antes de la cirugía para minimizar la pérdida de sangre. [80]
La cirugía se realiza cada vez más mediante técnicas laparoscópicas . Comúnmente conocida como cirugía de orificio de llave, esta cirugía no tiene las grandes incisiones que se ven en una nefrectomía radical o parcial realizada clásicamente, pero aún así extirpa con éxito todo o parte del riñón. La cirugía laparoscópica se asocia con estadías más cortas en el hospital y un tiempo de recuperación más rápido, pero aún existen riesgos asociados con el procedimiento quirúrgico. Estos tienen la ventaja de ser una carga menor para el paciente y la supervivencia libre de enfermedad es comparable a la de la cirugía abierta. [4] Para lesiones exofíticas pequeñas que no involucran extensamente los vasos principales o el sistema colector urinario, se puede realizar una nefrectomía parcial (también conocida como "cirugía de conservación de nefronas"). Esto puede implicar detener temporalmente el flujo sanguíneo al riñón mientras se elimina la masa, así como enfriar el riñón con un granizado de hielo. También se puede administrar manitol para ayudar a limitar el daño al riñón. Esto generalmente se realiza a través de una incisión abierta, aunque las lesiones más pequeñas se pueden realizar por laparoscopia con o sin asistencia robótica.
La crioterapia laparoscópica también se puede realizar en lesiones más pequeñas. Normalmente se toma una biopsia en el momento del tratamiento. Se puede utilizar una ecografía intraoperatoria para ayudar a guiar la colocación de las sondas de congelación. Luego se realizan dos ciclos de congelación/descongelación para matar las células tumorales. Como el tumor no se extirpa, el seguimiento es más complicado (ver a continuación) y las tasas generales de ausencia de enfermedad no son tan buenas como las que se obtienen con la extirpación quirúrgica.
Cirugía para la enfermedad metastásica: si hay enfermedad metastásica, el tratamiento quirúrgico puede ser una opción viable. También se puede realizar una nefrectomía radical y parcial y, en algunos casos, si la metástasis es pequeña, también se puede extirpar quirúrgicamente. [10] Esto depende de la etapa de crecimiento y de lo lejos que se haya propagado la enfermedad.
Terapias ablativas percutáneas
Las terapias de ablación percutánea utilizan la guía de imágenes por parte de radiólogos para tratar tumores localizados cuando un procedimiento quirúrgico no es una buena opción. Aunque el uso de técnicas quirúrgicas laparoscópicas para nefrectomías completas ha reducido algunos de los riesgos asociados con la cirugía, [81] la cirugía de cualquier tipo en algunos casos aún no será factible. Por ejemplo, en los ancianos, las personas que ya tienen disfunción renal grave o las personas que tienen varias comorbilidades , no se justifica la cirugía de ningún tipo. [82]
Se coloca una sonda a través de la piel hasta el tumor utilizando imágenes en tiempo real tanto de la punta de la sonda como del tumor mediante tomografía computarizada , ecografía o incluso resonancia magnética , y luego se destruye el tumor con calor ( ablación por radiofrecuencia ) o frío ( crioterapia ). Estas modalidades tienen una desventaja en comparación con la cirugía tradicional en que no es posible la confirmación patológica de la destrucción completa del tumor. Por lo tanto, el seguimiento a largo plazo es crucial para evaluar la integridad de la ablación del tumor. [83] [84] Idealmente, la ablación percutánea se limita a tumores menores de 3,5 cm y para guiar el tratamiento. Sin embargo, hay algunos casos en los que la ablación se puede utilizar en tumores más grandes. [82]
Los dos tipos principales de técnicas de ablación que se utilizan para el carcinoma de células renales son la ablación por radiofrecuencia y la crioablación . [82]
La ablación por radiofrecuencia utiliza una sonda de electrodos que se inserta en el tejido afectado para enviar radiofrecuencias al tejido y generar calor mediante la fricción de las moléculas de agua. El calor destruye el tejido tumoral. [10] La muerte celular generalmente se produce en cuestión de minutos después de la exposición a temperaturas superiores a 50 °C.
La crioablación también implica la inserción de una sonda en el área afectada, [10] sin embargo, se utiliza frío para matar el tumor en lugar de calor. La sonda se enfría con fluidos químicos que son muy fríos. Las temperaturas de congelación hacen que las células tumorales mueran al causar deshidratación osmótica , que extrae el agua de la célula destruyendo la enzima , los orgánulos , la membrana celular y congelando el citoplasma . [82]
Medicamentos dirigidos
Los cánceres a menudo crecen de manera desenfrenada porque son capaces de evadir el sistema inmunológico. [9] La inmunoterapia es un método que activa el sistema inmunológico de la persona y lo utiliza para su propio beneficio. [9] Se desarrolló después de observar que en algunos casos había regresión espontánea. [85] La inmunoterapia capitaliza este fenómeno y tiene como objetivo desarrollar la respuesta inmunológica de una persona a las células cancerosas. [85] Otros medicamentos de terapia dirigida inhiben los factores de crecimiento que se ha demostrado que promueven el crecimiento y la propagación de los tumores. [86] [87] La mayoría de estos medicamentos fueron aprobados en los últimos diez años. [88] Estos tratamientos son: [89]
- Nivolumab [90]
- Axitinib [91]
- Sunitinib [92]
- Cabozantinib [90]
- Everolimus
- Lenvatinib
- Pazopanib
- Bevacizumab
- Sorafenib
- Tivozanib
- Temsirolimus [93]
- La interleucina-2 (IL-2) ha producido "remisiones duraderas" en un pequeño número de pacientes, pero con una toxicidad sustancial. [94]
- Interferón-α
En el caso de los pacientes con cáncer metastásico, el sunitinib probablemente provoque una mayor progresión del cáncer que el pembrolizumab, el axitinib y el avelumab. [95] En comparación con el pembrolizumab y el axitinib, probablemente provoque más muertes, pero puede reducir ligeramente los efectos no deseados graves. [95] En comparación con las combinaciones de inmunoterapia (nivolumab e ipilimumab), el sunitinib puede provocar una mayor progresión y efectos graves. [95] Puede haber poca o ninguna diferencia en la progresión, la supervivencia y los efectos graves entre el pazopanib y el sunitinib. [95]
También se ha informado de actividad para ipilimumab [96], pero no es un medicamento aprobado para el cáncer renal. [97]
Se espera que haya más medicamentos disponibles en un futuro cercano, ya que actualmente se están realizando varios ensayos clínicos para nuevos tratamientos dirigidos, [98] incluidos: atezolizumab , varlilumab , durvalumab , avelumab , LAG525 , MBG453, TRC105 y savolitinib .
Quimioterapia
La quimioterapia y la radioterapia no son tan exitosas en el caso del CCR. El CCR es resistente en la mayoría de los casos, pero la tasa de éxito es de alrededor del 4-5 %, aunque suele ser de corta duración y más adelante se desarrollan más tumores y tumores. [10]
Terapia adyuvante y neoadyuvante
Durante mucho tiempo no se había demostrado que la terapia adyuvante , que se refiere a la terapia administrada después de una cirugía primaria, fuera beneficiosa en el cáncer de células renales. [99] Sin embargo, en 2021, se aprobó el pembrolizumab para el tratamiento adyuvante después de mostrar mejoras prometedoras en la supervivencia libre de enfermedad. [100]
Por el contrario, la terapia neoadyuvante se administra antes del tratamiento primario o principal previsto. En algunos casos, se ha demostrado que la terapia neoadyuvante reduce el tamaño y el estadio del CCR para luego permitir su extirpación quirúrgica. [87] Esta es una nueva forma de tratamiento y la eficacia de este enfoque aún se está evaluando en ensayos clínicos .
Metástasis
El carcinoma de células renales metastásico (mRCC) es la propagación del carcinoma de células renales primario desde el riñón a otros órganos. Aproximadamente entre el 25 y el 30 % de las personas presentan esta propagación metastásica en el momento en que se les diagnostica carcinoma de células renales. [101] Esta alta proporción se explica por el hecho de que los signos clínicos son generalmente leves hasta que la enfermedad progresa a un estado más grave. [102] Los sitios más comunes de metástasis son los ganglios linfáticos, el pulmón, los huesos, el hígado y el cerebro. [12] En las secciones "Diagnóstico" y "Pronóstico" se analiza cómo esta propagación afecta la estadificación de la enfermedad y, por lo tanto, el pronóstico.
El CCMR tiene un pronóstico malo en comparación con otros tipos de cáncer, aunque los tiempos de supervivencia promedio han aumentado en los últimos años debido a los avances en el tratamiento. En 2008, el tiempo de supervivencia promedio para la forma metastásica de la enfermedad era inferior a un año [103] y en 2013 mejoró hasta un promedio de 22 meses [104] . A pesar de esta mejora, la tasa de supervivencia a cinco años para el CCMR sigue siendo inferior al 10 % [105] y entre el 20 y el 25 % de los pacientes no responden a ningún tratamiento y, en estos casos, la enfermedad tiene una progresión rápida [104] .
Los tratamientos disponibles para el CCR que se analizan en la sección "Tratamiento" también son relevantes para la forma metastásica de la enfermedad. Las opciones incluyen la interleucina-2, que es una terapia estándar para el carcinoma de células renales avanzado. [99] De 2007 a 2013, se aprobaron siete nuevos tratamientos específicamente para el CCRm (sunitinib, temsirolimus, bevacizumab, sorafenib, everolimus, pazopanib y axitinib). [8] Estos nuevos tratamientos se basan en el hecho de que los carcinomas de células renales son tumores muy vasculares: contienen una gran cantidad de vasos sanguíneos. Los medicamentos tienen como objetivo inhibir el crecimiento de nuevos vasos sanguíneos en los tumores, lo que ralentiza el crecimiento y, en algunos casos, reduce el tamaño de los tumores. [106] Lamentablemente, los efectos secundarios son bastante comunes con estos tratamientos e incluyen: [107]
- Efectos gastrointestinales: náuseas, vómitos, diarrea, anorexia.
- Efectos respiratorios: tos, disnea (dificultad para respirar)
- Efectos cardiovasculares: hipertensión (presión arterial alta)
- Efectos neurológicos: hemorragia intracraneal (sangrado en el cerebro), trombosis (coágulos de sangre) en el cerebro.
- Efectos sobre la piel y las mucosas: erupciones cutáneas, síndrome mano-pie , estomatitis.
- Supresión de la médula ósea: resulta en una reducción de glóbulos blancos, lo que aumenta el riesgo de infecciones, además de anemia y reducción de plaquetas.
- Efectos renales: deterioro de la función renal
- Fatiga
La radioterapia y la quimioterapia se utilizan con mayor frecuencia en la forma metastásica del CCR para atacar los tumores secundarios en los huesos, el hígado, el cerebro y otros órganos. Si bien no son curativos, estos tratamientos brindan alivio para los síntomas asociados con la propagación de los tumores. [104]
Pronóstico
El pronóstico está influenciado por varios factores, entre ellos el tamaño del tumor, el grado de invasión y metástasis, el tipo histológico y el grado nuclear. [26] La estadificación es el factor más importante en el resultado del cáncer de células renales. Las siguientes cifras se basan en pacientes diagnosticados por primera vez en 2001 y 2002 por la Base de Datos Nacional del Cáncer: [108]
| Escenario | Descripción | Tasa de supervivencia a 5 años |
|---|---|---|
| I | Confinado al riñón | 81% |
| II | Se extienden a través de la cápsula renal, confinada a la fascia de Gerota. | 74% |
| III | Incluye la vena renal o los ganglios linfáticos hiliares. | 53% |
| IV | Incluye tumores que son invasivos a órganos adyacentes (excepto las glándulas suprarrenales) o metástasis a distancia. | 8% |
Un estudio coreano estimó una tasa de supervivencia global a cinco años específica de la enfermedad del 85%. [109] En conjunto, si la enfermedad se limita al riñón, solo el 20-30% desarrolla enfermedad metastásica después de la nefrectomía. [110] Los subconjuntos más específicos muestran una tasa de supervivencia a cinco años de alrededor del 90-95% para tumores de menos de 4 cm. Para tumores más grandes confinados al riñón sin invasión venosa, la supervivencia sigue siendo relativamente buena, del 80-85%. [ cita requerida ] Para tumores que se extienden a través de la cápsula renal y fuera de las inversiones fasciales locales , la capacidad de supervivencia se reduce a cerca del 60%. [ cita requerida ] Factores como la salud y el estado físico general o la gravedad de sus síntomas afectan las tasas de supervivencia. Por ejemplo, las personas más jóvenes (entre 20 y 40 años) tienen un mejor pronóstico a pesar de tener más síntomas en la presentación, posiblemente debido a tasas más bajas de propagación del cáncer a los ganglios linfáticos (estadio III).
El grado histológico está relacionado con la agresividad del cáncer y se clasifica en 4 grados, siendo 1 el de mejor pronóstico (supervivencia a cinco años superior al 89%) y 4 el de peor pronóstico (46% de supervivencia a cinco años).
En algunas personas, el cáncer de células renales se detecta antes de que presenten síntomas (de manera incidental) gracias a una tomografía computarizada ( TC ) o una ecografía . El cáncer de células renales diagnosticado de manera incidental (sin síntomas) tiene un pronóstico diferente al de aquellos diagnosticados después de presentar síntomas de carcinoma de células renales o metástasis. La tasa de supervivencia a cinco años fue mayor para los tumores incidentales que para los sintomáticos: 85,3% frente a 62,5%. Las lesiones incidentales fueron significativamente de estadio inferior a las que causan síntomas, ya que el 62,1% de los pacientes con carcinoma de células renales incidental se observaron con lesiones de estadio I, frente al 23% que se encontraron con carcinoma de células renales sintomático. [111]
Si se ha producido metástasis en los ganglios linfáticos, la supervivencia a cinco años es de alrededor del 5% al 15%. En el caso del carcinoma de células renales metastásico, los factores que pueden presentar un mal pronóstico incluyen una puntuación baja en el estado funcional de Karnofsky (una forma estándar de medir el deterioro funcional en pacientes con cáncer), un nivel bajo de hemoglobina , un nivel alto de lactato deshidrogenasa sérica y un nivel alto corregido de calcio sérico. [112] [113] En los casos no metastásicos, se puede utilizar el algoritmo de puntuación de Leibovich para predecir la progresión de la enfermedad posoperatoria. [114]
El carcinoma de células renales es uno de los cánceres más fuertemente asociados con los síndromes paraneoplásicos , con mayor frecuencia debido a la producción ectópica de hormonas por parte del tumor. El tratamiento para estas complicaciones del CCR generalmente se limita a tratar el cáncer subyacente.
Epidemiología
La incidencia de la enfermedad varía según factores geográficos, demográficos y, en menor medida, hereditarios. Existen algunos factores de riesgo conocidos, pero la importancia de otros factores de riesgo potenciales sigue siendo más controvertida. La incidencia del cáncer ha ido aumentando en frecuencia en todo el mundo a un ritmo de aproximadamente el 2-3% por década [103] hasta los últimos años, cuando el número de casos nuevos se ha estabilizado. [18]
La incidencia del CCR varía según el sexo, la edad, la raza y la ubicación geográfica en todo el mundo. Los hombres tienen una incidencia mayor que las mujeres (aproximadamente 1,6:1) [99] y la gran mayoría son diagnosticados después de los 65 años de edad. [99] Se informa que los asiáticos tienen una incidencia significativamente menor de CCR que los blancos y, si bien los países africanos tienen las incidencias informadas más bajas, los afroamericanos tienen la incidencia más alta de la población en los Estados Unidos. [18] Los países desarrollados tienen una incidencia más alta que los países en desarrollo, y las tasas más altas se encuentran en América del Norte, Europa y Australia/Nueva Zelanda. [115]
Historia
Daniel Sennert hizo la primera referencia que sugiere un tumor que surge en el riñón en su texto Practicae Medicinae , publicado por primera vez en 1613. [116]
Miril publicó el primer caso inequívoco de carcinoma renal en 1810. [117] Describió el caso de Françoise Levelly, una mujer de 35 años, que se presentó en el Hospital Cívico de Brest el 6 de abril de 1809, supuestamente en las últimas etapas del embarazo. [116]
Koenig publicó la primera clasificación de tumores renales basada en la morfología macroscópica en 1826. Koenig dividió los tumores en formas escirrosas, esteatomatosas, fungoides y medulares. [118]
La controversia sobre el hipernefroma
Tras la clasificación del tumor, los investigadores intentaron identificar el tejido de origen del carcinoma renal.
La patogenia de los tumores epiteliales renales fue debatida durante décadas. El debate fue iniciado por Paul Grawitz cuando en 1883 publicó sus observaciones sobre la morfología de tumores renales pequeños y amarillos . Grawitz concluyó que sólo los tumores alveolares eran de origen suprarrenal , mientras que los tumores papilares se derivaban del tejido renal . [116]
En 1893, Paul Sudeck desafió la teoría postulada por Grawitz al publicar descripciones de tumores renales en las que identificó características atípicas dentro de los túbulos renales y notó una gradación de estas características atípicas entre los túbulos y el tumor maligno vecino . En 1894, Otto Lubarsch , quien apoyó la teoría postulada por Grawitz, acuñó el término tumor hipernefroide , que fue modificado a hipernefroma por Felix Victor Birch-Hirschfeld para describir estos tumores. [119]
Oskar Stoerk criticó duramente a Grawitz en 1908, al considerar que el origen suprarrenal de los tumores renales no estaba demostrado. A pesar de los argumentos convincentes en contra de la teoría postulada por Grawitz, el término hipernefroma, con su connotación suprarrenal asociada, persistió en la literatura. [116]
Foot y Humphreys, y Foote et al. introdujeron el término carcinoma de células renales para enfatizar el origen tubular renal de estos tumores . Su designación fue ligeramente modificada por Fetter al término ahora ampliamente aceptado carcinoma de células renales . [120]
En 1959, Oberling et al. ofrecieron pruebas convincentes para resolver el debate al estudiar la ultraestructura de células claras de ocho carcinomas renales . Descubrieron que el citoplasma de las células tumorales contenía numerosas mitocondrias y depósitos de glucógeno y grasa. Identificaron membranas citoplasmáticas insertadas perpendicularmente sobre la membrana basal con células ocasionales que contenían microvellosidades a lo largo de los bordes libres. Concluyeron que estas características indicaban que los tumores surgían de las células epiteliales del túbulo contorneado renal , resolviendo así finalmente una de las cuestiones más debatidas en la patología tumoral . [116] [121]
Véase también
- Disuria
- Interferón
- Interleucina-2
- Cáncer de riñón
- Hipótesis de Knudson [122]
- Rapamicina
- Síndrome de Stauffer
- Vinblastina
- Mimetismo vasculogénico
Referencias
- ^ abcdefg Curti, B; Jana, BRP; Javeed, M; Makhoul, I; Sachdeva, K; Hu, W; Perry, M; Talavera, F (26 de febrero de 2014). Harris, JE (ed.). "Carcinoma de células renales". Referencia de Medscape . WebMD. Archivado desde el original el 7 de marzo de 2014. Consultado el 7 de marzo de 2014 .
- ^ Directrices de la EAU: carcinoma de células renales: actualización limitada de marzo de 2023 (PDF) . Asociación Europea de Urología . 2023. ISBN 978-94-92671-19-6.
- ^ Znaor A, Lortet-Tieulent J, Laversanne M, Jemal A, Bray F (marzo de 2015). "Variaciones y tendencias internacionales en la incidencia y mortalidad del carcinoma de células renales". Urología europea . 67 (3): 519–30. doi :10.1016/j.eururo.2014.10.002. PMID 25449206.
- ^ abc Rini BI, Rathmell WK, Godley P (2008). "Carcinoma de células renales". Curr Opin Oncol . 20 (3): 300–6. doi :10.1097/CCO.0b013e3282f9782b. PMID 18391630.
- ^ "Cáncer de riñón". nhs.uk . 2017-10-23. Archivado desde el original el 3 de octubre de 2017 . Consultado el 19 de marzo de 2018 .
- ^ Fausto, V; Abbas, A; Fausto, N (2004). Robbins y Cotran Pathologic Basis of disease (7.ª ed.). Filadelfia, PA: Elsevier/Saunders. ISBN 978-0721601878.
- ^ abc Master, VA (noviembre de 2013). «Carcinoma de células renales». Manual Profesional Merck . Merck Sharp & Dohme Corp. Archivado desde el original el 7 de marzo de 2014. Consultado el 7 de marzo de 2014 .
- ^ ab Singer, Eric A.; Gupta, Gopal N.; Marchalik, Daniel; Srinivasan, Ramaprasad (2013). "Evolución de dianas terapéuticas en el carcinoma de células renales". Current Opinion in Oncology . 25 (3): 273–80. doi :10.1097/CCO.0b013e32835fc857. PMID 23455028. S2CID 11526724.
- ^ abc Syn, Nicholas L; Teng, Michele WL; Mok, Tony SK; Soo, Ross A (2017). "Resistencia de novo y adquirida a la focalización de puntos de control inmunitario". The Lancet Oncology . 18 (12): e731–e741. doi :10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ abcdefghijklm Cohen, Herbert T.; McGovern, Francis J. (2005). "Carcinoma de células renales". New England Journal of Medicine . 353 (23): 2477–90. doi :10.1056/NEJMra043172. PMID 16339096.
- ^ Almdalal, Tarik; Sundqvist, Pernilla; Harmenberg, Ulrika; Hellstrom, Mikael; Lindskog, Magnus; Lindblad, Per; Lundstam, Svan; Ljungberg, Börje (1 de mayo de 2022). "El carcinoma clínico de células renales T1a, no siempre es una enfermedad inofensiva: un estudio de registro nacional". Ciencia abierta de urología europea . 39 : 22-28. doi :10.1016/j.euros.2022.03.005. ISSN 2666-1683. PMC 9068725 . PMID 35528783.
- ^ abcd Motzer, Robert J.; Bander, Neil H.; Nanus, David M. (1996). "Carcinoma de células renales". New England Journal of Medicine . 335 (12): 865–75. doi :10.1056/NEJM199609193351207. PMID 8778606.
- ^ abc Kim, Hyung L.; Belldegrun, Arie S.; Freitas, Danielo G.; Bui, Matthew HT; Han, KEN-RYU; Dorey, Frederick J.; Figlin, Robert A. (2003). "Signos y síntomas paraneoplásicos del carcinoma de células renales: implicaciones para el pronóstico". Revista de Urología . 170 (5): 1742–6. doi :10.1097/01.ju.0000092764.81308.6a. PMID 14532767.
- ^ Birkhauser; Kroeger, Pantuck (2013). "Etiología del carcinoma de células renales: incidencia, demografía y factores ambientales". Manejo clínico del carcinoma de células renales . Humana Pr Inc. págs. 3–22. ISBN 978-1-62703-061-8.
- ^ Lane, Brian R. (2013). "Factores pronósticos del carcinoma de células renales localizado". Carcinoma de células renales . págs. 83–102. doi :10.1007/978-1-62703-062-5_5. ISBN 978-1-62703-061-8.
- ^ Metz; Davis (2013). "Cuidado paliativo y de apoyo para el cáncer renal". Tratamiento clínico del carcinoma de células renales . Humana. págs. 339–348. ISBN 978-1-62703-061-8.
- ^ Häggström, Christel; Rapp, Kilian; Acciones, Tanja; Manjer, Jonás; Bjørge, Tono; Ulmer, Hanón; Inglaterra, Anders; Almqvist, Martín; Concín, Hans; Selmer, R; Ljungberg, B; Tretli, S; Nagel, G; Hallmans, G; Jonsson, H; Stattin, P (2013). Miller, Todd W (ed.). "Factores metabólicos asociados con el riesgo de carcinoma de células renales". MÁS UNO . 8 (2): e57475. Código Bib : 2013PLoSO...857475H. doi : 10.1371/journal.pone.0057475 . PMC 3585341 . PMID 23468995.
- ^ abc Ljungberg, Börje; Campbell, Steven C.; Choi, Han Yong; Jacqmin, Didier; Lee, Jung Eun; Weikert, Steffen; Kiemeney, Lambertus A. (2011). "La epidemiología del carcinoma de células renales". Urología europea . 60 (4): 615–21. doi :10.1016/j.eururo.2011.06.049. PMID 21741761.
- ^ Dhôte, R.; Pellicer-Coeuret, M.; Thiounn, N.; Debré, B.; Vidal-Trecan, G. (2007). "Factores de riesgo del carcinoma de células renales en adultos: una revisión sistemática e implicaciones para la prevención". BJU International . 86 (1): 20–7. doi :10.1046/j.1464-410x.2000.00708.x. PMID 10886077. S2CID 21271953.
- ^ Boffetta, P.; Fontana, L.; Stewart, P.; Zaridze, D.; Szeszenia-Dabrowska, N.; Janout, V.; Bencko, V.; Foretova, L.; Jinga, V.; Matveev, V.; Kollarova, H.; Ferro, G.; Chow, W.-H.; Rothman, N.; Van Bemmel, D.; Karami, S.; Brennan, P.; Moore, LE (2011). "Exposición ocupacional a arsénico, cadmio, cromo, plomo y níquel, y carcinoma de células renales: un estudio de casos y controles de Europa central y oriental". Medicina ocupacional y ambiental . 68 (10): 723–8. doi :10.1136/oem.2010.056341. hdl : 11585/682305 . Número de modelo: PMID 21217163. Número de modelo: S2CID 29328889.
- ^ Cho, Eunyoung; Curhan, G; Hankinson, SE; Kantoff, P; Atkins, MB; Stampfer, M; Choueiri, TK (2011). "Evaluación prospectiva del uso de analgésicos y el riesgo de cáncer de células renales". Archivos de Medicina Interna . 171 (16): 1487–93. doi :10.1001/archinternmed.2011.356. PMC 3691864 . PMID 21911634.
- ^ Zucchetto, Antonella; Talamini, Renato; Dal Masó, Luigino; Negri, Eva; Polesel, Jerry; Ramazzotti, Valerio; Montella, Mauricio; Canzonieri, Vincenzo; Serraino, Diego; La Vecchia, Carlo; Franceschi, Silvia (2008). "Factores reproductivos, menstruales y otros factores relacionados con las hormonas y riesgo de cáncer de células renales". Revista Internacional de Cáncer . 123 (9): 2213–6. doi : 10.1002/ijc.23750 . PMID 18711701.
- ^ Bellocco, R.; Pasquali, E.; Rota, M.; Bagnardi, V.; Tramacere, I.; Scotti, L.; Pelucchi, C.; Boffetta, P.; Corrao, G. (1 de septiembre de 2012). "Consumo de alcohol y riesgo de carcinoma de células renales: resultados de un metanálisis". Anales de Oncología . 23 (9): 2235–2244. doi : 10.1093/annonc/mds022 . ISSN 1569-8041. PMID 22398178.
- ^ Lipworth, L; Tarone, RE; Lund, L; McLaughlin, JK (2009). "Características epidemiológicas y factores de riesgo del cáncer de células renales". Epidemiología clínica . 1 : 33–43. doi : 10.2147/clep.s4759 . PMC 2943168 . PMID 20865085.
- ^ Pavlovich, Christian P.; Schmidt, Laura S. (2004). "Búsqueda de las causas hereditarias del carcinoma de células renales". Nature Reviews Cancer . 4 (5): 381–93. doi :10.1038/nrc1364. PMID 15122209. S2CID 17905393.
- ^ abcdef Rini, Brian I; Campbell, Steven C; Escudier, Bernard (2009). "Carcinoma de células renales". The Lancet . 373 (9669): 1119–1132. doi :10.1016/S0140-6736(09)60229-4. PMID 19269025. S2CID 24535138.
- ^ Baldewijns, Marcella ML; Van Vlodrop, Iris JH; Schouten, Leo J.; Soetekouw, Patricia MMB; De Bruïne, Adriaan P.; Van England, Manon (2008). "Genética y epigenética del cáncer de células renales". Biochimica et Biophysica Acta (BBA) - Reseñas sobre el cáncer . 1785 (2): 133-155. doi :10.1016/j.bbcan.2007.12.002. PMID 18187049.
- ^ Tjaden, Christin; Werner, Jens; Buechler, Markus W.; Hackert, Thilo (2011). "Hipertrofia reactiva de un bazo accesorio que imita la recurrencia tumoral del carcinoma de células renales metastásico". Revista asiática de cirugía . 34 (1): 50–2. doi : 10.1016/S1015-9584(11)60019-5 . PMID 21515214.
- ^ Elizabeth D Agabegi; Agabegi, Steven S. (2008). Un paso adelante hacia la medicina (Serie Step-Up) . Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7153-5.
- ^ Catto, James WF; Shariat, Shahrokh F. (2013). "El rostro cambiante del carcinoma de células renales: el impacto de la secuenciación genética sistemática en nuestra comprensión de la biología de este tumor". Urología europea . 63 (5): 855–7, discusión 857–8. doi :10.1016/j.eururo.2012.09.049. PMID 23026395.
- ^ abcdefg Zhou, Ming; He, Huiying (2013). "Patología del carcinoma de células renales". Carcinoma de células renales . págs. 23–41. doi :10.1007/978-1-62703-062-5_2. ISBN 978-1-62703-061-8. Número de identificación del sujeto 2101851.
- ^ Robbins y Cotran, bases patológicas de la enfermedad (novena edición). Elsevier. 2015. pág. 954. ISBN 9780808924500.
- ^ Kumar, Vinay; Abbas, Abul K.; Aster, Jon C. (2015). Robbins y Cotran, bases patológicas de la enfermedad (novena edición). Elsevier/Saunders. pág. 954. ISBN 9780808924500.
- ^ Lopez-Beltran, Antonio; Scarpelli, Marina; Montironi, Rodolfo; Kirkali, Ziya (2006). "Clasificación de la OMS de 2004 de los tumores renales de los adultos". Urología Europea . 49 (5): 798–805. doi :10.1016/j.eururo.2005.11.035. PMID 16442207.
- ^ Hagenkord, Jill M; Parwani, Anil V; Lyons-Weiler, Maureen A; Alvarez, Karla; Amato, Robert; Gatalica, Zoran; Gonzalez-Berjon, Jose M; Peterson, Leif; Dhir, Rajiv; Monzon, Federico A (2008). "El cariotipo virtual con microarrays de SNP reduce la incertidumbre en el diagnóstico de tumores epiteliales renales". Patología Diagnóstica . 3 : 44. doi : 10.1186/1746-1596-3-44 . PMC 2588560 . PMID 18990225.
- ^ Monzón, Federico A; Hagenkord, Jill M; Lyons-Weiler, Maureen A; Balani, Jyoti P; Parwani, Anil V; Sciulli, Christin M; Li, Jia; Chandran, Uma R; Bastacky, Sheldon I; Dhir, Rajiv (2008). "Matrices de SNP de todo el genoma como una posible herramienta de diagnóstico para la detección de aberraciones cromosómicas características en tumores epiteliales renales". Patología moderna . 21 (5): 599–608. doi : 10.1038/modpathol.2008.20 . PMID 18246049.
- ^ Lyons-Weiler M, Hagenkord J, Sciulli C, Dhir R, Monzon FA (2008). "Optimización del ensayo Affymetrix GeneChip Mapping 10K 2.0 para uso clínico de rutina en tejidos fijados con formalina e incluidos en parafina". Diagn. Mol. Pathol . 17 (1): 3–13. doi :10.1097/PDM.0b013e31815aca30. PMID 18303412. S2CID 24420204.
- ^ abc Crumley, SM; Divatia, M; Truong, L; Shen, S; Ayala, AG; Ro, JY (2013). "Carcinoma de células renales: subtipos en evolución y emergentes". Revista mundial de casos clínicos . 1 (9): 262–275. doi : 10.12998/wjcc.v1.i9.262 . PMC 3868710 . PMID 24364021.
- ^ Rohan, SM; Xiao, Y; Liang, Y; Dudas, ME; Al-Ahmadie, HA; Fine, SW; Gopalan, A; Reuter, VE; Rosenblum, MK; Russo, P; Tickoo, SK (2011). "Carcinoma de células renales papilares de células claras: análisis molecular e inmunohistoquímico con énfasis en el gen de von Hippel-Lindau y las proteínas relacionadas con la vía del factor inducible por hipoxia". Patología moderna . 24 (9): 1207–20. doi : 10.1038/modpathol.2011.80 . PMID 21602815.
- ^ Wood, Laura S. (30 de noviembre de 2009). "Carcinoma de células renales". Revista clínica de enfermería oncológica . 13 : 3–7. doi :10.1188/09.CJON.S2.3-7. PMID 19948453.
- ^ Bonn, Dorothy (31 de enero de 2004). "Análisis de orina para el carcinoma de células renales". The Lancet Oncology . 5 (2): 72. doi :10.1016/S1470-2045(04)01368-3. PMID 14974475.
- ^ Johann, Donald J.; Wei, Bih-Rong; Prieto, Darue A.; Chan, King C.; Ye, Xiaying; Valera, Vladimir A.; Simpson, R. Mark; Rudnick, Paul A.; Xiao, Zhen; Issaq, Haleem J.; Linehan, W. Marston; Stein, Stephen E.; Veenstra, Timothy D.; Blonder, Josip (2010). "Análisis combinado de sangre y tejido para el descubrimiento de biomarcadores de cáncer: aplicación al carcinoma de células renales". Química analítica . 82 (5): 1584–8. doi :10.1021/ac902204k. PMC 3251958 . PMID 20121140.
- ^ Hatzaras, Ioannis; Gleisner, Ana L.; Pulitano, Carlo; Sandroussi, Charbel; Hirose, Kenzo; Hyder, Omar; Wolfgang, Christopher L.; Aldrighetti, Luca; Crawford, Michael; Choti, Michael A.; Pawlik, Timothy M. (2012). "Un análisis multiinstitucional de los resultados de la cirugía dirigida al hígado para el cáncer de células renales metastásico". HPB . 14 (8): 532–8. doi :10.1111/j.1477-2574.2012.00495.x. PMC 3406350 . PMID 22762401.
- ^ Motzer, RJ (1 de abril de 2003). "Carcinoma de células renales: una neoplasia maligna prioritaria para el desarrollo y estudio de nuevas terapias". Journal of Clinical Oncology . 21 (7): 1193–4. doi :10.1200/JCO.2003.12.072. PMID 12663704.
- ^ Sahni, VA (1 de enero de 2009). "REVISIÓN: Biopsia de masas renales: cuándo y por qué". Cancer Imaging . 9 (1): 44–55. doi :10.1102/1470-7330.2009.0005. PMC 2739685 . PMID 19602467.
- ^ Nakada, G; Machida, T; Masuda, F; Onishi, T; Yamazaki, H; Kiyota, H; Suzuki, M; Goto, H (1983). "Un caso de fístula arteriovenosa secundaria a carcinoma de células renales acompañado de insuficiencia cardíaca congestiva". Hinyokika Kiyo. Acta Urologica Japonica . 29 (8): 901–5. PMID 6675440.
- ^ Pattamapaspong, Nuttaya; Muttarak, Malai; Sivasomboon, Chate (2011). "Artritis tuberculosa y tenosinovitis". Seminarios en radiología musculoesquelética . 15 (5): 459–69. doi : 10.1055/s-0031-1293492 . PMID: 22081281. S2CID : 260321430.
- ^ Israel, Gary M.; Bosniak, Morton A. (2005). "Cómo lo hago: evaluación de masas renales1". Radiología . 236 (2): 441–50. doi :10.1148/radiol.2362040218. PMID 16040900. S2CID 1916092.
- ^ ab Jubelirer, SJ; Rubin, M (1993). "El uso de métodos radiológicos modernos para identificar carcinoma de células renales incidental". The West Virginia Medical Journal . 89 (1): 21–3. PMID 8421912.
- ^ ab Beck, AD (octubre de 1997). "Carcinoma de células renales que afecta la vena cava inferior: evaluación radiológica y tratamiento quirúrgico". The Journal of Urology . 118 (4): 533–7. doi :10.1016/S0022-5347(17)58098-2. PMID 916043.
- ^ Sauk, Steven C.; Hsu, Margaret S.; Margolis, Daniel JA; Lu, David SK; Rao, Nagesh P.; Belldegrun, Arie S.; Pantuck, Allan J.; Raman, Steven S. (2011). "Carcinoma de células renales de células claras: las características de las imágenes por TC multidetector multifásicas ayudan a predecir los cariotipos genéticos". Radiología . 261 (3): 854–62. doi :10.1148/radiol.11101508. PMID 22025734.
- ^ ab Lane, Brian R.; Samplaski, Mary K.; Herts, Brian R.; Zhou, Ming; Novick, Andrew C.; Campbell, Steven C. (2008). "Biopsia de masa renal: ¿un renacimiento?". The Journal of Urology . 179 (1): 20–7. doi :10.1016/j.juro.2007.08.124. PMID 17997455.
- ^ Hricak, H; Demas, BE; Williams, RD; McNamara, MT; Hedgcock, MW; Amparo, EG; Tanagho, EA (1985). "Imágenes por resonancia magnética en el diagnóstico y estadificación de neoplasias renales y perirrenales". Radiología . 154 (3): 709–15. doi :10.1148/radiology.154.3.3969475. PMID 3969475.
- ^ Janus, CL; Mendelson, DS (1991). "Comparación de la resonancia magnética y la tomografía computarizada para el estudio de masas renales y perirrenales". Critical Reviews in Diagnostic Imaging . 32 (2): 69–118. PMID 1863349.
- ^ Nishimura, Kazuo; Hida, Shuichi; Okada, Kenichiro; Yoshida, Osamu; Nishimuara, Kazumasa (1988). "Estadificación y diagnóstico diferencial del carcinoma de células renales: una comparación entre la resonancia magnética y la tomografía computarizada". Acta Urologica Japonica . 34 (8): 1323–31. hdl :2433/119684. PMID 3195400.
- ^ Reznek, RH (14 de febrero de 2004). "CT/MRI in staging renal cell carcinoma" (TC/RM en la estadificación del carcinoma de células renales). Cancer Imaging (Imagen de cáncer ). 4 N.º de especificación A (N.º de especificación A): S25–32. doi :10.1102/1470-7330.2004.0012. PMC 1435344. PMID 18215972 .
- ^ Kocak, Mehmet; Sudakoff, Gary S.; Erickson, Scott; Begun, Frank; Datta, Milton (2001). "Uso de la angiografía por resonancia magnética para la planificación quirúrgica en el carcinoma de células renales del riñón pélvico". American Journal of Roentgenology . 177 (3): 659–60. doi :10.2214/ajr.177.3.1770659. PMID 11517066.
- ^ ab Cáncer de riñón / Información general Archivado el 1 de noviembre de 2011 en Wayback Machine en Weill Cornell Medical College, James Buchanan Brady Foundation, Departamento de Urología
- ^ Oto, A; Herts, BR; Remer, EM; Novick, AC (1998). "Trombo tumoral en la vena cava inferior en el carcinoma de células renales: estadificación mediante imágenes por RM e impacto en el tratamiento quirúrgico". American Journal of Roentgenology . 171 (6): 1619–24. doi :10.2214/ajr.171.6.9843299. PMID 9843299.
- ^ "Carcinoma de células claras, tumor hipernefroide o hipernefroma". Archivado desde el original el 7 de mayo de 2010. Consultado el 31 de marzo de 2010 .
- ^ Vasil'Eva, NN; Koriakina, RF (1976). "Diagnóstico morfológico del carcinoma de células renales. Paralelismos histocitológicos". Arkhiv Patologii . 38 (12): 12–7. PMID 1016084.
- ^ "Carcinoma renal de células claras (tumor de Grawitz)". Atlas de patología . 30 de enero de 2009. Archivado desde el original el 10 de marzo de 2009.
- ^ López, JI (marzo de 2013). "Tumores renales de células claras. Una revisión". Patología, investigación y práctica . 209 (3): 137–46. doi :10.1016/j.prp.2013.01.007. PMID 23433880.
- ^ Rioux-Leclercq, Nathalie (noviembre de 2006). "Le grade nucléaire de fuhrman, facteur pronostique du cancer du rein depuis 25 ans" [El sistema de clasificación de Fuhrman para el pronóstico del cáncer de riñón]. Progrès en Urologie (en francés). 16 (4): 5–8. PMID 17183964. INIST 18271804.
- ^ Delahunt, Brett; Sika-Paotonu, Dianne ; Bethwaite, Peter B.; McCredie, Margaret RE; Martignoni, Guido; Eble, John N.; Jordania, T. (2007). "La clasificación de Fuhrman no es adecuada para el carcinoma de células renales cromófobos". La Revista Estadounidense de Patología Quirúrgica . 31 (6): 957–60. doi :10.1097/01.pas.0000249446.28713.53. PMID 17527087. S2CID 27154220.
- ^ Kovacs, Gyula; Akhtar, Mohammed; Beckwith, Bruce J.; Bugert, Peter; Cooper, Colin S.; Delahunt, Brett; Eble, John N.; Fleming, Stewart; Ljungberg, Börje; Medeiros, L. Jeffrey; Moch, Holger; Reuter, Victor E.; Ritz, Eberhard; Roos, Göran; Schmidt, Dietmar; Srigley, John R.; Störkel, Stephan; Van Den Berg, Eva; Zbar, Bert (1997). "La clasificación de Heidelberg de los tumores de células renales". Revista de patología . 183 (2): 131–3. doi : 10.1002/(SICI)1096-9896(199710)183:2<131::AID-PATH931>3.0.CO;2-G . Número de modelo: PMID 9390023. Número de modelo: S2CID 34796951.
- ^ Lauby-Secretan, B; Scoccianti, C; Loomis, D; Grosse, Y; Bianchini, F; Straif, K (25 de agosto de 2016). "Grasa corporal y cáncer: punto de vista del grupo de trabajo del IARC". The New England Journal of Medicine . 375 (8): 794–798. doi :10.1056/nejmsr1606602. PMC 6754861 . PMID 27557308.
- ^ Simmons; Campbell (26 de septiembre de 2012). "Evaluación del riesgo oncológico para tumores renales en estadio clínico T1". Tratamiento clínico del carcinoma de células renales . Humana Pr Inc. págs. 105-118. ISBN 978-1-62703-061-8.
- ^ ab Smaldone, Marc C.; Canter, Daniel; Kutikov, Alexander; Uzzo, Robert G. (2013). "Vigilancia activa de la masa renal pequeña". Carcinoma de células renales . págs. 167–94. doi :10.1007/978-1-62703-062-5_10. ISBN 978-1-62703-061-8.
- ^ Novick AC (septiembre de 1998). "Cirugía conservadora de nefronas para carcinoma de células renales". Br J Urol . 82 (3): 321–4. doi : 10.1046/j.1464-410X.1998.00751.x . PMID 9772865.
- ^ Herr HW (enero de 1999). "Nefrectomía parcial para carcinoma renal unilateral y riñón contralateral normal: seguimiento de 10 años". J. Urol . 161 (1): 33–4, discusión 34–5. doi :10.1016/S0022-5347(01)62052-4. PMID 10037361.
- ^ Van Poppel H, Bamelis B, Oyen R, Baert L (septiembre de 1998). "La nefrectomía parcial para el carcinoma de células renales puede lograr un control tumoral a largo plazo". J. Urol . 160 (3 Pt 1): 674–8. doi :10.1016/S0022-5347(01)62751-4. PMID 9720519.
- ^ Mattar K, Jewett MA (enero de 2008). "Espera vigilante para masas renales pequeñas". Curr Urol Rep . 9 (1): 22–5. doi :10.1007/s11934-008-0006-3. PMID 18366970. S2CID 26763264.
- ^ Peso, Christopher J.; Larson, Benjamin T.; Fergany, Amr F.; Gao, Tianming; Lane, Brian R.; Campbell, Steven C.; Kaouk, Jihad H.; Klein, Eric A.; Novick, Andrew C. (2010). "La insuficiencia renal crónica inducida por nefrectomía se asocia con un mayor riesgo de muerte cardiovascular y muerte por cualquier causa en pacientes con masas renales cT1b localizadas". Revista de Urología . 183 (4): 1317–23. doi :10.1016/j.juro.2009.12.030. PMID 20171688.
- ^ Peso, Christopher J.; Crispen, Paul L.; Breau, Rodney H.; Kim, Simon P.; Lohse, Christine M.; Boorjian, Stephen A.; Thompson, R. Houston; Leibovich, Bradley C. (2013). "El entorno de práctica y las características del cirujano influyen en gran medida en la decisión de realizar una nefrectomía parcial entre los cirujanos de la Asociación Urológica Estadounidense". BJU International . 111 (5): 731–8. doi :10.1111/j.1464-410X.2012.11112.x. PMID 22502641. S2CID 829345.
- ^ Casey, RG; Raheem, OA; Elmusharaf, E.; Madhavan, P.; Tolan, M.; Lynch, TH (2013). "Carcinoma de células renales con trombo auricular y en la vena cava: experiencia quirúrgica de 10 años de un único centro". The Surgeon . 11 (6): 295–9. doi :10.1016/j.surge.2013.02.007. PMID 23510704.
- ^ Ciancio, Gaetano; Livingstone, Alan S.; Soloway, Mark (2007). "Tratamiento quirúrgico del carcinoma de células renales con trombo tumoral en la vena cava inferior y renal: la experiencia de la Universidad de Miami en el uso de técnicas de trasplante hepático". Urología europea . 51 (4). Elsevier BV: 988–995. doi :10.1016/j.eururo.2006.11.055. ISSN 0302-2838. PMID 17175095.
- ^ Ciancio, Gaetano; Soloway, Mark S. (2005). "Carcinoma de células renales con trombo tumoral que se extiende por encima del diafragma: cómo evitar la derivación cardiopulmonar". Urología . 66 (2). Elsevier BV: 266–270. doi :10.1016/j.urology.2005.03.039. ISSN 0090-4295. PMID 16098354.
- ^ Flanigan RC, Mickisch G, Sylvester R, Tangen C, Van Poppel H, Crawford ED (marzo de 2004). "Nefrectomía citorreductora en pacientes con cáncer renal metastásico: un análisis combinado". J. Urol . 171 (3): 1071–6. CiteSeerX 10.1.1.469.2497 . doi :10.1097/01.ju.0000110610.61545.ae. PMID 14767273.
- ^ Mulders PF, Brouwers AH, Hulsbergen-van der Kaa CA, van Lin EN, Osanto S, de Mulder PH (febrero de 2008). "[Pauta 'Carcinoma de células renales']". Nederlands Tijdschrift voor Geneeskunde (en holandés). 152 (7): 376–80. PMID 18380384.
- ^ Russo (2013). "Nefrectomía radical para tumores renales localizados: consideraciones oncológicas y funcionales renales". Manejo clínico del carcinoma de células renales . Humana Pr Inc. págs. 119–132. ISBN 978-1-62703-061-8.
- ^ abcd Matin; Ahrar (2013). "Ablación térmica". Tratamiento clínico del carcinoma de células renales . Humana. págs. 155-166. ISBN 978-1-62703-061-8.
- ^ Mogami T, Harada J, Kishimoto K, Sumida S (abril de 2007). "Crioablación percutánea guiada por RM para neoplasias malignas, con especial atención al carcinoma de células renales". Int. J. Clin. Oncol . 12 (2): 79–84. doi :10.1007/s10147-006-0654-6. PMID 17443274. S2CID 5743758.
- ^ Boss A, Clasen S, Kuczyk M, Schick F, Pereira PL (marzo de 2007). "Ablación por radiofrecuencia guiada por imágenes del carcinoma de células renales". Eur Radiol . 17 (3): 725–33. doi :10.1007/s00330-006-0415-y. PMID 17021704. S2CID 12651841.
- ^ ab Davar; Fenton; Appleman (2013). "Inmunoterapia para el carcinoma de células renales". Tratamiento clínico del carcinoma de células renales . Humana. págs. 279–302. ISBN 978-1-62703-061-8.
- ^ Santoni, M; De Tursi, M; Felici, A; Lo Re, G; Ricotta, R; Ruggeri, EM; Sabbatini, R; Santini, D; Vaccaro, V; Milella, M (junio de 2013). "Manejo de pacientes con carcinoma de células renales metastásico con características de alto riesgo: estado actual y perspectivas futuras". Revisión experta de terapias contra el cáncer . 13 (6): 697–709. doi :10.1586/era.13.52. PMID 23773104. S2CID 36871651.
- ^ ab Stroup (2013). "Terapia dirigida neoadyuvante y cirugía consolidativa". Tratamiento clínico del carcinoma de células renales . Humana. págs. 219–230. ISBN 978-1-62703-061-8.
- ^ Shoji, S; Nakano, M; Sato, H; Tang, XY; Osamura, YR; Terachi, T; Uchida, T; Takeya, K (enero de 2014). "El estado actual de la medicina a medida con biomarcadores moleculares para pacientes con carcinoma renal de células claras". Clinical & Experimental Metastasis . 31 (1): 111–34. doi :10.1007/s10585-013-9612-7. PMID 23959576. S2CID 15100003.
- ^ Jonasch, E; Futreal, Pensilvania; Davis, IJ; Bailey, ST; Kim, Wyoming; Brugarolas, J; Giaccia, AJ; Kurban, G; Pausa, A; Frydman, J; Zurita, AJ; Rini, BI; Sharma, P; Atkins, MB; Walker, CL; Rathmell, WK (julio de 2012). "Estado de la ciencia: una actualización sobre el carcinoma de células renales". Investigación del cáncer molecular . 10 (7): 859–80. doi :10.1158/1541-7786.MCR-12-0117. PMC 3399969 . PMID 22638109.
- ^ ab Quinn DI, Lara PN (2015). "Cáncer de células renales: focalización en un punto de control inmunitario o en múltiples quinasas". N. Engl. J. Med . 373 (19): 1872–4. doi :10.1056/NEJMe1511252. PMC 7526749. PMID 26406149 .
- ^ Dranitsaris, G; Schmitz, S; Broom, RJ (noviembre de 2013). "Terapias dirigidas a moléculas pequeñas para el tratamiento de segunda línea del carcinoma de células renales metastásico: una revisión sistemática y una comparación indirecta de la seguridad y la eficacia". Revista de investigación oncológica y oncología clínica . 139 (11): 1917–26. doi :10.1007/s00432-013-1510-5. PMID 24037486. S2CID 27524034.
- ^ Motzer, Robert J.; Hutson, Thomas E.; Tomczak, Piotr; Michaelson, M. Dror; Bukowski, Ronald M.; Rixe, Olivier; Oudard, Stéphane; Negrier, Sylvie; Szczylik, Cezary; Kim, Sindy T.; Chen, Isan; Bycott, Paul W.; Baum, Charles M.; Figlin, Robert A. (2007). "Sunitinib versus interferón alfa en el carcinoma metastásico de células renales". New England Journal of Medicine . 356 (2): 115–124. doi : 10.1056/NEJMoa065044 . ISSN 0028-4793. PMID 17215529.
- ^ "TORISEL® (temsirolimus) -Información de seguridad- Tratamiento del carcinoma de células renales" www.torisel.com . Archivado desde el original el 13 de abril de 2018 . Consultado el 19 de marzo de 2018 .
- ^ Carcinoma de células renales Archivado el 5 de julio de 2016 en Wayback Machine MedlinePlus Medical Encyclopedia. Recuperado el 10 de septiembre de 2010.
- ^ abcd Hofmann, Fabian; Hwang, Eu Chang; Lam, Thomas BL; Bex, Axel; Yuan, Yuhong; Marconi, Lorenzo SO; Ljungberg, Börje (14 de octubre de 2020). "Terapia dirigida para el carcinoma de células renales metastásico". Base de Datos Cochrane de Revisiones Sistemáticas . 2020 (10): CD012796. doi :10.1002/14651858.cd012796.pub2. hdl : 2164/11109 . ISSN 1465-1858. PMC 8094280. PMID 33058158 .
- ^ Yang JC, Hughes M, Kammula U, Royal R, Sherry RM, Topalian SL, Suri KB, Levy C, Allen T, Mavroukakis S, Lowy I, White DE, Rosenberg SA (2007). "El ipilimumab (anticuerpo anti-CTLA4) provoca la regresión del cáncer de células renales metastásico asociado con enteritis e hipofisitis". J. Immunother . 30 (8): 825–30. doi :10.1097/CJI.0b013e318156e47e. PMC 2134980 . PMID 18049334.
- ^ "Copia archivada" (PDF) . Archivado (PDF) desde el original el 6 de febrero de 2015 . Consultado el 29 de octubre de 2014 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ "Cáncer de riñón". Instituto de Investigación del Cáncer . Archivado desde el original el 24 de diciembre de 2017. Consultado el 19 de marzo de 2018 .
- ^ abcd Cohen, Herbert T.; McGovern, Francis J. (2005). "Carcinoma de células renales". New England Journal of Medicine . 353 (23): 2477–90. doi :10.1056/NEJMra043172. PMID 16339096.[ enlace muerto permanente ]
- ^ "La FDA aprueba el pembrolizumab para el tratamiento adyuvante del carcinoma de células renales". FDA . 17 de noviembre de 2021.
- ^ Lam, John S.; Leppert, John T.; Belldegrun, Arie S.; Figlin, Robert A. (2005). "Nuevos enfoques en la terapia del carcinoma de células renales metastásico". Revista Mundial de Urología . 23 (3): 202–12. doi :10.1007/s00345-004-0466-0. PMID 15812574. S2CID 12091991.
- ^ Ljungberg, Börje; Hanbury, Damian C.; Kuczyk, Marcus A.; Merseburger, Axel S.; Mulders, Peter FA; Patard, Jean-Jacques; Sinescu, Ioanel C.; Grupo de directrices de la Asociación Europea de Urología para el carcinoma de células renales (2007). "Directrices sobre el carcinoma de células renales". Urología europea . 51 (6): 1502–10. doi :10.1016/j.eururo.2007.03.035. PMID 17408850.
- ^ ab Gupta, Kiran; Miller, Jeffrey D.; Li, Jim Z.; Russell, Mason W.; Charbonneau, Claudie (2008). "Carga epidemiológica y socioeconómica del carcinoma de células renales metastásico (mRCC): una revisión de la literatura". Cancer Treatment Reviews . 34 (3): 193–205. doi :10.1016/j.ctrv.2007.12.001. PMID 18313224.
- ^ abc Buti, Sebastiano; Bersanelli, Melissa; Sikokis, Angélica; Maines, Francesca; Facchinetti, Francesco; Bría, Emilio; Ardizzoni, Andrea; Tortora, Giampaolo; Massari, Francesco (2013). "¿Quimioterapia en el carcinoma de células renales metastásico hoy? Una revisión sistemática". Medicamentos contra el cáncer . 24 (6): 535–54. doi :10.1097/CAD.0b013e3283609ec1. PMID 23552469. S2CID 205529087.
- ^ Patil, Sujata; Manola, Judith; Elson, Paul; Negrier, Sylvie; Escudier, Bernard; Eisen, Tim; Atkins, Michael; Bukowski, Ronald; Motzer, Robert J. (2012). "Mejora de la supervivencia global de pacientes con carcinoma avanzado de células renales: análisis de tendencias de factores pronósticos a partir de un conjunto de datos internacionales de ensayos clínicos". The Journal of Urology . 188 (6): 2095–100. doi :10.1016/j.juro.2012.08.026. PMID 23083849.
- ^ Calvo, Emiliano; Ravaud, Alain; Bellmunt, Joaquim (2013). "¿Cuál es la terapia óptima para pacientes con carcinoma de células renales metastásico que progresan con un VEGFr-TKI inicial?". Cancer Treatment Reviews . 39 (4): 366–74. doi :10.1016/j.ctrv.2012.06.010. PMID 22832091.
- ^ Alasker, Ahmed; Meskawi, Malek; Sun, Maxine; Ismail, Salima; Hanna, Nawar; Hansen, Jens; Tian, Zhe; Bianchi, Marco; Perrotte, Paul; Karakiewicz, Pierre I. (2013). "Una actualización contemporánea sobre las tasas y el manejo de las toxicidades de las terapias dirigidas para el carcinoma de células renales metastásico". Cancer Treatment Reviews . 39 (4): 388–401. doi :10.1016/j.ctrv.2012.12.006. PMID 23317510.
- ^ Cáncer de riñón (adulto): carcinoma de células renales Archivado el 5 de abril de 2016 en Wayback Machine . Sociedad Estadounidense del Cáncer. Consultado el 10 de septiembre de 2010.
- ^ "EN ESTE NÚMERO". Revista Japonesa de Oncología Clínica . 41 (1): NP. 2010. doi : 10.1093/jjco/hyq238 . ISSN 0368-2811.
- ^ [1] Archivado el 5 de diciembre de 2015 en Wayback Machine. Causas, síntomas y tratamiento del cáncer renal. eMedicine Health. Consultado el 10 de septiembre de 2010.
- ^ Tsui KH, Shvarts O, Smith RB, Figlin R, de Kernion JB, Belldegrun A (febrero de 2000). "Carcinoma de células renales: importancia pronóstica de tumores detectados incidentalmente". The Journal of Urology . 163 (2): 426–30. doi :10.1016/s0022-5347(05)67892-5. PMID 10647646.
- ^ Motzer, RJ; Bacik, J; Schwartz, LH; Reuter, V; Russo, P; Marion, S; Mazumdar, M (2003). "Factores pronósticos de supervivencia en pacientes con carcinoma de células renales metastásico tratados previamente". Journal of Clinical Oncology . 22 (3): 454–63. doi : 10.1200/JCO.2004.06.132 . PMID 14752067.
- ^ Motzer, RJ; Mazumdar, M; Bacik, J; Berg, W; Amsterdam, A; Ferrara, J (1999). "Estratificación pronóstica y de supervivencia de 670 pacientes con carcinoma avanzado de células renales". Journal of Clinical Oncology . 17 (8): 2530–40. doi :10.1200/jco.1999.17.8.2530. PMID 10561319.
- ^ Leibovich, Bradley C.; Blute, Michael L.; Cheville, John C.; Lohse, Christine M.; Frank, Igor; Kwon, Eugene D.; Weaver, Amy L.; Parker, Alexander S.; Zincke, Horst (2003). "Predicción de la progresión después de la nefrectomía radical para pacientes con carcinoma renal de células claras". Cáncer . 97 (7): 1663–71. doi : 10.1002/cncr.11234 . PMID 12655523.
- ^ Birkhäuser, Frédéric D.; Kroeger, Nils; Pantuck, Allan J. (2013). "Etiología del carcinoma de células renales: incidencia, demografía y factores ambientales". Carcinoma de células renales . págs. 3–22. doi :10.1007/978-1-62703-062-5_1. ISBN 978-1-62703-061-8.
- ^ abcde Delahunt, Brett (8 de marzo de 2009). "Historia de la neoplasia renal" (PDF) . Reunión anual de la Academia Estadounidense y Canadiense de Patología de 2009. Archivado desde el original (PDF) el 29 de marzo de 2020. Consultado el 27 de abril de 2013 .
- ^ Delahunt, Brett; Thornton A (1996). "Carcinoma de células renales. Una perspectiva histórica". J Urol Pathol . 4 : 31–49.
- ^ Delahunt, Brett; Eble, John N. (2005). "Historia del desarrollo de la clasificación de la neoplasia de células renales". Clinics in Laboratory Medicine . 25 (2): 231–46, v. doi :10.1016/j.cll.2005.01.007. PMID 15848734.
- ^ Judd, E. Starr (1929). "Carcinoma de la corteza renal con factores que influyen en el pronóstico". Archivos de Medicina Interna . 44 (5): 746. doi :10.1001/archinte.1929.00140050123011.
- ^ Foot, NC; Humphreys, GA; Whitmore, WF (1951). "Tumores renales: patología y pronóstico en 295 casos". Revista de Urología . 66 (2): 190–200. doi :10.1016/S0022-5347(17)74326-1. PMID 14861941.
- ^ Oberling, CH.; Rivière, M.; Haguenau, FR. (1960). "Ultraestructura de las células claras en carcinomas renales y su importancia para la demostración de su origen renal". Nature . 186 (4722): 402–403. Bibcode :1960Natur.186..402O. doi :10.1038/186402a0. PMID 14428164. S2CID 4224899.
- ^ Valladares Ayerbes, Manuel; Aparicio Gallego, Guadalupe; Díaz Prado, Silvia; Jiménez Fonseca, Paula; García Campelo, Rosario; Antón Aparicio, Luis Miguel (2008). "Origen de los carcinomas de células renales". Oncología Clínica y Traslacional . 10 (11): 697–712. doi :10.1007/s12094-008-0276-8. hdl : 2183/19413 . PMID 19015066.

