Carbonildiimidazol
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Di(1 H -imidazol-1-il)metanona | |
| Otros nombres Reactivo N,N'-carbonildiimidazol CDI Staab | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.007.718 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C7H6N4O | |
| Masa molar | 162,152 g·mol −1 |
| Apariencia | Polvo fino blanco |
| Punto de fusión | 119 °C (246 °F; 392 K) |
| Reacciona con el agua | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Corrosivo para algunos metales. Provoca quemaduras químicas graves en contacto con la piel o los ojos. |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H302 , H314 , H315 , H319 | |
| P260 , P264 , P270 , P280 , P301+P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P330 , P332+P313 , P337+P313 , P362 , P363 , P405 , P501 | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
| Compuestos relacionados | |
Compuestos relacionados | fosgeno , imidazol |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El 1,1'-carbonildiimidazol (CDI) es un compuesto orgánico con la fórmula molecular (C3H3N2 ) 2CO . Es un sólido cristalino blanco . Se utiliza a menudo para el acoplamiento de aminoácidos para la síntesis de péptidos y como reactivo en la síntesis orgánica .
Preparación
El CDI se puede preparar directamente mediante la reacción de fosgeno con cuatro equivalentes de imidazol en condiciones anhidras. [1] La eliminación del producto secundario, cloruro de imidazolio , y el solvente da como resultado el producto cristalino con un rendimiento de ~90%. [2]
En esta conversión, el imidazol actúa como nucleófilo y como base. Un precursor alternativo, el 1-(trimetilsilil)imidazol, requiere un mayor esfuerzo preparatorio, con la ventaja de que el coproducto cloruro de trimetilsililo es volátil.
El CDI se hidroliza fácilmente para devolver imidazol:
- (C 3 H 3 N 2 ) 2 CO + H 2 O → 2 C 3 H 4 N 2 + CO 2
La pureza del CDI se puede determinar por la cantidad de CO 2 que se forma durante la hidrólisis. [3]
Uso en síntesis
El CDI se emplea principalmente para convertir aminas en amidas , carbamatos y ureas . También se puede utilizar para convertir alcoholes en ésteres . [1]
Derivados de ácidos
La formación de amidas es promovida por el CDI. Aunque la reactividad del CDI es menor que la de los cloruros de ácido , se maneja más fácilmente y evita el uso de cloruro de tionilo en la formación de cloruro de ácido, que puede causar reacciones secundarias. [3] Una aplicación temprana de este tipo de reacción se observó en la formación de enlaces peptídicos (con la formación de CO 2 como fuerza impulsora). El mecanismo propuesto para la reacción entre un ácido carboxílico y el CDI se presenta a continuación. [4]
En el ámbito de la síntesis de péptidos, este producto puede tratarse con una amina como la que se encuentra en un aminoácido para liberar el grupo imidazol y acoplar los péptidos. Los productos secundarios, dióxido de carbono e imidazol, son relativamente inocuos. [5] La racemización de los aminoácidos también tiende a ser mínima, lo que refleja las suaves condiciones de reacción.
El CDI también se puede utilizar para la esterificación , aunque la alcoholisis requiere calor o la presencia de un nucleófilo potente como el etóxido de sodio, [1] [3] u otras bases fuertes como el NaH. Esta reacción tiene generalmente un buen rendimiento y un amplio alcance, aunque la formación del éster a partir de alcoholes terciarios cuando el reactivo ácido tiene un protón α relativamente ácido es problemática, ya que pueden producirse condensaciones CC , aunque esta en sí misma puede ser una reacción deseable. [1] Una reacción similar que involucra tioles y selenoles puede producir los ésteres correspondientes. [6] La reacción del alcohol también se puede utilizar para formar enlaces glucosídicos. [7]
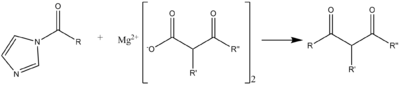
De manera similar, se puede utilizar un ácido en lugar de un alcohol para formar el anhídrido , aunque el diciclohexilcarbodiimida es un reactivo más típico. El equilibrio se puede desplazar a favor del anhídrido utilizando un ácido en una proporción de 2:1 que forme una sal insoluble con el imidazol. Los ácidos típicos son los ácidos trifluoro- y tricloroacético . Por lo tanto, se pueden formar anhídridos simétricos reemplazando este grupo trifluoro- o tricloroacetilo con el ácido que se utilizó para formar el reactivo original.
Otra reacción relacionada es la reacción del ácido fórmico con CDI para formar el imidazol formilizado. Este reactivo es un buen agente formilante y puede regenerar el imidazol no sustituido (con formación de monóxido de carbono) al calentarlo.
Otra reacción implica la acilación de trifenilalquenilfosforanos.
- (C 6 H 5 ) 3 P=CHR + R'−CO−Im → (C 6 H 5 ) 3 P + −CHR−COR' + Im −
- ( C6H5 ) 3P + −CHR−COR ' + ( C6H5 ) 3P = CHR → ( C6H5 ) 3P = CR − COR ' + ( C6H5 ) 3P + −CH2R
Estos pueden experimentar la reacción de Wittig para formar cetonas o aldehídos α,β insaturados.
El reactivo puede incluso reaccionar con peróxido para formar ácido peroxicarboxílico , que puede reaccionar posteriormente para formar peróxidos de diacilo. El grupo imidazol también se reduce con LiAlH4 para formar aldehídos a partir del ácido carboxílico ( en lugar de aminas o alcoholes). El reactivo también puede reaccionar con reactivos de Grignard para formar cetonas. [1]
Una reacción de acilación CC puede ocurrir con un compuesto tipo éster malónico , en el siguiente esquema útil para síntesis de antibióticos macrólidos. [8]
Otras reacciones
El derivado N-fenilimino de CDI se puede formar en una reacción tipo Wittig con fenilimida de trifenilfosfina . [1]
- OCIm 2 + Ph 3 P=NPh → PhN=CIm 2 + Ph 3 PO
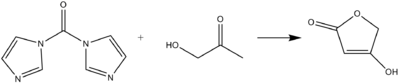
El CDI puede actuar como un equivalente carbonílico en la formación de ácidos tetrónicos o pulvinonas a partir de hidroxicetonas y dicetonas en condiciones básicas. [9]
Un alcohol tratado con al menos 3 equivalentes de un haluro activado (como bromuro de alilo o yodometano) y CDI produce el haluro correspondiente con un buen rendimiento. La bromación y la yodación funcionan mejor, aunque esta reacción no preserva la estereoquímica del alcohol. En un contexto similar, el CDI se utiliza a menudo en reacciones de deshidratación. [3]
Como el CDI es un equivalente del fosgeno , se puede utilizar en una reacción similar, aunque con mayor selectividad: permite la síntesis de carbonatos de bisalquilo asimétricos [10]
Seguridad
Las características de seguridad del CDI se han investigado como parte de una evaluación más amplia de los reactivos formadores de enlaces amida. Se ha demostrado que el CDI presenta corrosión dérmica e irritación ocular. [11] Se ha demostrado que el potencial de sensibilización del CDI es bajo en comparación con otros agentes formadores de enlaces amida comunes (no sensibilizante al 1 % en pruebas LLNA según la OCDE 429 [12] ). El análisis de riesgo térmico por calorimetría diferencial de barrido (DSC) muestra que el CDI plantea riesgos mínimos de explosión. [13]
Véase también
- Tiocarbonildiimidazol (TCDI), el análogo de la tiourea
Referencias
- ^ abcdef HA Staab (1962). "Síntesis utilizando amidas heterocíclicas (azolidas)". Angewandte Chemie Edición Internacional en inglés . 1 (7): 351–367. doi :10.1002/anie.196203511.
- ^ HA Staab y K. Wendel (1973). "1,1'-Carbonyldiimidazole". Síntesis orgánicas; Volúmenes recopilados , vol. 5, pág. 201.
- ^ abcd A. Armstrong; Wenju Li (2007). "N,N'-Carbonildiimidazol". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/9780470842898.rc024.pub2.
- ^ Staab, Heinz A.; Maleck, Gerhard (1966). "Über den Mechanismus der Reaktion vonN.N′-Carbonyl-di-azolen mit Carbonsäuren zu Carbonsäure-azoliden". Chemische Berichte (en alemán). 99 (9): 2955–2961. doi :10.1002/cber.19660990931.
- ^ R. Paul y GW Anderson (1960). "N,N'-Carbonildiimidazol, un nuevo reactivo formador de péptidos"". Revista de la Sociedad Química Americana . 82 (17): 4596–4600. doi :10.1021/ja01502a038.
- ^ H.-J. Gais (1977). "Síntesis de ésteres de tiol y selenol a partir de ácidos carboxílicos y tioles o selenoles, respectivamente". Angewandte Chemie International Edition en inglés . 16 (4): 244–246. doi :10.1002/anie.197702441.
- ^ MJ Ford y SV Ley (1990). "Un procedimiento de glicosidación simple en un solo paso mediante glicósidos de (1-imidazolilcaronilo) y bromuro de cinc". Synlett . 1990 (5): 255–256. doi :10.1055/s-1990-21053.
- ^ DW Brooks; et al. (1979). "C-Acilación en condiciones prácticamente neutras". Angewandte Chemie International Edition en inglés . 18 : 72–74. doi :10.1002/anie.197900722.
- ^ PJ Jerris; et al. (1979). "Una síntesis fácil de ácidos tetrónicos simples y pulvinonas". Tetrahedron Letters . 20 (47): 4517–4520. doi :10.1016/S0040-4039(01)86637-5.
- ^ Steve P. Rannard, Nicola J. Davis (1999). "Síntesis controlada de carbonatos cíclicos y dialquilo asimétricos utilizando las reacciones altamente selectivas de ésteres carboxílicos de imidazol". Organic Letters . 1 (6): 933–936. doi :10.1021/ol9908528.
- ^ Graham, Jessica C.; Trejo-Martin, Alejandra; Chilton, Martyn L.; Kostal, Jakub; Bercu, Joel; Beutner, Gregory L.; Bruen, Uma S.; Dolan, David G.; Gomez, Stephen; Hillegass, Jedd; Nicolette, John; Schmitz, Matthew (20 de junio de 2022). "Una evaluación de los riesgos para la salud ocupacional de los acopladores de péptidos". Investigación química en toxicología . 35 (6): 1011–1022. doi :10.1021/acs.chemrestox.2c00031. ISSN 0893-228X. PMC 9214767 . PMID 35532537.
- ^ OCDE (2010). Prueba n.º 429: Sensibilización cutánea: ensayo de ganglio linfático local. París: Organización para la Cooperación y el Desarrollo Económicos.
- ^ Sperry, Jeffrey B.; Minteer, Christopher J.; Tao, JingYa; Johnson, Rebecca; Duzguner, Remzi; Hawksworth, Michael; Oke, Samantha; Richardson, Paul F.; Barnhart, Richard; Bill, David R.; Giusto, Robert A.; Weaver, John D. (21 de septiembre de 2018). "Evaluación de la estabilidad térmica de reactivos de acoplamiento de péptidos comúnmente utilizados en la fabricación farmacéutica". Investigación y desarrollo de procesos orgánicos . 22 (9): 1262–1275. doi :10.1021/acs.oprd.8b00193. ISSN 1083-6160.