Selenol

Los selenoles son compuestos orgánicos que contienen el grupo funcional con la conectividad C − Se − H . Los selenoles a veces también se denominan selenomercaptanos y selenotioles . Los selenoles son una de las principales clases de compuestos de organoselenio . [1] Un selenol bien conocido es el aminoácido selenocisteína .
Estructura, enlaces, propiedades
Los selenoles son estructuralmente similares a los tioles , pero el enlace C−Se es aproximadamente un 8% más largo a 196 pm . El ángulo C−Se−H se acerca a los 90°. El enlace involucra orbitales p casi puros en Se, de ahí los ángulos cercanos a 90°. La energía de enlace Se−H es más débil que el enlace S −H , en consecuencia, los selenoles se oxidan fácilmente y sirven como donantes de átomos de H. El enlace Se-H es más débil que el enlace S−H como se refleja en su respectiva energía de disociación de enlace (BDE). Para C 6 H 5 Se−H , la BDE es 326 kJ/mol , mientras que para C 6 H 5 S−H , la BDE es 368 kJ/mol. [2]
Los selenoles son ácidos aproximadamente 1000 veces más fuertes que los tioles: el p K a de CH 3 SeH es 5,2 frente a 8,3 para CH 3 SH . La desprotonación produce el anión selenolato , RSe − , la mayoría de los cuales son altamente nucleofílicos y se oxidan rápidamente en presencia de aire. [3]
Los puntos de ebullición de los selenoles tienden a ser ligeramente mayores que los de los tioles. Esta diferencia se puede atribuir a la mayor importancia de los enlaces de van der Waals más fuertes para los átomos más grandes. Los selenoles volátiles tienen olores muy desagradables.
Aplicaciones y ocurrencia
Los selenoles tienen pocas aplicaciones comerciales, ya que están limitadas por la toxicidad del selenio y la sensibilidad del enlace Se−H . Sus bases conjugadas , los selenolatos, también tienen aplicaciones limitadas en la síntesis orgánica .

Papel bioquímico
Los selenoles son importantes en ciertos procesos biológicos. Tres enzimas que se encuentran en los mamíferos contienen selenoles en sus sitios activos: glutatión peroxidasa , yodotironina desyodasa y tiorredoxina reductasa . Los selenoles en estas proteínas son parte del aminoácido esencial selenocisteína . [3] Los selenoles funcionan como agentes reductores para dar el derivado del ácido selenénico ( RSe−OH ), que a su vez se vuelve a reducir mediante enzimas que contienen tiol. El metanoselenol (comúnmente llamado "metilselenol") ( CH 3 SeH ), que se puede producir in vitro incubando selenometionina con una enzima bacteriana metionina gamma-liasa (METasa) , por metilación biológica del ion seleniuro o in vivo por reducción del ácido metanoselínico ( CH 3 −Se(=O)−OH ), se ha invocado para explicar la actividad anticancerígena de ciertos compuestos de organoselenio. [4] [5] [6] Los precursores del metanoselenol están bajo investigación activa en la prevención y terapia del cáncer. En estos estudios, se encontró que el metanoselenol es más activo biológicamente que el etanoselenol ( CH 3 CH 2 SeH ) o el 2-propanoselenol ( (CH 3 ) 2 CH(SeH) ). [7]
Preparación
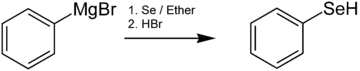
Los selenoles se preparan generalmente mediante la reacción de reactivos de organolitio o reactivos de Grignard con Se elemental. Por ejemplo, el bencenoselenol se genera mediante la reacción de bromuro de fenilmagnesio con selenio seguida de acidificación : [8]
Otra vía preparativa para los selenoles implica la alquilación de la selenourea , seguida de hidrólisis . Los selenoles se generan a menudo mediante la reducción de los diseleniuros seguida de la protonación del selenolato resultante:
- 2 RSe−SeR + 2 Li + [HB(CH 2 CH 3 ) 3 ] − → 2 RSe − Li + + 2 B(CH 2 CH 3 ) 3 + H 2
- RSe − Li + + HCl → RSeH + LiCl
El dimetildiseleniuro se puede reducir fácilmente a metanoselenol dentro de las células. [9]
Reacciones
Los selenoles se oxidan fácilmente y se convierten en diseleniuros, compuestos que contienen un enlace Se−Se . Por ejemplo, el tratamiento del bencenoselenol con bromo produce diseleniuro de difenilo .
- 2 C 6 H 5 SeH + Br 2 → (C 6 H 5 Se) 2 + 2 HBr
En presencia de una base, los selenoles se alquilan fácilmente para dar seleniuros. Esta relación se ilustra mediante la metilación del metanoselenol para dar dimetilseleniuro .
Seguridad
Los compuestos de organoselenio (o cualquier compuesto de selenio) son venenos acumulativos a pesar del hecho de que se requieren cantidades mínimas de Se para la salud. [10]
Véase también
Selenol, alcohol, orden de acidez del tiol
Referencias
- ^ Tanini, Damiano; Capperucci, Antonella (2021). "Síntesis y aplicaciones de selenoles orgánicos". Síntesis y catálisis avanzadas . 363 (24): 5360–5385. doi :10.1002/adsc.202101147. hdl : 2158/1259438 . S2CID 244109470.
- ^ Lide, David R., ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ ab Wessjohann L, Schneider A, Abbas M, Brandt W (2007). "El selenio en la química y la bioquímica en comparación con el azufre". Química biológica . 388 (10): 997–1006. doi :10.1515/BC.2007.138. PMID 17937613. S2CID 34918691.
- ^ Zeng H, Briske-Anderson M, Wu M, Moyer MP (2012). "El metilselenol, un metabolito de selenio, desempeña funciones comunes y diferentes en la proliferación de células cancerosas de colon HCT116 y células no cancerosas de colon NCM460". Nutrición y cáncer . 64 (1): 128–135. doi :10.1080/01635581.2012.630555. PMID 22171558. S2CID 21968566.
- ^ Fernandes AP, Wallenberg M, Gandin V, Misra S, Marzano C, Rigobello MP, et al. (2012). "El metilselenol formado por metilación espontánea de seleniuro es un sustrato de selenio superior a los sistemas de tiorredoxina y glutaredoxina". PLOS ONE . 7 (11): e50727. Bibcode :2012PLoSO...750727F. doi : 10.1371/journal.pone.0050727 . PMC 3511371 . PMID 23226364.
- ^ Ip C, Dong Y, Ganther HE (2002). "Nuevos conceptos en la quimioprevención con selenio". Cancer and Metastasis Reviews . 21 (3–4): 281–289. doi :10.1023/a:1021263027659. PMID 12549766. S2CID 7636317.
- ^ Zuazo A, Plano D, Ansó E, Lizarraga E, Font M, Irujo JJ (2012). "Las actividades citotóxicas y proapoptóticas de los derivados del imidoselenocarbamato dependen de la liberación de metilselenol". Chemical Research in Toxicology . 25 (11): 2479–2489. doi :10.1021/tx300306t. PMID 23043559.
- ^ Foster DG (1944). "Selenofenol". Síntesis orgánicas . 24 : 89. doi :10.15227/orgsyn.024.0089.
- ^ Gabel-Jensen C, Lunøe K, Gammelgaard B (2010). "Formación de metilselenol, dimetilselenuro y dimetildiselenuro en modelos de metabolismo in vitro determinados por cromatografía de gases-espectrometría de masas en espacio de cabeza". Metallomics . 2 (2): 167–173. doi : 10.1039/b914255j . PMID 21069149.
- ^ Rayman, M (2012). "Selenio y salud humana" (PDF) . The Lancet . 379 (9822): 1256–1268. doi :10.1016/S0140-6736(11)61452-9. PMID 22381456. S2CID 34151222.