Einstenio
El einstenio es un elemento químico sintético ; su símbolo es Es y número atómico 99. Recibe su nombre de Albert Einstein y es miembro de la serie de los actínidos y es el séptimo elemento transuránico .
El einstenio fue descubierto como un componente de los restos de la primera explosión de la bomba de hidrógeno en 1952. Su isótopo más común , el einstenio-253 ( 253 Es; vida media 20,47 días), se produce artificialmente a partir de la desintegración del californio -253 en unos pocos reactores nucleares dedicados de alta potencia con un rendimiento total del orden de un miligramo por año. La síntesis del reactor es seguida por un proceso complejo de separación del einstenio-253 de otros actínidos y productos de su desintegración. Otros isótopos se sintetizan en varios laboratorios, pero en cantidades mucho menores, bombardeando elementos actínidos pesados con iones ligeros. Debido a las pequeñas cantidades de einstenio producido y la corta vida media de su isótopo más común, no existen aplicaciones prácticas para él excepto la investigación científica básica. En particular, el einstenio se utilizó para sintetizar, por primera vez, 17 átomos del nuevo elemento mendelevio en 1955.
El einstenio es un metal blando, plateado y paramagnético . Su química es típica de los últimos actínidos, con una preponderancia del estado de oxidación +3 ; el estado de oxidación +2 también es accesible, especialmente en sólidos. La alta radiactividad del 253 Es produce un brillo visible y daña rápidamente su red metálica cristalina, con un calor liberado de unos 1000 vatios por gramo. La dificultad para estudiar sus propiedades se debe a la desintegración del 253 Es en berkelio -249 y luego en californio-249 a una tasa de aproximadamente el 3% por día. El isótopo de einstenio de vida más larga, el 252 Es (vida media de 471,7 días) sería más adecuado para la investigación de las propiedades físicas, pero ha demostrado ser mucho más difícil de producir y está disponible solo en cantidades mínimas, no en masa. [3] El einstenio es el elemento con el número atómico más alto que se ha observado en cantidades macroscópicas en su forma pura como einstenio-253. [4]
Como todos los elementos transuránicos sintéticos, los isótopos del einstenio son muy radiactivos y se consideran altamente peligrosos para la salud en caso de ingestión. [5]
Historia

El einstenio fue identificado por primera vez en diciembre de 1952 por Albert Ghiorso y sus colaboradores de la Universidad de California, Berkeley, en colaboración con los Laboratorios Nacionales de Argonne y Los Álamos , en las consecuencias de la prueba nuclear Ivy Mike . [6] La prueba se realizó el 1 de noviembre de 1952 en el atolón Enewetak en el océano Pacífico y fue la primera prueba exitosa de un arma termonuclear . [7] El examen inicial de los restos de la explosión había demostrado la producción de un nuevo isótopo de plutonio .244
94Pu
, que sólo pudo haberse formado mediante la absorción de seis neutrones por un núcleo de uranio-238 seguida de dos desintegraciones beta .
En ese momento, se pensaba que la absorción de neutrones múltiples era un proceso extremadamente raro, pero la identificación de 244 Pu indicó que aún más neutrones podrían haber sido capturados por el uranio, produciendo nuevos elementos más pesados que el californio . [7]

Ghiorso y sus colaboradores analizaron papeles de filtro que habían volado a través de la nube de explosión en aviones (la misma técnica de muestreo que se había utilizado para descubrir 244 Pu). [8] Posteriormente se aislaron mayores cantidades de material radiactivo de los restos de coral del atolón, que se enviaron a los EE. UU. [7] La separación de los nuevos elementos sospechosos se llevó a cabo en presencia de una solución tampón de ácido cítrico / amonio en un medio débilmente ácido ( pH ≈ 3,5), utilizando intercambio iónico a temperaturas elevadas; al final se recuperaron menos de 200 átomos de einstenio. [9] Sin embargo, el elemento 99, einstenio, es decir, 253 Es, pudo detectarse a través de su característica desintegración alfa de alta energía a 6,6 MeV. [7] Se produjo por la captura de 15 neutrones por núcleos de uranio-238 seguido de siete desintegraciones beta, y tuvo una vida media de 20,5 días. Esta absorción múltiple de neutrones fue posible gracias a la alta densidad de flujo de neutrones durante la detonación, de modo que los isótopos pesados recién generados tenían una gran cantidad de neutrones disponibles para absorber antes de que pudieran desintegrarse en elementos más ligeros. La captura de neutrones inicialmente elevó el número másico sin cambiar el número atómico del nucleido, y las desintegraciones beta concomitantes dieron como resultado un aumento gradual del número atómico: [7]
Sin embargo, unos 238 átomos de U podrían absorber dos neutrones adicionales (para un total de 17), lo que da como resultado 255 Es, así como el isótopo 255 Fm de otro nuevo elemento, el fermio . [10] El descubrimiento de los nuevos elementos y los nuevos datos asociados sobre la captura múltiple de neutrones se mantuvieron inicialmente en secreto por orden del ejército estadounidense hasta 1955 debido a las tensiones de la Guerra Fría y la competencia con la Unión Soviética en tecnologías nucleares. [7] [11] [12] Sin embargo, la captura rápida de tantos neutrones proporcionaría la confirmación experimental directa necesaria de la absorción multineutrón del proceso r necesaria para explicar la nucleosíntesis cósmica (producción) de ciertos elementos pesados (más pesados que el níquel) en supernovas , antes de la desintegración beta . Tal proceso es necesario para explicar la existencia de muchos elementos estables en el universo. [13]
Mientras tanto, los isótopos del elemento 99 (así como del nuevo elemento 100, el fermio ) se produjeron en los laboratorios de Berkeley y Argonne, en una reacción nuclear entre el nitrógeno -14 y el uranio-238, [14] y más tarde mediante una intensa irradiación neutrónica de plutonio o californio :
Estos resultados fueron publicados en varios artículos en 1954 con la advertencia de que estos no eran los primeros estudios que se habían llevado a cabo sobre los elementos. [15] [16] [17] [18] [19] El equipo de Berkeley también informó algunos resultados sobre las propiedades químicas del einstenio y el fermio. [20] [21] Los resultados de Ivy Mike fueron desclasificados y publicados en 1955. [11]

En su descubrimiento de los elementos 99 y 100, los equipos estadounidenses habían competido con un grupo del Instituto Nobel de Física, Estocolmo , Suecia . A finales de 1953 y principios de 1954, el grupo sueco logró sintetizar isótopos ligeros del elemento 100, en particular 250 Fm, bombardeando uranio con núcleos de oxígeno. Estos resultados también se publicaron en 1954. [22] Sin embargo, la prioridad del equipo de Berkeley fue generalmente reconocida, ya que sus publicaciones precedieron al artículo sueco, y se basaron en los resultados previamente no revelados de la explosión termonuclear de 1952; por lo tanto, al equipo de Berkeley se le dio el privilegio de nombrar los nuevos elementos. Como el esfuerzo que había llevado al diseño de Ivy Mike se denominó Proyecto PANDA, [23] el elemento 99 había sido apodado en broma "Pandemonium" [24] pero los nombres oficiales sugeridos por el grupo de Berkeley derivaban de dos científicos prominentes, Einstein y Fermi: "Sugerimos para el nombre del elemento con el número atómico 99, einstenio (símbolo E) en honor a Albert Einstein y para el nombre del elemento con el número atómico 100, fermio (símbolo Fm), en honor a Enrico Fermi ". [11] Tanto Einstein como Fermi murieron entre el momento en que se propusieron originalmente los nombres y cuando se anunciaron. El descubrimiento de estos nuevos elementos fue anunciado por Albert Ghiorso en la primera Conferencia Atómica de Ginebra celebrada del 8 al 20 de agosto de 1955. [7] El símbolo del einstenio se dio primero como "E" y luego se cambió a "Es" por la IUPAC. [25] [26]
Características
Físico

El einstenio es un metal sintético, plateado y radiactivo. En la tabla periódica , se encuentra a la derecha del actínido californio , a la izquierda del actínido fermio y debajo del lantánido holmio , con el que comparte muchas similitudes en propiedades físicas y químicas. Su densidad de 8,84 g/cm 3 es menor que la del californio (15,1 g/cm 3 ) y es casi la misma que la del holmio (8,79 g/cm 3 ), a pesar de que el einstenio es mucho más pesado por átomo que el holmio. El punto de fusión del einstenio (860 °C) también es relativamente bajo, por debajo del californio (900 °C), el fermio (1527 °C) y el holmio (1461 °C). [5] [28] El einstenio es un metal blando, con un módulo volumétrico de solo 15 GPa, uno de los más bajos entre los metales no alcalinos . [29]
A diferencia de los actínidos más ligeros californio , berkelio , curio y americio , que cristalizan en una estructura hexagonal doble en condiciones ambientales; se cree que el einstenio tiene una simetría cúbica centrada en las caras ( fcc ) con el grupo espacial Fm 3 m y la constante reticular a = 575 pm . Sin embargo, existe un informe de metal einstenio hexagonal a temperatura ambiente con a = 398 pm y c = 650 pm , que se convirtió a la fase fcc al calentar a 300 °C. [30]
El daño autoinducido por la radiactividad del einstenio es tan fuerte que destruye rápidamente la red cristalina, [31] y la liberación de energía durante este proceso, 1000 vatios por gramo de 253 Es, induce un brillo visible. [4] Estos procesos pueden contribuir a la densidad y punto de fusión relativamente bajos del einstenio. [32] Además, debido al pequeño tamaño de las muestras disponibles, el punto de fusión del einstenio a menudo se deducía observando la muestra calentándose dentro de un microscopio electrónico. [33] Por lo tanto, los efectos de superficie en muestras pequeñas podrían reducir el punto de fusión.
El metal es trivalente y tiene una volatilidad notablemente alta. [34] Para reducir el daño por autorradiación, la mayoría de las mediciones de einstenio sólido y sus compuestos se realizan justo después del recocido térmico. [35] Además, algunos compuestos se estudian bajo la atmósfera del gas reductor, por ejemplo H 2 O + HCl para EsOCl para que la muestra se regenere parcialmente durante su descomposición. [36]
Además de la autodestrucción del einstenio sólido y sus compuestos, otras dificultades intrínsecas en el estudio de este elemento incluyen la escasez (el isótopo 253 Es más común está disponible solo una o dos veces al año en cantidades inferiores a un miligramo) y la autocontaminación debido a la rápida conversión de einstenio en berkelio y luego en californio a una tasa de aproximadamente 3,3% por día: [37] [38] [39]
Por lo tanto, la mayoría de las muestras de einstenio están contaminadas y sus propiedades intrínsecas suelen deducirse extrapolando datos experimentales acumulados a lo largo del tiempo. Otras técnicas experimentales para evitar el problema de la contaminación incluyen la excitación óptica selectiva de iones de einstenio mediante un láser sintonizable, como en el estudio de sus propiedades de luminiscencia. [40]
Se han estudiado las propiedades magnéticas del metal einstenio, su óxido y fluoruro. Los tres materiales mostraron un comportamiento paramagnético de Curie-Weiss desde el helio líquido hasta la temperatura ambiente. Los momentos magnéticos efectivos se dedujeron como10,4 ± 0,3 μ B para Es 2 O 3 y11,4 ± 0,3 μ B para el EsF 3 , que son los valores más altos entre los actínidos, y las temperaturas de Curie correspondientes son 53 y 37 K. [41] [42]
Químico
Como todos los actínidos, el einstenio es bastante reactivo. Su estado de oxidación trivalente es más estable en sólidos y soluciones acuosas donde induce un color rosa pálido. [43] La existencia de einstenio divalente está firmemente establecida, especialmente en la fase sólida; dicho estado +2 no se observa en muchos otros actínidos, incluidos protactinio , uranio , neptunio , plutonio , curio y berkelio . Los compuestos de einstenio (II) se pueden obtener, por ejemplo, reduciendo einstenio (III) con cloruro de samario (II) . [44]
Isótopos
Se conocen dieciocho isótopos y cuatro isómeros nucleares del einstenio, con números másicos de 240 a 257. [2] Todos son radiactivos; el más estable, el 252 Es, tiene una vida media de 471,7 días. [45] Los siguientes isótopos más estables son el 254 Es (vida media de 275,7 días), [46] el 255 Es (39,8 días) y el 253 Es (20,47 días). Todos los demás isótopos tienen vidas medias inferiores a 40 horas, la mayoría inferiores a 30 minutos. De los cinco isómeros, el más estable es el 254m Es con una vida media de 39,3 horas. [2]
Fisión nuclear
El einstenio tiene una alta tasa de fisión nuclear que da como resultado una masa crítica baja . Esta masa es de 9,89 kilogramos para una esfera desnuda de 254 Es, y puede reducirse a 2,9 kg añadiendo un reflector de neutrones de acero de 30 centímetros de espesor , o incluso a 2,26 kg con un reflector de 20 cm de espesor hecho de agua. Sin embargo, incluso esta pequeña masa crítica excede con creces la cantidad total de einstenio aislado hasta ahora, especialmente del raro 254 Es. [47]
Ocurrencia natural
Debido a la corta vida media de todos los isótopos del einstenio, cualquier einstenio primordial (es decir, el einstenio que podría haber estado presente en la Tierra en el momento de su formación) se ha desintegrado hace mucho tiempo. La síntesis de einstenio a partir de uranio y torio naturales en la corteza terrestre requiere la captura de múltiples neutrones, un evento extremadamente improbable. Por lo tanto, todo el einstenio en la Tierra se produce en laboratorios, reactores nucleares de alta potencia o pruebas nucleares , y existe solo unos pocos años después del momento de la síntesis. [9]
Los elementos transuránicos americio y fermio , incluido el einstenio, fueron creados en el reactor de fisión nuclear natural de Oklo , pero cualquier cantidad producida entonces se habría desintegrado hace mucho tiempo. [48]
El einstenio se observó teóricamente en el espectro de la estrella de Przybylski . [49] Sin embargo, la autora principal de los estudios que encontraron einstenio y otros actínidos de vida corta en la estrella de Przybylski, Vera F. Gopka, admitió que "la posición de las líneas de los elementos radiactivos en búsqueda simplemente se visualizaron en el espectro sintético como marcadores verticales porque no hay ningún dato atómico para estas líneas excepto sus longitudes de onda (Sansonetti et al. 2004), lo que permite calcular sus perfiles con intensidades más o menos reales". [50] Los espectros de firma de los isótopos del einstenio se han analizado exhaustivamente experimentalmente desde entonces (en 2021), [51] aunque no hay ninguna investigación publicada que confirme si las firmas de einstenio teorizadas que se proponen encontrar en el espectro de la estrella coinciden con los resultados determinados en el laboratorio.
Síntesis y extracción

El einstenio se produce en cantidades minúsculas bombardeando actínidos más ligeros con neutrones en reactores nucleares dedicados de alto flujo . Las principales fuentes de irradiación del mundo son el reactor de isótopos de alto flujo (HFIR) de 85 megavatios en el Laboratorio Nacional Oak Ridge (ORNL), Tennessee, EE. UU., [53] y el reactor de bucle SM-2 en el Instituto de Investigación de Reactores Atómicos (NIIAR) en Dimitrovgrad, Rusia , [54] que se dedican a la producción de elementos transcurio ( Z > 96). Estas instalaciones tienen niveles de potencia y flujo similares, y se espera que tengan capacidades de producción comparables para elementos transcurio, [55] aunque las cantidades producidas en NIIAR no se informan ampliamente. En una "campaña de procesamiento típica" en ORNL, se irradian decenas de gramos de curio para producir cantidades de decigramos de californio , miligramos de berkelio ( 249 Bk) y einstenio y picogramos de fermio . [56] [57]
La primera muestra microscópica de 253 Es, que pesaba unos 10 nanogramos , se preparó en 1961 en el HFIR. Se diseñó una balanza magnética especial para estimar su peso. [5] [58] Posteriormente se produjeron lotes más grandes a partir de varios kilogramos de plutonio con rendimientos de einstenio (principalmente 253 Es) de 0,48 miligramos en 1967-1970, 3,2 miligramos en 1971-1973, seguidos de una producción constante de unos 3 miligramos por año entre 1974 y 1978. [59] Sin embargo, estas cantidades se refieren a la cantidad integral en el objetivo justo después de la irradiación. Los procedimientos de separación posteriores redujeron la cantidad de einstenio isotópicamente puro aproximadamente diez veces. [55]
Síntesis de laboratorio
La irradiación de neutrones pesados del plutonio da como resultado cuatro isótopos principales del einstenio: 253 Es (emisor α; vida media de 20,47 días, vida media de fisión espontánea de 7×10 5 años); 254m Es (emisor β, vida media de 39,3 horas), 254 Es (emisor α, vida media de 276 días) y 255 Es (emisor β, vida media de 39,8 días). [60] [61] Una ruta alternativa implica el bombardeo del uranio-238 con haces de iones de nitrógeno u oxígeno de alta intensidad. [62]
El 247 Es (vida media de 4,55 min) se produjo irradiando 241 Am con carbono o 238 U con iones de nitrógeno. [63] La última reacción se realizó por primera vez en 1967 en Dubna, Rusia, y los científicos involucrados recibieron el Premio Lenin Komsomol . [64]
El 248 Es se produjo irradiando 249 Cf con iones de deuterio . Se desintegra principalmente en β a 248 Cf con una vida media de25 ± 5 minutos, pero también libera partículas α de 6,87 MeV; la relación entre partículas β y α es de aproximadamente 400. [65]
Los 249, 250, 251, 252 Es se obtuvieron bombardeando 249 Bk con partículas α. Se liberan de uno a cuatro neutrones, por lo que se forman cuatro isótopos diferentes en una reacción. [66]
El 253 Es se produjo irradiando un objetivo de 0,1 a 0,2 miligramos de 252 Cf con un flujo de neutrones térmicos de (2 a 5) × 10 14 neutrones/(cm 2 ·s) durante 500 a 900 horas: [67]
En 2020, los científicos del ORNL crearon alrededor de 200 nanogramos de 254 Es, lo que permitió estudiar por primera vez algunas propiedades químicas del elemento. [68]
Síntesis en explosiones nucleares

El análisis de los restos de la prueba nuclear de 10 megatones Ivy Mike fue parte de un proyecto a largo plazo. Uno de los objetivos era estudiar la eficiencia de la producción de elementos transuránicos en explosiones nucleares de alta potencia. El motivo de estos experimentos era que la síntesis de dichos elementos a partir del uranio requiere la captura de múltiples neutrones. La probabilidad de tales eventos aumenta con el flujo de neutrones , y las explosiones nucleares son las fuentes de neutrones artificiales más poderosas, proporcionando densidades del orden de 10 23 neutrones/cm 2 en un microsegundo, o alrededor de 10 29 neutrones/(cm 2 ·s). En comparación, el flujo de HFIR es de 5 × 1015 neutrones/(cm 2 ·s). Se instaló un laboratorio específico en el atolón Enewetak para realizar un análisis preliminar de los desechos, ya que algunos isótopos podrían haberse desintegrado para cuando las muestras de desechos llegaran a los Estados Unidos continentales. El laboratorio estaba recibiendo muestras para su análisis lo antes posible, desde aviones equipados con filtros de papel que sobrevolaron el atolón después de las pruebas. Si bien se esperaba descubrir nuevos elementos químicos más pesados que el fermio, ninguno de ellos se encontró ni siquiera después de una serie de explosiones de megatones realizadas entre 1954 y 1956 en el atolón. [8]
Los resultados atmosféricos se complementaron con los datos de pruebas subterráneas acumulados en la década de 1960 en el Sitio de Pruebas de Nevada , ya que se esperaba que las explosiones potentes en un espacio confinado pudieran dar mejores rendimientos e isótopos más pesados. Además de las cargas de uranio tradicionales, se han probado combinaciones de uranio con americio y torio , así como una carga mixta de plutonio-neptunio, pero tuvieron menos éxito en términos de rendimiento y se atribuyó a mayores pérdidas de isótopos pesados debido a mayores tasas de fisión en cargas de elementos pesados. El aislamiento del producto fue problemático ya que las explosiones estaban esparciendo escombros a través de la fusión y vaporización de las rocas circundantes a profundidades de 300 a 600 metros. La perforación a tales profundidades para extraer los productos era lenta e ineficiente en términos de volúmenes recolectados. [8] [69]
De las nueve pruebas subterráneas realizadas entre 1962 y 1969, [70] [71] la última fue la más potente y la que produjo el mayor rendimiento de transuránicos. En un microsegundo se produjeron miligramos de einstenio que normalmente requerirían un año de irradiación en un reactor de alta potencia. [69] Sin embargo, el principal problema práctico de toda la propuesta era recoger los restos radiactivos dispersados por la potente explosión. Los filtros de los aviones adsorbieron sólo ~4 × 10−14 de la cantidad total, y la recolección de toneladas de corales en el atolón Enewetak aumentó esta fracción en solo dos órdenes de magnitud. La extracción de unos 500 kilogramos de rocas subterráneas 60 días después de la explosión de Hutch recuperó solo ~1 × 10−7 de la carga total. La cantidad de elementos transuránicos en este lote de 500 kg fue solo 30 veces mayor que en una roca de 0,4 kg recogida 7 días después de la prueba, lo que demostró la dependencia altamente no lineal del rendimiento de transuránicos en la cantidad de roca radiactiva recuperada. [72] Se perforaron pozos en el sitio antes de la prueba para acelerar la recolección de muestras después de la explosión, de modo que la explosión expulsara material radiactivo desde el epicentro a través de los pozos y hacia volúmenes de recolección cerca de la superficie. Este método se probó en dos pruebas y proporcionó instantáneamente cientos de kilogramos de material, pero con una concentración de actínidos 3 veces menor que en las muestras obtenidas después de la perforación. Si bien dicho método podría haber sido eficiente en estudios científicos de isótopos de vida corta, no pudo mejorar la eficiencia general de recolección de los actínidos producidos. [73]
Aunque no se pudieron detectar elementos nuevos (excepto einstenio y fermio) en los restos de pruebas nucleares, y los rendimientos totales de transuránicos fueron decepcionantemente bajos, estas pruebas proporcionaron cantidades significativamente mayores de isótopos pesados raros que las que estaban disponibles previamente en los laboratorios. [74]
Separación
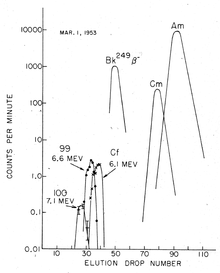
El procedimiento de separación del einstenio depende del método de síntesis. En el caso del bombardeo de iones ligeros dentro de un ciclotrón, el objetivo de iones pesados se adhiere a una lámina delgada, y el einstenio generado simplemente se elimina de la lámina después de la irradiación. Sin embargo, las cantidades producidas en tales experimentos son relativamente bajas. [75] Los rendimientos son mucho mayores para la irradiación del reactor, pero allí, el producto es una mezcla de varios isótopos de actínidos, así como lantánidos producidos en las desintegraciones de fisión nuclear. En este caso, el aislamiento del einstenio es un procedimiento tedioso que implica varios pasos repetidos de intercambio de cationes, a temperatura y presión elevadas, y cromatografía. La separación del berkelio es importante, porque el isótopo de einstenio más común producido en reactores nucleares, 253 Es, se desintegra con una vida media de solo 20 días a 249 Bk, que es rápido en la escala de tiempo de la mayoría de los experimentos. Esta separación se basa en el hecho de que el berkelio se oxida fácilmente al estado sólido +4 y precipita, mientras que otros actínidos, incluido el einstenio, permanecen en su estado +3 en soluciones. [76]
Los actínidos trivalentes se pueden separar de los productos de fisión de los lantánidos mediante una columna de resina de intercambio catiónico utilizando una solución de 90% de agua/10% de etanol saturada con ácido clorhídrico (HCl) como eluyente . Generalmente, se realiza una cromatografía de intercambio aniónico utilizando HCl 6 M como eluyente. Luego se utiliza una columna de resina de intercambio catiónico (columna de intercambio Dowex-50) tratada con sales de amonio para separar las fracciones que contienen los elementos 99, 100 y 101. Estos elementos se pueden identificar simplemente en función de su posición/tiempo de elución, utilizando una solución de α-hidroxiisobutirato (α-HIB), por ejemplo, como eluyente. [77]
Los actínidos 3+ también pueden separarse mediante cromatografía de extracción con disolventes, utilizando ácido bis-(2-etilhexil)fosfórico (abreviado como HDEHP) como fase orgánica estacionaria y ácido nítrico como fase acuosa móvil. La secuencia de elución de los actínidos es inversa a la de la columna de resina de intercambio catiónico. El einstenio separado por este método tiene la ventaja de estar libre de agente complejante orgánico, en comparación con la separación mediante una columna de resina. [77]
Preparación del metal
El einstenio es altamente reactivo, por lo que se requieren agentes reductores fuertes para obtener el metal puro a partir de sus compuestos. [78] Esto se puede lograr mediante la reducción del fluoruro de einstenio (III) con litio metálico :
- EsF3 + 3Li → Es+3LiF
Sin embargo, debido a su bajo punto de fusión y a su alta tasa de daño por autoradiación, el einstenio tiene una presión de vapor más alta que el fluoruro de litio . Esto hace que esta reacción de reducción sea bastante ineficiente. Se intentó en los primeros intentos de preparación y se abandonó rápidamente a favor de la reducción del óxido de einstenio (III) con el metal lantano : [30] [32] [79]
- Es 2 O 3 + 2 La → 2 Es + La 2 O 3
Compuestos químicos
| Compuesto | Color | Simetría | Grupo espacial | No | Símbolo de Pearson | a ( pm ) | b (de la tarde) | c (p.m.) |
|---|---|---|---|---|---|---|---|---|
| Es2O3 | Incoloro | Cúbico [38] | Yo 3 | 206 | cI80 | 1076.6 | ||
| Es2O3 | Incoloro | Monoclínico [80] | C2/m | 12 | mS30 | 1411 | 359 | 880 |
| Es2O3 | Incoloro | Hexagonal [80] | P3m1 | 164 | hP5 | 370 | 600 | |
| ESF3 | Hexagonal [37] | |||||||
| ESF 4 | Monoclínico [81] | C2/c | 15 | mS60 | ||||
| EsCl 3 | Naranja | Hexagonal [82] [83] | C6 3 /m | hP8 | 727 | 410 | ||
| EsBr3 | Amarillo | Monoclínico [84] | C2/m | 12 | mS16 | 727 | 1259 | 681 |
| EsI 3 | Ámbar | Hexagonal [85] [86] | R3 | 148 | hR24 | 753 | 2084 | |
| EsOCl | Tetragonal [85] [87] | P4/nm | 394.8 | 670.2 |
Óxidos
El óxido de einstenio (III) (Es 2 O 3 ) se obtuvo quemando nitrato de einstenio (III). Forma cristales cúbicos incoloros, que se caracterizaron por primera vez a partir de muestras de microgramos de un tamaño de aproximadamente 30 nanómetros. [31] [38] Se conocen otras dos fases, monoclínica y hexagonal, para este óxido. La formación de una determinada fase de Es 2 O 3 depende de la técnica de preparación y del historial de la muestra, y no existe un diagrama de fases claro. Las interconversiones entre las tres fases pueden ocurrir espontáneamente, como resultado de la autoirradiación o el autocalentamiento. [88] La fase hexagonal es isotípica con el óxido de lantano , donde el ion Es 3+ está rodeado por un grupo de 6 coordinados de iones O 2− . [80] [85]
Haluros

Los haluros de einstenio son conocidos por los estados de oxidación +2 y +3. [87] [89] El estado más estable es +3 para todos los haluros, desde el fluoruro hasta el yoduro.
El fluoruro de einstenio(III) (EsF 3 ) se puede precipitar a partir de soluciones de cloruro de Es(III) tras la reacción con iones fluoruro . Un procedimiento de preparación alternativo es la exposición del óxido de Es(III) a trifluoruro de cloro (ClF 3 ) o gas F 2 a una presión de 1–2 atmósferas y una temperatura de 300–400 °C. La estructura cristalina del EsF 3 es hexagonal, como en el fluoruro de californio(III) (CfF 3 ), donde los iones Es 3+ están coordinados óctuplemente por iones flúor en una disposición de prisma trigonal bicapipado . [37] [90] [91]
El cloruro de Es(III) (EsCl 3 ) se puede preparar recociendo óxido de Es(III) en una atmósfera de vapores de cloruro de hidrógeno seco a unos 500 °C durante unos 20 minutos. Cristaliza al enfriarse a unos 425 °C en un sólido naranja con una estructura hexagonal de tipo UCl 3 , donde los átomos de einstenio están coordinados 9 veces por átomos de cloro en una geometría de prisma trigonal tricapped. [83] [90] [92] El bromuro de einstenio(III) (EsBr 3 ) es un sólido de color amarillo pálido con una estructura monoclínica de tipo AlCl 3 , donde los átomos de einstenio están coordinados octaédricamente por bromo (número de coordinación 6). [86] [90]
Los compuestos divalentes del einstenio se obtienen reduciendo los haluros trivalentes con hidrógeno : [93]
- 2EsX3 + H2 → 2EsX2 + 2HX ; X = F, Cl, Br, I
Se han producido cloruro de einstenio (II) (EsCl 2 ), [94] bromuro de einstenio (II) (EsBr 2 ), [95] y yoduro de einstenio (II) (EsI 2 ) [87] y se han caracterizado por absorción óptica, sin que aún se disponga de información estructural. [86]
Los oxihaluros conocidos de einstenio incluyen EsOCl, [87] EsOBr [93] y EsOI. [87] Estas sales se sintetizan tratando un trihaluro con una mezcla de vapor de agua y el haluro de hidrógeno correspondiente: por ejemplo, EsCl 3 + H 2 O/HCl para obtener EsOCl. [36]
Compuestos de organoeinstenio
La alta radiactividad del einstenio tiene un uso potencial en radioterapia , y se han sintetizado complejos organometálicos para administrar einstenio a un órgano apropiado en el cuerpo. Se han realizado experimentos en los que se inyecta citrato de einstenio (así como compuestos de fermio) a perros. [4] El einstenio (III) también se incorporó a complejos de quelato de β-dicetona, ya que los complejos análogos con lantánidos mostraron previamente la luminiscencia excitada por UV más fuerte entre los compuestos metalorgánicos. Al preparar complejos de einstenio, los iones Es 3+ se diluyeron 1000 veces con iones Gd 3+ . Esto permitió reducir el daño por radiación para que los compuestos no se desintegraran durante los 20 minutos necesarios para las mediciones. La luminiscencia resultante de Es 3+ fue demasiado débil para ser detectada. Esto se explicó por las energías relativas desfavorables de los constituyentes individuales del compuesto que obstaculizaron la transferencia eficiente de energía desde la matriz de quelato a los iones Es 3+ . Se llegó a una conclusión similar para el americio, el berkelio y el fermio. [96]
Sin embargo, se observó luminiscencia de iones Es 3+ en soluciones inorgánicas de ácido clorhídrico, así como en soluciones orgánicas con ácido di(2-etilhexil)ortofosfórico. Muestra un pico ancho a unos 1064 nanómetros (ancho medio de unos 100 nm) que puede ser excitado resonantemente por luz verde (longitud de onda de aprox. 495 nm). La luminiscencia tiene una vida útil de varios microsegundos y el rendimiento cuántico por debajo del 0,1%. Las tasas de desintegración no radiativa relativamente altas, en comparación con los lantánidos, en Es 3+ se asociaron con la interacción más fuerte de los electrones f con los electrones internos de Es 3+ . [97]
Aplicaciones
Ningún isótopo del einstenio tiene prácticamente ninguna utilidad fuera de la investigación científica básica destinada a la producción de elementos transuránicos superiores y elementos superpesados . [98]
En 1955, se sintetizó el mendelevio irradiando un blanco compuesto por unos 109 átomos de 253 Es en el ciclotrón de 60 pulgadas del Laboratorio Berkeley. La reacción resultante 253 Es(α,n) 256 Md produjo 17 átomos del nuevo elemento con el número atómico 101. [99]
El isótopo raro 254 Es es el preferido para la producción de elementos superpesados debido a su gran masa, su vida media relativamente larga de 270 días y su disponibilidad en cantidades significativas de varios microgramos. [100] Por lo tanto, el 254 Es se utilizó como objetivo en el intento de síntesis de ununennium (elemento 119) en 1985 bombardeándolo con iones de calcio-48 en el acelerador de partículas lineal superHILAC en Berkeley, California. No se identificaron átomos, lo que estableció un límite superior para la sección transversal de esta reacción en 300 nanobarns . [101]
El 254 Es se utilizó como marcador de calibración en el espectrómetro de análisis químico (" analizador de superficie de dispersión alfa ") de la sonda lunar Surveyor 5. La gran masa de este isótopo redujo la superposición espectral entre las señales del marcador y los elementos más ligeros estudiados de la superficie lunar. [102]
Seguridad
La mayor parte de los datos disponibles sobre la toxicidad del einstenio proceden de investigaciones con animales. Tras la ingestión por ratas , sólo el 0,01% del mismo acaba en el torrente sanguíneo. Desde allí, alrededor del 65% va a los huesos, donde permanecería durante unos 50 años si no fuera por su desintegración radiactiva, por no hablar de la esperanza de vida máxima de 3 años de las ratas, el 25% a los pulmones (vida media biológica de unos 20 años, aunque esto vuelve a ser irrelevante debido a la corta vida media del einstenio), el 0,035% a los testículos o el 0,01% a los ovarios, donde el einstenio permanece indefinidamente. Alrededor del 10% de la cantidad ingerida se excreta. La distribución del einstenio sobre las superficies óseas es uniforme y es similar a la del plutonio. [103]
Referencias
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ abc Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Einstenio Archivado el 19 de mayo de 2021 en Wayback Machine . periodic.lanl.gov
- ^ abc Haire, pág. 1579
- ^ abc Hammond CR "Los elementos" en Lide, DR, ed. (2005). Manual de química y física del CRC (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "Einstenio (Es) | AMERICAN ELEMENTS ®". American Elements: The Materials Science Company . Consultado el 20 de septiembre de 2024 .
- ^ abcdefg Ghiorso, Albert (2003). «Einstenio y fermio». Chemical and Engineering News . 81 (36): 174–175. doi :10.1021/cen-v081n036.p174. Archivado desde el original el 6 de septiembre de 2018 . Consultado el 15 de abril de 2007 .
- ^ abc Seaborg, pág. 39
- ^ de John Emsley (2003). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos. Oxford University Press. pp. 133–135. ISBN 0-19-850340-7Archivado desde el original el 9 de junio de 2016.
- ^ 254 Es, 254 Fm y 253 Fm no se producirían debido a la falta de desintegración beta en 254 Cf y 253 Es
- ^ abc Ghiorso, A.; Thompson, S.; Higgins, G.; Seaborg, G.; Studier, M.; Fields, P.; Fried, S.; Diamond, H.; Mech, J.; Pyle, G.; Huizenga, J.; Hirsch, A.; Manning, W.; Browne, C.; Smith, H.; Spence, R. (1955). "Nuevos elementos einstenio y fermio, números atómicos 99 y 100". Phys. Rev . 99 (3): 1048–1049. Código Bibliográfico :1955PhRv...99.1048G. doi : 10.1103/PhysRev.99.1048 . Archivado desde el original el 2021-05-19 . Consultado el 2010-11-24 . Seaborg, Glenn Theodore (1994), Alquimia moderna: artículos seleccionados de Glenn T. Seaborg, World Scientific, ISBN 9789810214401, archivado desde el original el 13 de abril de 2016
- ^ Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S.; Manning, W.; Pyle, G.; Huizenga, J.; Hirsch, A.; Manning, W.; Browne, C.; Smith, H.; Spence, R. (1956). "Elementos transplutonio en restos de pruebas termonucleares". Physical Review . 102 (1): 180–182. Código Bibliográfico :1956PhRv..102..180F. doi :10.1103/PhysRev.102.180. Archivado desde el original el 23 de abril de 2016 – vía Google Books.
- ^ Byrne, J. (2011). Neutrones, núcleos y materia . Mineola, Nueva York: Dover Publications. ISBN 978-0-486-48238-5.(pbk.) págs. 267.
- ^ Ghiorso, Albert; Rossi, G. Bernard; Harvey, Bernard G. y Thompson, Stanley G. (1954). "Reacciones de U-238 con iones de nitrógeno producidos por ciclotrón". Physical Review . 93 (1): 257. Bibcode :1954PhRv...93..257G. doi :10.1103/PhysRev.93.257. S2CID 121499772.
- ^ Thompson, SG; Ghiorso, A.; Harvey, BG; Choppin, GR (1954). "Isótopos de transcurio producidos en la irradiación neutrónica del plutonio". Physical Review . 93 (4): 908. Bibcode :1954PhRv...93..908T. doi : 10.1103/PhysRev.93.908 . Archivado desde el original el 2020-03-16 . Consultado el 2019-07-14 .
- ^ Harvey, Bernard; Thompson, Stanley; Ghiorso, Albert; Choppin, Gregory (1954). "Further Production of Transcurium Nuclides by Neutron Irradiation". Physical Review . 93 (5): 1129. Bibcode :1954PhRv...93.1129H. doi :10.1103/PhysRev.93.1129. Archivado desde el original el 2020-03-09 . Consultado el 2019-07-14 .
- ^ Studier, M.; Fields, P.; Diamond, H.; Mech, J.; Friedman, A.; Sellers, P.; Pyle, G.; Stevens, C.; Magnusson, L.; Huizenga, J. (1954). "Elementos 99 y 100 del plutonio irradiado en pilas". Physical Review . 93 (6): 1428. Bibcode :1954PhRv...93.1428S. doi :10.1103/PhysRev.93.1428.
- ^ Choppin, GR; Thompson, SG; Ghiorso, A .; Harvey, BG (1954). "Propiedades nucleares de algunos isótopos del californio, elementos 99 y 100". Physical Review . 94 (4): 1080–1081. Bibcode :1954PhRv...94.1080C. doi : 10.1103/PhysRev.94.1080 .
- ^ Campos, P.; Studier, M.; Mech, J.; Diamond, H.; Friedman, A.; Magnusson, L.; Huizenga, J. (1954). "Propiedades adicionales de los isótopos de los elementos 99 y 100". Physical Review . 94 (1): 209–210. Código Bibliográfico :1954PhRv...94..209F. doi :10.1103/PhysRev.94.209.
- ^ Seaborg, GT; Thompson, SG; Harvey, BG y Choppin, GR (23 de julio de 1954), Propiedades químicas de los elementos 99 y 100 (PDF) , archivado desde el original (PDF) el 2019-07-10
{{citation}}: CS1 maint: multiple names: authors list (link)Laboratorio de Radiación, Universidad de California, Berkeley, UCRL-2591 - ^ Thompson, SG; Harvey, BG; Choppin, GR; Seaborg, GT (1954). "Propiedades químicas de los elementos 99 y 100". Journal of the American Chemical Society . 76 (24): 6229–6236. doi :10.1021/ja01653a004. Archivado desde el original el 20 de octubre de 2019 . Consultado el 14 de julio de 2019 .
- ^ Atterling, Hugo; Forsling, Wilhelm; Holm, Lennart; Melander, Lars; Åström, Björn (1954). "Elemento 100 producido por medio de iones de oxígeno acelerados por ciclotrón". Revisión física . 95 (2): 585–586. Código bibliográfico : 1954PhRv...95..585A. doi : 10.1103/PhysRev.95.585.2.
- ^ Richard Lee Miller (1991). Bajo la nube: las décadas de pruebas nucleares . Two-Sixty Press. pág. 115. ISBN 978-1-881043-05-8.
- ^ McPhee, John (1980). La curva de energía de enlace . Farrar, Straus & Giroux Inc. pág. 116. ISBN 978-0-374-51598-0.
- ^ Haire, pág. 1577
- ^ Seaborg, GT (1994). Alquimia moderna: artículos seleccionados de Glenn T. Seaborg. World Scientific. pág. 6. ISBN 981-02-1440-5Archivado desde el original el 9 de junio de 2016..
- ^ Haire, pág. 1580
- ^ Haire, RG (1990) "Propiedades de los metales transplutonio (Am-Fm)", en: Metals Handbook, vol. 2, décima edición, (ASM International, Materials Park, Ohio), págs. 1198-1201.
- ^ Haire, pág. 1591
- ^ ab Haire, R. (1986). "Preparación, propiedades y algunos estudios recientes de los metales actínidos". Journal of the Less Common Metals . 121 : 379–398. doi :10.1016/0022-5088(86)90554-0. S2CID 97518446. Archivado desde el original el 2013-05-13 . Consultado el 2010-11-24 .
- ^ de Greenwood, pág. 1268
- ^ ab Haire, RG; Baybarz, RD (1979). "Estudios del metal einstenio" (PDF) . Le Journal de Physique . 40 : C4–101. doi :10.1051/jphyscol:1979431. S2CID 98493620. Archivado (PDF) desde el original el 7 de marzo de 2012. Consultado el 24 de noviembre de 2010 .Borrador del manuscrito Archivado el 10 de julio de 2019 en Wayback Machine.
- ^ Seaborg, pág. 61
- ^ Kleinschmidt, Phillip D.; Ward, John W.; Matlack, George M.; Haire, Richard G. (1984). "Estudios de vaporización de la Ley de Henry y termodinámica del metal einstenio-253 disuelto en iterbio". The Journal of Chemical Physics . 81 (1): 473–477. Bibcode :1984JChPh..81..473K. doi :10.1063/1.447328.
- ^ Seaborg, pág. 52
- ^ de Seaborg, pág. 60
- ^ abc Ensor, DD; Peterson, JR; Haire, RG; Young, JP (1981). "Estudio espectrofotométrico de absorción de 253 EsF 3 y sus productos de desintegración en estado sólido en fase masiva". Journal of Inorganic and Nuclear Chemistry . 43 (10): 2425–2427. doi :10.1016/0022-1902(81)80274-6.
- ^ abc Haire, RG; Baybarz, RD (1973). "Identificación y análisis de sesquióxido de einstenio por difracción de electrones". Revista de química inorgánica y nuclear . 35 (2): 489–496. doi :10.1016/0022-1902(73)80561-5.
- ^ Seaborg, pág. 55
- ^ Seaborg, pág. 76
- ^ Huray, P.; Nave, S.; Haire, R. (1983). "Magnetismo de los elementos pesados 5f". Revista de metales menos comunes . 93 (2): 293–300. doi :10.1016/0022-5088(83)90175-3.
- ^ Huray, Paul G.; Nave, SE; Haire, RG; Moore, JR (1984). “Propiedades Magnéticas del Es 2 O 3 y EsF 3 ”. Acta química inorgánica . 94 (1–3): 120–122. doi :10.1016/S0020-1693(00)94587-0.
- ^ Holleman, pág. 1956
- ^ Seaborg, pág. 53
- ^ Ahmad, I.; Wagner, Frank (1977). "Vida media del isótopo de einstenio de vida más larga, el 252Es". Revista de química inorgánica y nuclear . 39 (9): 1509–1511. doi :10.1016/0022-1902(77)80089-4.
- ^ McHarris, William; Stephens, F.; Asaro, F.; Perlman, I. (1966). "Esquema de desintegración del einstenio-254". Physical Review . 144 (3): 1031–1045. Código Bibliográfico :1966PhRv..144.1031M. doi :10.1103/PhysRev.144.1031.
- ^ Institut de Radioprotection et de Sûreté Nucléaire, "Evaluación de datos de seguridad de criticidad nuclear y límites para actínidos en el transporte" Archivado el 6 de marzo de 2016 en Wayback Machine , p. 16.
- ^ Emsley, John (2011). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos (Nueva edición). Nueva York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Gopka, VF; Yushchenko, AV; Yushchenko, VA; Panov, IV; Kim, Ch. (2008). "Identificación de líneas de absorción de actínidos de vida media corta en el espectro de la estrella de Przybylski (HD 101065)". Cinemática y física de cuerpos celestes . 24 (2): 89–98. Bibcode :2008KPCB...24...89G. doi :10.3103/S0884591308020049. S2CID 120526363.
- ^ Gopka, VF; Yushchenko, Alexander V.; Shavrina, Angelina V.; Mkrtichian, David E.; Hatzes, Artie P.; Andrievsky, Sergey M.; Chernysheva, Larissa V. (2005). "Sobre las capas radiactivas en estrellas peculiares de la secuencia principal: el fenómeno de la estrella de Przybylski". Actas de la Unión Astronómica Internacional . 2004 : 734–742. doi : 10.1017/S174392130500966X . S2CID 122474778.
- ^ Nothhelfer, S.; Albrecht-Schönzart, Th.E.; Bloque, M.; Chhetri, P.; Düllmann, Ch.E.; Ezold, JG; Gadelshin, V.; Gaiser, A.; Giacoppo, F.; Heinke, R.; Kieck, T.; Kneip, N.; Laatiaoui, M.; Mokry, Ch.; Raeder, S.; Runke, J.; Schneider, F.; Sperling, JM; Studer, D.; Thörle-Pospiech, P.; Trautmann, N.; Weber, F.; Wendt, K. (2022). "Investigaciones de la estructura nuclear de 253-255Es mediante espectroscopia láser". Revisión Física C. 105 . doi : 10.1103/PhysRevC.105.L021302 . S2CID 246603539.
- ^ Seaborg, pág. 51
- ^ "Reactor de isótopos de alto flujo". Laboratorio Nacional de Oak Ridge. Archivado desde el original el 28 de febrero de 2015. Consultado el 23 de septiembre de 2010 .
- ^ Радионуклидные источники и препараты (en ruso). Instituto de Investigación de Reactores Atómicos. Archivado desde el original el 26 de julio de 2020 . Consultado el 26 de septiembre de 2010 .
- ^ de Haire, pág. 1582
- ^ Greenwood, pág. 1262
- ^ Porter, CE; Riley, FD Jr.; Vandergrift, RD; Felker, LK (1997). "Purificación de fermio mediante cromatografía de extracción con resina de Teva". Sep. Sci. Technol . 32 (1–4): 83–92. doi :10.1080/01496399708003188. Archivado desde el original el 2020-03-11 . Consultado el 2018-05-18 .
- ^ Hoffman, Darleane C.; Ghiorso, Albert y Seaborg, Glenn Theodore (2000) The Transuranium People: The Inside Story , Imperial College Press, págs. 190-191, ISBN 978-1-86094-087-3 .
- ^ Seaborg, págs. 36-37
- ^ Jones, M.; Schuman, R.; Butler, J.; Cowper, G.; Eastwood, T.; Jackson, H. (1956). "Isótopos de einstenio y fermio producidos por irradiación neutrónica de plutonio". Physical Review . 102 (1): 203–207. Código Bibliográfico :1956PhRv..102..203J. doi :10.1103/PhysRev.102.203.
- ^ Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Chinese Physics C . 41 (3): 030001. Bibcode :2017ChPhC..41c0001A. doi :10.1088/1674-1137/41/3/030001.
- ^ Guseva, L.; Filippova, K.; Gerlit, Y.; Druin, V.; Myasoedov, B.; Tarantin, N. (1956). "Experimentos sobre la producción de einstenio y fermio con un ciclotrón". Journal of Nuclear Energy . 3 (4): 341–346. doi :10.1016/0891-3919(56)90064-X.
- ^ Harry H. Binder: Lexikon der chemischen Elemente , S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 , págs.
- ^ Эйнштейний Archivado el 19 de mayo de 2021 en Wayback Machine (en ruso, un artículo popular de uno de los científicos involucrados)
- ^ Chetham-Strode, A.; Holm, L. (1956). "Nuevo isótopo einstenio-248". Physical Review . 104 (5): 1314. Bibcode :1956PhRv..104.1314C. doi :10.1103/PhysRev.104.1314. S2CID 102836584.
- ^ Harvey, Bernard; Chetham-Strode, Alfred; Ghiorso, Albert; Choppin, Gregory; Thompson, Stanley (1956). "Nuevos isótopos del einstenio". Physical Review . 104 (5): 1315–1319. Código Bibliográfico :1956PhRv..104.1315H. doi :10.1103/PhysRev.104.1315. Archivado desde el original el 2020-03-12 . Consultado el 2019-07-14 .
- ^ Kulyukhin, S.; Auerman, LN; Novichenko, VL; Mikheev, NB; Rumer, IA; Kamenskaya, AN; Goncharov, LA; Smirnov, AI (1985). "Producción de cantidades de microgramos de einstenio-253 mediante la irradiación de californio en un reactor". Acta química inorgánica . 110 : 25-26. doi :10.1016/S0020-1693(00)81347-X.
- ^ Carter, Korey P.; Shield, Katherine M.; Smith, Kurt F.; Jones, Zachary R.; Wacker, Jennifer N.; Arnedo-Sanchez, Leticia; Mattox, Tracy M.; Moreau, Liane M.; Knope, Karah E.; Kozimor, Stosh A.; Booth, Corwin H.; Abergel, Rebecca J. (3 de febrero de 2021). "Caracterización estructural y espectroscópica de un complejo de einstenio". Nature . 590 (7844): 85–88. Código Bibliográfico :2021Natur.590...85C. doi :10.1038/s41586-020-03179-3. OSTI 1777970. PMID 33536647. S2CID 231805413. Archivado desde el original el 3 de febrero de 2021 . Consultado el 3 de febrero de 2021 .
- ^ abc Seaborg, pág. 40
- ^ Estos fueron nombrados en código: "Anacostia" (5,2 kilotones , 1962), "Kennebec" (<5 kilotones, 1963), "Par" (38 kilotones, 1964), "Barbel" (<20 kilotones, 1964), "Tweed" (<20 kilotones, 1965), "Cyclamen" (13 kilotones, 1966), "Kankakee" (20-200 kilotones, 1966), "Vulcan" (25 kilotones, 1966) y "Hutch" (20-200 kilotones, 1969)
- ^ Pruebas nucleares de Estados Unidos de julio de 1945 a septiembre de 1992 Archivado el 15 de junio de 2010 en Wayback Machine ., DOE/NV--209-REV 15, diciembre de 2000.
- ^ Seaborg, pág. 43
- ^ Seaborg, pág. 44
- ^ Seaborg, pág. 47
- ^ Haire, pág. 1583
- ^ Haire, págs. 1584-1585
- ^ ab Hall, Nina (2000). La nueva química. Cambridge University Press. pp. 9-11. ISBN 978-0-521-45224-3Archivado desde el original el 20 de mayo de 2016. Consultado el 5 de enero de 2016 .
- ^ Haire, pág. 1588
- ^ Haire, pág. 1590
- ^ abc Haire, RG y Eyring, L. (1994). "Química de los lantánidos y actínidos". En KA Gscheidner, Jr.; et al. (eds.). Manual sobre la física y la química de las tierras raras . Vol. 18. North-Holland, Nueva York. págs. 414–505. ISBN 978-0-444-81724-2.
{{cite book}}: CS1 maint: location missing publisher (link) - ^ Kleinschmidt, P. (1994). "Termoquímica de los actínidos". Journal of Alloys and Compounds . 213–214: 169–172. doi :10.1016/0925-8388(94)90898-2. Archivado desde el original el 2020-03-16 . Consultado el 2019-07-14 .
- ^ Fujita, D.; Cunningham, B. B.; Parsons, T. C. (1969). "Estructuras cristalinas y parámetros reticulares del tricloruro de einstenio y del oxicloruro de einstenio". Inorganic and Nuclear Chemistry Letters . 5 (4): 307–313. doi :10.1016/0020-1650(69)80203-5. Archivado desde el original el 2020-03-13 . Consultado el 2019-07-14 .
- ^ ab Miasoedov, BF Química analítica de elementos transplutonio, Wiley, 1974 (Original de la Universidad de California), ISBN 0-470-62715-8 , p. 99
- ^ Fellows, R.; Peterson, JR; Noé, M.; Young, JP; Haire, RG (1975). "Difracción de rayos X y estudios espectroscópicos del bromuro de einstenio(III) cristalino, 253 EsBr 3 ". Inorganic and Nuclear Chemistry Letters . 11 (11): 737–742. doi :10.1016/0020-1650(75)80090-0.
- ^ abc Haire, págs. 1595-1596
- ^ abc Seaborg, pág. 62
- ^ abcde Young, JP; Haire, RG; Peterson, JR; Ensor, DD; Fellow, RL (1981). "Consecuencias químicas de la desintegración radiactiva. 2. Estudio espectrofotométrico del crecimiento interno de berkelio-249 y californio-249 en haluros de einstenio-253". Química inorgánica . 20 (11): 3979–3983. doi :10.1021/ic50225a076.
- ^ Haire, pág. 1598
- ^ Holleman, pág. 1969
- ^ abc Greenwood, pág. 1270
- ^ Young, JP; Haire, RG; Fellows, RL; Peterson, JR (1978). "Estudios espectrofotométricos de haluros y oxihaluros de elementos transcurio en estado sólido". Journal of Radioanalytical Chemistry . 43 (2): 479–488. Bibcode :1978JRNC...43..479Y. doi :10.1007/BF02519508. S2CID 95361392.
- ^ Fujita, D.; Cunningham, B. B.; Parsons, T. C.; Peterson, J. R. (1969). "El espectro de absorción de la solución de Es3+". Inorganic and Nuclear Chemistry Letters . 5 (4): 245–250. doi :10.1016/0020-1650(69)80192-3. Archivado desde el original el 2020-03-09 . Consultado el 2019-07-14 .
- ^ ab Peterson, JR; et al. (1979). "Preparación, caracterización y desintegración del einstenio(II) en estado sólido" (PDF) . Le Journal de Physique . 40 (4): C4–111. CiteSeerX 10.1.1.729.8671 . doi :10.1051/jphyscol:1979435. S2CID 95575017. Archivado (PDF) desde el original el 2012-03-07 . Consultado el 2010-11-24 . Borrador del manuscrito Archivado el 13 de mayo de 2013 en Wayback Machine.
- ^ Fellows, RL; Young, JP; Haire, RG y Peterson JR (1977) en: GJ McCarthy y JJ Rhyne (eds) The Rare Earths in Modern Science and Technology , Plenum Press, Nueva York, págs. 493–499.
- ^ Young, JP; Haire RG, Fellows, RL; Noe, M. y Peterson, JR (1976) "Estudios espectroscópicos y de difracción de rayos X de los bromuros de californio-249 y einstenio-253", en: W. Müller y R. Lindner (eds.) Plutonium 1975 , North Holland, Ámsterdam, págs. 227-234.
- ^ Nugent, Leonard J.; Burnett, JL; Baybarz, RD; Werner, George Knoll; Tanner, SP; Tarrant, JR; Keller, OL (1969). "Transferencia de energía intramolecular y luminiscencia sensibilizada en quelatos de actínido(III) .beta.-dicetona". The Journal of Physical Chemistry . 73 (5): 1540–1549. doi :10.1021/j100725a060.
- ^ Beitz, J.; Wester, D.; Williams, C. (1983). "Interacción del estado 5f con ligandos de esfera de coordinación interna: fluorescencia del ion Es 3+ en fases acuosas y orgánicas". Journal of the Less Common Metals . 93 (2): 331–338. doi :10.1016/0022-5088(83)90178-9.
- ^ Es elemental: el elemento einstenio Archivado el 10 de julio de 2019 en Wayback Machine . Consultado el 2 de diciembre de 2007.
- ^ Ghiorso, A.; Harvey, B.; Choppin, G.; Thompson, S.; Seaborg, G. (1955). "Nuevo elemento mendelevio, número atómico 101". Physical Review . 98 (5): 1518–1519. Bibcode :1955PhRv...98.1518G. doi : 10.1103/PhysRev.98.1518 . ISBN 978-981-02-1440-1Archivado desde el original el 18 de mayo de 2016. Consultado el 5 de enero de 2016 .
- ^ Schadel, M.; Bruchle, W.; Brugger, M.; Gaggeler, H.; Moody, K.; Schardt, D.; Summerer, K.; Hulet, E.; Dougan, A.; Dougan, R.; Landrum, J.; Lougheed, R.; Wild, J.; O'Kelley, G.; Hahn, R. (1986). "Producción de isótopos pesados mediante reacciones de transferencia multinucleónica con 254Es". Journal of the Less Common Metals . 122 : 411–417. doi :10.1016/0022-5088(86)90435-2. Archivado desde el original el 25 de noviembre de 2020 . Consultado el 29 de octubre de 2018 .
- ^ Lougheed, RW; Landrum, JH; Hulet, EK; Wild, JF; Dougan, RJ; Dougan, AD; Gäggeler, H.; Schädel, M.; Moody, KJ; Gregorich, KE y Seaborg, GT (1985). "Búsqueda de elementos superpesados mediante la reacción 48 Ca + 254 Es g ". Physical Review C . 32 (5): 1760–1763. Bibcode :1985PhRvC..32.1760L. doi :10.1103/PhysRevC.32.1760. PMID 9953034.
- ^ Turkevich, AL; Franzgrote, EJ; Patterson, JH (1967). "Análisis químico de la Luna en el lugar de aterrizaje del Surveyor V". Science . 158 (3801): 635–637. Bibcode :1967Sci...158..635T. doi :10.1126/science.158.3801.635. PMID 17732956. S2CID 21286144.
- ^ Comisión Internacional de Protección Radiológica (1988). Límites de ingestión de radionucleidos por parte de los trabajadores, Parte 4. Vol. 19. Elsevier Health Sciences. Págs. 18-19. ISBN. 978-0-08-036886-3Archivado desde el original el 25 de abril de 2016. Consultado el 5 de enero de 2016 .
Bibliografía
- Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth–Heinemann. ISBN 978-0080379418.
- Haire, Richard G. (2006). "Einstenio". En Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). La química de los elementos actínidos y transactínidos (PDF) . Vol. 3 (3.ª ed.). Dordrecht, Países Bajos: Springer. págs. 1577–1620. doi :10.1007/1-4020-3598-5_12. ISBN . 978-1-4020-3555-5. Archivado desde el original (PDF) el 17 de julio de 2010.
- Holleman, Arnold F. y Wiberg, Nils (2007). Libro de texto de química inorgánica (102ª ed.). Berlín: de Gruyter. ISBN 978-3-11-017770-1.
- Seaborg, GT, ed. (23 de enero de 1978). Actas del Simposio en conmemoración del 25º aniversario de los elementos 99 y 100 (PDF) . Informe LBL-7701.
Enlaces externos
- El einstenio en la tabla periódica de vídeos (Universidad de Nottingham)
- Factores relacionados con la edad en el metabolismo y la dosimetría de radionúclidos: Actas – contiene varios estudios relacionados con la salud del einstenio




![{\displaystyle {\ce {^{238}_{92}U->[{\ce {+6(n,\gamma )}}][-2\ \beta ^{-}]{}_{94 }^{244}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adc5607f4aa66702f7f8331613b838b19e5fbccc)
![{\displaystyle {\ce {^{238}_{92}U ->[{\ce {+15n}}][6 \beta^-] ^{253}_{98}Cf ->[\beta^ -] ^{253}_{99}Es}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54c4fccdd01ebda8ab75c3aac855a348c6f5ea2c)
![{\displaystyle {\ce {^{252}_{98}Cf ->[{\ce {(n,\gamma)}}] ^{253}_{98}Cf ->[\beta^-][ 17.81 {\ce {d}}] ^{253}_{99}Es ->[{\ce {(n,\gamma)}}] ^{254}_{99}Es ->[\beta^- ] ^{254}_{100}FM}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63f13874738d0dfe8637d3dd71bef4ba0cbc6b14)
![{\displaystyle {\ce {^{253}_{99}Es ->[\alpha][20 {\ce {d}}] ^{249}_{97}Bk ->[\beta^-][ 314 {\ce {d}}] ^{249}_{98}Cf}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/864c693290ca15763e10e38145d86820f7ebe7d3)
![{\displaystyle {\ce {^{249}_{98}Cf + ^{2}_{1}H -> ^{248}_{99}Es + 3^{1}_{0}n}} \quad \left({\ce {^{248}_{99}Es ->[\epsilon][27 {\ce {min}}] ^{248}_{98}Cf}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69e370a8ba5d797ee936149909f858d66b3f9edb)
![{\displaystyle {\ce {^{249}_{97}Bk ->[+\alpha] ^{249,250,251,252}_{99}Es}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46af865ac0b1463965f1790285f36a01d24eb318)
![{\displaystyle {\ce {^{252}_{98}Cf ->[{\ce {(n,\gamma)}}] ^{253}_{98}Cf ->[\beta^-][ 17.81 {\ce {d}}] ^{253}_{99}Es}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45d75d0f0badaf920ba511372718f8dc284b9587)


