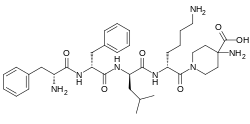
Difelikefalina
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Corsuva |
| Otros nombres | CR845, FE-202845, ácido D-Phe-D-Phe-D-Leu-D-Lys-[γ-(4-N-piperidinil)aminocarboxílico] [1] |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Intravenoso |
| Clase de droga | Agonista del receptor opioide kappa |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 100% ( IV ) [10] |
| Metabolismo | No metabolizado [10] |
| Vida media de eliminación | 2 horas [10] |
| Excreción | Se excreta como fármaco inalterado a través de la bilis y la orina [10] |
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| Química biológica |
|
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C36H53N7O6 |
| Masa molar | 679,863 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
La difelikefalina , comercializada bajo la marca Korsuva , es un péptido opioide utilizado para el tratamiento del prurito moderado a intenso . Actúa como un agonista altamente selectivo y de restricción periférica del receptor opioide κ (KOR). [10] [11] [12] [13]
La difelikefalina actúa como analgésico al activar los KOR en las terminales nerviosas periféricas y los KOR expresados por ciertas células del sistema inmunológico . [10] La activación de los KOR en las terminales nerviosas periféricas da como resultado la inhibición de los canales iónicos responsables de la actividad nerviosa aferente , lo que provoca una reducción de la transmisión de señales de dolor, mientras que la activación de los KOR expresados por las células del sistema inmunológico da como resultado una reducción de la liberación de mediadores proinflamatorios y sensibilizadores de los nervios (p. ej., prostaglandinas ). [10]
La difelikefalina fue aprobada para uso médico en los Estados Unidos en agosto de 2021. [8] [14] [15] La Administración de Alimentos y Medicamentos de los Estados Unidos la considera un medicamento de primera clase . [16]
Sociedad y cultura
Estatus legal
El 24 de febrero de 2022, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Kapruvia, destinado al tratamiento del prurito moderado a severo asociado a la enfermedad renal crónica. [17] El solicitante de este medicamento es Vifor Fresenius Medical Care Renal Pharma France. [17] La difelikefalina fue aprobada para uso médico en la Unión Europea en abril de 2022. [9] [18]
Investigación
Cara Therapeutics lo está desarrollando como un agente intravenoso para el tratamiento del dolor posoperatorio . [10] [11] [13] También se ha desarrollado una formulación oral . [13] Debido a su selectividad periférica, la difelikefalina carece de los efectos secundarios centrales como sedación , disforia y alucinaciones de los analgésicos de acción KOR anteriores, como la pentazocina y la fenazocina . [10] [11] Además de su uso como analgésico, la difelikefalina también se está investigando para el tratamiento del prurito (picazón). [10] [11] [12] La difelikefalina ha completado ensayos clínicos de fase II para el dolor posoperatorio y ha demostrado una eficacia clínica significativa y "robusta", además de ser segura y bien tolerada. [11] [13] También ha completado un ensayo clínico de fase III para el prurito urémico en pacientes en hemodiálisis . [19]
Referencias
- ^ Janecka A, Perlikowska R, Gach K, Wyrebska A, Fichna J (2010). "Desarrollo de análogos de péptidos opioides para el alivio del dolor". Current Pharmaceutical Design . 16 (9): 1126–1135. doi :10.2174/138161210790963869. PMID 20030621.
- ^ ab "Korsuva". Therapeutic Goods Administration (TGA) . 25 de noviembre de 2022. Archivado desde el original el 5 de febrero de 2023. Consultado el 7 de abril de 2023 .
- ^ "Actualizaciones de la base de datos de prescripción de medicamentos durante el embarazo". Therapeutic Goods Administration (TGA) . 21 de diciembre de 2022. Archivado desde el original el 3 de abril de 2022. Consultado el 2 de enero de 2023 .
- ^ https://www.tga.gov.au/resources/auspar/auspar-korsuva [ URL básica ]
- ^ "Monografía del producto" (PDF) . Health Canada . Archivado (PDF) del original el 1 de octubre de 2022 . Consultado el 7 de abril de 2023 .
- ^ "Base resumida de la decisión - Korsuva". Health Canada . 23 de octubre de 2014. Archivado desde el original el 24 de enero de 2023. Consultado el 24 de enero de 2023 .
- ^ "Detalles de: Korsuva". Health Canada . 6 de febrero de 2023. Archivado desde el original el 3 de marzo de 2024 . Consultado el 3 de marzo de 2024 .
- ^ ab "Korsuva- difelikefalin injection, solution". DailyMed . Archivado desde el original el 12 de septiembre de 2021 . Consultado el 12 de septiembre de 2021 .
- ^ ab «Kapruvia EPAR». Agencia Europea de Medicamentos (EMA) . 22 de febrero de 2022. Archivado desde el original el 6 de mayo de 2022. Consultado el 28 de abril de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ abcdefghij Chalmers D (14 de octubre de 2010). "Agonistas kappa periféricos". En Sinatra RS, Jahr JS, Watkins-Pitchford JM (eds.). La esencia de la analgesia y los analgésicos . Cambridge University Press. págs. 490–491. ISBN 978-1-139-49198-3.
- ^ abcde Apfelbaum J (8 de septiembre de 2014). Anestesia ambulatoria, un número de Anesthesiology Clinics. Elsevier Health Sciences. págs. 190–. ISBN 978-0-323-29934-3.
- ^ ab Leslie TA, Greavers MW, Yosipovitch G (10 de abril de 2015). "Terapias tópicas y sistémicas actuales para el prurito". En Cowan A, Yosipovitch G (eds.). Farmacología del prurito . Springer. págs. 307–. ISBN 978-3-662-44605-8.
- ^ abcd Goli V, Pryde D, Omoto K (2013). "Opioides orales". En Allerton C (ed.). Terapéutica del dolor: paradigmas de tratamiento actuales y futuros . Royal Society of Chemistry. págs. 56–. ISBN 978-1-84973-645-9.
- ^ "Korsuva: medicamentos aprobados por la FDA". Administración de Alimentos y Medicamentos de Estados Unidos . Archivado desde el original el 25 de agosto de 2021. Consultado el 24 de agosto de 2021 .
- ^ "Vifor Pharma y Cara Therapeutics anuncian la aprobación por parte de la FDA de EE. UU. de la inyección de Korsuva para el tratamiento del prurito de moderado a severo en pacientes en hemodiálisis" (Comunicado de prensa). Vifor Pharma. 24 de agosto de 2021. Archivado desde el original el 24 de agosto de 2021 . Consultado el 24 de agosto de 2021 – vía Business Wire.
- ^ Promoción de la salud mediante la innovación: aprobaciones de nuevos tratamientos farmacológicos en 2021 (PDF) . Administración de Alimentos y Medicamentos de Estados Unidos (FDA) (informe). 13 de mayo de 2022. Archivado desde el original el 6 de diciembre de 2022 . Consultado el 22 de enero de 2023 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ ab «Kapruvia: pendiente de decisión de la CE». Agencia Europea de Medicamentos . 24 de febrero de 2022. Archivado desde el original el 27 de octubre de 2022. Consultado el 26 de febrero de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ «Información del producto Kapruvia». Registro de medicamentos de la Unión . Archivado desde el original el 4 de marzo de 2023. Consultado el 3 de marzo de 2023 .
- ^ Fishbane S, Jamal A, Munera C, Wen W, Menzaghi F (enero de 2020). "Un ensayo de fase 3 de difelikefalina en pacientes en hemodiálisis con prurito". La Revista de Medicina de Nueva Inglaterra . 382 (3): 222–232. doi : 10.1056/NEJMoa1912770 . PMID 31702883.
Enlaces externos
- Número de ensayo clínico NCT03422653 para "Un estudio para evaluar la seguridad y eficacia de CR845 en pacientes de hemodiálisis con prurito moderado a severo (KALM-1)" en ClinicalTrials.gov
- Número de ensayo clínico NCT03636269 para "CR845-CLIN3103: Un estudio global para evaluar la seguridad y eficacia de CR845 en pacientes de hemodiálisis con prurito moderado a severo (KALM-2)" en ClinicalTrials.gov

