Hidrógeno
El hidrógeno es un elemento químico ; tiene símbolo H y número atómico 1. Es el elemento más ligero y, en condiciones estándar , es un gas de moléculas diatómicas con la fórmula H 2 , a veces llamado dihidrógeno , [11] pero más comúnmente llamado gas hidrógeno , hidrógeno molecular o simplemente hidrógeno. Es incoloro, inodoro, [12] no tóxico y altamente combustible . Constituyendo aproximadamente el 75% de toda la materia normal , el hidrógeno es el elemento químico más abundante en el universo . [13] [nota 1] Las estrellas , incluido el Sol , consisten principalmente en hidrógeno en estado de plasma , mientras que en la Tierra, el hidrógeno se encuentra en el agua , compuestos orgánicos , como dihidrógeno y en otras formas moleculares . El isótopo más común del hidrógeno (protio, 1 H) consiste en un protón , un electrón y ningún neutrón .
En el universo primitivo , la formación de los protones del hidrógeno se produjo en el primer segundo después del Big Bang ; los átomos de hidrógeno neutros sólo se formaron unos 370.000 años después durante la época de la recombinación , cuando el universo se enfrió y el plasma se había enfriado lo suficiente para que los electrones permanecieran unidos a los protones. [14] El hidrógeno, normalmente no metálico excepto bajo presión extrema , forma fácilmente enlaces covalentes con la mayoría de los no metales, lo que contribuye a la formación de compuestos como el agua y varias sustancias orgánicas. Su papel es crucial en las reacciones ácido-base , que implican principalmente el intercambio de protones entre moléculas solubles. En los compuestos iónicos , el hidrógeno puede adoptar la forma de un anión con carga negativa , donde se le conoce como hidruro , o como un catión con carga positiva , H + . El catión, normalmente sólo un protón (símbolo p ), exhibe un comportamiento específico en soluciones acuosas y en los compuestos iónicos implica el apantallamiento de su carga eléctrica por las moléculas polares o aniones circundantes . La posición única del hidrógeno como el único átomo neutro para el cual se puede resolver directamente la ecuación de Schrödinger , ha contribuido significativamente a los principios fundamentales de la mecánica cuántica a través de la exploración de su energía y enlace químico . [15]
El gas hidrógeno se produjo artificialmente por primera vez a principios del siglo XVI mediante la reacción de ácidos con metales. Henry Cavendish , entre 1766 y 1781, identificó el gas hidrógeno como una sustancia distinta [16] y descubrió su propiedad de producir agua cuando se quemaba; de ahí que su nombre significa "formador de agua" en griego.
La mayor parte de la producción de hidrógeno se produce mediante reformado con vapor de gas natural ; una porción más pequeña proviene de métodos de alto consumo energético, como la electrólisis del agua . [17] [18] Sus principales usos industriales incluyen el procesamiento de combustibles fósiles , como el hidrocraqueo , y la producción de amoníaco , con usos emergentes en celdas de combustible para la generación de electricidad y como fuente de calor. [19] Cuando se utiliza en celdas de combustible, la única emisión de hidrógeno en el punto de uso es vapor de agua, [19] aunque la combustión puede producir óxidos de nitrógeno . [19] La interacción del hidrógeno con metales puede causar fragilización . [20]
Propiedades
Combustión

El gas hidrógeno es altamente inflamable:
- 2 H 2 (g) + O 2 (g) → 2 H 2 O(l) (572 kJ/2 mol = 286 kJ/mol = 141,865 MJ/kg) [nota 2]
Entalpía de combustión : −286 kJ/mol. [21]
El gas hidrógeno forma mezclas explosivas con el aire en concentraciones de 4 a 74 % [22] y con cloro en concentraciones de 5 a 95 %. La temperatura de autoignición del hidrógeno , la temperatura de ignición espontánea en el aire, es de 500 °C (932 °F). [23]
Llama
Las llamas de hidrógeno y oxígeno puro emiten luz ultravioleta y, con una mezcla alta de oxígeno, son casi invisibles a simple vista, como lo ilustra la tenue columna de humo del motor principal del transbordador espacial , en comparación con la columna altamente visible de un cohete propulsor sólido del transbordador espacial , que utiliza un compuesto de perclorato de amonio . La detección de una fuga de hidrógeno en llamas puede requerir un detector de llamas ; tales fugas pueden ser muy peligrosas. Las llamas de hidrógeno en otras condiciones son azules, parecidas a las llamas azules del gas natural. [24] La destrucción del dirigible Hindenburg fue un ejemplo notorio de combustión de hidrógeno y la causa aún se debate. Las llamas visibles en las fotografías fueron el resultado de la quema de compuestos de carbono en la piel del dirigible. [25]
Reactivos
El H2 no es reactivo en comparación con elementos diatómicos como los halógenos o el oxígeno. La base termodinámica de esta baja reactividad es el enlace H–H muy fuerte, con una energía de disociación de enlace de 435,7 kJ/mol. [26] La base cinética de la baja reactividad es la naturaleza no polar del H2 y su débil polarizabilidad. Reacciona espontáneamente con cloro y flúor para formar cloruro de hidrógeno y fluoruro de hidrógeno , respectivamente. [27] La reactividad del H2 se ve fuertemente afectada por la presencia de catalizadores metálicos. Por lo tanto, mientras que las mezclas de H2 con O2 o aire se queman fácilmente cuando se calientan a al menos 500 °C mediante una chispa o llama, no reaccionan a temperatura ambiente en ausencia de un catalizador.
Niveles de energía de los electrones

El nivel de energía del estado fundamental del electrón en un átomo de hidrógeno es −13,6 eV , [28] equivalente a un fotón ultravioleta de una longitud de onda de aproximadamente 91 nm. [29]
Los niveles de energía del hidrógeno se pueden calcular con bastante precisión utilizando el modelo de Bohr del átomo, en el que el electrón "orbita" alrededor del protón, de la misma manera que la Tierra orbita alrededor del Sol. Sin embargo, el electrón y el protón se mantienen unidos por atracción electrostática, mientras que los planetas y los objetos celestes se mantienen unidos por la gravedad . Debido a la discretización del momento angular postulada en la mecánica cuántica temprana por Bohr, el electrón en el modelo de Bohr solo puede ocupar ciertas distancias permitidas del protón y, por lo tanto, solo ciertas energías permitidas. [30]
Una descripción más precisa del átomo de hidrógeno proviene de un análisis cuántico que utiliza la ecuación de Schrödinger , la ecuación de Dirac o la formulación de la integral de trayectoria de Feynman para calcular la densidad de probabilidad del electrón alrededor del protón. [31] Las fórmulas más complejas incluyen los pequeños efectos de la relatividad especial y la polarización del vacío . En el tratamiento mecánico cuántico, el electrón en un átomo de hidrógeno en estado fundamental no tiene momento angular, lo que ilustra cómo la "órbita planetaria" difiere del movimiento del electrón.
Isómeros de espín
El H 2 molecular existe como dos isómeros de espín, es decir, compuestos que difieren solo en los estados de espín de sus núcleos. [32] En la forma ortohidrógeno , los espines de los dos núcleos son paralelos, formando un estado triplete de espín que tiene un espín molecular total ; en la forma parahidrógeno los espines son antiparalelos y forman un estado singlete de espín que tiene espín . La relación de equilibrio de orto- a para-hidrógeno depende de la temperatura. A temperatura ambiente o más cálida, el gas hidrógeno en equilibrio contiene aproximadamente el 25% de la forma para y el 75% de la forma orto. [33] La forma orto es un estado excitado , que tiene una energía más alta que la forma para en 1,455 kJ/mol, [34] y se convierte a la forma para en el transcurso de varios minutos cuando se enfría a baja temperatura. [35] Las propiedades térmicas de las formas difieren porque difieren en sus estados cuánticos rotacionales permitidos , lo que resulta en diferentes propiedades térmicas como la capacidad calorífica. [36]
La relación orto-para en H2 es una consideración importante en la licuefacción y el almacenamiento de hidrógeno líquido : la conversión de orto a para es exotérmica y produce suficiente calor para evaporar la mayor parte del líquido si no se convierte primero en parahidrógeno durante el proceso de enfriamiento. [37] Los catalizadores para la interconversión orto-para, como el óxido férrico y los compuestos de carbón activado , se utilizan durante el enfriamiento del hidrógeno para evitar esta pérdida de líquido. [38]
Fases


- Hidrógeno gaseoso
- Hidrógeno líquido
- Hidrógeno granizado
- Hidrógeno sólido
- Hidrógeno metálico
- Hidrógeno de plasma
Compuestos
Compuestos covalentes y orgánicos
Si bien el H2 no es muy reactivo en condiciones estándar, forma compuestos con la mayoría de los elementos. El hidrógeno puede formar compuestos con elementos que son más electronegativos , como los halógenos (F, Cl, Br, I) o el oxígeno ; en estos compuestos, el hidrógeno adquiere una carga positiva parcial. [39] Cuando se une a un elemento más electronegativo, en particular flúor , oxígeno o nitrógeno , el hidrógeno puede participar en una forma de enlace no covalente de fuerza media con otro elemento electronegativo con un par solitario, un fenómeno llamado enlace de hidrógeno que es fundamental para la estabilidad de muchas moléculas biológicas. [40] [41] El hidrógeno también forma compuestos con elementos menos electronegativos, como metales y metaloides , donde adquiere una carga negativa parcial. Estos compuestos a menudo se conocen como hidruros . [42]
El hidrógeno forma muchos compuestos con el carbono llamados hidrocarburos , y aún más con heteroátomos que, por su asociación con los seres vivos, se denominan compuestos orgánicos . [43] El estudio de sus propiedades se conoce como química orgánica [44] y su estudio en el contexto de los organismos vivos se llama bioquímica . [45] Según algunas definiciones, los compuestos "orgánicos" solo deben contener carbono. Sin embargo, la mayoría de ellos también contienen hidrógeno, y debido a que es el enlace carbono-hidrógeno el que da a esta clase de compuestos la mayoría de sus características químicas particulares, los enlaces carbono-hidrógeno son necesarios en algunas definiciones de la palabra "orgánico" en química. [43] Se conocen millones de hidrocarburos , y generalmente se forman por vías complicadas que rara vez involucran hidrógeno elemental.
El hidrógeno es altamente soluble en muchos metales de transición y tierras raras [46] y es soluble tanto en metales nanocristalinos como amorfos . [47] La solubilidad del hidrógeno en los metales está influenciada por distorsiones locales o impurezas en la red cristalina . [48] Estas propiedades pueden ser útiles cuando el hidrógeno se purifica al pasar a través de discos de paladio calientes , pero la alta solubilidad del gas es un problema metalúrgico, que contribuye a la fragilización de muchos metales, [20] complicando el diseño de tuberías y tanques de almacenamiento. [49]
Hidruros

Los compuestos de hidrógeno a menudo se denominan hidruros , un término que se usa con bastante ligereza. El término "hidruro" sugiere que el átomo de H ha adquirido un carácter negativo o aniónico, denotado H − ; y se usa cuando el hidrógeno forma un compuesto con un elemento más electropositivo . La existencia del anión hidruro , sugerida por Gilbert N. Lewis en 1916 para los hidruros de tipo sal del grupo 1 y 2, fue demostrada por Moers en 1920 mediante la electrólisis del hidruro de litio fundido (LiH), produciendo una cantidad estequiométrica de hidrógeno en el ánodo. [50] Para los hidruros que no sean metales del grupo 1 y 2, el término es bastante engañoso, considerando la baja electronegatividad del hidrógeno. Una excepción en los hidruros del grupo 2 es BeH 2 , que es polimérico. En el hidruro de litio y aluminio , el anión [AlH 4 ] − lleva centros hidródicos firmemente unidos al Al(III).
Aunque los hidruros se pueden formar con casi todos los elementos del grupo principal, el número y la combinación de compuestos posibles varía ampliamente; por ejemplo, se conocen más de 100 hidruros binarios de borano, pero solo un hidruro binario de aluminio. [51] El hidruro binario de indio aún no se ha identificado, aunque existen complejos más grandes. [52]
En química inorgánica , los hidruros también pueden servir como ligandos puente que unen dos centros metálicos en un complejo de coordinación . Esta función es particularmente común en los elementos del grupo 13 , especialmente en los boranos ( hidruros de boro ) y complejos de aluminio , así como en los carboranos agrupados . [53]
Protones y ácidos
La oxidación del hidrógeno elimina su electrón y da H + , que no contiene electrones y un núcleo que generalmente está compuesto por un protón. Por eso, a menudo se llama protón al H + . Esta especie es fundamental para el análisis de los ácidos . Según la teoría ácido-base de Brønsted-Lowry , los ácidos son donantes de protones, mientras que las bases son aceptores de protones.
Un protón desnudo, H + , no puede existir en solución o en cristales iónicos debido a su fuerte atracción hacia otros átomos o moléculas con electrones. Excepto a las altas temperaturas asociadas con los plasmas, dichos protones no pueden ser retirados de las nubes de electrones de átomos y moléculas, y permanecerán unidos a ellos. Sin embargo, el término "protón" a veces se usa de manera imprecisa y metafórica para referirse al hidrógeno catiónico o con carga positiva unido a otras especies de esta manera, y como tal se denota " H + " sin ninguna implicación de que algún protón individual exista libremente como especie.
Para evitar la implicación del "protón solvatado" desnudo en solución, a veces se considera que las soluciones acuosas ácidas contienen una especie ficticia menos improbable, denominada " ion hidronio " ( [H 3 O] + ). Sin embargo, incluso en este caso, dichos cationes de hidrógeno solvatados se conciben de manera más realista como organizados en grupos que forman especies más cercanas a [H 9 O 4 ] + . [54] Se encuentran otros iones de oxonio cuando el agua está en solución ácida con otros solventes. [55]
Aunque exótico en la Tierra, uno de los iones más comunes en el universo es el H+3ion, conocido como hidrógeno molecular protonado o catión trihidrógeno. [56]
Isótopos



El hidrógeno tiene tres isótopos naturales, denominados1
Yo ,2
Mano3
H . Otros núcleos altamente inestables (4
H a7
H ) se han sintetizado en el laboratorio pero no se han observado en la naturaleza. [57] [58]
- 1
H es el isótopo de hidrógeno más común, con una abundancia de >99,98%. Debido a que el núcleo de este isótopo consta de un solo protón, se le da el nombre descriptivo pero raramente utilizado de protio . [59] Es el único isótopo estable sin neutrones; consulte diprotón para una discusión sobre por qué no existen otros. - 2
El H , el otro isótopo estable del hidrógeno, se conoce como deuterio y contiene un protón y un neutrón en el núcleo. Se cree que casi todo el deuterio del universo se produjo en el momento del Big Bang y ha perdurado desde entonces. El deuterio no es radiactivo y no supone un riesgo de toxicidad significativo. El agua enriquecida con moléculas que incluyen deuterio en lugar de hidrógeno normal se denomina agua pesada . El deuterio y sus compuestos se utilizan como marcador no radiactivo en experimentos químicos y en disolventes para1
Espectroscopia de RMN de H. [ 60] El agua pesada se utiliza como moderador de neutrones y refrigerante para reactores nucleares. El deuterio también es un combustible potencial para la fusión nuclear comercial . [61] - 3
El H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo, se desintegra en helio-3 a través de la desintegración beta con una vida media de 12,32 años. [53] Es lo suficientemente radiactivo como para usarse en pintura luminosa para mejorar la visibilidad de las pantallas de datos, como para pintar las manecillas y los marcadores de la esfera de los relojes. El cristal del reloj evita que la pequeña cantidad de radiación escape de la caja. [62] Pequeñas cantidades de tritio se producen de forma natural por los rayos cósmicos que inciden en los gases atmosféricos; el tritio también se ha liberado en pruebas de armas nucleares . [63] Se utiliza en la fusión nuclear, [64] como trazador en la geoquímica de isótopos , [65] y en dispositivos de iluminación autoalimentados especializados. [66] El tritio también se ha utilizado en experimentos de etiquetado químico y biológico como radiomarcador . [67]
Único entre los elementos, a sus isótopos se les asignan nombres distintos en el uso común. Durante los primeros estudios de la radiactividad, los radioisótopos pesados recibieron sus propios nombres, pero en su mayoría ya no se usan. Los símbolos D y T (en lugar de2
Mano3
H ) se utilizan a veces para el deuterio y el tritio, pero el símbolo P ya se utilizaba para el fósforo y, por lo tanto, no estaba disponible para el protio. [68] En sus directrices de nomenclatura , la Unión Internacional de Química Pura y Aplicada (IUPAC) permite cualquiera de los siguientes: D, T,2
Mano3
H para ser utilizado, aunque2
Mano3
Se prefieren H. [69]
El átomo exótico muonio (símbolo Mu), compuesto por un antimuón y un electrón , también puede considerarse un radioisótopo ligero del hidrógeno. [70] Debido a que los muones se desintegran con el tiempo de vida2,2 µs , el muonio es demasiado inestable para la química observable. [71] Sin embargo, los compuestos de muonio son casos de prueba importantes para la simulación cuántica , debido a la diferencia de masa entre el antimuón y el protón, [72] y la nomenclatura de la IUPAC incorpora compuestos hipotéticos como el cloruro de muonio (MuCl) y el muonuro de sodio (NaMu), análogos al cloruro de hidrógeno y al hidruro de sodio respectivamente. [73]
Propiedades térmicas y físicas
Tabla de propiedades térmicas y físicas del hidrógeno (H 2 ) a presión atmosférica: [74] [75]
| Temperatura (K) | Densidad (kg/m3) | Calor específico (kJ/kg·K) | Viscosidad dinámica (kg/ms) | Viscosidad cinemática (m^2/s) | Conductividad térmica (W/m·K) | Difusividad térmica (m^2/s) | Número de Prandtl |
| 100 | 0,24255 | 11.23 | 4.21E-06 | 1.74E-05 | 6.70E-02 | 2.46E-05 | 0,707 |
| 150 | 0,16371 | 12.602 | 5.60E-06 | 3.42E-05 | 0,0981 | 4.75E-05 | 0,718 |
| 200 | 0,1227 | 13.54 | 6.81E-06 | 5.55E-05 | 0,1282 | 7.72E-05 | 0,719 |
| 250 | 0,09819 | 14.059 | 7.92E-06 | 8.06E-05 | 0,1561 | 1.13E-04 | 0,713 |
| 300 | 0,08185 | 14.314 | 8.96E-06 | 1.10E-04 | 0,182 | 1.55E-04 | 0,706 |
| 350 | 0,07016 | 14.436 | 9.95E-06 | 1.42E-04 | 0,206 | 2.03E-04 | 0,697 |
| 400 | 0,06135 | 14.491 | 1.09E-05 | 1.77E-04 | 0,228 | 2.57E-04 | 0,69 |
| 450 | 0,05462 | 14.499 | 1.18E-05 | 2.16E-04 | 0,251 | 3.16E-04 | 0,682 |
| 500 | 0,04918 | 14.507 | 1.26E-05 | 2.57E-04 | 0,272 | 3.82E-04 | 0,675 |
| 550 | 0,04469 | 14.532 | 1.35E-05 | 3.02E-04 | 0,292 | 4.52E-04 | 0,668 |
| 600 | 0,04085 | 14.537 | 1.43E-05 | 3.50E-04 | 0,315 | 5.31E-04 | 0,664 |
| 700 | 0,03492 | 14.574 | 1.59E-05 | 4.55E-04 | 0,351 | 6.90E-04 | 0,659 |
| 800 | 0,0306 | 14.675 | 1.74E-05 | 5.69E-04 | 0,384 | 8.56E-04 | 0,664 |
| 900 | 0,02723 | 14.821 | 1.88E-05 | 6.90E-04 | 0,412 | 1.02E-03 | 0,676 |
| 1000 | 0,02424 | 14,99 | 2.01E-05 | 8.30E-04 | 0,448 | 1.23E-03 | 0,673 |
| 1100 | 0,02204 | 15.17 | 2.13E-05 | 9.66E-04 | 0,488 | 1.46E-03 | 0,662 |
| 1200 | 0,0202 | 15.37 | 2.26E-05 | 1.12E-03 | 0,528 | 1.70E-03 | 0,659 |
| 1300 | 0,01865 | 15,59 | 2.39E-05 | 1.28E-03 | 0,568 | 1.96E-03 | 0,655 |
| 1400 | 0,01732 | 15.81 | 2.51E-05 | 1.45E-03 | 0,61 | 2.23E-03 | 0,65 |
| 1500 | 0,01616 | 16.02 | 2.63E-05 | 1.63E-03 | 0,655 | 2.53E-03 | 0,643 |
| 1600 | 0,0152 | 16.28 | 2.74E-05 | 1.80E-03 | 0,697 | 2.82E-03 | 0,639 |
| 1700 | 0,0143 | 16.58 | 2.85E-05 | 1.99E-03 | 0,742 | 3.13E-03 | 0,637 |
| 1800 | 0,0135 | 16,96 | 2.96E-05 | 2.19E-03 | 0,786 | 3.44E-03 | 0,639 |
| 1900 | 0,0128 | 17.49 | 3.07E-05 | 2.40E-03 | 0,835 | 3.73E-03 | 0,643 |
| 2000 | 0,0121 | 18.25 | 3.18E-05 | 2.63E-03 | 0,878 | 3.98E-03 | 0,661 |
Historia
Descubrimiento y uso
Roberto Boyle
.jpg/440px-Portret_van_Robert_Boyle,_RP-P-OB-4578_(cropped).jpg)
En 1671, el científico irlandés Robert Boyle descubrió y describió la reacción entre limaduras de hierro y ácidos diluidos , que da como resultado la producción de gas hidrógeno. [76] [77]
Después de haber preparado un ácido clorhídrico, que por un método poco común se volvió extremadamente agudo y penetrante, pusimos en un frasco, capaz de contener tres o cuatro onzas de agua, una cantidad conveniente de limaduras de acero, que no eran las que se venden comúnmente en las tiendas de los químicos y boticarios (que por lo general no están lo suficientemente libres de óxido), sino las que había hecho rellenar a propósito de un buen trozo de acero. Este polvo metálico se humedeció en la viola con un poco de menstruo y luego se empapó con más; con lo cual la mezcla se calentó mucho y eructo humos copiosos y malolientes; no es necesario discutir aquí si consistían en su totalidad en azufre volátil del Marte [hierro] o en vapores metálicos que participaban de una naturaleza sulfurosa y se unían a las exhalaciones salinas del menstruo. Pero, de dondequiera que procediera ese humo apestoso, era tan inflamable que, al acercarle una vela encendida, se incendiaba con bastante facilidad y ardía con una llama apagada y algo verdosa en la boca de la viola durante un buen rato; y eso, aunque con poca luz, con más fuerza de la que uno fácilmente sospecharía.
— Robert Boyle, Tratados escritos por el Honorable Robert Boyle que contienen nuevos experimentos sobre la relación entre la llama y el aire...
La palabra "sulfuroso" puede resultar algo confusa, especialmente porque Boyle realizó un experimento similar con hierro y ácido sulfúrico. [78] Sin embargo, con toda probabilidad, "sulfuroso" debería entenderse aquí como "combustible". [79]
Henry Cavendish
En 1766, Henry Cavendish fue el primero en reconocer el gas hidrógeno como una sustancia discreta, al denominar al gas resultante de una reacción entre un metal y un ácido "aire inflamable". Especuló que el "aire inflamable" era, de hecho, idéntico a la sustancia hipotética " flogisto " [80] [81] y, además, descubrió en 1781 que el gas produce agua cuando se quema. Generalmente se le atribuye el descubrimiento del hidrógeno como elemento. [7] [8]
Antoine Lavoisier
.jpg/440px-Antoine-Laurent_Lavoisier_by_Louis_Jean_Desire_Delaistre_(cropped).jpg)
En 1783, Antoine Lavoisier identificó el elemento que se conocería como hidrógeno [82] cuando él y Laplace reprodujeron el hallazgo de Cavendish de que se produce agua cuando se quema hidrógeno. [8] Lavoisier produjo hidrógeno para sus experimentos sobre conservación de masa al hacer reaccionar un flujo de vapor con hierro metálico a través de un tubo de hierro incandescente calentado al fuego. La oxidación anaeróbica del hierro por los protones del agua a alta temperatura se puede representar esquemáticamente mediante el conjunto de reacciones siguientes:
- 1) Fe + H 2 O → FeO + H 2
- 2 ) Fe + 3H2O → Fe2O3 + 3H2
- 3 ) Fe + 4H2O → Fe3O4 + 4H2
Muchos metales, como el circonio, experimentan una reacción similar con el agua que conduce a la producción de hidrógeno. [83]
Siglo XIX
François Isaac de Rivaz construyó el primer motor de Rivaz , un motor de combustión interna alimentado por una mezcla de hidrógeno y oxígeno en 1806. Edward Daniel Clarke inventó el soplete de gas hidrógeno en 1819. La lámpara y la luz de calcio de Döbereiner se inventaron en 1823. [8]
El hidrógeno fue licuado por primera vez por James Dewar en 1898 mediante el uso de enfriamiento regenerativo y su invención, el matraz de vacío . [8] Produjo hidrógeno sólido al año siguiente. [8]
Dirigible propulsado por hidrógeno
.jpg/440px-Hindenburg_over_New_York_1937_(cropped).jpg)
El primer globo lleno de hidrógeno fue inventado por Jacques Charles en 1783. [8] El hidrógeno proporcionó el sustento para la primera forma confiable de viaje aéreo después de la invención en 1852 del primer dirigible impulsado por hidrógeno por Henri Giffard . [8] El conde alemán Ferdinand von Zeppelin promovió la idea de dirigibles rígidos impulsados por hidrógeno que más tarde se llamaron Zeppelins ; el primero de los cuales tuvo su vuelo inaugural en 1900. [8] Los vuelos programados regularmente comenzaron en 1910 y para el estallido de la Primera Guerra Mundial en agosto de 1914, habían transportado 35.000 pasajeros sin un incidente grave. Los dirigibles impulsados por hidrógeno se utilizaron como plataformas de observación y bombarderos durante la guerra.
El primer cruce transatlántico sin escalas lo realizó el dirigible británico R34 en 1919. El servicio regular de pasajeros se reanudó en la década de 1920 y el descubrimiento de reservas de helio en los Estados Unidos prometió una mayor seguridad, pero el gobierno estadounidense se negó a vender el gas para este propósito. Por lo tanto, se utilizó H 2 en el dirigible Hindenburg , que fue destruido en un incendio en el aire sobre Nueva Jersey el 6 de mayo de 1937. [8] El incidente fue transmitido en vivo por radio y filmado. Se asume ampliamente que la ignición de hidrógeno filtrado fue la causa, pero investigaciones posteriores apuntaron a la ignición del revestimiento de tela aluminizada por electricidad estática . Pero el daño a la reputación del hidrógeno como gas de elevación ya estaba hecho y los viajes comerciales en dirigibles de hidrógeno cesaron . El hidrógeno todavía se usa, en preferencia al helio no inflamable pero más caro, como gas de elevación para globos meteorológicos .
Deuterio y tritio
El deuterio fue descubierto en diciembre de 1931 por Harold Urey , y el tritio fue preparado en 1934 por Ernest Rutherford , Mark Oliphant y Paul Harteck . [7] El agua pesada , que consiste en deuterio en lugar de hidrógeno regular, fue descubierta por el grupo de Urey en 1932. [8]
Turbogenerador refrigerado por hidrógeno
El primer turbogenerador refrigerado por hidrógeno entró en servicio utilizando hidrógeno gaseoso como refrigerante en el rotor y el estator en 1937 en Dayton , Ohio, propiedad de Dayton Power & Light Co. [84] Esto se justificó por la alta conductividad térmica y la muy baja viscosidad del gas hidrógeno, por lo tanto menor arrastre que el aire. Este es el refrigerante más común utilizado para generadores de 60 MW y más grandes; los generadores más pequeños generalmente se enfrían con aire .
Batería de níquel-hidrógeno
La batería de níquel-hidrógeno se utilizó por primera vez en 1977 a bordo del satélite de tecnología de navegación NTS-2 (Navigation Technology Satellite-2) de la Marina de los Estados Unidos. [85] La Estación Espacial Internacional , [86] Mars Odyssey [87] y Mars Global Surveyor [88] están equipadas con baterías de níquel-hidrógeno. En la parte oscura de su órbita, el telescopio espacial Hubble también está alimentado por baterías de níquel-hidrógeno, que finalmente fueron reemplazadas en mayo de 2009, [89] más de 19 años después del lanzamiento y 13 años más allá de su vida útil prevista. [90]
Papel en la teoría cuántica

Debido a su estructura atómica simple, que consiste únicamente en un protón y un electrón, el átomo de hidrógeno , junto con el espectro de luz producido por él o absorbido por él, ha sido central para el desarrollo de la teoría de la estructura atómica . [91] Además, el estudio de la simplicidad correspondiente de la molécula de hidrógeno y el catión H correspondiente+2Aportó comprensión a la naturaleza del enlace químico , que se produjo poco después de que se desarrollara el tratamiento mecánico cuántico del átomo de hidrógeno a mediados de la década de 1920.
Uno de los primeros efectos cuánticos que se notaron explícitamente (pero que no se entendieron en ese momento) fue una observación de Maxwell relacionada con el hidrógeno, medio siglo antes de que llegara la teoría mecánica cuántica completa . Maxwell observó que la capacidad calorífica específica del H2 se aleja inexplicablemente de la de un gas diatómico por debajo de la temperatura ambiente y comienza a parecerse cada vez más a la de un gas monoatómico a temperaturas criogénicas. Según la teoría cuántica , este comportamiento surge del espaciamiento de los niveles de energía rotacional (cuantificados), que están particularmente espaciados ampliamente en el H2 debido a su baja masa. Estos niveles ampliamente espaciados inhiben la distribución equitativa de la energía térmica en el movimiento rotacional en el hidrógeno a bajas temperaturas. Los gases diatómicos compuestos de átomos más pesados no tienen niveles tan ampliamente espaciados y no exhiben el mismo efecto. [92]
Antihidrógeno (
yo
) es la contraparte de antimateria del hidrógeno. Consiste en un antiprotón con un positrón . El antihidrógeno es el único tipo de átomo de antimateria que se ha producido hasta 2015. [actualizar][ 93] [94]
Prevalencia y distribución cósmica

El hidrógeno, como H atómico, es el elemento químico más abundante en el universo, ya que constituye el 75% de la materia normal en masa y más del 90% en número de átomos. Sin embargo, la mayor parte de la masa del universo no se encuentra en forma de materia de tipo elemento químico, sino que se postula que se presenta en formas de masa aún no detectadas, como la materia oscura y la energía oscura . [95]
El hidrógeno se encuentra en gran abundancia en las estrellas y en los planetas gigantes gaseosos . Las nubes moleculares de H 2 están asociadas con la formación de estrellas . El hidrógeno desempeña un papel vital en la energía de las estrellas a través de la reacción protón-protón en el caso de estrellas con una masa muy baja o aproximadamente 1 masa de la del Sol y el ciclo CNO de fusión nuclear en el caso de estrellas más masivas que el Sol . [96]
Estados
En todo el universo, el hidrógeno se encuentra principalmente en estado atómico y de plasma , con propiedades muy distintas a las del hidrógeno molecular. En el plasma, el electrón y el protón del hidrógeno no están unidos, lo que da lugar a una conductividad eléctrica y una emisividad muy elevadas (que producen la luz del Sol y otras estrellas). Las partículas cargadas están muy influenciadas por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar interactúan con la magnetosfera de la Tierra dando lugar a las corrientes de Birkeland y a la aurora .
El hidrógeno se encuentra en estado atómico neutro en el medio interestelar porque los átomos rara vez chocan y se combinan. Son la fuente de la línea de hidrógeno de 21 cm a 1420 MHz que se detecta para investigar el hidrógeno primordial. [97] Se cree que la gran cantidad de hidrógeno neutro que se encuentra en los sistemas Lyman-alfa amortiguados domina la densidad bariónica cosmológica del universo hasta un corrimiento al rojo de z = 4. [98]
En condiciones normales en la Tierra, el hidrógeno elemental existe como gas diatómico, H 2 . El gas hidrógeno es muy raro en la atmósfera de la Tierra (alrededor de 0,53 ppm en términos molares [99] ) debido a su peso ligero, lo que le permite escapar de la atmósfera más rápidamente que los gases más pesados. Sin embargo, el hidrógeno es el tercer elemento más abundante en la superficie de la Tierra, [100] principalmente en forma de compuestos químicos como hidrocarburos y agua. [53]
Una forma molecular llamada hidrógeno molecular protonado ( H+3) se encuentra en el medio interestelar, donde se genera por ionización del hidrógeno molecular de los rayos cósmicos . Este ion también se ha observado en la atmósfera superior de Júpiter . El ion es relativamente estable en el espacio exterior debido a la baja temperatura y densidad. H+3es uno de los iones más abundantes en el universo y desempeña un papel notable en la química del medio interestelar. [101] El hidrógeno triatómico neutro H 3 solo puede existir en forma excitada y es inestable. [102] Por el contrario, el ion molecular de hidrógeno positivo ( H+2) es una molécula rara en el universo.
Producción
Existen muchos métodos para producir H 2 , pero tres dominan comercialmente: el reformado con vapor a menudo acoplado al desplazamiento de agua-gas, la oxidación parcial de hidrocarburos y la electrólisis del agua. [103]
Reformado con vapor
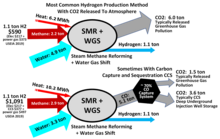
El hidrógeno se produce principalmente mediante la reformación de metano con vapor (SMR), la reacción del agua y el metano. [104] [105] [106] Así, a alta temperatura (1000–1400 K, 700–1100 °C o 1300–2000 °F), el vapor (vapor de agua) reacciona con el metano para producir monóxido de carbono y H 2 .
- CH4 + H2O → CO+ 3H2
El reformado con vapor también se utiliza para la preparación industrial de amoníaco.
Esta reacción se ve favorecida a bajas presiones, pero se lleva a cabo a altas presiones (2,0 MPa, 20 atm o 600 inHg ) porque el H2 a alta presión es el producto más comercializable y los sistemas de purificación por adsorción por oscilación de presión (PSA) funcionan mejor a presiones más altas. La mezcla de productos se conoce como " gas de síntesis " porque a menudo se utiliza directamente para la producción de metanol y muchos otros compuestos. Se pueden utilizar hidrocarburos distintos del metano para producir gas de síntesis con diferentes proporciones de producto. Una de las muchas complicaciones de esta tecnología altamente optimizada es la formación de coque o carbono:
- CH4 → C+ 2H2
Por lo tanto, el reformado con vapor normalmente emplea un exceso de H2O . Se puede recuperar hidrógeno adicional del vapor utilizando monóxido de carbono a través de la reacción de desplazamiento de gas de agua (WGS). Este proceso requiere un catalizador de óxido de hierro : [ 106]
- CO2 + H2O → CO2 + H2
El hidrógeno a veces se produce y se consume en el mismo proceso industrial, sin separarse. En el proceso Haber para la producción de amoníaco , el hidrógeno se genera a partir de gas natural. [107]
Oxidación parcial de hidrocarburos
Otros métodos para la producción de CO y H 2 incluyen la oxidación parcial de hidrocarburos: [108]
- 2CH4 +O2 → 2CO + 4H2
Aunque es menos importante comercialmente, el carbón puede servir como preludio a la reacción de desplazamiento mencionada anteriormente: [106]
- C + H2O → CO + H2
Las unidades de producción de olefinas pueden producir cantidades sustanciales de hidrógeno como subproducto, particularmente a partir del craqueo de materias primas ligeras como el etano o el propano . [109]
Electrólisis del agua

La electrólisis del agua es un método conceptualmente simple para producir hidrógeno.
- 2H2O (l) → 2H2 ( g ) + O2 (g)
Los electrolizadores comerciales utilizan catalizadores a base de níquel en una solución fuertemente alcalina. El platino es un catalizador mejor, pero es caro. [110]
La electrólisis de salmuera para producir cloro también produce hidrógeno como coproducto. [111]
Pirólisis de metano
El hidrógeno se puede producir mediante pirólisis del gas natural (metano).
Esta ruta tiene una huella de carbono menor que los procesos comerciales de producción de hidrógeno. [112] [113] [114] [115] El desarrollo de un proceso comercial de pirólisis de metano podría acelerar el uso expandido del hidrógeno en aplicaciones industriales y de transporte. La pirólisis de metano se logra al pasar metano a través de un catalizador de metal fundido que contiene níquel disuelto . El metano se convierte en gas hidrógeno y carbono sólido . [116] [117]
- CH4 (g) → C(s) + 2 H2 ( g ) (ΔH° = 74 kJ/mol)
El carbono puede venderse como materia prima para la fabricación o como combustible, o bien depositarse en vertederos.
Se continúan realizando investigaciones en varios laboratorios, incluidos el Laboratorio de Metales Líquidos de Karlsruhe [118] y la Universidad de California en Santa Bárbara. [119] BASF construyó una planta piloto de pirólisis de metano. [120]
Termoquímico
Se pueden utilizar más de 200 ciclos termoquímicos para la división del agua . Muchos de estos ciclos, como el ciclo del óxido de hierro , el ciclo del óxido de cerio (IV)-óxido de cerio (III) , el ciclo del óxido de zinc-zinc , el ciclo del azufre-yodo , el ciclo del cobre-cloro y el ciclo híbrido del azufre, se han evaluado por su potencial comercial para producir hidrógeno y oxígeno a partir de agua y calor sin utilizar electricidad. [121] Varios laboratorios (incluidos en Francia , Alemania , Grecia , Japón y Estados Unidos ) están desarrollando métodos termoquímicos para producir hidrógeno a partir de energía solar y agua. [122]
Métodos de laboratorio
El H 2 se produce en los laboratorios, a menudo como subproducto de otras reacciones. Muchos metales reaccionan con el agua para producir H 2 , pero la velocidad de evolución del hidrógeno depende del metal, el pH y la presencia de agentes de aleación. La mayoría de las veces, la evolución del hidrógeno es inducida por ácidos. Los metales alcalinos y alcalinotérreos, el aluminio, el zinc, el manganeso y el hierro reaccionan fácilmente con los ácidos acuosos. Esta reacción es la base del aparato de Kipp , que alguna vez se utilizó como fuente de gas de laboratorio:
- Zn+2H + → Zn2 + + H2
En ausencia de ácido, la evolución del H2 es más lenta . Como el hierro es un material estructural muy utilizado, su corrosión anaeróbica tiene importancia tecnológica:
- Fe+2H2O → Fe(OH) 2 + H2
Muchos metales, como el aluminio , reaccionan lentamente con el agua porque forman capas de óxido pasivado. Sin embargo, una aleación de aluminio y galio sí reacciona con el agua. [123] A un pH alto, el aluminio puede producir H 2 :
- 2Al + 6H2O + 2OH − → 2[Al( OH ) 4 ] − + 3H2
Algunos compuestos que contienen metales reaccionan con ácidos para desprender H 2 . En condiciones anaeróbicas, el hidróxido ferroso ( Fe(OH)
2) puede ser oxidado por los protones del agua para formar magnetita y H 2 . Este proceso se describe mediante la reacción de Schikorr :
- 3Fe( OH ) 2 → Fe3O4 + 2H2O + H2
Este proceso ocurre durante la corrosión anaeróbica del hierro y el acero en aguas subterráneas libres de oxígeno y en suelos reductores debajo del nivel freático .
Biohidrógeno
El H2 es producido por enzimas hidrogenasas en algunas fermentaciones . [124]
Pozos
Hay un pozo en Mali y yacimientos en varios otros países, como Francia. [125]
Aplicaciones

Industria petroquímica
En la "mejora" de los combustibles fósiles se utilizan grandes cantidades de H 2 . Los principales consumidores de H 2 son la hidrodesulfuración y el hidrocraqueo . Muchas de estas reacciones pueden clasificarse como hidrogenólisis , es decir, la ruptura de enlaces por hidrógeno. Un ejemplo ilustrativo es la separación del azufre de los combustibles fósiles líquidos: [103]
- R 2 S + 2 H 2 → H 2 S + 2 RH
Hidrogenación
La hidrogenación , la adición de H 2 a varios sustratos, se realiza a gran escala. La hidrogenación de N 2 para producir amoníaco mediante el proceso Haber , consume un pequeño porcentaje del presupuesto energético de toda la industria. El amoníaco resultante se utiliza para suministrar la mayor parte de las proteínas consumidas por los seres humanos. [127] La hidrogenación se utiliza para convertir grasas y aceites insaturados en grasas y aceites saturados (trans). La principal aplicación es la producción de margarina . El metanol se produce por hidrogenación de dióxido de carbono. De manera similar, es la fuente de hidrógeno en la fabricación de ácido clorhídrico . El H 2 también se utiliza como agente reductor para la conversión de algunos minerales en metales. [128]
Refrigerante
El hidrógeno se utiliza habitualmente en las centrales eléctricas como refrigerante en los generadores debido a una serie de propiedades favorables que son resultado directo de sus moléculas diatómicas ligeras. Entre ellas, se incluyen su baja densidad , baja viscosidad y el calor específico y la conductividad térmica más elevados de todos los gases.
Portador de energía
El hidrógeno elemental es un elemento ampliamente discutido en el contexto de la energía como un portador de energía con potencial para ayudar a descarbonizar las economías y mitigar las emisiones de gases de efecto invernadero. [129] [130] Por lo tanto, esto requiere que el hidrógeno se produzca de manera limpia en cantidades que se puedan suministrar en sectores y aplicaciones donde las alternativas de mitigación más baratas y energéticamente eficientes son limitadas. Estas incluyen la industria pesada y el transporte de larga distancia. [129] El hidrógeno es un portador de energía más que un recurso energético, porque no existe una fuente natural de hidrógeno en cantidades útiles. [131]
El hidrógeno se puede utilizar como fuente de energía en las pilas de combustible para producir electricidad o mediante combustión para generar calor. [19] Cuando se consume hidrógeno en las pilas de combustible, la única emisión en el punto de uso es vapor de agua. [19] La combustión de hidrógeno puede provocar la formación térmica de óxidos de nitrógeno nocivos . [19] Las emisiones totales del ciclo de vida del hidrógeno dependen de cómo se produce. Casi todo el suministro actual de hidrógeno del mundo se crea a partir de combustibles fósiles. [132] [133] El método principal es el reformado de metano con vapor , en el que el hidrógeno se produce a partir de una reacción química entre vapor y metano , el principal componente del gas natural. La producción de una tonelada de hidrógeno a través de este proceso emite entre 6,6 y 9,3 toneladas de dióxido de carbono. [134] Si bien la captura y almacenamiento de carbono (CCS) podría eliminar una gran fracción de estas emisiones, la huella de carbono general del hidrógeno a partir del gas natural es difícil de evaluar a partir de 2021 [actualizar], en parte debido a las emisiones (incluido el metano ventilado y fugitivo ) creadas en la producción del propio gas natural. [135]
La electricidad se puede utilizar para dividir las moléculas de agua, produciendo hidrógeno sostenible, siempre que la electricidad se genere de forma sostenible. Sin embargo, este proceso de electrólisis es actualmente más caro que la creación de hidrógeno a partir de metano sin CCS y la eficiencia de la conversión de energía es inherentemente baja. [130] El hidrógeno se puede producir cuando hay un excedente de electricidad renovable variable , luego almacenarse y usarse para generar calor o para regenerar electricidad. [136] El hidrógeno creado a través de la electrólisis utilizando energía renovable se conoce comúnmente como " hidrógeno verde ". [137] Puede transformarse además en combustibles sintéticos como el amoníaco y el metanol . [138]
La innovación en electrolizadores de hidrógeno podría hacer que la producción a gran escala de hidrógeno a partir de electricidad sea más competitiva en términos de costos. [139] El hidrógeno producido de esta manera tiene potencial para desempeñar un papel importante en la descarbonización de los sistemas energéticos donde existen desafíos y limitaciones para reemplazar los combustibles fósiles con el uso directo de electricidad. [129]
El combustible de hidrógeno puede producir el calor intenso necesario para la producción industrial de acero, cemento, vidrio y productos químicos, contribuyendo así a la descarbonización de la industria junto con otras tecnologías, como los hornos de arco eléctrico para la fabricación de acero. [140] Sin embargo, es probable que desempeñe un papel más importante en el suministro de materia prima industrial para una producción más limpia de amoníaco y productos químicos orgánicos. [129] Por ejemplo, en la fabricación de acero , el hidrógeno podría funcionar como un portador de energía limpia y también como un catalizador bajo en carbono, reemplazando al coque derivado del carbón . [141] Es probable que el hidrógeno utilizado para descarbonizar el transporte encuentre sus mayores aplicaciones en el transporte marítimo, la aviación y, en menor medida, los vehículos pesados, mediante el uso de combustibles sintéticos derivados del hidrógeno, como el amoníaco y el metanol , y la tecnología de pilas de combustible. [129] En el caso de los vehículos ligeros, incluidos los automóviles, el hidrógeno está muy por detrás de otros vehículos de combustible alternativo , especialmente en comparación con la tasa de adopción de vehículos eléctricos a batería , y es posible que no desempeñe un papel significativo en el futuro. [142]
Las desventajas del hidrógeno como portador de energía incluyen los altos costos de almacenamiento y distribución debido a su explosividad, su gran volumen en comparación con otros combustibles y su tendencia a hacer que las tuberías sean quebradizas. [135]
Industria de semiconductores
El hidrógeno se emplea para saturar enlaces rotos ("colgantes") de silicio amorfo y carbono amorfo que ayudan a estabilizar las propiedades del material. [143] También es un donante potencial de electrones en varios materiales de óxido, incluidos ZnO , [144] [145] SnO 2 , CdO , MgO , [146] ZrO 2 , HfO 2 , La 2 O 3 , Y 2 O 3 , TiO 2 , SrTiO 3 , LaAlO 3 , SiO 2 , Al 2 O 3 , ZrSiO 4 , HfSiO 4 y SrZrO3. [147]
Usos nicho y en evolución
- Gas de protección: El hidrógeno se utiliza como gas de protección en métodos de soldadura como la soldadura con hidrógeno atómico . [148] [149]
- Investigación criogénica: El H2 líquido se utiliza en la investigación criogénica , incluidos los estudios de superconductividad . [150]
- Elevación flotante: debido a que el H2 tiene solo el 7% de la densidad del aire, alguna vez se usó ampliamente como gas de elevación en globos y dirigibles . [151]
- Detección de fugas: Puro o mezclado con nitrógeno (a veces llamado gas formador ), el hidrógeno es un gas trazador para la detección de fugas diminutas. Se pueden encontrar aplicaciones en las industrias automotriz, química, de generación de energía, aeroespacial y de telecomunicaciones. [152] El hidrógeno es un aditivo alimentario autorizado (E 949) que permite realizar pruebas de fugas en envases de alimentos, además de tener propiedades antioxidantes. [153]
- Moderación de neutrones: El deuterio (hidrógeno-2) se utiliza en aplicaciones de fisión nuclear como moderador para ralentizar los neutrones .
- Combustible de fusión nuclear: El deuterio se utiliza en reacciones de fusión nuclear . [8]
- Marcado isotópico: Los compuestos de deuterio tienen aplicaciones en química y biología en estudios de los efectos de los isótopos en las velocidades de reacción. [154]
- Combustible para cohetes: el hidrógeno líquido y el oxígeno líquido juntos sirven como propulsores criogénicos en cohetes de propulsante líquido , como en los motores principales del transbordador espacial . La NASA ha investigado el uso de propulsor para cohetes hecho de hidrógeno atómico, boro o carbono que se congela en partículas de hidrógeno molecular sólido suspendidas en helio líquido. Al calentarse, la mezcla se vaporiza para permitir que las especies atómicas se recombinen, calentando la mezcla a alta temperatura. [155]
- Usos del tritio: El tritio (hidrógeno-3), producido en reactores nucleares , se utiliza en la producción de bombas de hidrógeno , [156] como etiqueta isotópica en las biociencias, [67] y como fuente de radiación beta en pintura radioluminiscente para diales de instrumentos y señalización de emergencia. [62]
Reacciones biológicas
El H 2 es un producto de algunos tipos de metabolismo anaeróbico y es producido por varios microorganismos , generalmente a través de reacciones catalizadas por enzimas que contienen hierro o níquel llamadas hidrogenasas . Estas enzimas catalizan la reacción redox reversible entre el H 2 y sus componentes dos protones y dos electrones. La creación de gas hidrógeno ocurre en la transferencia de equivalentes reductores, producidos durante la fermentación del piruvato , al agua. [157] El ciclo natural de producción y consumo de hidrógeno por los organismos se llama ciclo del hidrógeno . [158] Las bacterias como Mycobacterium smegmatis pueden usar la pequeña cantidad de hidrógeno en la atmósfera como fuente de energía cuando faltan otras fuentes, utilizando una hidrogenasa con pequeños canales que excluyen el oxígeno y así permiten que la reacción ocurra aunque la concentración de hidrógeno sea muy baja y la concentración de oxígeno sea como en el aire normal. [99] [159]
El hidrógeno es el elemento más abundante en el cuerpo humano por número de átomos , pero el tercero más abundante por masa. El H 2 se produce en el aliento humano debido a la actividad metabólica de los microorganismos que contienen hidrogenasa en el intestino grueso y es un componente natural de los flatos . La concentración en el aliento de personas en ayunas en reposo es típicamente inferior a 5 partes por millón (ppm), pero puede ser de 50 ppm cuando las personas con trastornos intestinales consumen moléculas que no pueden absorber durante las pruebas diagnósticas de aliento con hidrógeno . [160]
La división del agua , en la que el agua se descompone en sus componentes protones, electrones y oxígeno, ocurre en las reacciones luminosas en todos los organismos fotosintéticos . Algunos de estos organismos, incluyendo el alga Chlamydomonas reinhardtii y las cianobacterias , han desarrollado un segundo paso en las reacciones oscuras en las que los protones y electrones se reducen para formar gas H 2 por hidrogenasas especializadas en el cloroplasto . [161] Se han realizado esfuerzos para modificar genéticamente las hidrogenasas de las cianobacterias para sintetizar eficientemente el gas H 2 incluso en presencia de oxígeno. [162] También se han realizado esfuerzos con algas modificadas genéticamente en un biorreactor . [163]
Seguridad y precauciones
| Peligros | |
|---|---|
| Etiquetado SGA : | |
 | |
| Peligro | |
| H220 | |
| P202 , P210 , P271 , P377 , P381 , P403 [164] | |
| NFPA 704 (rombo cortafuegos) | |
El hidrógeno plantea una serie de peligros para la seguridad humana, desde posibles detonaciones e incendios cuando se mezcla con el aire hasta ser un asfixiante en su forma pura, libre de oxígeno . [165] Además, el hidrógeno líquido es un criógeno y presenta peligros (como la congelación ) asociados con líquidos muy fríos. [166] El hidrógeno se disuelve en muchos metales y además de filtrarse, puede tener efectos adversos sobre ellos, como la fragilización por hidrógeno , [167] lo que conduce a grietas y explosiones. [168] El gas hidrógeno que se filtra al aire exterior puede encenderse espontáneamente. Además, el fuego de hidrógeno, aunque es extremadamente caliente, es casi invisible y, por lo tanto, puede provocar quemaduras accidentales. [169]
Incluso la interpretación de los datos del hidrógeno (incluidos los datos de seguridad) se ve confusa por una serie de fenómenos. Muchas propiedades físicas y químicas del hidrógeno dependen de la relación parahidrógeno/ortohidrógeno (a menudo se necesitan días o semanas a una temperatura determinada para alcanzar la relación de equilibrio, para la que se suelen proporcionar los datos). Los parámetros de detonación del hidrógeno, como la presión y la temperatura críticas de detonación, dependen en gran medida de la geometría del recipiente. [165]
Véase también
- Planta de energía de hidrógeno de ciclo combinado
- Economía del hidrógeno : el uso del hidrógeno para descarbonizar más sectores
- Producción de hidrógeno – Producción industrial de hidrógeno molecular
- Seguridad del hidrógeno : procedimientos para la producción, manipulación y uso seguros del hidrógeno
- Tecnologías del hidrógeno : tecnologías relacionadas con la producción y el uso del hidrógeno.
- Transporte de hidrógeno
- Hidrógeno líquido – Estado líquido del elemento hidrógeno
- Pirólisis de metano : descomposición térmica de materiales Páginas que muestran descripciones breves de los objetivos de redireccionamiento(para hidrógeno)
- Hidrógeno natural : hidrógeno molecular que se encuentra de forma natural en la Tierra.
- Pirólisis : descomposición térmica de materiales
Notas
- ^ Sin embargo, la mayor parte de la masa del universo no está en forma de bariones o elementos químicos. Véase materia oscura y energía oscura .
- ^ 286 kJ/mol: energía por mol del material combustible (hidrógeno molecular).
Referencias
- ^ "Pesos atómicos estándar: hidrógeno". CIAAW . 2009.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Química inorgánica. Academic Press. pág. 240. ISBN 978-0123526519.
- ^ Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Lide, DR, ed. (2005). "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física del CRC (PDF) (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0486-6.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 978-0-8493-0464-4.
- ^ abc "Hidrógeno". Enciclopedia de química de Van Nostrand . Wylie-Interscience. 2005. págs. 797–799. ISBN 978-0-471-61525-5.
- ^ abcdefghijkl Emsley, John (2001). Los bloques de construcción de la naturaleza . Oxford: Oxford University Press. págs. 183-191. ISBN 978-0-19-850341-5.
- ^ Miśkowiec, Paweł (abril de 2023). "Juego de nombres: La historia de los nombres de los elementos químicos, parte 1, desde la antigüedad hasta finales del siglo XVIII". Fundamentos de la química . 25 (1): 29–51. doi :10.1007/s10698-022-09448-5.
- ^ Stwertka, Albert (1996). Una guía de los elementos . Oxford University Press. Págs. 16-21. ISBN. 978-0-19-508083-4.
- ^ "Dihidrógeno". Directorio O=CHem . Universidad del Sur de Maine . Archivado desde el original el 13 de febrero de 2009 . Consultado el 6 de abril de 2009 .
- ^ "Hidrógeno". Encyclopædia Britannica . Archivado desde el original el 24 de diciembre de 2021. Consultado el 25 de diciembre de 2021 .
- ^ Boyd, Padi (19 de julio de 2014). «¿Cuál es la composición química de las estrellas?». NASA . Archivado desde el original el 15 de enero de 2015. Consultado el 5 de febrero de 2008 .
- ^ Tanabashi, M.; et al. (2018). "Big-Bang Cosmology" (PDF) . Physical Review D . 98 (3): 358. doi : 10.1103/PhysRevD.98.030001 . Archivado (PDF) del original el 29 de junio de 2021 – vía Particle Data Group en Lawrence Berkeley National Laboratory .
Capítulo 21.4.1 - Esto ocurrió cuando la edad del Universo era de unos 370.000 años.
(Revisado en septiembre de 2017) por Keith A. Olive y John A. Peacock . - ^ Laursen, S.; Chang, J.; Medlin, W.; Gürmen, N.; Fogler, HS (27 de julio de 2004). "Una introducción extremadamente breve a la química cuántica computacional". Modelado molecular en ingeniería química . Universidad de Michigan. Archivado desde el original el 20 de mayo de 2015. Consultado el 4 de mayo de 2015 .
- ^ Presentador: Profesor Jim Al-Khalili (21 de enero de 2010). "Descubriendo los elementos". Química: una historia volátil . Minuto 25:40. BBC . BBC Four . Archivado desde el original el 25 de enero de 2010. Consultado el 9 de febrero de 2010 .
- ^ Dincer, Ibrahim; Acar, Canan (14 de septiembre de 2015). "Revisión y evaluación de los métodos de producción de hidrógeno para una mejor sostenibilidad". Revista Internacional de Energía del Hidrógeno . 40 (34): 11094–11111. Bibcode :2015IJHE...4011094D. doi :10.1016/j.ijhydene.2014.12.035. ISSN 0360-3199. Archivado desde el original el 15 de febrero de 2022 . Consultado el 4 de febrero de 2022 .
- ^ "Conceptos básicos del hidrógeno: producción". Centro de energía solar de Florida . 2007. Archivado desde el original el 18 de febrero de 2008. Consultado el 5 de febrero de 2008 .
- ^ abcdef Lewis, Alastair C. (10 de junio de 2021). «Optimización de los beneficios colaterales de la calidad del aire en una economía del hidrógeno: un caso de normas específicas para el hidrógeno en materia de emisiones de NO x». Ciencias ambientales: atmósferas . 1 (5): 201–207. doi : 10.1039/D1EA00037C . S2CID 236732702. Este artículo incorpora texto de esta fuente, que está disponible bajo la licencia CC BY 3.0.
- ^ ab Rogers, HC (1999). "Fragilización de metales por hidrógeno". Science . 159 (3819): 1057–1064. Bibcode :1968Sci...159.1057R. doi :10.1126/science.159.3819.1057. PMID 17775040. S2CID 19429952.
- ^ Comité de Alternativas y Estrategias para la Producción y Uso Futuro del Hidrógeno (2004). La Economía del Hidrógeno: Oportunidades, Costos, Barreras y Necesidades de I+D. National Academies Press . p. 240. ISBN 978-0-309-09163-3Archivado del original el 29 de enero de 2021 . Consultado el 3 de septiembre de 2020 .
- ^ Carcassi, MN; Fineschi, F. (2005). "Deflagraciones de mezclas pobres en H2 - aire y CH4 - aire en un entorno multicompartimental ventilado". Energía . 30 (8): 1439–1451. Código Bibliográfico :2005Ene....30.1439C. doi :10.1016/j.energy.2004.02.012.
- ^ Patnaik, P. (2007). Una guía completa sobre las propiedades peligrosas de las sustancias químicas. Wiley-Interscience. pág. 402. ISBN 978-0-471-71458-3Archivado del original el 26 de enero de 2021 . Consultado el 3 de septiembre de 2020 .
- ^ Schefer, EW; Kulatilaka, WD; Patterson, BD; Settersten, TB (junio de 2009). «Emisión visible de llamas de hidrógeno». Combustion and Flame . 156 (6): 1234–1241. Código Bibliográfico :2009CoFl..156.1234S. doi :10.1016/j.combustflame.2009.01.011. Archivado desde el original el 29 de enero de 2021 . Consultado el 30 de junio de 2019 .
- ^ "Mitos sobre el accidente del Hindenburg". Airships.net . Archivado desde el original el 20 de abril de 2021 . Consultado el 29 de marzo de 2021 .
- ^ Lide, David R., ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ Clayton, DD (2003). Manual de isótopos en el cosmos: del hidrógeno al galio . Cambridge University Press . ISBN 978-0-521-82381-4.
- ^ NAAP Labs (2009). «Niveles de energía». Universidad de Nebraska Lincoln. Archivado desde el original el 11 de mayo de 2015. Consultado el 20 de mayo de 2015 .
- ^ "longitud de onda del fotón 13,6 eV". Wolfram Alpha . 20 de mayo de 2015. Archivado desde el original el 12 de mayo de 2016 . Consultado el 20 de mayo de 2015 .
- ^ Stern, DP (16 de mayo de 2005). "El núcleo atómico y el modelo inicial del átomo de Bohr". Centro de vuelo espacial Goddard de la NASA (espejo). Archivado desde el original el 17 de octubre de 2008. Consultado el 20 de diciembre de 2007 .
- ^ Stern, DP (13 de febrero de 2005). «Wave Mechanics». Centro de vuelo espacial Goddard de la NASA. Archivado desde el original el 13 de mayo de 2008. Consultado el 16 de abril de 2008 .
- ^ Staff (2003). "Propiedades, usos y aplicaciones del hidrógeno (H2): gas hidrógeno e hidrógeno líquido". Universal Industrial Gases, Inc. Archivado desde el original el 19 de febrero de 2008. Consultado el 5 de febrero de 2008 .
- ^ Green, Richard A.; et al. (2012). "La teoría y la práctica de la hiperpolarización en resonancia magnética utilizando parahidrógeno". Prog. Nucl. Magn. Reson. Spectrosc . 67 : 1–48. Bibcode :2012PNMRS..67....1G. doi :10.1016/j.pnmrs.2012.03.001. PMID 23101588. Archivado desde el original el 28 de agosto de 2021. Consultado el 28 de agosto de 2021 .
- ^ "Die Entdeckung des para-Wasserstoffs (El descubrimiento del parahidrógeno)". Max-Planck-Institut für Biophysikalische Chemie (en alemán). Archivado desde el original el 16 de noviembre de 2020 . Consultado el 9 de noviembre de 2020 .
- ^ Milenko, Yu. Ya.; Sibileva, RM; Strzhemechny, MA (1997). "Tasa de conversión orto-para natural en hidrógeno líquido y gaseoso". Journal of Low Temperature Physics . 107 (1–2): 77–92. Bibcode :1997JLTP..107...77M. doi :10.1007/BF02396837. S2CID 120832814.
- ^ Hritz, J. (marzo de 2006). «CH. 6 – Hydrogen» (PDF) . Manual de seguridad de Glenn del Centro de investigación Glenn de la NASA, documento GRC-MQSA.001 . NASA. Archivado desde el original (PDF) el 16 de febrero de 2008. Consultado el 5 de febrero de 2008 .
- ^ Amos, Wade A. (1 de noviembre de 1998). «Costos de almacenamiento y transporte de hidrógeno» (PDF) . Laboratorio Nacional de Energías Renovables. pp. 6–9. Archivado (PDF) desde el original el 26 de diciembre de 2014. Consultado el 19 de mayo de 2015 .
- ^ Svadlenak, RE; Scott, AB (1957). "La conversión de ortohidrógeno a parahidrógeno en catalizadores de óxido de hierro y óxido de cinc". Revista de la Sociedad Química Americana . 79 (20): 5385–5388. doi :10.1021/ja01577a013.
- ^ Clark, J. (2002). "La acidez de los haluros de hidrógeno". Chemguide . Archivado desde el original el 20 de febrero de 2008. Consultado el 9 de marzo de 2008 .
- ^ Kimball, JW (7 de agosto de 2003). «Hidrógeno». Páginas de biología de Kimball . Archivado desde el original el 4 de marzo de 2008. Consultado el 4 de marzo de 2008 .
- ^ Compendio de terminología química de la IUPAC, versión electrónica, enlace de hidrógeno Archivado el 19 de marzo de 2008 en Wayback Machine.
- ^ Sandrock, G. (2 de mayo de 2002). «Metal-Hydrogen Systems». Sandia National Laboratories. Archivado desde el original el 24 de febrero de 2008. Consultado el 23 de marzo de 2008 .
- ^ ab "Estructura y nomenclatura de los hidrocarburos". Universidad de Purdue. Archivado desde el original el 11 de junio de 2012. Consultado el 23 de marzo de 2008 .
- ^ "Química orgánica". Dictionary.com . Lexico Publishing Group. 2008. Archivado desde el original el 18 de abril de 2008. Consultado el 23 de marzo de 2008 .
- ^ "Bioquímica". Dictionary.com . Lexico Publishing Group. 2008. Archivado desde el original el 29 de marzo de 2008 . Consultado el 23 de marzo de 2008 .
- ^ Takeshita, T.; Wallace, WE; Craig, RS (1974). "Solubilidad del hidrógeno en compuestos 1:5 entre itrio o torio y níquel o cobalto". Química inorgánica . 13 (9): 2282–2283. doi :10.1021/ic50139a050.
- ^ Kirchheim, R.; Mutschele, T.; Kieninger, W.; Gleiter, H.; Birringer, R.; Koble, T. (1988). "Hidrógeno en metales amorfos y nanocristalinos". Ciencia e Ingeniería de Materiales . 99 (1–2): 457–462. doi :10.1016/0025-5416(88)90377-1.
- ^ Kirchheim, R. (1988). "Solubilidad y difusividad del hidrógeno en metales defectuosos y amorfos". Progreso en la ciencia de los materiales . 32 (4): 262–325. doi :10.1016/0079-6425(88)90010-2.
- ^ Christensen, CH; Nørskov, JK; Johannessen, T. (9 de julio de 2005). «Making society independent of fossil fuels – Danish scientists revealed new technology» (Independizar la sociedad de los combustibles fósiles: investigadores daneses revelan nueva tecnología). Universidad Técnica de Dinamarca . Archivado desde el original el 21 de mayo de 2015. Consultado el 19 de mayo de 2015 .
- ^ Moers, K. (1920). "Investigaciones sobre el carácter salino del hidruro de litio". Zeitschrift für Anorganische und Allgemeine Chemie . 113 (191): 179–228. doi :10.1002/zaac.19201130116. Archivado (PDF) desde el original el 24 de agosto de 2019 . Consultado el 24 de agosto de 2019 .
- ^ Downs, AJ; Pulham, CR (1994). "Los hidruros de aluminio, galio, indio y talio: una reevaluación". Chemical Society Reviews . 23 (3): 175–184. doi :10.1039/CS9942300175.
- ^ Hibbs, DE; Jones, C.; Smithies, NA (1999). "Un complejo de trihidruro de indio notablemente estable: síntesis y caracterización de [InH 3 P(C 6 H 11 ) 3 ]". Chemical Communications (2): 185–186. doi :10.1039/a809279f.
- ^ abc Miessler, GL; Tarr, DA (2003). Química inorgánica (3.ª ed.). Prentice Hall. ISBN 978-0-13-035471-6.
- ^ Okumura, AM; Yeh, LI; Myers, JD; Lee, YT (1990). "Espectros infrarrojos del ion hidronio solvatado: espectroscopia de predisociación vibracional de H 3 O+•(H 2 O )n •(H 2 ) m seleccionado por masa ". Journal of Physical Chemistry . 94 (9): 3416–3427. doi :10.1021/j100372a014.
- ^ Perdoncin, G.; Scorrano, G. (1977). "Equilibrios de protonación en agua a varias temperaturas de alcoholes, éteres, acetona, sulfuro de dimetilo y sulfóxido de dimetilo". Revista de la Sociedad Química Americana . 99 (21): 6983–6986. doi :10.1021/ja00463a035.
- ^ Carrington, A.; McNab, IR (1989). "El espectro de predisociación infrarroja del catión hidrógeno triatómico (H 3 + )". Accounts of Chemical Research . 22 (6): 218–222. doi :10.1021/ar00162a004.
- ^ Gurov, YB; Aleshkin, DV; Behr, Minnesota; Lapushkin, SV; Morokhov, PV; Pechkurov, VA; Poroshin, NO; Sandukovsky, VG; Tel'kushev, MV; Chernyshev, BA; Tschurenková, TD (2004). "Espectroscopia de isótopos de hidrógeno superpesados en absorción de piones detenidos por los núcleos". Física de los Núcleos Atómicos . 68 (3): 491–97. Código Bib : 2005PAN....68..491G. doi :10.1134/1.1891200. S2CID 122902571.
- ^ Korsheninnikov, A.; Nikolskii, E.; Kuzmin, E.; Ozawa, A.; Morimoto, K.; Tokanai, F.; Kanungo, R.; Tanihata, I.; et al. (2003). "Evidencia experimental de la existencia de 7 H y de una estructura específica de 8 He". Physical Review Letters . 90 (8): 082501. Bibcode :2003PhRvL..90h2501K. doi :10.1103/PhysRevLett.90.082501. PMID 12633420.
- ^ Urey, HC; Brickwedde, FG; Murphy, GM (1933). "Nombres de los isótopos del hidrógeno". Science . 78 (2035): 602–603. Bibcode :1933Sci....78..602U. doi :10.1126/science.78.2035.602. PMID 17797765.
- ^ Oda, Y.; Nakamura, H.; Yamazaki, T.; Nagayama, K.; Yoshida, M.; Kanaya, S.; Ikehara, M. (1992). "Estudios de RMN de 1H de la ribonucleasa HI deuterada marcada selectivamente con aminoácidos protonados". Journal of Biomolecular NMR . 2 (2): 137–47. doi :10.1007/BF01875525. PMID 1330130. S2CID 28027551.
- ^ Broad, WJ (11 de noviembre de 1991). «Un gran avance en la fusión nuclear ofrece esperanzas para la energía del futuro». The New York Times . Archivado desde el original el 29 de enero de 2021. Consultado el 12 de febrero de 2008 .
- ^ ab Traub, RJ; Jensen, JA (junio de 1995). «Dispositivos radioluminiscentes de tritio, Manual de salud y seguridad» (PDF) . Organismo Internacional de Energía Atómica. pág. 2.4. Archivado (PDF) desde el original el 6 de septiembre de 2015. Consultado el 20 de mayo de 2015 .
- ^ Staff (15 de noviembre de 2007). «Tritium». Agencia de Protección Ambiental de Estados Unidos. Archivado desde el original el 2 de enero de 2008. Consultado el 12 de febrero de 2008 .
- ^ Nave, CR (2006). «Fusión de deuterio-tritio». HyperPhysics . Universidad Estatal de Georgia. Archivado desde el original el 16 de marzo de 2008. Consultado el 8 de marzo de 2008 .
- ^ Kendall, C.; Caldwell, E. (1998). C. Kendall; JJ McDonnell (eds.). "Capítulo 2: Fundamentos de la geoquímica isotópica". Trazadores isotópicos en hidrología de cuencas hidrográficas . Servicio Geológico de Estados Unidos: 51–86. doi :10.1016/B978-0-444-81546-0.50009-4. Archivado desde el original el 14 de marzo de 2008. Consultado el 8 de marzo de 2008 .
- ^ "El Laboratorio de Tritio". Universidad de Miami. 2008. Archivado desde el original el 28 de febrero de 2008. Consultado el 8 de marzo de 2008 .
- ^ ab Holte, AE; Houck, MA; Collie, NL (2004). "Potencial papel del parasitismo en la evolución del mutualismo en ácaros astigmátidos". Acarología experimental y aplicada . 25 (2): 97–107. doi :10.1023/A:1010655610575. PMID 11513367. S2CID 13159020.
- ^ van der Krogt, P. (5 de mayo de 2005). «Hidrógeno». Elementymology & Elements Multidict. Archivado desde el original el 23 de enero de 2010. Consultado el 20 de diciembre de 2010 .
- ^ § IR-3.3.2, Recomendaciones provisionales archivadas el 9 de febrero de 2016 en Wayback Machine , Nomenclatura de la química inorgánica, División de nomenclatura química y representación de la estructura, IUPAC. Consultado en línea el 3 de octubre de 2007.
- ^ IUPAC (1997). "Muonio". En AD McNaught, A. Wilkinson (ed.). Compendio de terminología química (2.ª ed.). Blackwell Scientific Publications . doi :10.1351/goldbook.M04069. ISBN. 978-0-86542-684-9Archivado desde el original el 13 de marzo de 2008 . Consultado el 15 de noviembre de 2016 .
- ^ VW Hughes; et al. (1960). "Formación de muonio y observación de su precesión de Larmor". Physical Review Letters . 5 (2): 63–65. Código Bibliográfico :1960PhRvL...5...63H. doi :10.1103/PhysRevLett.5.63.
- ^ Bondi, DK; Connor, JNL; Manz, J.; Römelt, J. (20 de octubre de 1983). "Estudio cuántico y vibracionalmente adiabático, semiclásico y cuasiclásico exacto de las reacciones colineales Cl + MuCl, Cl + HCl, Cl + DCl". Física molecular . 50 (3): 467–488. Código Bibliográfico :1983MolPh..50..467B. doi :10.1080/00268978300102491. ISSN 0026-8976.
- ^ WH Koppenol; IUPAC (2001). «Nombres de átomos de muonio e hidrógeno y sus iones» (PDF) . Química pura y aplicada . 73 (2): 377–380. doi :10.1351/pac200173020377. S2CID 97138983. Archivado (PDF) desde el original el 14 de mayo de 2011 . Consultado el 15 de noviembre de 2016 .
- ^ Holman, Jack P. (2002). Transferencia de calor (novena edición). Nueva York, NY: McGraw-Hill. pp. 600–606. ISBN 0-07-240655-0.OCLC 46959719 .
- ^ Incropera, Frank P .; Dewitt, David P.; Bergman, Theodore L.; Lavigne, Adrienne S. (2007). Fundamentos de transferencia de calor y masa (6.ª ed.). Hoboken, Nueva Jersey: John Wiley and Sons, Inc., págs. 941–950. ISBN 978-0-471-45728-2.OCLC 62532755 .
- ^ Boyle, R. (1672). Tratados escritos por el Honorable Robert Boyle que contienen nuevos experimentos sobre la relación entre la llama y el aire, y sobre explosiones, un discurso hidrostático provocado por algunas objeciones del Dr. Henry More contra algunas explicaciones de nuevos experimentos realizados por el autor de estos tratados. A lo que se adjunta una carta hidrostática que explica un experimento sobre una forma de pesar el agua en el agua, nuevos experimentos sobre la levedad positiva o relativa de los cuerpos bajo el agua, sobre la fuerza del aire sobre los cuerpos bajo el agua, sobre la presión diferente de los sólidos y fluidos pesados. Impreso para Richard Davis. págs. 64-65.
- ^ Winter, M. (2007). «Hidrógeno: información histórica». WebElements Ltd. Archivado desde el original el 10 de abril de 2008. Consultado el 5 de febrero de 2008 .
- ^ Szydło, ZA (2020). "Hidrógeno: algunos puntos destacados de la historia". Química-Didáctica-Ecología-Metrología . 25 (1–2): 5–34. doi : 10.2478/cdem-2020-0001 . S2CID 231776282.
- ^ Ramsay, W. (1896). Los gases de la atmósfera: La historia de su descubrimiento. Macmillan. pág. 19.
- ^ Musgrave, A. (1976). "¿Por qué el oxígeno sustituyó al flogisto? Programas de investigación en la revolución química". En Howson, C. (ed.). Método y evaluación en las ciencias físicas . Antecedentes críticos de la ciencia moderna, 1800-1905. Cambridge University Press. doi :10.1017/CBO9780511760013. ISBN 978-0-521-21110-9. Consultado el 22 de octubre de 2011 .
- ^ Cavendish, Henry (12 de mayo de 1766). "Tres artículos que contienen experimentos sobre el aire facticio, por el honorable Henry Cavendish, FRS" Philosophical Transactions . 56 : 141–184. Bibcode :1766RSPT...56..141C. doi : 10.1098/rstl.1766.0019 . JSTOR 105491.
- ^ Stwertka, Albert (1996). Una guía de los elementos . Oxford University Press. Págs. 16-21. ISBN. 978-0-19-508083-4.
- ^ Northwood, DO; Kosasih, U. (1983). "Hidruros y agrietamiento retardado por hidrógeno en circonio y sus aleaciones". International Metals Reviews . 28 (1): 92–121. doi :10.1179/imtr.1983.28.1.92. ISSN 0308-4590.
- ^ Asociación Nacional de Fabricantes Eléctricos (1946). Una historia cronológica del desarrollo eléctrico desde el año 600 a. C. Nueva York, NY, Asociación Nacional de Fabricantes Eléctricos. p. 102. Archivado desde el original el 4 de marzo de 2016 . Consultado el 9 de febrero de 2016 .
- ^ Stockel, JF; jd Dunlop; Betz, F (1980). "Rendimiento de la batería de níquel-hidrógeno NTS-2 31". Revista de naves espaciales y cohetes . 17 : 31–34. Código Bibliográfico :1980JSpRo..17...31S. doi :10.2514/3.57704.
- ^ Jannette, AG; Hojnicki, JS; McKissock, DB; Fincannon, J.; Kerslake, TW; Rodríguez, CD (julio de 2002). Validación del modelo de rendimiento eléctrico de la estación espacial internacional mediante telemetría en órbita (PDF) . IECEC '02. 2002 37th Intersociety Energy Conversion Engineering Conference, 2002. págs. 45–50. doi :10.1109/IECEC.2002.1391972. hdl : 2060/20020070612 . ISBN . 0-7803-7296-4. Archivado (PDF) del original el 14 de mayo de 2010 . Consultado el 11 de noviembre de 2011 .
- ^ Anderson, PM; Coyne, JW (2002). "Un sistema de energía de una sola batería, ligero y de alta confiabilidad para naves espaciales interplanetarias". Actas, IEEE Aerospace Conference . Vol. 5. págs. 5–2433. doi :10.1109/AERO.2002.1035418. ISBN 978-0-7803-7231-3.S2CID108678345 .
- ^ "Mars Global Surveyor". Astronautix.com. Archivado desde el original el 10 de agosto de 2009. Consultado el 6 de abril de 2009 .
- ^ Lori Tyahla, ed. (7 de mayo de 2009). «Hubble servicing mission 4 essentials». NASA. Archivado desde el original el 13 de marzo de 2015. Consultado el 19 de mayo de 2015 .
- ^ Hendrix, Susan (25 de noviembre de 2008). Lori Tyahla (ed.). "Extending Hubble's mission life with new Batteries" (Extendiendo la vida útil de la misión del Hubble con nuevas baterías). NASA. Archivado desde el original el 5 de marzo de 2016. Consultado el 19 de mayo de 2015 .
- ^ Crepeau, R. (1 de enero de 2006). Niels Bohr: El modelo atómico . Grandes mentes científicas. ISBN 978-1-4298-0723-4.
- ^ Berman, R.; Cooke, AH; Hill, RW (1956). "Criogenia". Revista Anual de Química Física . 7 : 1–20. Código Bibliográfico :1956ARPC....7....1B. doi :10.1146/annurev.pc.07.100156.000245.
- ^ Charlton, Mike; Van Der Werf, Dirk Peter (1 de marzo de 2015). "Avances en la física del antihidrógeno". Science Progress . 98 (1): 34–62. doi :10.3184/003685015X14234978376369. PMC 10365473 . PMID 25942774. S2CID 23581065.
- ^ Kellerbauer, Alban (29 de enero de 2015). "Por qué importa la antimateria". European Review . 23 (1): 45–56. doi :10.1017/S1062798714000532. S2CID 58906869.
- ^ Gagnon, S. "Hidrógeno". Laboratorio Jefferson. Archivado desde el original el 10 de abril de 2008. Consultado el 5 de febrero de 2008 .
- ^ Haubold, H.; Mathai, AM (15 de noviembre de 2007). «Solar Thermonuclear Energy Generation». Universidad de Columbia . Archivado desde el original el 11 de diciembre de 2011. Consultado el 12 de febrero de 2008 .
- ^ "Hidrógeno". mysite.du.edu . Archivado desde el original el 18 de abril de 2009 . Consultado el 20 de abril de 2008 .
- ^ Storrie-Lombardi, LJ; Wolfe, AM (2000). "Estudios para sistemas de absorción Lyman-alfa amortiguados z > 3: la evolución del gas neutro". Astrophysical Journal . 543 (2): 552–576. arXiv : astro-ph/0006044 . Bibcode :2000ApJ...543..552S. doi :10.1086/317138. S2CID 120150880.
- ^ ab Rhys Grinter; Kropp, A.; Venugopal; et al. (2023). "Base estructural para la extracción de energía bacteriana a partir del hidrógeno atmosférico". Nature . 615 (7952): 541–547. Bibcode :2023Natur.615..541G. doi :10.1038/s41586-023-05781-7. PMC 10017518 . PMID 36890228.
- ^ Dresselhaus, M. ; et al. (15 de mayo de 2003). "Basic Research Needs for the Hydrogen Economy" (PDF) . Resúmenes de la reunión de marzo de la APS . 2004 . Laboratorio Nacional Argonne, Departamento de Energía de los EE. UU., Oficina del Laboratorio Científico: m1.001. Código Bibliográfico :2004APS..MAR.m1001D. Archivado desde el original (PDF) el 13 de febrero de 2008 . Consultado el 5 de febrero de 2008 .
- ^ McCall Group; Oka Group (22 de abril de 2005). «H3+ Resource Center». Universidades de Illinois y Chicago. Archivado desde el original el 11 de octubre de 2007. Consultado el 5 de febrero de 2008 .
- ^ Helm, H.; et al. (2003), "Acoplamiento de estados ligados a estados continuos en hidrógeno triatómico neutro", Recombinación disociativa de iones moleculares con electrones , Departamento de Física Molecular y Óptica, Universidad de Friburgo, Alemania, págs. 275–288, doi :10.1007/978-1-4615-0083-4_27, ISBN 978-1-4613-4915-0
- ^ ab Baade, William F.; Parekh, Uday N.; Raman, Venkat S. (2001). "Hidrógeno". Enciclopedia Kirk-Othmer de tecnología química . doi :10.1002/0471238961.0825041803262116.a01.pub2. ISBN 9780471484943.
- ^ Freyermuth, George H. «Patente de 1934: «La fabricación de hidrógeno a partir de hidrocarburos de metano mediante la acción del vapor a temperatura elevada»». Bases de datos de texto completo de patentes . Oficina de Patentes y Marcas de los Estados Unidos. Archivado desde el original el 1 de octubre de 2021 . Consultado el 30 de octubre de 2020 .
- ^ Press, Roman J.; Santhanam, KSV; Miri, Massoud J.; Bailey, Alla V.; Takacs, Gerald A. (2008). Introducción a la tecnología del hidrógeno . John Wiley & Sons. pág. 249. ISBN 978-0-471-77985-8.
- ^ abc Oxtoby, DW (2002). Principios de la química moderna (5.ª ed.). Thomson Brooks/Cole. ISBN 978-0-03-035373-4.
- ^ Funderburg, E. (2008). "¿Por qué son tan altos los precios del nitrógeno?". The Samuel Roberts Noble Foundation. Archivado desde el original el 9 de mayo de 2001. Consultado el 11 de marzo de 2008 .
- ^ "Propiedades, usos y aplicaciones del hidrógeno". Universal Industrial Gases, Inc. 2007. Archivado desde el original el 27 de marzo de 2008. Consultado el 11 de marzo de 2008 .
- ^ Hannula, Ilkka (2015). "Coproducción de combustibles sintéticos y calefacción urbana a partir de residuos de biomasa, dióxido de carbono y electricidad: análisis de rendimiento y costes". Biomasa y bioenergía . 74 : 26–46. Bibcode :2015BmBe...74...26H. doi :10.1016/j.biombioe.2015.01.006. ISSN 0961-9534.
- ^ Gong, Ming; Zhou, Wu; Tsai, Mon-Che; Zhou, Jigang; Guan, Mingyun; Lin, Meng-Chang; Zhang, Bo; Hu, Yongfeng; Wang, Di-Yan; Yang, Jiang; Pennycook, Stephen J.; Hwang, Bing-Joe; Dai, Hongjie (2014). "Heteroestructuras de óxido de níquel / níquel a nanoescala para electrocatálisis de desprendimiento activo de hidrógeno". Comunicaciones de la naturaleza . 5 : 4695. Código Bib : 2014NatCo...5.4695G. doi : 10.1038/ncomms5695 . PMID 25146255. S2CID 205329127.
- ^ Lees, A. (2007). «Productos químicos a partir de la sal». BBC. Archivado desde el original el 26 de octubre de 2007. Consultado el 11 de marzo de 2008 .
- ^ Von Wald, Gregory A. (2020). «Análisis tecnoeconómico basado en la optimización de la pirólisis de metano en medios fundidos para reducir las emisiones de CO2 del sector industrial». Energía y combustibles sostenibles . 4 (9). Royal Society of Chemistry: 4598–4613. doi :10.1039/D0SE00427H. S2CID 225676190. Archivado desde el original el 8 de noviembre de 2020 . Consultado el 31 de octubre de 2020 .
- ^ Schneider, Stefan (2020). "Estado del arte de la producción de hidrógeno mediante pirólisis de gas natural". ChemBioEng Reviews . 7 (5). Wiley Online Library: 150–158. doi : 10.1002/cben.202000014 .
- ^ Cartwright, Jon. «La reacción que nos daría combustibles fósiles limpios para siempre». New Scientist . Archivado desde el original el 26 de octubre de 2020. Consultado el 30 de octubre de 2020 .
- ^ Instituto Tecnológico de Karlsruhe. «Hidrógeno a partir de metano sin emisiones de CO2». Phys.Org . Archivado desde el original el 21 de octubre de 2020. Consultado el 30 de octubre de 2020 .
- ^ Upham, D. Chester (2017). "Metales fundidos catalíticos para la conversión directa de metano en hidrógeno y carbono separable". Science . 358 (6365). Asociación Estadounidense para el Avance de la Ciencia: 917–921. Bibcode :2017Sci...358..917U. doi : 10.1126/science.aao5023 . PMID 29146810. S2CID 206663568.
- ^ Clarke , Palmer (2020). «Reformado en seco de metano catalizado por aleaciones metálicas fundidas». Nature Catalysis . 3 : 83–89. Archivado desde el original el 29 de enero de 2021. Consultado el 31 de octubre de 2020 .
- ^ Gusev, Alexander. «KITT/IASS – Producción de hidrógeno libre de CO2 a partir de gas natural para uso energético». European Energy Innovation . Instituto de Estudios Avanzados de Sostenibilidad. Archivado desde el original el 29 de enero de 2021. Consultado el 30 de octubre de 2020 .
- ^ Fernandez, Sonia. «Investigadores desarrollan una tecnología potencialmente de bajo costo y bajas emisiones que puede convertir metano sin formar CO2». Phys-Org . Instituto Americano de Física. Archivado desde el original el 19 de octubre de 2020. Consultado el 19 de octubre de 2020 .
- ^ BASF. «Investigadores de BASF trabajan en procesos de producción fundamentalmente nuevos y bajos en carbono: la pirólisis de metano». Estados Unidos Sustentabilidad . BASF. Archivado desde el original el 19 de octubre de 2020 . Consultado el 19 de octubre de 2020 .
- ^ Weimer, Al (25 de mayo de 2005). "Desarrollo de la producción termoquímica de hidrógeno a partir del agua con energía solar" (PDF) . Proyecto de generación termoquímica de hidrógeno solar. Archivado (PDF) desde el original el 17 de abril de 2007. Consultado el 21 de diciembre de 2008 .
- ^ Perret, R. "Desarrollo de la producción termoquímica de hidrógeno a partir del agua con energía solar, Programa de Hidrógeno del DOE, 2007" (PDF) . Archivado desde el original (PDF) el 27 de mayo de 2010. Consultado el 17 de mayo de 2008 .
- ^ Parmuzina, AV; Kravchenko, OV (2008). "Activación del metal de aluminio para generar hidrógeno a partir del agua". Revista internacional de energía del hidrógeno . 33 (12): 3073–3076. Bibcode :2008IJHE...33.3073P. doi :10.1016/j.ijhydene.2008.02.025.
- ^ Lubitz, Wolfgang; Reijerse, Eduard; Van Gastel, Maurice (2007). "Hidrogenasas [NiFe] y [FeFe] estudiadas mediante técnicas avanzadas de resonancia magnética". Chemical Reviews . 107 (10): 4331–4365. doi :10.1021/cr050186q. PMID 17845059.
- ^ "Hidrógeno natural: una fuente potencial de energía limpia bajo nuestros pies". Yale E360 . Consultado el 27 de enero de 2024 .
- ^ Barnard, Michael (22 de octubre de 2023). "¿Qué hay de nuevo en los peldaños de la escalera del hidrógeno de Liebreich?". CleanTechnica . Consultado el 10 de marzo de 2024 .
- ^ Smil, Vaclav (2004). Enriqueciendo la Tierra: Fritz Haber, Carl Bosch y la transformación de la producción mundial de alimentos (1.ª ed.). Cambridge, MA: MIT. ISBN 978-0-262-69313-4.
- ^ Chemistry Operations (15 de diciembre de 2003). «Hidrógeno». Laboratorio Nacional de Los Álamos. Archivado desde el original el 4 de marzo de 2011. Consultado el 5 de febrero de 2008 .
- ^ abcde IPCC (2022). Shukla, PR; Skea, J.; Slade, R.; Al Khourdajie, A.; et al. (eds.). Cambio climático 2022: mitigación del cambio climático (PDF) . Contribución del Grupo de trabajo III al sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático. Cambridge, Reino Unido y Nueva York, NY, EE. UU.: Cambridge University Press (en prensa). págs. 91–92. doi :10.1017/9781009157926. ISBN 9781009157926.
- ^ ab Evans, Simon; Gabbatiss, Josh (30 de noviembre de 2020). "Preguntas y respuestas en profundidad: ¿Necesita el mundo hidrógeno para resolver el cambio climático?". Carbon Brief . Archivado desde el original el 1 de diciembre de 2020. Consultado el 1 de diciembre de 2020 .
- ^ McCarthy, J. (31 de diciembre de 1995). «Hidrógeno». Universidad de Stanford . Archivado desde el original el 14 de marzo de 2008. Consultado el 14 de marzo de 2008 .
- ^ Reed, Stanley; Ewing, Jack (13 de julio de 2021). «El hidrógeno es una respuesta al cambio climático. Conseguirlo es la parte difícil». The New York Times . ISSN 0362-4331. Archivado desde el original el 14 de julio de 2021. Consultado el 14 de julio de 2021 .
- ^ IRENA (2019). Hidrógeno: una perspectiva de energía renovable (PDF) . p. 9. ISBN 978-92-9260-151-5Archivado (PDF) del original el 29 de septiembre de 2021 . Consultado el 17 de octubre de 2021 ..
- ^ Bonheure, Mike; Vandewalle, Laurien A.; Marin, Guy B.; Van Geem, Kevin M. (marzo de 2021). "¿Sueño o realidad? Electrificación de las industrias de procesos químicos". Revista CEP . Instituto Americano de Ingenieros Químicos . Archivado desde el original el 17 de julio de 2021. Consultado el 6 de julio de 2021 .
- ^ ab Griffiths, Steve; Sovacool, Benjamin K.; Kim, Jinsoo; Bazilian, Morgan; et al. (2021). "Descarbonización industrial a través del hidrógeno: una revisión crítica y sistemática de los desarrollos, los sistemas sociotécnicos y las opciones de política". Investigación energética y ciencias sociales . 80 : 39. Bibcode :2021ERSS...8002208G. doi :10.1016/j.erss.2021.102208. ISSN 2214-6296. Archivado desde el original el 16 de octubre de 2021 . Consultado el 11 de septiembre de 2021 .
- ^ Palys, Matthew J.; Daoutidis, Prodromos (2020). "Uso de hidrógeno y amoníaco para el almacenamiento de energía renovable: un estudio tecnoeconómico geográficamente completo". Computers & Chemical Engineering . 136 : 106785. doi : 10.1016/j.compchemeng.2020.106785 . ISSN 0098-1354.
- ^ "La industria del hidrógeno debe sanearse antes de expandirse a nuevos…". Canary Media . 31 de agosto de 2021 . Consultado el 5 de abril de 2023 .
- ^ IRENA (2021). Perspectivas de la transición energética mundial: trayectoria de 1,5 °C (PDF) . pp. 12, 22. ISBN 978-92-9260-334-2. Archivado (PDF) del original el 11 de junio de 2021.
- ^ AIE (2021). Net Zero by 2050: A Roadmap for the Global Energy Sector (PDF) . págs. 15, 75–76. Archivado (PDF) del original el 23 de mayo de 2021.
- ^ Kjellberg-Motton, Brendan (7 de febrero de 2022). «La descarbonización del acero cobra velocidad | Argus Media». www.argusmedia.com . Consultado el 7 de septiembre de 2023 .
- ^ Blank, Thomas; Molly, Patrick (enero de 2020). "El impacto de la descarbonización del hidrógeno en la industria" (PDF) . Rocky Mountain Institute . pp. 2, 7, 8. Archivado (PDF) del original el 22 de septiembre de 2020.
- ^ Plötz, Patrick (31 de enero de 2022). «Es poco probable que la tecnología del hidrógeno desempeñe un papel importante en el transporte por carretera sostenible». Nature Electronics . 5 (1): 8–10. doi :10.1038/s41928-021-00706-6. ISSN 2520-1131. S2CID 246465284.
- ^ Le Comber, PG; Jones, DI; Spear, WE (1977). "Efecto Hall y conducción de impurezas en silicio amorfo dopado sustitucionalmente". Revista filosófica . 35 (5): 1173–1187. Código Bibliográfico :1977PMag...35.1173C. doi :10.1080/14786437708232943.
- ^ Van de Walle, CG (2000). "El hidrógeno como causa de dopaje en el óxido de zinc" (PDF) . Physical Review Letters . 85 (5): 1012–1015. Bibcode :2000PhRvL..85.1012V. doi :10.1103/PhysRevLett.85.1012. hdl : 11858/00-001M-0000-0026-D0E6-E . PMID 10991462. Archivado (PDF) desde el original el 15 de agosto de 2017 . Consultado el 1 de agosto de 2018 .
- ^ Janotti, A.; Van De Walle, CG (2007). "Enlaces multicéntricos de hidrógeno". Materiales de la naturaleza . 6 (1): 44–47. Código Bib : 2007NatMa...6...44J. doi :10.1038/nmat1795. PMID 17143265.
- ^ Kilic, C.; Zunger, Alex (2002). "Dopaje de óxidos de tipo n por hidrógeno". Applied Physics Letters . 81 (1): 73–75. Bibcode :2002ApPhL..81...73K. doi :10.1063/1.1482783. S2CID 96415065.
- ^ Peacock, PW; Robertson, J. (2003). "Comportamiento del hidrógeno en aisladores de compuerta de óxido de constante dieléctrica alta". Applied Physics Letters . 83 (10): 2025–2027. Código Bibliográfico :2003ApPhL..83.2025P. doi :10.1063/1.1609245.
- ^ Durgutlu, A. (2003). "Investigación experimental del efecto del hidrógeno en argón como gas de protección en la soldadura TIG de acero inoxidable austenítico". Materiales y diseño . 25 (1): 19–23. doi :10.1016/j.matdes.2003.07.004.
- ^ "Soldadura con hidrógeno atómico". Soldaduras especiales. 2007. Archivado desde el original el 16 de julio de 2011.
- ^ Hardy, WN (2003). "De H2 a máseres criogénicos de H a superconductores HiTc: un camino improbable pero gratificante". Physica C: Superconductivity . 388–389: 1–6. Bibcode :2003PhyC..388....1H. doi :10.1016/S0921-4534(02)02591-1.
- ^ Almqvist, Ebbe (2003). Historia de los gases industriales. Nueva York, NY: Kluwer Academic/Plenum Publishers. pp. 47–56. ISBN 978-0-306-47277-0. Recuperado el 20 de mayo de 2015 .
- ^ Block, M. (3 de septiembre de 2004). Hidrógeno como gas trazador para la detección de fugas. 16.° WCNDT 2004. Montreal, Canadá: Sensistor Technologies. Archivado desde el original el 8 de enero de 2009. Consultado el 25 de marzo de 2008 .
- ^ "Informe de la Comisión sobre la ingesta de aditivos alimentarios dietéticos" (PDF) . Unión Europea . Archivado (PDF) desde el original el 16 de febrero de 2008 . Consultado el 5 de febrero de 2008 .
- ^ Reinsch, J.; Katz, A.; Wean, J.; Aprahamian, G.; MacFarland, JT (1980). "El efecto del isótopo de deuterio sobre la reacción de la acil-CoA grasa deshidrogenasa y butiril-CoA". J. Biol. Chem . 255 (19): 9093–97. doi : 10.1016/S0021-9258(19)70531-6 . PMID 7410413.
- ^ "NASA/TM—2002-211915: Experimentos con hidrógeno sólido para propulsores atómicos" (PDF) . Archivado (PDF) del original el 9 de julio de 2021 . Consultado el 2 de julio de 2021 .
- ^ Bergeron, KD (2004). "La muerte del uso no dual". Boletín de los científicos atómicos . 60 (1): 15–17. Código Bibliográfico :2004BuAtS..60a..15B. doi :10.2968/060001004. Archivado desde el original el 19 de abril de 2008. Consultado el 13 de abril de 2008 .
- ^ Cammack, R.; Robson, RL (2001). El hidrógeno como combustible: aprendiendo de la naturaleza. Taylor & Francis Ltd., págs. 202-203. ISBN 978-0-415-24242-4Archivado del original el 29 de enero de 2021 . Consultado el 3 de septiembre de 2020 .
- ^ Rhee, TS; Brenninkmeijer, CAM; Röckmann, T. (19 de mayo de 2006). "El papel abrumador de los suelos en el ciclo atmosférico global del hidrógeno" (PDF) . Química y física atmosférica . 6 (6): 1611–1625. Bibcode :2006ACP.....6.1611R. doi : 10.5194/acp-6-1611-2006 . Archivado (PDF) desde el original el 24 de agosto de 2019 . Consultado el 24 de agosto de 2019 .
- ^ Alex Wilkins (8 de marzo de 2023). "La enzima de las bacterias del suelo genera electricidad a partir del hidrógeno del aire". New Scientist . 257 (3430): 13. Bibcode :2023NewSc.257...13W. doi :10.1016/S0262-4079(23)00459-1. S2CID 257625443.
- ^ Eisenmann, Alexander; Amann, Anton; Said, Michael; Datta, Bettina; Ledochowski, Maximilian (2008). "Implementación e interpretación de pruebas de aliento con hidrógeno" (PDF) . Journal of Breath Research . 2 (4): 046002. Bibcode :2008JBR.....2d6002E. doi :10.1088/1752-7155/2/4/046002. PMID 21386189. S2CID 31706721. Archivado desde el original (PDF) el 29 de enero de 2021 . Consultado el 26 de diciembre de 2020 .
- ^ Kruse, O.; Rupprecht, J.; Bader, K.; Thomas-Hall, S.; Schenk, PM; Finazzi, G.; Hankamer, B. (2005). "Producción fotobiológica mejorada de H2 en células de algas verdes diseñadas" (PDF) . The Journal of Biological Chemistry . 280 (40): 34170–7. doi : 10.1074/jbc.M503840200 . PMID 16100118. S2CID 5373909. Archivado (PDF) desde el original el 29 de enero de 2021 . Consultado el 24 de agosto de 2019 .
- ^ Smith, Hamilton O.; Xu, Qing (2005). "IV.E.6 Hidrógeno a partir del agua en un nuevo sistema de cianobacterias recombinantes tolerantes al oxígeno" (PDF) . Informe de progreso del año fiscal 2005 . Departamento de Energía de los Estados Unidos. Archivado (PDF) desde el original el 29 de diciembre de 2016 . Consultado el 6 de agosto de 2016 .
- ^ Williams, C. (24 de febrero de 2006). «Pond life: the future of energy» (Vida en los estanques: el futuro de la energía). Science . The Register. Archivado desde el original el 9 de mayo de 2011 . Consultado el 24 de marzo de 2008 .
- ^ "MyChem: Chemical" (PDF) . Archivado desde el original (PDF) el 1 de octubre de 2018. Consultado el 1 de octubre de 2018 .
- ^ ab Brown, WJ; et al. (1997). "Norma de seguridad para el hidrógeno y los sistemas de hidrógeno" (PDF) . NASA . NSS 1740.16. Archivado (PDF) del original el 1 de mayo de 2017. Consultado el 12 de julio de 2017 .
- ^ "Ficha de datos de seguridad del hidrógeno líquido" (PDF) . Praxair, Inc. Septiembre de 2004. Archivado desde el original (PDF) el 27 de mayo de 2008 . Consultado el 16 de abril de 2008 .
- ^ "'Bichos' y fragilización por hidrógeno". Science News . 128 (3): 41. 20 de julio de 1985. doi :10.2307/3970088. JSTOR 3970088.
- ^ Hayes, B. "Union Oil Amine Absorber Tower". TWI. Archivado desde el original el 20 de noviembre de 2008. Consultado el 29 de enero de 2010 .
- ^ Walker, James L.; Waltrip, John S.; Zanker, Adam (1988). "Relaciones entre la oferta y la demanda de ácido láctico y magnesio". En John J. McKetta; William Aaron Cunningham (eds.). Enciclopedia de procesamiento y diseño químico . Vol. 28. Nueva York: Dekker. pág. 186. ISBN. 978-0-8247-2478-8. Recuperado el 20 de mayo de 2015 .
Lectura adicional
- La división hiperfina del hidrógeno - Las conferencias Feynman sobre física
- Diagrama de los nucleidos (17.ª ed.). Laboratorio de Energía Atómica Knolls. 2010. ISBN 978-0-9843653-0-2.
- Newton, David E. (1994). Los elementos químicos. Nueva York: Franklin Watts. ISBN 978-0-531-12501-4.
- Rigden, John S. (2002). Hidrógeno: el elemento esencial. Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-531-12501-4.
- Romm, Joseph J. (2004). El bombo publicitario sobre el hidrógeno: realidad y ficción en la carrera por salvar el clima . Island Press. ISBN 978-1-55963-703-9.
- Scerri, Eric (2007). El sistema periódico, su historia y su importancia . Nueva York: Oxford University Press. ISBN 978-0-19-530573-9.
Enlaces externos
- Cálculos básicos de la mecánica cuántica sobre el hidrógeno
- El hidrógeno en la tabla periódica de vídeos (Universidad de Nottingham)
- Diagrama de fases del hidrógeno a alta temperatura
- Función de onda del hidrógeno










