Éter dietílico
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Etoxietano | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 1696894 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.000.425 |
| Número CE |
|
| 25444 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1155 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C4H10O | |
| Masa molar | 74,123 g·mol −1 |
| Apariencia | Líquido incoloro |
| Olor | Olor seco, dulce y parecido al ron [1] |
| Densidad | 0,7134 g/cm3 , líquido |
| Punto de fusión | -116,3 °C (-177,3 °F; 156,8 K) |
| Punto de ebullición | 34,6 °C (94,3 °F; 307,8 K) [4] |
| 6,05 g/(100 ml) [2] | |
| registro P | 0,98 [3] |
| Presión de vapor | 440 mmHg (58,66 kPa) a 20 °C [1] |
| −55,1·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1.353 (20 °C) |
| Viscosidad | 0,224 cP (25 °C) |
| Estructura | |
| 1,15 D (gas) | |
| Termoquímica | |
Capacidad calorífica ( C ) | 172,5 J/(mol·K) |
Entropía molar estándar ( S ⦵ 298 ) | 253,5 J/(mol·K) |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −271,2 ± 1,9 kJ/mol |
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −2732,1 ± 1,9 kJ/mol |
| Farmacología | |
| N01AA01 ( OMS ) | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Extremadamente inflamable, nocivo para la piel, se descompone en peróxidos explosivos en el aire y la luz [1] |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H224 , H302 , H336 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P303+P361+P353 , P304+P340 , P312 , P330 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | -45 °C (-49 °F; 228 K) [7] |
| 160 °C (320 °F; 433 K) [7] | |
| Límites de explosividad | 1,9–48,0 % [5] |
| Dosis o concentración letal (LD, LC): | |
LC 50 ( concentración media ) | 73.000 ppm (rata, 2 h) 6500 ppm (ratón, 1,65 h) [6] |
LC Lo ( valor más bajo publicado ) | 106.000 ppm (conejo) 76.000 ppm (perro) [6] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 400 ppm (1200 mg/m3 ) [ 1] |
REL (recomendado) | No hay REL establecido [1] |
IDLH (Peligro inmediato) | 1900 ppm [1] |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
| Compuestos relacionados | |
Éteres relacionados | |
Compuestos relacionados | |
| Página de datos complementarios | |
| Éter dietílico (página de datos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
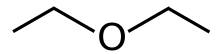
El éter dietílico , o simplemente éter , es un compuesto orgánico con la fórmula química ( CH3CH2 ) 2O , a veces abreviado como Et2O . [ a] Es un líquido incoloro, altamente volátil , de olor dulce ("olor etéreo") y extremadamente inflamable . Pertenece a la clase de compuestos orgánicos de los éteres . Es un disolvente común . Antiguamente se utilizaba como anestésico general . [8]
Producción
La mayor parte del éter dietílico se produce como subproducto de la hidratación en fase de vapor del etileno para producir etanol . Este proceso utiliza catalizadores de ácido fosfórico soportados en sólidos y se puede ajustar para producir más éter si surge la necesidad: [9] La deshidratación en fase de vapor del etanol sobre algunos catalizadores de alúmina puede dar rendimientos de éter dietílico de hasta el 95 %. [10]
- 2CH3CH2OH → ( CH3CH2 ) 2O + H2O
El éter dietílico se puede preparar tanto en laboratorios como a escala industrial mediante la síntesis de éter ácido. [11]
Usos
El uso predominante del éter dietílico es como disolvente. Una aplicación particular es en la producción de plásticos de celulosa como el acetato de celulosa . [9]
Disolvente de laboratorio
Es un disolvente común para la reacción de Grignard además de otras reacciones que involucran reactivos organometálicos. [12] Estos usos explotan su basicidad. El éter dietílico es un disolvente no polar popular en la extracción líquido-líquido . Como extractante, es inmiscible con el agua y menos denso que ella.
Aunque es inmiscible, tiene una solubilidad significativa en agua (6,05 g/(100 ml) a 25 °C [2] ) y disuelve 1,5 g/(100 g) (1,0 g/(100 ml)) de agua a 25 °C. [13]
Combustible
El éter dietílico tiene un alto índice de cetano de 85-96 y, en combinación con destilados de petróleo para motores de gasolina y diésel, [14] se utiliza como fluido de arranque debido a su alta volatilidad y bajo punto de inflamación . El fluido de arranque de éter se vende y se utiliza en países con climas fríos, ya que puede ayudar a arrancar un motor en frío a temperaturas bajo cero. Por la misma razón, también se utiliza como componente de la mezcla de combustible para motores de modelo de encendido por compresión con carburador .
Reacciones químicas
El tetrafluoroborato de trietiloxonio se prepara a partir de trifluoruro de boro , éter dietílico y epiclorhidrina : [15]
- 4 Et 2 O·BF 3 + 2 Et 2 O + 3 C 2 H 3 OCH 2 Cl → 3 [Et 3 O] + [BF 4 ] − + B(OCH(CH 2 Cl)CH 2 OEt) 3
El éter dietílico es una base de Lewis dura que reacciona con una variedad de ácidos de Lewis como yodo , fenol y trimetilaluminio , y sus parámetros de base en el modelo ECW son E B = 1,80 y C B = 1,63. El éter dietílico es un disolvente aprótico de laboratorio común .
El éter dietílico es susceptible a la formación de hidroperóxidos .
Metabolismo
Se propone una enzima del citocromo P450 para metabolizar el éter dietílico. [16]
El éter dietílico inhibe la alcohol deshidrogenasa y, por lo tanto, ralentiza el metabolismo del etanol . [17] También inhibe el metabolismo de otros fármacos que requieren un metabolismo oxidativo . Por ejemplo, el diazepam requiere oxidación hepática, mientras que su metabolito oxidado, el oxazepam, no la requiere. [18]
Seguridad, estabilidad, normativa
El éter dietílico es extremadamente inflamable y puede formar mezclas explosivas de vapor y aire. [19]
Como el éter es más pesado que el aire, puede acumularse cerca del suelo y el vapor puede viajar distancias considerables hasta fuentes de ignición. El éter se encenderá si se expone a una llama abierta, aunque debido a su alta inflamabilidad, no se requiere una llama abierta para la ignición. Otras posibles fuentes de ignición incluyen, entre otras, placas calefactoras, tuberías de vapor, calentadores y arcos eléctricos creados por interruptores o enchufes. [19] El vapor también puede encenderse por la electricidad estática que se puede acumular cuando se vierte éter de un recipiente a otro. La temperatura de autoignición del éter dietílico es de 160 °C (320 °F). La difusión del éter dietílico en el aire es de 9,18 × 10 −6 m 2 /s (298 K, 101,325 kPa). [ cita requerida ]
El éter es sensible a la luz y al aire, y tiende a formar peróxidos explosivos . [19] Los peróxidos de éter tienen un punto de ebullición más alto que el éter y son explosivos por contacto cuando están secos. [19] El éter dietílico comercial se suministra normalmente con trazas del antioxidante hidroxitolueno butilado (BHT), que reduce la formación de peróxidos. El almacenamiento sobre hidróxido de sodio precipita los hidroperóxidos de éter intermedios. El agua y los peróxidos se pueden eliminar mediante destilación a partir de sodio y benzofenona , o haciéndolos pasar a través de una columna de alúmina activada . [20]
Debido a su aplicación en la fabricación de sustancias ilícitas, se encuentra incluido en el Cuadro II de precursores de la Convención de las Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Psicotrópicas, al igual que sustancias como la acetona , el tolueno y el ácido sulfúrico . [21]
Historia
El compuesto pudo haber sido sintetizado por Jābir ibn Hayyān en el siglo VIII [22] o por Ramon Llull en 1275. [22] [23] Fue sintetizado en 1540 por Valerius Cordus , quien lo llamó "aceite dulce de vitriolo" ( oleum dulce vitrioli ) - el nombre refleja el hecho de que se obtiene destilando una mezcla de etanol y ácido sulfúrico (entonces conocido como aceite de vitriolo) - y señaló algunas de sus propiedades medicinales . [22] Casi al mismo tiempo, Paracelso descubrió las propiedades analgésicas de la molécula en los perros. [22] El nombre de éter fue dado a la sustancia en 1729 por August Sigmund Frobenius . [24]
Se consideró que era un compuesto de azufre hasta que la idea fue refutada alrededor de 1800. [25]
La síntesis del éter dietílico mediante una reacción entre etanol y ácido sulfúrico se conoce desde el siglo XIII. [25]
Anestesia


William TG Morton participó en una demostración pública de anestesia con éter el 16 de octubre de 1846, en el Ether Dome de Boston, Massachusetts . Morton había llamado a su preparación de éter, con aceites aromáticos para ocultar su olor, " Letheon ", en honor al río Lethe (Λήθη, que significa "olvido, olvido"). [26] Sin embargo, ahora se sabe que Crawford Williamson Long demostró su uso en privado como anestésico general en cirugía a funcionarios de Georgia, ya el 30 de marzo de 1842, y Long demostró públicamente el uso del éter como anestésico quirúrgico en seis ocasiones antes de la demostración de Boston. [27] [28] [29] Los médicos británicos conocían las propiedades anestésicas del éter ya en 1840, cuando se prescribía ampliamente junto con el opio. [30] Algunos médicos preferían el éter dietílico al cloroformo como anestésico general debido al índice terapéutico más favorable del éter , es decir, una mayor diferencia entre una dosis efectiva y una dosis potencialmente tóxica. [31]
El éter dietílico no deprime el miocardio sino que estimula el sistema nervioso simpático, lo que produce hipertensión y taquicardia. Se utiliza de forma segura en pacientes con shock, ya que preserva el reflejo barorreceptor . [32] Su efecto mínimo sobre la depresión miocárdica y el impulso respiratorio, así como su bajo coste y alto índice terapéutico permiten que se siga utilizando en países en desarrollo. [33] El éter dietílico también se puede mezclar con otros agentes anestésicos como el cloroformo para hacer una mezcla de CE , o cloroformo y alcohol para hacer una mezcla de ECA . En el siglo XXI, el éter rara vez se utiliza. El uso de éter inflamable fue desplazado por anestésicos de hidrocarburos fluorados no inflamables. El halotano fue el primer anestésico de este tipo desarrollado y otros anestésicos inhalados de uso actual, como el isoflurano , el desflurano y el sevoflurano , son éteres halogenados. [34] Se ha descubierto que el éter dietílico tiene efectos secundarios indeseables, como náuseas y vómitos postanestésicos. Los agentes anestésicos modernos reducen estos efectos secundarios. [27]

Antes de 2005, figuraba en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud para su uso como anestésico. [35] [36]
Medicamento
El éter se utilizó en el pasado en formulaciones farmacéuticas. Una mezcla de alcohol y éter, una parte de éter dietílico y tres partes de etanol, se conocía como "Espíritu de éter" , Anodyne de Hoffman o Gotas de Hoffman. En los Estados Unidos, este brebaje fue eliminado de la Farmacopea en algún momento antes de junio de 1917, [37] ya que un estudio publicado por William Procter, Jr. en el American Journal of Pharmacy en 1852 demostró que existían diferencias en la formulación entre los fabricantes comerciales, entre las farmacopeas internacionales y con respecto a la receta original de Hoffman. [38] También se utiliza para tratar el hipo mediante instilación en la cavidad nasal. [39]
Abuso recreativo
El uso recreativo del éter también se dio en fiestas organizadas en el siglo XIX llamadas ether frolics , donde se animaba a los invitados a inhalar cantidades terapéuticas de éter dietílico u óxido nitroso , lo que producía un estado de excitación. Long, así como sus colegas dentistas Horace Wells , William Edward Clarke y William TG Morton observaron que durante estas reuniones, las personas a menudo sufrían lesiones menores pero parecían no mostrar reacción a la lesión, ni recuerdo de lo que había sucedido, lo que demuestra los efectos anestésicos del éter. [40]
En el siglo XIX y principios del XX, el consumo de éter era popular entre los campesinos polacos. [41] Es una droga recreativa tradicional y todavía relativamente popular entre los lemkos . [42] Por lo general, se consume en una pequeña cantidad ( kropka o "dot") vertida sobre leche , agua azucarada o jugo de naranja en un vaso de chupito . Como droga, se sabe que causa dependencia psicológica , a veces denominada eteromanía . [43] [ cita médica requerida ]
Véase también
- El gran momento : película sobre William TG Morton y el éter
- Flurotilo – derivado fluorado
Notas explicativas
- ^ Et representa el grupo etilo monovalente CH 3 CH 2 que a menudo se escribe como C 2 H 5 (ver símbolo del pseudoelemento )
Referencias
- ^ abcdef Guía de bolsillo del NIOSH sobre peligros químicos. "#0277". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Merck Index , 10.ª ed., Martha Windholz, editora, Merck & Co., Inc., Rahway, NJ, 1983, pág. 551
- ^ "Éter dietílico_msds".
- ^ "Éter dietílico". ChemSpider . Consultado el 19 de enero de 2017 .
- ^ Carl L. Yaws, Manual de propiedades químicas , McGraw-Hill, Nueva York, 1999, pág. 567
- ^ ab "Éter etílico". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Ficha de datos de seguridad del éter etílico". JT Baker. Archivado desde el original el 28 de marzo de 2012. Consultado el 24 de junio de 2010 .
- ^ Sakuth, Michael; Mensing, Thomas; Schuler, Joachim; Heitmann, Wilhelm; Strehlke, Günther; Mayer, Dieter (2010). "Éteres alifáticos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a10_023.pub2. ISBN 978-3-527-30385-4.
- ^ ab "Éteres, por Lawrence Karas y WJ Piel". Enciclopedia Kirk‑Othmer de tecnología química . John Wiley & Sons, Inc. 2004.
- ^ Éter etílico, Manual de economía química . Menlo Park, California: SRI International. 1991.
- ^ Cohen, Julius Berend (1920). A Class-book of Organic Chemistry, Volume 1. Londres: Macmillan and Co. p. 39.
la estructura del alcohol etílico cohen julius éter dietílico.
- ^ Moyer, WW; Marveltitle=Triethyl Carbinol, CS (1931). Síntesis orgánicas . 11 : 98. doi :10.15227/orgsyn.011.0098.
{{cite journal}}: Falta o está vacío|title=( ayuda ) - ^ HH Rowley; Wm. R. Reed (1951). "Solubilidad del agua en éter dietílico a 25 °". J. Am. Chem. Soc . 73 (6): 2960. doi :10.1021/ja01150a531.
- ^ "Fluido de arranque de máxima potencia: cómo funciona". Valvovine. Archivado desde el original el 27 de septiembre de 2007. Consultado el 5 de septiembre de 2007 .
- ^ H. Meerwein (1966). "Fluoroborato de trietiloxonio". Organic Syntheses . 46 : 113. doi :10.15227/orgsyn.046.0113.
- ^ 109. La cepa mutante 241 de Aspergillus flavus, bloqueada en la biosíntesis de aflatoxina, no acumula la transcripción de aflR. Archivado el 17 de septiembre de 2017 en Wayback Machine Matthew P. Brown y Gary A. Payne, Universidad Estatal de Carolina del Norte , Raleigh, NC, fgsc.net
- ^ PT Normann; A. Ripel; J. Morland (1987). "El éter dietílico inhibe el metabolismo del etanol in vivo mediante interacción con la alcohol deshidrogenasa". Alcoholismo: investigación clínica y experimental . 11 (2): 163–166. doi :10.1111/j.1530-0277.1987.tb01282.x. PMID 3296835.
- ^ Larry K. Keefer; William A. Garland; Neil F. Oldfield; James E. Swagzdis; Bruce A. Mico (1985). "Inhibición del metabolismo de N-nitrosodimetilamina en ratas mediante anestesia con éter" (PDF) . Cancer Research . 45 (11 Pt 1): 5457–5460. PMID 4053020.
- ^ abcd "Copia archivada" (PDF) . Archivado desde el original (PDF) el 2014-11-13 . Consultado el 2014-02-15 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ WLF Armarego; CLL Chai (2003). Purificación de productos químicos de laboratorio . Boston: Butterworth-Heinemann. ISBN 978-0-7506-7571-0.
- ^ Microsoft Word – RedListE2007.doc Archivado el 27 de febrero de 2008 en Wayback Machine .
- ^ abcd Toski, Judith A; Tocino, Douglas R; Calverley, Rod K (2001). La historia de la Anestesiología . En: Barash, Paul G; Cullen, Bruce F; Stoelting, Robert K. Anestesia clínica (4ª ed.). Lippincott Williams y Wilkins. pag. 3.ISBN 978-0-7817-2268-1.
- ^ Hademenos, George J.; Murphree, Shaun; Zahler, Kathy; Warner, Jennifer M. (2008). PCAT de McGraw-Hill. McGraw-Hill. pág. 39. ISBN 978-0-07-160045-3. Consultado el 25 de mayo de 2011 .
- ^ "VIII. Relato de un spiritus vini æthereus, junto con varios experimentos realizados con él". Philosophical Transactions of the Royal Society of London . 36 (413): 283–289. 1730. doi :10.1098/rstl.1729.0045. S2CID 186207852.
- ^ ab Chisholm, Hugh , ed. (1911). . Encyclopædia Britannica . Vol. 9 (11.ª ed.). Cambridge University Press. pág. 806.
- ^ Cavendish, Marshall (2008). Inventores e invenciones, volumen 4. Marshall Cavendish. pág. 1129. ISBN 978-0-7614-7767-9.
- ^ ab Hill, John W. y Kolb, Doris K. Química para tiempos de cambio: décima edición . pág. 257. Pearson: Prentice Hall. Upper Saddle River, Nueva Jersey. 2004.
- ^ Madden, M. Leslie (14 de mayo de 2004). «Crawford Long (1815–1878)». New Georgia Encyclopedia (Nueva enciclopedia de Georgia) . University of Georgia Press ( Prensa de la Universidad de Georgia ). Consultado el 13 de febrero de 2015 .
- ^ "Crawford W. Long". Día del Médico . Asociación Médica del Sur. Archivado desde el original el 13 de febrero de 2015. Consultado el 13 de febrero de 2015 .
- ^ Grattan, N. "Tratamiento de la hemorragia uterina". Provincial Medicine and Surgical Journal . Vol. 1, No. 6 (7 de noviembre de 1840), pág. 107.
- ^ Calderone, FA (1935). "Estudios sobre la dosificación de éter después de la medicación preanestésica con narcóticos (barbitúricos, sulfato de magnesio y morfina)" (PDF) . Revista de farmacología y terapéutica experimental . 55 (1): 24–39.
- ^ "Efectos del éter". 31 de octubre de 2010.
- ^ "Éter y sus efectos en la anestesia". Anestesia General . 2010-10-31.
- ^ Morgan, G. Edward, Jr. et al. (2002). Anestesiología clínica , 3.ª edición. Nueva York: McGraw-Hill. pág. 3.
- ^ "Lista modelo de medicamentos esenciales de la OMS (revisada en abril de 2003)" (PDF) . apps.who.int (13.ª ed.). Ginebra (Suiza): Organización Mundial de la Salud. Abril de 2003. Consultado el 6 de septiembre de 2017 .
- ^ "Lista modelo de la OMS de medicamentos esenciales (revisada en marzo de 2005)" (PDF) . apps.who.int (14.ª ed.). Ginebra (Suiza): Organización Mundial de la Salud. Marzo de 2005. Archivado desde el original (PDF) el 5 de agosto de 2005 . Consultado el 6 de septiembre de 2017 .
- ^ The National Druggist, volumen 47, junio de 1917, págs. 220
- ^ Procter, William Jr. (1852). "Sobre el licor anodino de Hoffman". American Journal of Pharmacy . 28 .
- ^ ncbi, Tratamiento del hipo con instilación de éter en la cavidad nasal.
- ^ "Cómo el éter pasó de ser una droga recreativa y divertida a ser el primer anestésico quirúrgico". Revista Smithsonian . Consultado el 11 de octubre de 2020 .
- ^ Zandberg, Adrian (2010). «Breve artículo «Los pueblos… huelen a vapores de éter»: consumo de éter en Silesia antes de 1939». Medical History . 54 (3): 387–396. doi :10.1017/s002572730000466x. PMC 2890321 . PMID 20592886.
- ^ Kaszycki, Néstor (30 de agosto de 2006). "Łemkowska Watra w Żdyni 2006 - pilnowanie ognia pamięci". Histmag.org - historia od podszewki (en polaco). Cracovia, Polonia: i-Press . Consultado el 25 de noviembre de 2009 .
Dawniej eteru używało się w lecznictwie do narkozy, ponieważ ma właściwości halucynogenne, a już kilka kropel inhalacji wystarczyło do silnego znieczulenia pacjenta. Jednak eter, jak każda ciecz, może teoretycznie być napojem. Łemkowie tę teorię praktykują. Mimo to, nazywanie skroplonego eteru – "kropki" – ich "napojem narodowym" byłoby przesadą. Chociaż stanowi to pewną część mitu "bycia Łemkiem".
- ^ Krenz, Sonia; Zimmermann, Gregoire; Kolly, Stéphane; Zullino, Daniele Fabio (agosto de 2003). "Éter: una adicción olvidada". Adicción . 98 (8): 1167–1168. doi :10.1046/j.1360-0443.2003.00439.x. PMID 12873252.
Enlaces externos
- Anuncio de Michael Faraday sobre el éter como anestésico en 1818 Archivado el 22 de mayo de 2011 en Wayback Machine
- Cálculo de presión de vapor, densidad de líquido, viscosidad dinámica de líquido, tensión superficial del éter dietílico, ddbonline.ddbst.de
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos




