Dióxido de silicio
Una muestra de dióxido de silicio | |
| Nombres | |
|---|---|
| Nombre IUPAC Dióxido de silicio | |
Otros nombres
| |
| Identificadores | |
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.028.678 |
| Número CE |
|
| Número E | E551 (reguladores de acidez, ...) |
| 200274 | |
| BARRIL | |
| Malla | Dióxido de silicio |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| Propiedades | |
| SiO2 | |
| Masa molar | 60,08 g/mol |
| Apariencia | Transparente o blanco |
| Densidad | 2,648 (cuarzo α), 2,196 (amorfo) g·cm −3 [1] |
| Punto de fusión | 1.713 °C (3.115 °F; 1.986 K) (amorfo) [1] : 4,88 |
| Punto de ebullición | 2.950 °C (5.340 °F; 3.220 K) [1] |
| −29,6·10 −6 cm3 / mol | |
| Conductividad térmica | 12 (|| eje c), 6,8 (⊥ eje c), 1,4 (am.) W/(m⋅K) [1] : 12,213 |
Índice de refracción ( n D ) | 1,544 ( o ), 1,553 (e) [1] : 4,143 |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 20 mppcf (80 mg/m 3 /%SiO 2 ) (amorfo) [2] |
REL (recomendado) | TWA 6 mg/m 3 (amorfo) [2] Ca TWA 0,05 mg/m 3 [3] |
IDLH (Peligro inmediato) | 3000 mg/m 3 (amorfo) [2] Ca [25 mg/m 3 (cristobalita, tridimita); 50 mg/m 3 (cuarzo)] [3] |
| Compuestos relacionados | |
Dionisos relacionados | Dióxido de carbono Dióxido de germanio Dióxido de estaño Dióxido de plomo |
Compuestos relacionados | Monóxido de silicio Disulfuro de silicio |
| Termoquímica | |
Entropía molar estándar ( S ⦵ 298 ) | 42 J·mol −1 ·K −1 [4] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −911 kJ·mol −1 [4] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El dióxido de silicio , también conocido como sílice , es un óxido de silicio con la fórmula química SiO 2 , que se encuentra comúnmente en la naturaleza como cuarzo . [5] [6] En muchas partes del mundo, la sílice es el componente principal de la arena . La sílice es una de las familias de materiales más complejas y abundantes , que existe como un compuesto de varios minerales y como un producto sintético. Los ejemplos incluyen cuarzo fundido , sílice pirogénica , ópalo y aerogeles . Se utiliza en materiales estructurales , microelectrónica y como componentes en las industrias alimentaria y farmacéutica. Todas las formas son blancas o incoloras, aunque las muestras impuras pueden ser coloreadas.
El dióxido de silicio es un componente fundamental común del vidrio .
Estructura
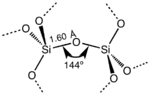


En la mayoría de los dióxidos de silicio, el átomo de silicio muestra una coordinación tetraédrica , con cuatro átomos de oxígeno rodeando a un átomo central de Si (ver Celda Unitaria 3-D). Por lo tanto, SiO2 forma sólidos de red tridimensionales en los que cada átomo de silicio está unido covalentemente de manera tetraédrica a 4 átomos de oxígeno. [8] [9] Por el contrario, CO2 es una molécula lineal. Las estructuras marcadamente diferentes de los dióxidos de carbono y silicio son una manifestación de la regla del doble enlace . [10]
En función de las diferencias estructurales de los cristales, el dióxido de silicio se puede dividir en dos categorías: cristalino y no cristalino (amorfo). En forma cristalina, esta sustancia se puede encontrar en la naturaleza como cuarzo , tridimita (forma de alta temperatura), cristobalita (forma de alta temperatura), stishovita (forma de alta presión) y coesita (forma de alta presión). Por otro lado, la sílice amorfa se puede encontrar en la naturaleza como ópalo y tierra de diatomeas . El vidrio de cuarzo es una forma de estado intermedio entre estas estructuras. [11]
Todas estas formas cristalinas distintas tienen siempre la misma estructura local alrededor del Si y el O. En el cuarzo α, la longitud del enlace Si-O es de 161 pm, mientras que en la α-tridimita está en el rango de 154-171 pm. El ángulo Si-O-Si también varía entre un valor bajo de 140° en la α-tridimita, hasta 180° en la β-tridimita. En el cuarzo α, el ángulo Si-O-Si es de 144°. [12]
Polimorfismo
El cuarzo alfa es la forma más estable de SiO 2 sólido a temperatura ambiente. Los minerales de alta temperatura, cristobalita y tridimita, tienen densidades e índices de refracción más bajos que el cuarzo. La transformación de α-cuarzo a beta-cuarzo tiene lugar abruptamente a 573 °C. Dado que la transformación está acompañada por un cambio significativo en el volumen, puede inducir fácilmente la fractura de cerámicas o rocas que pasan por este límite de temperatura. [13] Sin embargo , los minerales de alta presión, seifertita , stishovita y coesita, tienen densidades e índices de refracción más altos que el cuarzo. [14] La stishovita tiene una estructura similar al rutilo donde el silicio es de 6 coordenadas. La densidad de la stishovita es de 4,287 g/cm 3 , que se compara con el α-cuarzo, la más densa de las formas de baja presión, que tiene una densidad de 2,648 g/cm 3 . [15] La diferencia en densidad se puede atribuir al aumento en la coordinación, ya que las seis longitudes de enlace Si-O más cortas en la stishovita (cuatro longitudes de enlace Si-O de 176 pm y otras dos de 181 pm) son mayores que la longitud de enlace Si-O (161 pm) en el cuarzo α. [16] El cambio en la coordinación aumenta la ionicidad del enlace Si-O. [17]
La sílice faujasita , otro polimorfo, se obtiene mediante la desaluminización de una zeolita Y ultraestable con bajo contenido de sodio mediante un tratamiento combinado térmico y ácido. El producto resultante contiene más del 99 % de sílice y tiene una alta cristalinidad y área de superficie específica (más de 800 m 2 /g). La sílice faujasita tiene una estabilidad térmica y ácida muy alta. Por ejemplo, mantiene un alto grado de orden molecular de largo alcance o cristalinidad incluso después de hervir en ácido clorhídrico concentrado . [18]
SiO fundido2
La sílice fundida presenta varias características físicas peculiares que son similares a las observadas en el agua líquida : expansión térmica negativa, densidad máxima a temperaturas de ~5000 °C y una capacidad térmica mínima. [19] Su densidad disminuye de 2,08 g/cm 3 a 1950 °C a 2,03 g/cm 3 a 2200 °C. [20]
SiO molecular2
El SiO 2 molecular tiene una estructura lineal como el CO 2 . Se ha producido combinando monóxido de silicio (SiO) con oxígeno en una matriz de argón . El dióxido de silicio dimérico, (SiO 2 ) 2 se ha obtenido haciendo reaccionar O 2 con monóxido de silicio dimérico aislado de la matriz, (Si 2 O 2 ). En el dióxido de silicio dimérico hay dos átomos de oxígeno que forman un puente entre los átomos de silicio con un ángulo Si–O–Si de 94° y una longitud de enlace de 164,6 pm y la longitud de enlace Si–O terminal es de 150,2 pm. La longitud de enlace Si–O es de 148,3 pm, que se compara con la longitud de 161 pm en el cuarzo α. La energía de enlace se estima en 621,7 kJ/mol. [21]
Ocurrencia natural
Geología

El SiO 2 se encuentra más comúnmente en la naturaleza como cuarzo , que comprende más del 10% en masa de la corteza terrestre. [22] El cuarzo es el único polimorfo de sílice estable en la superficie de la Tierra. Se han encontrado ocurrencias metaestables de las formas de alta presión coesita y stishovita alrededor de estructuras de impacto y asociadas con eclogitas formadas durante el metamorfismo de ultra alta presión . Las formas de alta temperatura de tridimita y cristobalita se conocen de rocas volcánicas ricas en sílice . En muchas partes del mundo, la sílice es el principal componente de la arena . [23]
Biología
Aunque es poco soluble, el sílice se encuentra en muchas plantas, como el arroz . Los materiales vegetales con un alto contenido de fitolitos de sílice parecen ser importantes para los animales de pastoreo, desde los insectos masticadores hasta los ungulados . El sílice acelera el desgaste de los dientes, y los altos niveles de sílice en las plantas que los herbívoros comen con frecuencia pueden haberse desarrollado como un mecanismo de defensa contra la depredación. [24] [25]
La sílice también es el componente principal de la ceniza de cáscara de arroz , que se utiliza, por ejemplo, en la filtración y como material cementante complementario (SCM) en la fabricación de cemento y hormigón . [26]
La silicificación en y por las células ha sido común en el mundo biológico y ocurre en bacterias, protistas, plantas y animales (invertebrados y vertebrados). [27]
Algunos ejemplos destacados incluyen:
- Pruebas o frústulas (es decir, conchas) de diatomeas , radiolarios y amebas testadas . [6]
- Fitolitos de sílice en las células de muchas plantas [28], incluidas Equisetaceae , [29] muchas gramíneas y una amplia gama de dicotiledóneas . [30] [31]
- Las espículas que forman el esqueleto de muchas esponjas . [32]
Usos
Uso estructural
Aproximadamente el 95% del uso comercial del dióxido de silicio (arena) se produce en la industria de la construcción, por ejemplo para la producción de hormigón ( hormigón de cemento Portland ). [22]
Ciertos depósitos de arena de sílice, con tamaño y forma de partículas deseables y contenido deseable de arcilla y otros minerales, eran importantes para la fundición en arena de productos metálicos. [33] El alto punto de fusión de la sílice permite su uso en aplicaciones tales como la fundición de hierro; la fundición en arena moderna a veces utiliza otros minerales por otras razones.
La sílice cristalina se utiliza en la fracturación hidráulica de formaciones que contienen petróleo compacto y gas de esquisto . [34]
Precursor del vidrio y del silicio
La sílice es el ingrediente principal en la producción de la mayoría de los vidrios . A medida que se funden otros minerales con sílice, el principio de depresión del punto de congelación reduce el punto de fusión de la mezcla y aumenta la fluidez. La temperatura de transición vítrea del SiO2 puro es de aproximadamente 1475 K. [35] Cuando el dióxido de silicio fundido SiO2 se enfría rápidamente, no cristaliza, sino que se solidifica como vidrio. [36] Debido a esto, la mayoría de los esmaltes cerámicos tienen sílice como ingrediente principal. [37]
La geometría estructural del silicio y el oxígeno en el vidrio es similar a la del cuarzo y la mayoría de las demás formas cristalinas de silicio y oxígeno, con el silicio rodeado de tetraedros regulares de centros de oxígeno. La diferencia entre las formas vítreas y cristalinas surge de la conectividad de las unidades tetraédricas: aunque no hay una periodicidad de largo alcance en la red vítrea, el ordenamiento se mantiene en escalas de longitud mucho más allá de la longitud del enlace SiO. Un ejemplo de este ordenamiento es la preferencia por formar anillos de 6-tetraedros. [38]
La mayoría de las fibras ópticas para telecomunicaciones también están hechas de sílice. Se trata de una materia prima fundamental para muchos productos cerámicos, como la loza , el gres y la porcelana .
El dióxido de silicio se utiliza para producir silicio elemental . El proceso implica una reducción carbotérmica en un horno de arco eléctrico : [39]
Sílice pirogénica
La sílice pirogénica , también conocida como sílice pirogénica, se prepara quemando SiCl4 en una llama de hidrógeno rica en oxígeno para producir un "humo" de SiO2 . [ 15]
También se puede producir vaporizando arena de cuarzo en un arco eléctrico a 3000 °C. Ambos procesos dan como resultado gotitas microscópicas de sílice amorfa fusionadas en partículas secundarias tridimensionales ramificadas en forma de cadena que luego se aglomeran en partículas terciarias, un polvo blanco con una densidad aparente extremadamente baja (0,03-0,15 g/cm 3 ) y, por lo tanto, una gran área superficial. [40] Las partículas actúan como un agente espesante tixotrópico o como un agente antiaglomerante y se pueden tratar para hacerlas hidrófilas o hidrófobas para aplicaciones en agua o líquidos orgánicos.

El humo de sílice es un polvo ultrafino que se obtiene como subproducto de la producción de aleaciones de silicio y ferrosilicio . Está formado por partículas esféricas amorfas (no cristalinas) con un diámetro medio de partícula de 150 nm, sin la ramificación del producto pirogénico. Su principal uso es como material puzolánico para hormigón de alto rendimiento. Las nanopartículas de sílice pirogénica se pueden utilizar con éxito como agente antienvejecimiento en aglutinantes asfálticos. [41]
Aplicaciones alimentarias, cosméticas y farmacéuticas
La sílice, ya sea coloidal, precipitada o pirogénica, es un aditivo común en la producción de alimentos. Se utiliza principalmente como agente de flujo o antiaglomerante en alimentos en polvo, como especias y cremas para café no lácteas, o polvos para formar tabletas farmacéuticas. [40] Puede adsorber agua en aplicaciones higroscópicas . La sílice coloidal se utiliza como agente clarificante para vino, cerveza y jugo, con el número E de referencia E551 . [22]
En cosmética, la sílice es útil por sus propiedades de difusión de la luz [42] y su capacidad de absorción natural. [43]
La tierra de diatomeas , un producto extraído de minas, se ha utilizado en alimentos y cosméticos durante siglos. Consiste en las cáscaras de sílice de diatomeas microscópicas ; en una forma menos procesada se vendía como "polvo de dientes". [44] [45] La sílice hidratada fabricada o extraída se utiliza como abrasivo duro en la pasta de dientes .
Semiconductores
El dióxido de silicio se utiliza ampliamente en la tecnología de semiconductores:
- para la pasivación primaria (directamente sobre la superficie del semiconductor),
- Como dieléctrico de compuerta original en la tecnología MOS . Hoy en día, cuando el escalamiento (dimensión de la longitud de la compuerta del transistor MOS) ha progresado por debajo de los 10 nm, el dióxido de silicio ha sido reemplazado por otros materiales dieléctricos como el óxido de hafnio o similares con una constante dieléctrica más alta en comparación con el dióxido de silicio.
- como una capa dieléctrica entre capas de metal (cableado) (a veces hasta 8-10) que conectan elementos y
- como una segunda capa de pasivación (para proteger los elementos semiconductores y las capas de metalización) generalmente hoy en día se recubre con otros dieléctricos como el nitruro de silicio .
Debido a que el dióxido de silicio es un óxido nativo de silicio, se utiliza más ampliamente en comparación con otros semiconductores como el arseniuro de galio o el fosfuro de indio .
El dióxido de silicio podría cultivarse en una superficie semiconductora de silicio . [46] Las capas de óxido de silicio podrían proteger las superficies de silicio durante los procesos de difusión y podrían usarse para enmascarar la difusión. [47] [48]
La pasivación de la superficie es el proceso por el cual una superficie semiconductora se vuelve inerte y no cambia las propiedades semiconductoras como resultado de la interacción con el aire u otros materiales en contacto con la superficie o el borde del cristal. [49] [50] La formación de una capa de dióxido de silicio cultivada térmicamente reduce en gran medida la concentración de estados electrónicos en la superficie del silicio . [50] Las películas de SiO2 preservan las características eléctricas de las uniones p–n y evitan que estas características eléctricas se deterioren por el entorno ambiental gaseoso. [48] Las capas de óxido de silicio podrían usarse para estabilizar eléctricamente las superficies de silicio. [47] El proceso de pasivación de la superficie es un método importante de fabricación de dispositivos semiconductores que implica recubrir una oblea de silicio con una capa aislante de óxido de silicio para que la electricidad pueda penetrar de manera confiable hasta el silicio conductor que se encuentra debajo. El crecimiento de una capa de dióxido de silicio sobre una oblea de silicio le permite superar los estados de la superficie que de otra manera evitarían que la electricidad llegue a la capa semiconductora. [49] [51]
El proceso de pasivación de la superficie del silicio mediante oxidación térmica (dióxido de silicio) es fundamental para la industria de los semiconductores . Se utiliza habitualmente para fabricar transistores de efecto de campo de semiconductores de óxido metálico (MOSFET) y chips de circuitos integrados de silicio (con el proceso planar ). [49] [51]
Otro
La sílice hidrófoba se utiliza como componente antiespumante .
En su calidad de refractario , es útil en forma de fibra como tejido de protección térmica de alta temperatura . [52]
La sílice se utiliza en la extracción de ADN y ARN debido a su capacidad para unirse a los ácidos nucleicos en presencia de caótropos . [53]
El aerogel de sílice se utilizó en la nave espacial Stardust para recoger partículas extraterrestres. [54]
La sílice pura (dióxido de silicio), cuando se enfría como cuarzo fundido formando un vidrio sin punto de fusión real, se puede utilizar como fibra de vidrio para fibra de vidrio.
Producción
El dióxido de silicio se obtiene principalmente mediante la minería, incluida la extracción de arena y la purificación del cuarzo . El cuarzo es adecuado para muchos propósitos, mientras que se requiere un procesamiento químico para obtener un producto más puro o más adecuado (por ejemplo, más reactivo o de grano fino). [55] [56]
Sílice precipitada
La sílice precipitada o sílice amorfa se produce mediante la acidificación de soluciones de silicato de sodio . El precipitado gelatinoso o gel de sílice , primero se lava y luego se deshidrata para producir sílice microporosa incolora. [15] La ecuación idealizada que involucra un trisilicato y ácido sulfúrico es:
De esta manera se produjeron aproximadamente mil millones de kilogramos de sílice al año (1999), principalmente para su uso en compuestos de polímeros: neumáticos y suelas de zapatos. [22]
Sobre los microchips
Las películas delgadas de sílice crecen espontáneamente sobre obleas de silicio mediante oxidación térmica , produciendo una capa muy superficial de aproximadamente 1 nm o 10 Å del llamado óxido nativo. [57] Se utilizan temperaturas más altas y entornos alternativos para hacer crecer capas bien controladas de dióxido de silicio sobre silicio, por ejemplo a temperaturas entre 600 y 1200 °C, utilizando la llamada oxidación seca con O 2
o oxidación húmeda con H 2 O. [58] [59]
La capa de óxido nativo es beneficiosa en microelectrónica , donde actúa como aislante eléctrico con alta estabilidad química. Puede proteger el silicio, almacenar carga, bloquear la corriente e incluso actuar como una vía controlada para limitar el flujo de corriente. [60]
Métodos de laboratorio o especiales
A partir de compuestos organosilícicos
Muchas rutas para obtener dióxido de silicio comienzan con un compuesto de organosilicio, por ejemplo, HMDSO, [61] TEOS. La síntesis de sílice se ilustra a continuación utilizando tetraetilortosilicato (TEOS). [62] Simplemente calentando el TEOS a 680–730 °C se obtiene el óxido:
De manera similar, el TEOS arde alrededor de 400 °C:
El TEOS sufre hidrólisis mediante el llamado proceso sol-gel . El curso de la reacción y la naturaleza del producto se ven afectados por los catalizadores, pero la ecuación idealizada es: [63]
Otros métodos
El dióxido de silicio, al ser muy estable, se obtiene a partir de muchos métodos. La combustión del silano , que es conceptualmente sencilla pero de poco valor práctico, produce dióxido de silicio. Esta reacción es análoga a la combustión del metano:
Sin embargo, se ha utilizado la deposición química de vapor de dióxido de silicio sobre la superficie del cristal a partir de silano utilizando nitrógeno como gas portador a 200–500 °C. [64]
Reacciones químicas
El dióxido de silicio es un material relativamente inerte (de ahí su amplia presencia como mineral). El sílice se utiliza a menudo como recipiente inerte para reacciones químicas. A altas temperaturas, se convierte en silicio mediante reducción con carbono.
El flúor reacciona con el dióxido de silicio para formar SiF 4 y O 2 mientras que los otros gases halógenos (Cl 2 , Br 2 , I 2 ) no son reactivos. [15]
La mayoría de las formas de dióxido de silicio son atacadas ("grabadas") por ácido fluorhídrico (HF) para producir ácido hexafluorosilícico : [12]
- SiO2 + 6HF → H2SiF6 + 2H2O
La stishovita no reacciona al HF en ningún grado significativo. [65] El HF se utiliza para eliminar o modelar el dióxido de silicio en la industria de los semiconductores.
El dióxido de silicio actúa como un ácido Lux-Flood , pudiendo reaccionar con bases bajo ciertas condiciones. Como no contiene hidrógeno, la sílice no hidratada no puede actuar directamente como un ácido de Brønsted-Lowry . Mientras que el dióxido de silicio es poco soluble en agua a pH bajo o neutro (normalmente, 2 × 10 −4 M para el cuarzo hasta 10 −3 M para la calcedonia criptocristalina ), las bases fuertes reaccionan con el vidrio y lo disuelven fácilmente. Por lo tanto, las bases fuertes tienen que almacenarse en botellas de plástico para evitar atascar la tapa de la botella, preservar la integridad del recipiente y evitar la contaminación indeseable por aniones de silicato. [66]
El dióxido de silicio se disuelve en álcali concentrado caliente o hidróxido fundido, como se describe en esta ecuación idealizada: [15]
El dióxido de silicio neutralizará los óxidos metálicos básicos (por ejemplo , óxido de sodio , óxido de potasio , óxido de plomo (II) , óxido de zinc o mezclas de óxidos, formando silicatos y vidrios a medida que los enlaces Si-O-Si en la sílice se rompen sucesivamente). [12] Como ejemplo, la reacción de óxido de sodio y SiO 2 puede producir ortosilicato de sodio , silicato de sodio y vidrios, dependiendo de las proporciones de los reactivos: [15]
- .
Ejemplos de tales vidrios tienen importancia comercial, por ejemplo, el vidrio sódico-cálcico , el vidrio de borosilicato , el vidrio de plomo . En estos vidrios, la sílice se denomina formador de red o formador de retícula. [12] La reacción también se utiliza en altos hornos para eliminar las impurezas de arena en el mineral mediante neutralización con óxido de calcio , formando escoria de silicato de calcio .

El dióxido de silicio reacciona en reflujo caliente bajo dinitrógeno con etilenglicol y una base de metal alcalino para producir silicatos pentacoordinados altamente reactivos que brindan acceso a una amplia variedad de nuevos compuestos de silicio. [67] Los silicatos son esencialmente insolubles en todos los disolventes polares excepto el metanol .
El dióxido de silicio reacciona con el silicio elemental a altas temperaturas para producir SiO: [12]
Solubilidad en agua
La solubilidad del dióxido de silicio en agua depende en gran medida de su forma cristalina y es tres o cuatro veces mayor para la sílice amorfa que para el cuarzo; en función de la temperatura, alcanza un máximo alrededor de los 340 °C (644 °F). [68] Esta propiedad se utiliza para hacer crecer cristales individuales de cuarzo en un proceso hidrotermal en el que el cuarzo natural se disuelve en agua sobrecalentada en un recipiente a presión que está más frío en la parte superior. Se pueden cultivar cristales de 0,5 a 1 kg durante 1 a 2 meses. [12] Estos cristales son una fuente de cuarzo muy puro para su uso en aplicaciones electrónicas. [15] Por encima de la temperatura crítica del agua de 647,096 K (373,946 °C; 705,103 °F) y una presión de 22,064 megapascales (3200,1 psi) o superior, el agua es un fluido supercrítico y la solubilidad es una vez más mayor que a temperaturas más bajas. [69]
Efectos sobre la salud

La sílice ingerida por vía oral es esencialmente no tóxica, con una DL50 de 5000 mg/kg (5 g/kg). [22] Un estudio de 2008 que siguió a sujetos durante 15 años descubrió que niveles más altos de sílice en el agua parecían reducir el riesgo de demencia . Un aumento de 10 mg/día de sílice en el agua potable se asoció con una reducción del riesgo de demencia del 11%. [70]
La inhalación de polvo de sílice cristalino finamente dividido puede provocar silicosis , bronquitis o cáncer de pulmón , ya que el polvo se aloja en los pulmones e irrita continuamente el tejido, reduciendo las capacidades pulmonares. [71] Cuando se inhalan partículas finas de sílice en cantidades suficientemente grandes (como a través de la exposición ocupacional), aumenta el riesgo de enfermedades autoinmunes sistémicas como el lupus [72] y la artritis reumatoide en comparación con las tasas esperadas en la población general. [73]
Riesgo laboral
La sílice es un riesgo laboral para las personas que realizan trabajos de pulido con chorro de arena o trabajan con productos de sílice cristalina en polvo. La sílice amorfa, como la sílice pirogénica, puede causar daño pulmonar irreversible en algunos casos, pero no está asociada con el desarrollo de silicosis. Los niños, los asmáticos de cualquier edad, las personas con alergias y los ancianos (todos ellos con capacidad pulmonar reducida ) pueden verse afectados en menos tiempo. [74]
La sílice cristalina es un riesgo laboral para quienes trabajan con encimeras de piedra porque el proceso de corte e instalación de las encimeras crea grandes cantidades de sílice en el aire. [75] La sílice cristalina utilizada en la fracturación hidráulica presenta un riesgo para la salud de los trabajadores. [34]
Fisiopatología
En el cuerpo, las partículas de sílice cristalina no se disuelven durante períodos clínicamente relevantes. Los cristales de sílice dentro de los pulmones pueden activar el inflamasoma NLRP3 dentro de los macrófagos y las células dendríticas y, por lo tanto, dar lugar a la producción de interleucina , una citocina altamente proinflamatoria en el sistema inmunológico. [76] [77] [78]
Regulación
Las reglamentaciones que restringen la exposición a la sílice "con respecto al riesgo de silicosis" especifican que se refieren únicamente a la sílice, que es cristalina y forma polvo. [79] [80] [81] [82] [83] [84]
En 2013, la Administración de Seguridad y Salud Ocupacional de Estados Unidos redujo el límite de exposición a 50 μg /m 3 de aire. Antes de 2013, permitía 100 μg/m 3 y, en el caso de los trabajadores de la construcción, incluso 250 μg/m 3 . [34] En 2013, la OSHA también exigió la "terminación ecológica" de los pozos fracturados para reducir la exposición a la sílice cristalina y restringir el límite de exposición. [34]
Formas cristalinas
El SiO 2 , más que casi cualquier otro material, existe en muchas formas cristalinas, que se denominan polimorfos .
| Forma | Simetría cristalina Símbolo de Pearson , grupo no. | ρ (g/ cm3 ) | Notas | Estructura |
|---|---|---|---|---|
| cuarzo α | romboédrico (trigonal) hP9, P3 1 21 No.152 [85] | 2.648 | Cadenas helicoidales que hacen que los cristales individuales sean ópticamente activos; el cuarzo α se convierte en cuarzo β a 846 K |  |
| β-cuarzo | hexagonal hP18, P6 2 22, n.º 180 [86] | 2.533 | Estrechamente relacionado con el cuarzo α (con un ángulo Si-O-Si de 155°) y ópticamente activo; el cuarzo β se convierte en β-tridimita a 1140 K |  |
| α-tridimita | ortorrómbico oS24, C222 1 , No.20 [87] | 2.265 | Forma metaestable bajo presión normal |  |
| β-tridimita | hexagonal hP12, P6 3 /mmc, n.º 194 [87] | Estrechamente relacionado con la α-tridimita; la β-tridimita se convierte en β-cristobalita a 2010 K |  | |
| α-cristobalita | tetragonal tP12, P4 1 2 1 2, No. 92 [88] | 2.334 | Forma metaestable bajo presión normal |  |
| β-cristobalita | cúbico cF104, Fd 3 m, No.227 [89] | Estrechamente relacionado con la α-cristobalita; se funde a 1978 K |  | |
| keatita | tetragonal tP36, P4 1 2 1 2, No. 92 [90] | 3.011 | Anillos Si 5 O 10 , Si 4 O 8 , Si 8 O 16 ; sintetizados a partir de sílice vítrea y álcali a 600–900 K y 40–400 MPa | 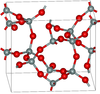 |
| moganita | monoclínico mS46, C2/c, n.º 15 [91] | Anillos Si 4 O 8 y Si 6 O 12 | 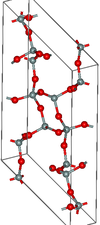 | |
| coesita | monoclínico mS48, C2/c, n.º 15 [92] | 2.911 | Anillos Si 4 O 8 y Si 8 O 16 ; 900 K y 3–3,5 GPa | 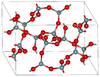 |
| stishovita | tetragonal tP6, P4 2 /mnm, No.136 [93] | 4.287 | Uno de los polimorfos más densos (junto con la seifertita) de sílice; similar al rutilo con Si coordinado 6 veces; 7,5–8,5 GPa |  |
| seifertita | OP ortorrómbico , Pbcn [94] | 4.294 | Uno de los polimorfos más densos (junto con la stishovita) de sílice; se produce a presiones superiores a 40 GPa. [95] | 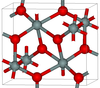 |
| melanoflogita | cúbico (cP*, P4 2 32, No.208) [7] o tetragonal (P4 2 /nbc) [96] | 2.04 | Anillos Si 5 O 10 , Si 6 O 12 ; mineral que siempre se encuentra con hidrocarburos en espacios intersticiales - un clatrasil ( clatrato de sílice ) [97] |  |
| sílice fibrosa W [15] | ortorrómbico oI12, Ibam, No.72 [98] | 1,97 | Al igual que el SiS 2 , que consta de cadenas que comparten aristas, se funde a ~1700 K. |  |
| Sílice 2D [99] | hexagonal | Estructura bicapa en forma de lámina |  |
Seguridad
La inhalación de sílice cristalina finamente dividida puede provocar una inflamación grave del tejido pulmonar , silicosis , bronquitis , cáncer de pulmón y enfermedades autoinmunes sistémicas , como el lupus y la artritis reumatoide . La inhalación de dióxido de silicio amorfo , en dosis altas, provoca una inflamación no permanente a corto plazo, en la que todos los efectos se curan. [100]
Otros nombres
Esta lista ampliada enumera sinónimos de dióxido de silicio; todos estos valores provienen de una única fuente; los valores en la fuente se presentan en mayúscula. [101]
- CAS 112945-52-5
- Acitel
- Aerosil
- Polvo de sílice amorfo
- Aguafil
- CABINA-O-GRIP II
- CAB-O-SIL
- CAB-O-SPERSE
- Catalogar
- Sílice coloidal [102]
- Dióxido de silicio coloidal
- Dicalita
- Insecticida DRI-DIE 67
- FLO-GARD
- Harina fósil
- Sílice pirogénica
- Dióxido de silicio ahumado
- HI-SEL
- AMOR-VELO
- Ludox
- Nalcoag
- Nyacol
- Santocel
- Sílice
- Aerogel de sílice
- Sílice amorfa
- Anhídrido silícico
- Silicio
- Sílice amorfa sintética
- Vulkasil
Véase también
Referencias
- ^ abcde Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . ISBN 1-4398-5511-0.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0552". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Guía de bolsillo del NIOSH sobre peligros químicos. "#0682". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ de Zumdahl, Steven S. (2009). Principios químicos, sexta edición . Houghton Mifflin Company. pág. A22. ISBN 978-0-618-94690-7.
- ^ Iler RK (1979). La química de la sílice . Nueva York: Wiley. ISBN 9780471024040.
- ^ ab Fernández LD, Lara E, Mitchell EA (2015). "Checklist, diversity and distribution of testate amoebae in Chile" (PDF) . Revista Europea de Protistología . 51 (5): 409–24. doi :10.1016/j.ejop.2015.07.001. PMID 26340665. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ ab Skinner BJ, Appleman DE (1963). "Melanophlogite, a cubic polymorph of silica" (PDF) . Am. Mineral. 48 : 854–867. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ Douglas BE, Ho SM, eds. (2006), "Estructuras cristalinas de sílice y silicatos metálicos", Structure and Chemistry of Crystalline Solids , Nueva York, NY: Springer, págs. 233-278, doi :10.1007/0-387-36687-3_10, ISBN 978-0-387-36687-6, consultado el 8 de octubre de 2023
- ^ Nekrashevich SS, Gritsenko VA (1 de febrero de 2014). "Estructura electrónica del dióxido de silicio (una revisión)". Física del estado sólido . 56 (2): 207–222. Bibcode :2014PhSS...56..207N. doi :10.1134/S106378341402022X. ISSN 1090-6460. S2CID 255234311.
- ^ NC Norman (1997). Periodicidad y elementos de los bloques s y p . Oxford University Press. págs. 50-52, 65-67. ISBN 978-0-19-855961-0.
- ^ Unger KK, ed. (1979), Capítulo 1 Química general de la sílice, Journal of Chromatography Library, vol. 16, Elsevier, págs. 1–14, doi :10.1016/s0301-4770(08)60805-2, ISBN 978-0-444-41683-4, consultado el 12 de septiembre de 2023
- ^ abcdefg Holleman AF, Wiberg E (2001), Wiberg N (ed.), Química inorgánica , traducido por Eagleson M, Brewer W, San Diego/Berlín: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Cuff YH (1996). Tecnología cerámica para alfareros y escultores. Filadelfia: Universidad de Pensilvania. pp. 93–95. ISBN 9780812213775.
- ^ De La Rocha C, Conley DJ (2017). "Cristales místicos de sílice". Silica Stories . Cham: Springer. págs. 50-55. doi :10.1007/978-3-319-54054-2_4. ISBN 9783319540542.
- ^ abcdefgh Greenwood NN , Earnshaw A (1984). Química de los elementos. Oxford: Pergamon Press . Págs. 393-99. ISBN. 978-0-08-022057-4.
- ^ Wells AF (1984). Química inorgánica estructural . Oxford Science Publications. ISBN 9780198553700.
- ^ Kirfel A, Krane HG, Blaha P, et al. (2001). "Distribución de la densidad electrónica en stishovita, SiO2: un nuevo estudio de radiación sincrotrón de alta energía". Acta Crystallographica Sección A . 57 (6): 663–77. Bibcode :2001AcCrA..57..663K. doi : 10.1107/S0108767301010698 . PMID 11679696.
- ^ Scherzer J (1978). "Estructuras de tipo faujasita desaluminizadas con relaciones SiO 2 /Al 2 O 3 superiores a 100". J. Catal. 54 (2): 285. doi :10.1016/0021-9517(78)90051-9.
- ^ Shell SM, Debenedetti PG, Panagiotopoulos AZ (2002). "Orden estructural molecular y anomalías en sílice líquida" (PDF) . Phys. Rev. E . 66 (1): 011202. arXiv : cond-mat/0203383 . Bibcode :2002PhRvE..66a1202S. doi :10.1103/PhysRevE.66.011202. PMID 12241346. S2CID 6109212. Archivado desde el original (PDF) el 2016-06-04 . Consultado el 2009-07-07 .
- ^ Aksay IA, Pask JA, Davis RF (1979). "Densidades de fundidos de SiO2-Al2O3" (PDF) . J. Am. Ceram. Soc. 62 (7–8): 332–336. doi :10.1111/j.1151-2916.1979.tb19071.x. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ Jutzi P, Schubert U (2003). Química del silicio: del átomo a los sistemas extendidos . Wiley-VCH. ISBN 9783527306473.
- ^ abcde Flörke OW, Graetsch HA, Brunk F, et al. (2018). "Sílice". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a23_583.pub3. ISBN 978-3527306732.
- ^ Berslien E (2012). Introducción a la geociencia forense . Wiley & Sons. pág. 138. ISBN 9781405160544.
- ^ Massey FP, Ennos AR, Hartley SE (2006). "Sílice en pastos como defensa contra insectos herbívoros: efectos contrastantes en folívoros y un alimentador de floema". J. Anim. Ecol. 75 (2): 595–603. Bibcode :2006JAnEc..75..595M. doi : 10.1111/j.1365-2656.2006.01082.x . PMID 16638012.
- ^ Keeping MG, Kvedaras OL (2008). "El silicio como defensa de las plantas contra la herbivoría de los insectos: respuesta a Massey, Ennos y Hartley". J. Anim. Ecol. 77 (3): 631–3. Bibcode :2008JAnEc..77..631K. doi : 10.1111/j.1365-2656.2008.01380.x . PMID 18341561.
- ^ Zain MF, Islam MN, Mahmud F, Jamil M (2011). "Producción de ceniza de cáscara de arroz para su uso en hormigón como material cementante complementario". Materiales de construcción y edificación . Materiales compuestos y tecnología de unión adhesiva. 25 (2): 798–805. doi :10.1016/j.conbuildmat.2010.07.003. ISSN 0950-0618.
- ^ Perry CC (2003). "Silicificación: los procesos por los cuales los organismos capturan y mineralizan sílice". Reseñas en mineralogía y geoquímica . 1 (54): 291–327. Bibcode :2003RvMG...54..291P. doi :10.2113/0540291.
- ^ Radini A (2024). "Arqueobotánica: microfósiles vegetales". En Nikita E, Rehren T (eds.). Enciclopedia de arqueología (segunda edición). Oxford: Academic Press. págs. 698–707. doi :10.1016/b978-0-323-90799-6.00114-2. ISBN 978-0-323-91856-5. Recuperado el 20 de junio de 2024 .
- ^ Neumann M, Wagner S, Noske R, Tiersch B, Strauch P (2010). "Morfología y estructura de sílice biomorfa aislada de Equisetum hyemale y Equisetum telmateia". Zeitschrift für Naturforschung B . 65 (9): 1113-1120. doi : 10.1515/znb-2010-0910 . ISSN 1865-7117.
- ^ Tubaña BS, Heckman JR (2015), Rodrigues FA, Datnoff LE (eds.), "Silicio en suelos y plantas", Silicio y enfermedades de las plantas , Cham: Springer International Publishing, págs. 7–51, doi :10.1007/978-3-319-22930-0_2, ISBN 978-3-319-22929-4, consultado el 19 de julio de 2024
- ^ Irzaman I, Yustaeni D, Aminullah A, Irmansyah I, Yuliarto B (19 de abril de 2021). "Pureza, caracterización morfológica y eléctrica del dióxido de silicio de la hierba cogon (Imperata cylindrica) utilizando diferentes temperaturas de incineración". Revista egipcia de química . 64 (8): 4143–4149. doi :10.21608/ejchem.2019.15430.1962. ISSN 2357-0245.
- ^ Uriz MJ, Turon X, Becerro MA, Agell G (2003). "Espículas silíceas y estructuras esqueléticas en esponjas: origen, diversidad, patrones ultraestructurales y funciones biológicas". Microscopy Research and Technique . 62 (4): 279–299. doi :10.1002/jemt.10395. ISSN 1059-910X. PMID 14534903.
- ^ Nevin CM (1925). Arenas de moldeo de Albany del valle del Hudson . Universidad del Estado de Nueva York en Albany.
- ^ abcd Greenhouse S (23 de agosto de 2013). "Nuevas reglas reducirían la exposición al polvo de sílice". The New York Times . Consultado el 24 de agosto de 2013 .
- ^ Ojovan MI (2004). "Formación de vidrio en SiO 2 amorfo como una transición de fase de percolación en un sistema de defectos de red". JETP Lett. 79 (12): 632–634. Bibcode :2004JETPL..79..632O. doi :10.1134/1.1790021. S2CID 124299526.
- ^ Stachurski ZH (2015). Fundamentos de los sólidos amorfos: estructura y propiedades. John Wiley & Sons. pág. 176. ISBN 978-3-527-68219-5.
- ^ Química Inorgánica Avanzada: Volumen II. Medios de Krishna Prakashan. pag. 563.
- ^ Elliott SR (1991). "Orden estructural de rango medio en sólidos amorfos covalentes". Nature . 354 (6353): 445–452. Código Bibliográfico :1991Natur.354..445E. doi :10.1038/354445a0. S2CID 4344891.
- ^ Atkins PW, Overton T, Rourke J, et al., eds. (2010). Química inorgánica de Shriver y Atkins (5.ª ed.). Oxford: Oxford University Press. pág. 354. ISBN 9780199236176.OCLC 430678988 .
- ^ ab "Óxidos metálicos ahumados Cab-O-Sil".
- ^ Cheraghian G, Wistuba MP, Kiani S, Barron AR, Behnood A (diciembre de 2021). "Propiedades reológicas, fisicoquímicas y microestructurales del ligante asfáltico modificado con nanopartículas de sílice pirogénica". Scientific Reports . 11 (1): 11455. Bibcode :2021NatSR..1111455C. doi :10.1038/s41598-021-90620-w. PMC 8169902 . PMID 34075083.
- ^ Barel AO, Paye M, Maibach HI (2014). Manual de ciencia y tecnología cosmética (4.ª edición). CRC Press. pág. 444. ISBN 9781842145654Estos pigmentos de enfoque suave, compuestos principalmente de polímeros
, micas y talcos recubiertos de partículas rugosas o esféricas de diámetros pequeños, como sílice o dióxido de titanio, se utilizan para reducir ópticamente la apariencia de las arrugas. Estos efectos se obtienen optimizando los contornos de las arrugas y reduciendo la diferencia de brillo debido a la reflexión difusa.
- ^ Barel AO, Paye M, Maibach HI (2014). Manual de ciencia y tecnología cosmética (4.ª edición). CRC Press. pág. 442. ISBN 9781842145654La sílice
es un ingrediente multiporoso, que absorbe el aceite y el sebo.
- ^ Gardner JS (1882). "Sobre las causas de elevación y subsidencia". Revista Geológica . 9 (10): 479–480. Código Bibliográfico :1882GeoM....9..479G. doi :10.1017/S0016756800172474. ISSN 0016-7568.
- ^ Mann A (1917). La importancia económica de las diatomeas . Washington DC, Estados Unidos de América: Smithsonian.
- ^ Bassett RK (2007). Hacia la era digital: laboratorios de investigación, empresas emergentes y el auge de la tecnología MOS. Johns Hopkins University Press . págs. 22-23. ISBN 9780801886393.
- ^ de Lécuyer C, Brock DC (2010). Los creadores del microchip: una historia documental de Fairchild Semiconductor. MIT Press . pág. 111. ISBN 9780262294324.
- ^ ab Saxena A (2009). Invención de circuitos integrados: hechos importantes no contados. Serie internacional sobre avances en electrónica y tecnología de estado sólido. World Scientific . págs. 96–97. ISBN 9789812814456.
- ^ abc "Martin Atalla en el Salón de la Fama de los Inventores, 2009" . Consultado el 21 de junio de 2013 .
- ^ ab Black LE (2016). Nuevas perspectivas sobre la pasivación de superficies: comprensión de la interfaz Si-Al2O3. Springer . p. 17. ISBN 9783319325217.
- ^ ab "Dawon Kahng". Salón Nacional de la Fama de los Inventores . Consultado el 27 de junio de 2019 .
- ^ Liu G, Liu Y, Zhao X (2017). "La influencia del contenido de nano-SiO 2 esférico en el rendimiento de protección térmica de telas revestidas resistentes a la ablación de aislamiento térmico". Journal of Nanomaterials . 2017 : 1–11. doi : 10.1155/2017/2176795 . ISSN 1687-4110.
- ^ Goodwin W, Linacre A, Hadi S (2007). Introducción a la genética forense . Wiley & Sons. pág. 29. ISBN 9780470010259.
- ^ Calderone J (20 de agosto de 2015). "Este material futurista, parecido a una nube, se ha estado infiltrando en tu vida desde 1931". Business Insider . Consultado el 11 de febrero de 2019 .
- ^ Götze J, Möckel R, eds. (2012). Cuarzo: Yacimientos, Mineralogía y Analítica. Geología Springer. Berlín, Heidelberg: Springer Berlín Heidelberg. Código Bib : 2012qdma.book.....G. doi :10.1007/978-3-642-22161-3. ISBN 978-3-642-22160-6.
- ^ Pan X, Li S, Li Y, Guo P, Zhao X, Cai Y (2022). "Recurso, característica, purificación y aplicación del cuarzo: una revisión". Ingeniería de minerales . 183 : 107600. Código Bibliográfico :2022MiEng.18307600P. doi :10.1016/j.mineng.2022.107600.
- ^ Doering R, Nishi Y, eds. (2007). Manual de tecnología de fabricación de semiconductores. CRC Press. ISBN 9781574446753.
- ^ Lee S (2006). Enciclopedia de procesamiento químico . CRC Press. ISBN 9780824755638.
- ^ Morgan DV, Board K (1991). Introducción a la microtecnología de semiconductores (2.ª ed.). Chichester, West Sussex, Inglaterra: John Wiley & Sons. pág. 72. ISBN 9780471924784.
- ^ Riordan M (2007). "La solución del dióxido de silicio: cómo el físico Jean Hoerni construyó el puente entre el transistor y el circuito integrado". IEEE Spectrum . Consultado el 11 de febrero de 2019 .
- ^ Chrystie RS, Ebertz FL, Dreier T, Schulz C (28 de enero de 2019). "Obtención de imágenes de concentración absoluta de SiO en llamas de síntesis de nanopartículas a baja presión mediante fluorescencia inducida por láser". Applied Physics B . 125 (2): 29. Bibcode :2019ApPhB.125...29C. doi :10.1007/s00340-019-7137-8. ISSN 1432-0649. S2CID 127735545.
- ^ Romero-Jaime AK, Acosta-Enríquez MC, Vargas-Hernández D, Tánori-Córdova JC, Pineda León HA, Castillo SJ (agosto de 2021). "Síntesis y caracterización de nanoesferas de núcleo-cubierta de sulfuro de plomo y sílice para aplicaciones en dispositivos optoelectrónicos". Revista de ciencia de materiales: materiales en electrónica . 32 (16): 21425–21431. doi :10.1007/s10854-021-06648-1. ISSN 0957-4522. S2CID 236182027.
- ^ Nandiyanto AB, Kim SG, Iskandar F, et al. (2009). "Síntesis de nanopartículas de sílice mesoporosas esféricas con poros y diámetros externos controlables de tamaño nanométrico". Materiales microporosos y mesoporosos . 120 (3): 447–453. Código Bibliográfico :2009MicMM.120..447N. doi :10.1016/j.micromeso.2008.12.019.
- ^ Morgan DV, Board K (1991). Introducción a la microtecnología de semiconductores (2.ª ed.). Chichester, West Sussex, Inglaterra: John Wiley & Sons. pág. 27. ISBN 9780471924784.
- ^ Fleischer M (1962). "Nuevos nombres minerales" (PDF) . Mineralogista estadounidense . 47 (2). Mineralogical Society of America: 172–174. Archivado (PDF) desde el original el 22 de julio de 2011.
- ^ Rodgers GE (2011). Química descriptiva inorgánica, de coordinación y del estado sólido. Cengage Learning. pp. 421–2. ISBN 9781133172482.
- ^ Laine RM, Blohowiak KY, Robinson TR, Hoppe ML, Nardi P, Kampf J, Uhm J (17 de octubre de 1991). "Síntesis de complejos de silicio pentacoordinados a partir de SiO2" (PDF) . Nature . 353 (6345): 642–644. Bibcode :1991Natur.353..642L. doi :10.1038/353642a0. hdl : 2027.42/62810 . S2CID 4310228. Archivado (PDF) desde el original el 19 de agosto de 2017.
- ^ Fournier RO, Rowe JJ (1977). "La solubilidad de la sílice amorfa en agua a altas temperaturas y altas presiones" (PDF) . Am. Mineral. 62 : 1052–1056. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ Okamoto A (2019). "Formación de partículas de sílice a partir de fluidos supercríticos y sus impactos en las propiedades hidrológicas de la corteza". Resúmenes de la Conferencia de la Asamblea General de la EGU : 4614. Código Bibliográfico :2019EGUGA..21.4614O.
- ^ Rondeau V, Jacqmin-Gadda H, Commenges D, et al. (2008). "Aluminio y sílice en el agua potable y el riesgo de enfermedad de Alzheimer o deterioro cognitivo: hallazgos de un seguimiento de 15 años de la cohorte PAQUID". American Journal of Epidemiology . 169 (4): 489–96. doi :10.1093/aje/kwn348. PMC 2809081 . PMID 19064650.
- ^ "Trabaje de forma segura con sílice". CPWR - Centro de investigación y capacitación en construcción . Consultado el 11 de febrero de 2019 .
- ^ "Plan de acción para la investigación del lupus". Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel . Institutos Nacionales de Salud . 2017. Consultado el 11 de febrero de 2019 .
- ^ Meyer A, Sandler DP, Beane Freeman LE, et al. (2017). "Exposición a pesticidas y riesgo de artritis reumatoide entre aplicadores de pesticidas masculinos autorizados en el estudio de salud agrícola". Environmental Health Perspectives . 125 (7): 077010-1–077010-7. doi : 10.1289/EHP1013 . PMC 5744649 . PMID 28718769.
- ^ Reuzel PG, Bruijntjes JP, Feron VJ, et al. (1991). "Toxicidad subcrónica por inhalación de sílice amorfa y polvo de cuarzo en ratas". Food Chem. Toxicol. 29 (5): 341–54. doi :10.1016/0278-6915(91)90205-L. PMID 1648030.
- ^ "Exposición de los trabajadores a la sílice durante la fabricación, el acabado y la instalación de encimeras" (PDF) . Instituto Nacional de Seguridad y Salud Ocupacional y Administración de Seguridad y Salud Ocupacional . 2015. Archivado (PDF) desde el original el 2022-10-10 . Consultado el 26 de febrero de 2015 .
- ^ Hornung V, Bauernfeind F, Halle A, et al. (2008). "Los cristales de sílice y las sales de aluminio activan el inflamasoma NALP3 a través de la desestabilización fagosomal". Nat. Inmunol. 9 (8): 847–856. doi :10.1038/ni.1631. PMC 2834784 . PMID 18604214.
- ^ Merchant JA, ed. (1986). Enfermedades respiratorias ocupacionales (PDF) . Cincinnati, OH: Departamento de Salud y Servicios Humanos de los EE. UU., NIOSH. doi :10.26616/NIOSHPUB86102. hdl :2027/uc1.31210023588922. Número de publicación 86-102 del DHHS (NIOSH).
- ^ NIOSH (2002) Hazard Review, Health Effects of Occupational Exposure to Respirable Crystalline Silica. Cincinnati, OH: Departamento de Salud y Servicios Humanos de los EE. UU., Servicio de Salud Pública de los EE. UU., Centros para el Control y la Prevención de Enfermedades, Instituto Nacional de Seguridad y Salud Ocupacional, DHHS (NIOSH) Publicación N.º 2002-129.
- ^ "Ficha técnica sobre cristales" (PDF) . Archivado desde el original (PDF) el 22 de diciembre de 2017 . Consultado el 3 de agosto de 2017 .
- ^ "Sílice cristalina" . Consultado el 3 de agosto de 2017 .
- ^ "Preguntas frecuentes" . Consultado el 3 de agosto de 2017 .
- ^ "¡Si es sílice, no es sólo polvo!" (PDF) . Archivado (PDF) del original el 10 de octubre de 2022 . Consultado el 3 de agosto de 2017 .
- ^ "Lo que debe saber sobre la sílice cristalina, la silicosis y las normas de OSHA sobre sílice de Oregón" (PDF) . Archivado (PDF) del original el 2022-10-10 . Consultado el 3 de agosto de 2017 .
- ^ Szymendera SD (16 de enero de 2018). Sílice cristalina respirable en el lugar de trabajo: nuevas normas de la Administración de Seguridad y Salud Ocupacional (OSHA) (PDF) . Washington, DC: Servicio de Investigación del Congreso. Archivado (PDF) del original el 10 de octubre de 2022 . Consultado el 27 de enero de 2018 .
- ^ Lager GA, Jorgensen JD, Rotella FJ (1982). "Estructura cristalina y expansión térmica del cuarzo alfa SiO2 a baja temperatura". Journal of Applied Physics . 53 (10): 6751–6756. Bibcode :1982JAP....53.6751L. doi :10.1063/1.330062.
- ^ Wright AF, Lehmann MS (1981). "La estructura del cuarzo a 25 y 590 °C determinada por difracción de neutrones". Journal of Solid State Chemistry . 36 (3): 371–80. Bibcode :1981JSSCh..36..371W. doi :10.1016/0022-4596(81)90449-7.
- ^ ab Kihara K, Matsumoto T, Imamura M (1986). "Cambio estructural de itridimita ortorrómbica con temperatura: un estudio basado en parámetros térmico-vibracionales de segundo orden". Zeitschrift für Kristallographie . 177 (1–2): 27–38. Código Bib : 1986ZK....177...27K. doi :10.1524/zkri.1986.177.1-2.27.
- ^ Downs RT, Palmer DC (1994). "El comportamiento de presión de una cristobalita" (PDF) . American Mineralologist . 79 : 9–14. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ Wright AF, Leadbetter AJ (1975). "Las estructuras de las fases de β-cristobalita de SiO 2 y AlPO 4 ". Revista filosófica . 31 (6): 1391–401. Código Bibliográfico :1975PMag...31.1391W. doi :10.1080/00318087508228690.
- ^ Shropshire J, Keat PP, Vaughan PA (1959). "La estructura cristalina de la keatita, una nueva forma de sílice". Zeitschrift für Kristallographie . 112 (1–6): 409–13. Código bibliográfico : 1959ZK....112..409S. doi :10.1524/zkri.1959.112.1-6.409.
- ^ Miehe G, Graetsch H (1992). "Estructura cristalina de la moganita: un nuevo tipo de estructura para la sílice". Revista Europea de Mineralogía . 4 (4): 693–706. Código Bibliográfico :1992EJMin...4..693M. doi :10.1127/ejm/4/4/0693.
- ^ Levien L., Prewitt CT (1981). "Estructura cristalina de alta presión y compresibilidad de la coesita" (PDF) . American Mineralogist . 66 : 324–333. Archivado (PDF) desde el original el 10 de octubre de 2022.
- ^ Smyth JR, Swope RJ, Pawley AR (1995). "H en compuestos de tipo rutilo: II. Química cristalina de la sustitución de Al en stishovita portadora de H" (PDF) . American Mineralogist . 80 (5–6): 454–456. Código Bibliográfico :1995AmMin..80..454S. doi :10.2138/am-1995-5-605. S2CID 196903109. Archivado (PDF) desde el original el 2022-10-10.
- ^ Dera P., Prewitt CT, Boctor NZ, Hemley RJ (2002). "Caracterización de una fase de alta presión de sílice del meteorito marciano Shergotty". Mineralogista estadounidense . 87 (7): 1018. Código Bibliográfico :2002AmMin..87.1018D. doi :10.2138/am-2002-0728. S2CID 129400258.
- ^ Seifertita. Mindat.org.
- ^ Nakagawa T., Kihara K., Harada K. (2001). "La estructura cristalina de la melanoflogita de bajo peso molecular". Mineralogista estadounidense . 86 (11–12): 1506. Código Bibliográfico :2001AmMin..86.1506N. doi :10.2138/am-2001-11-1219. S2CID 53525827.
- ^ Rosemarie Szostak (1998). Tamices moleculares: principios de síntesis e identificación. Springer. ISBN 978-0-7514-0480-7.
- ^ Weiss A, Weiss A (1954). "Über Siliciumchalkogenide. VI. Zur Kenntnis der faserigen Siliciumdioxyd-Modifikation". Zeitschrift für Anorganische und Allgemeine Chemie . 276 (1–2): 95–112. doi :10.1002/zaac.19542760110.
- ^ Björkman T, Kurasch S, Lehtinen O, Kotakoski J, Yazyev OV, Srivastava A, Skakalova V, Smet JH, Kaiser U, Krasheninnikov AV (2013). "Defectos en sílice bicapa y grafeno: tendencias comunes en diversos sistemas hexagonales bidimensionales". Scientific Reports . 3 : 3482. Bibcode :2013NatSR...3E3482B. doi :10.1038/srep03482. PMC 3863822 . PMID 24336488.
- ^ Johnston CJ, Driscoll KE, Finkelstein JN, et al. (2000). "Respuestas mutagénicas y quimiocinas pulmonares en ratas tras la inhalación subcrónica de sílice amorfa y cristalina". Toxicological Sciences . 56 (2): 405–413. doi : 10.1093/toxsci/56.2.405 . PMID 10911000.
- ^ Lewis GR (1999). 1001 sustancias químicas presentes en productos de uso cotidiano (2.ª ed.). John Wiley & Sons (Wiley-Interscience). pp. 250-1. ISBN 0-471-29212-5– vía Internet Archive.
- ^ Bergna HE, ed. (5 de mayo de 1994). La química coloidal de la sílice. Avances en química. Vol. 234. Washington DC: American Chemical Society. págs. 1–47. doi :10.1021/ba-1994-0234.ch001. ISBN . 978-0-8412-2103-1.
Enlaces externos
- Chisholm H , ed. (1911). . Encyclopædia Britannica (11.ª ed.). Cambridge University Press.
- Tridimita, Ficha internacional de seguridad química 0807
- Cuarzo, Ficha internacional de seguridad química 0808
- Cristobalita, Ficha de seguridad química internacional 0809
- Amorfo, Guía de bolsillo de NIOSH sobre peligros químicos
- Cristalino, como polvo respirable, Guía de bolsillo de NIOSH sobre peligros químicos
- Formación de capas de óxido de silicio en la industria de semiconductores. Comparación entre el método LPCVD y el método PECVD. Prevención de tensiones.
- Propiedades piezoeléctricas del cuarzo (SiO2)
- Sílice (SiO2) y agua
- Evidencia epidemiológica sobre la carcinogenicidad de la sílice: factores que influyen en el juicio científico por C. Soutar y otros. Informe de investigación del Instituto de Medicina del Trabajo TM/97/09
- Opinión científica sobre los efectos de la sílice en suspensión en el aire sobre la salud, por A. Pilkington y otros. Informe de investigación del Instituto de Medicina del Trabajo TM/95/08
- Los efectos tóxicos de la sílice Archivado el 15 de abril de 2016 en Wayback Machine por A. Seaton y otros. Informe de investigación del Instituto de Medicina del Trabajo TM/87/13
- Estructura de la sílice precipitada



















