Isocianato de metilo
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Isocianatometano | |
| Otros nombres Metil carbilamina MIC | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.009.879 |
| |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| C2H3NO | |
| Masa molar | 57,051 g/mol |
| Apariencia | Líquido incoloro |
| Olor | Olor penetrante y fuerte [1] |
| Densidad | 0,9230 g/cm3 a 27 °C |
| Punto de fusión | -45 °C (-49 °F; 228 K) [2] |
| Punto de ebullición | 38,3–41 °C (100,9–105,8 °F; 311,4–314,1 K) [2] |
| 10 % (15 °C) [1] | |
| Presión de vapor | 57,7 kPa |
| Estructura | |
| 2.8 D | |
| Termoquímica | |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −92,0 kJ·mol −1 [2] |
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -1,1275E+06 J/mol [3] |
| Peligros | |
| Etiquetado SGA : | |
     | |
| H225 , H300 , H311 , H315 , H317 , H318 , H330 , H334 , H335 , H361d | |
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P272 , P280 , P281 , P284 , P285 , P301+P310 , P302+P352 , P303+P361+P353 , P304+P340 , P304+P341 , P305+P351+P338 , P308+P313 , P310 , P312 , P320 , P321 , P322 , P330 , P332+P313 , P333+P313 , P342+P311 , P361 , P362 , P363 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | -7 °C (19 °F; 266 K) |
| 534 °C (993 °F; 807 K) | |
| Límites de explosividad | 5,3–26% [2] |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 120 mg/kg (oral, ratón) 51,5 mg/kg (oral, rata) [4] |
LC 50 ( concentración media ) | 6,1 ppm (rata, 6 h) 12,2 ppm (ratón, 6 h) 5,4 ppm (conejillo de indias, 6 h) 21 ppm (rata, 2 h) [4] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 0,02 ppm (0,05 mg/m 3 ) [piel] [1] |
REL (recomendado) | TWA 0,02 ppm (0,05 mg/m 3 ) [piel] [1] |
IDLH (Peligro inmediato) | 3 ppm [1] |
| Compuestos relacionados | |
Compuestos relacionados | Isotiocianato de metilo |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El isocianato de metilo ( MIC ) es un compuesto orgánico con la fórmula molecular CH3NCO . Los sinónimos son isocianatometano y metil carbilamina . El isocianato de metilo es un químico intermedio en la producción de pesticidas de carbamato (como carbaril , carbofurano , metomilo y aldicarb ). También se ha utilizado en la producción de cauchos y adhesivos . Como compuesto extremadamente tóxico e irritante, es muy peligroso para la salud humana. El MIC fue el principal tóxico involucrado en el desastre del gas de Bhopal , que mató a corto plazo a 4.000-8.000 personas y causó lesiones permanentes y muertes prematuras a decenas de miles más. [6] [7] [8] [9] [10] También es un agente lacrimógeno muy potente . [11]
Propiedades físicas
El isocianato de metilo es un líquido incoloro, venenoso, lacrimógeno ( agente lacrimógeno ) e inflamable. [12] Es soluble en agua en una proporción de 6 a 10 partes por cada 100 partes, pero también reacciona con el agua (ver Reacciones a continuación).
Tiene un índice de refracción de 1,363 con una longitud de onda de 589 nm a una temperatura de 20 °C [13]
Fabricar
El isocianato de metilo se fabrica generalmente mediante la reacción de monometilamina y fosgeno . Para la producción a gran escala, es ventajoso combinar estos reactivos a mayor temperatura en la fase gaseosa. Se forma una mezcla de isocianato de metilo y dos moles de cloruro de hidrógeno , pero se forma cloruro de N-metilcarbamoilo (MCC) a medida que se condensa la mezcla, lo que deja un mol de cloruro de hidrógeno en forma de gas.
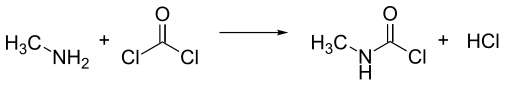
El isocianato de metilo se obtiene tratando el MCC con una amina terciaria , como N,N-dimetilanilina , o con piridina , [14] o separándolo mediante técnicas de destilación . [15]

El isocianato de metilo también se fabrica a partir de N-metilformamida y aire. En este último proceso, se consume inmediatamente en un proceso de circuito cerrado para producir metomilo . [16] Se han descrito otros métodos de fabricación. [17] [18]
Reacciones
El isocianato de metilo reacciona fácilmente con muchas sustancias que contienen grupos NH u OH. Con agua, forma 1,3-dimetilurea y dióxido de carbono con desprendimiento de calor (1358,5 julios o 325 calorías por gramo de MIC): reacciona con relativa lentitud a temperaturas inferiores a 68 °F, pero aumenta su velocidad con temperaturas elevadas o en presencia de ácido o base. [19]

A 25 °C, en exceso de agua, la mitad del MIC se consume en 9 min. [20] Si no se elimina eficazmente el calor de la mezcla reaccionante, la velocidad de la reacción aumentará y provocará rápidamente la ebullición del MIC. Esta reacción desencadenó el desastre de Bhopal después de que se introdujera una gran cantidad de agua en un tanque de almacenamiento de MIC. La consecuencia del proceso exotérmico fuera de control fue una reacción descontrolada y la liberación directa de 42 toneladas de MIC a la atmósfera.
Si el MIC está en exceso, se forma 1,3,5-trimetilbiuret junto con dióxido de carbono . [12] Los alcoholes y fenoles , que contienen un grupo OH, reaccionan lentamente con el MIC, pero la reacción puede ser catalizada por aminas de trialquil o dicarboxilato de dialquilestaño. Las oximas , hidroxilaminas y enoles también reaccionan con el MIC para formar metilcarbamatos. [12] Estas reacciones producen los productos descritos a continuación (Usos).
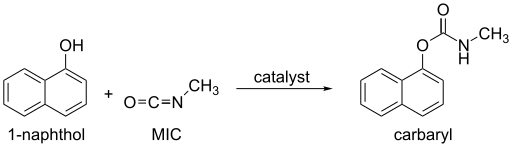
El amoníaco , las aminas primarias y secundarias reaccionan rápidamente con el MIC para formar ureas sustituidas . Otros compuestos de NH, como las amidas y las ureas , reaccionan mucho más lentamente con el MIC. [21]
También reacciona consigo mismo para formar un trímero o polímeros de mayor peso molecular. En presencia de catalizadores , el MIC reacciona consigo mismo para formar un trímero sólido, isocianurato de trimetilo, o un polímero de mayor peso molecular:

El metóxido de sodio , la trietilfosfina , el cloruro férrico y otros compuestos metálicos catalizan la formación del trímero MIC, mientras que la formación del polímero de alto peso molecular es catalizada por ciertas aminas de trialquilato . Dado que la formación del trímero MIC es exotérmica (1246 julios, o 298 calorías, por gramo de MIC), la reacción puede provocar una ebullición violenta del MIC. El polímero de alto peso molecular se hidroliza en agua caliente para formar el isocianurato de trimetilo . Dado que se pueden formar sales metálicas catalíticas a partir de impurezas en el MIC y el acero de calidad comercial, este producto no debe almacenarse en tambores o tanques de acero. [12]
Toxicidad
El isocianato de metilo es extremadamente tóxico . No se conoce ningún antídoto . El valor límite umbral establecido por la Conferencia Americana de Higienistas Industriales Gubernamentales es de 0,02 ppm . El MIC es tóxico por inhalación, ingestión y contacto en cantidades tan bajas como 0,4 ppm . Los síntomas de exposición incluyen tos, dolor en el pecho , disnea , asma , irritación de los ojos , la nariz y la garganta , así como daños en la piel . Los niveles más altos de exposición, por encima de 21 ppm, pueden provocar edema pulmonar o pulmonar , enfisema y hemorragias , neumonía bronquial y muerte . Aunque la mayoría de las personas no pueden detectar el olor del isocianato de metilo a 5 ppm, sus potentes propiedades lagrimales proporcionan una excelente advertencia de su presencia (a una concentración de 2 a 4 partes por millón (ppm) los sujetos expuestos se irritan, mientras que a 21 ppm, los sujetos no podrían tolerar la presencia de isocianato de metilo en el aire). [11]
Se debe tener el cuidado adecuado al almacenar el isocianato de metilo debido a su facilidad de polimerización exotérmica (ver Reacciones) y su sensibilidad similar al agua. Solo se pueden utilizar de forma segura recipientes de acero inoxidable o vidrio ; el MIC debe almacenarse a temperaturas inferiores a 40 °C (104 °F) y preferiblemente a 4 °C (39 °F). [ cita requerida ]
El efecto tóxico del compuesto fue evidente en el desastre de Bhopal de 1984 , cuando alrededor de 42.000 kilogramos (93.000 libras) de isocianato de metilo y otros gases se liberaron de los depósitos subterráneos de la fábrica de Union Carbide India Limited (UCIL), sobre un área poblada el 3 de diciembre de 1984, matando a unas 3.500 personas inmediatamente, 8.000 personas en las primeras 48 horas y 15.000 más durante los siguientes años. 200.000 personas sufrieron efectos duraderos en la salud por el desastre. [22] [23]
Durante los incendios estructurales, los materiales naturales pueden contribuir a la liberación de isocianatos, incluido el isocianato de metilo. [24]
Mecanismo de acción
Hasta hace pocas décadas, el mecanismo de toxicidad del metil isocianato en humanos era en gran parte desconocido o poco claro. [25] [26] El metil isocianato y otros isocianatos son electrófilos y actualmente se cree que causan toxicidad por la alquilación de biomoléculas. [27] Anteriormente se sospechaba que el mecanismo del metil isocianato era la carbamilación de la hemoglobina , lo que interfería con su capacidad de unión al oxígeno y causaba hipoxia . Sin embargo, los experimentos mostraron que cuando las ratas y los conejillos de indias fueron expuestos al metil isocianato en concentraciones superiores a la concentración letal media ( CL50 , la concentración suficiente para matar al 50% de la población analizada), solo el 2% de las moléculas de hemoglobina fueron carbamiladas, lo que sugiere que probablemente este no sea el mecanismo de toxicidad. [28] [29]
Aparición extraterrestre

El 30 de julio de 2015, los científicos informaron que tras el primer aterrizaje del módulo de aterrizaje Philae en la superficie del cometa 67/P , las mediciones de los instrumentos COSAC y Ptolomeo revelaron dieciséis compuestos orgánicos , cuatro de los cuales se observaron por primera vez en un cometa , entre ellos acetamida , acetona , isocianato de metilo y propionaldehído . [31] [32] [33]
En 2017, dos equipos de astrónomos que utilizan el interferómetro Atacama Large Millimeter Array (ALMA), compuesto por 66 radiotelescopios en el desierto de Atacama (norte de Chile ), descubrieron la presencia de MIC alrededor de estrellas jóvenes similares al Sol. [30]
El MIC es considerado una molécula prebiótica según explicaron los descubridores de los hallazgos de ALMA en IRAS 16293-2422 , un sistema múltiple de estrellas muy jóvenes: “Esta familia de moléculas orgánicas está involucrada en la síntesis de péptidos y aminoácidos , que, en forma de proteínas , son la base biológica de la vida tal como la conocemos”. [30]
Referencias
- ^ abcde Guía de bolsillo del NIOSH sobre peligros químicos. "#0423". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ abcd Lide, David R., ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ Lemoult (1898). Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences . 126 : 43.
{{cite journal}}: Falta o está vacío|title=( ayuda ) - ^ ab "Isocianato de metilo". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Información sobre la clasificación de riesgos de la NFPA para productos químicos comunes". nmsu.edu. Archivado desde el original el 17 de febrero de 2015. Consultado el 10 de junio de 2021 .
- ^ Broughton E (mayo de 2005). "El desastre de Bhopal y sus consecuencias: una revisión". Salud ambiental . 4 (1): 6. Bibcode :2005EnvHe...4....6B. doi : 10.1186/1476-069X-4-6 . PMC 1142333 . PMID 15882472.
- ^ Eckerman I (2001). "La industria química y la salud pública: Bhopal como ejemplo" (PDF) . MPH . 2001 (24). Gotemburgo, Suecia: Escuela Nórdica de Salud Pública. ISSN 1104-5701. Archivado (PDF) desde el original el 30 de octubre de 2012.
- ^ Eckerman I (2004). La saga de Bhopal: causas y consecuencias del mayor desastre industrial del mundo. India: Universities Press. ISBN 81-7371-515-7Archivado desde el original el 10 de junio de 2007.
- ^ Rosenberg J. "At 1984 - Huge Poison Gas Leak in Bhopal, India" (En 1984: enorme fuga de gas venenoso en Bhopal, India). About.com. Archivado desde el original el 2 de diciembre de 2007. Consultado el 10 de julio de 2008 .
- ^ Eckerman I (2013). "Catástrofe del gas de Bhopal de 1984: causas y consecuencias". Módulo de referencia en Ciencias ambientales y de sistemas terrestres . Elsevier. págs. 272–287. doi :10.1016/B978-0-12-409548-9.01903-5. ISBN 978-0-12-409548-9.
- ^ ab Kimmerle G, Eben A (1964). "Zur Toxizität von Mmethylisocyanat und desen quantum Bestimmung in der Luft". Archiv für Toxikologie . 20 (4): 235–241. doi :10.1007/bf00577897. S2CID 21422558.
- ^ abcd Publicación de información del producto "Isocianato de metilo" de Union Carbide Corporation, F-41443, noviembre de 1967.
- ^ Kirilin, Aleksei; Belova, Liya; Pletneva, Maria (enero-febrero de 2017). "Nuevos aspectos de la síntesis de isocianatos con el uso de O-sililuretanos". Comunicaciones de Mendeleev . 27 (1): 99–100. doi :10.1016/j.mencom.2017.01.033.
- ^ Patente estadounidense 2480088, Slocombe, RJ; Hardy, EE, "Proceso de producción de cloruros de carbamilo", expedida el 23 de agosto de 1949, asignada a Monsanto
- ^ Patente FR 1400863, Merz, W., "Procédé et dispositif de préparation d'isocianates d'alquile", expedida el 28 de mayo de 1965, asignada a Bayer
- ^ Chemical Week, "Una existencia fugaz para las moléculas de gases tóxicos", pág. 9, 12 de junio de 1985.
- ^ Patente DE 2828259, Giesselmann, G.; Günther, K.; Fuenten, W., "Verfahren zur Herstellung von Myl Isocianato", publicado el 10 de enero de 1980, asignado a Degussa
- ^ "Un método más seguro para fabricar carbamatos". Chemical Week . 1985b (20): 136. 1985.
- ^ Manilla (2021). "Metil isocianato: evaluación de riesgos, peligro para el medio ambiente y la salud". Evaluación de riesgos de gases peligrosos para el medio ambiente y la salud humana : 251–261.
- ^ Castro EA, Moodie RB, Sansom PJ (1985). "La cinética de la hidrólisis de isocianatos de metilo y fenilo". Journal of the Chemical Society, Perkin Transactions 2. 1985 ( 5): 737–742. doi :10.1039/P29850000737.
- ^ March J (1985). Química orgánica avanzada (3.ª ed.). Nueva York: John Wiley & Sons. pág. 802.
- ^ Varma, Daya; Mulay, Shree (2015). "Metil isocianato: el gas de Bhopal". Manual de toxicología de agentes de guerra química : 287–299. doi :10.1016/B978-0-12-800159-2.00022-1.
- ^ "Juicio de Bhopal: ocho condenados por el desastre del gas en India". BBC News . 7 de junio de 2010. Archivado desde el original el 7 de junio de 2010 . Consultado el 7 de junio de 2010 .
- ^ Dzhordzhio Naldzhiev, Matija Strlic; Aislamiento de poliuretano y productos domésticos: una revisión sistemática de su impacto en la calidad ambiental interior, [Construcción y medio ambiente https://www.sciencedirect.com/journal/building-and-environment], 2020
- ^ Mehta PS, Mehta AS, Mehta SJ, Makhijani AB (diciembre de 1990). "Efectos para la salud de la tragedia de Bhopal. Una revisión de la toxicidad del isocianato de metilo". JAMA . 264 (21): 2781–2787. doi :10.1001/jama.1990.03450210081037. PMID 2232065.
- ^ Varma DR (junio de 1987). "Estudios epidemiológicos y experimentales sobre los efectos del isocianato de metilo en el curso del embarazo". Environmental Health Perspectives . 72 : 153–157. doi :10.1289/ehp.8772153. PMC 1474644 . PMID 3622430.
- ^ Bessac, BF; Jordt, S.-E. (1 de julio de 2010). "Detección sensorial y respuestas a gases tóxicos: mecanismos, efectos sobre la salud y contramedidas". Actas de la American Thoracic Society . 7 (4): 269–277. doi :10.1513/pats.201001-004sm. ISSN 1546-3222. PMC 3136963 . PMID 20601631.
- ^ Varma, Daya R.; Guest, Ian (1993). "El accidente de Bhopal y la toxicidad del isocianato de metilo". Revista de toxicología y salud ambiental . 40 (4): 513–529. Bibcode :1993JTEH...40..513V. doi :10.1080/15287399309531816. ISSN 0098-4108. PMID 8277516.
- ^ Ramachandran, PK; Gandhe, BR; Venkateswaran, KS; Kaushik, MP; Vijayaraghavan, R.; Agarwal, GS; Gopalan, N.; Suryanarayana, MVS; Shinde, SK; Sriramachari, S. (1988). "Estudios cromatográficos de gases de la carbamilación de la hemoglobina por isocianato de metilo en ratas y conejos". Journal of Chromatography B: Biomedical Sciences and Applications . 426 (2): 239–247. doi :10.1016/s0378-4347(00)81952-0. ISSN 0378-4347. PMID 3392138.
- ^ abc «ALMA encuentra un ingrediente de vida alrededor de estrellas infantiles similares al Sol». www.eso.org . Archivado desde el original el 8 de junio de 2017 . Consultado el 8 de junio de 2017 .
- ^ Jordans F (30 de julio de 2015). «La sonda Philae encuentra evidencia de que los cometas pueden ser laboratorios cósmicos». The Washington Post . Associated Press. Archivado desde el original el 23 de diciembre de 2018. Consultado el 30 de julio de 2015 .
- ^ "Ciencia en la superficie de un cometa". Agencia Espacial Europea. 30 de julio de 2015. Archivado desde el original el 2 de agosto de 2015 . Consultado el 30 de julio de 2015 .
- ^ Bibring JP, Taylor MG, Alexander C, Auster U, Biele J, Finzi AE, et al. (julio de 2015). "La primera mirada de Philae. Los primeros días de Philae en el cometa. Introducción" (PDF) . Science . 349 (6247): 493. Bibcode :2015Sci...349..493B. doi : 10.1126/science.aac5116 . PMID 26228139.
Enlaces externos
- Tema de seguridad y salud del NIOSH: Isocianatos, del sitio web del Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- Biblioteca Nacional de Medicina de EE. UU.: Banco de datos de sustancias peligrosas: isocianato de metilo



