Glioblastoma
| Glioblastoma | |
|---|---|
| Otros nombres | Glioblastoma multiforme |
 | |
| Resonancia magnética coronal (vista desde la parte posterior de la cabeza) con contraste de un glioblastoma en un varón de 15 años | |
| Especialidad | Neurooncología , neurocirugía |
| Síntomas | Inicialmente inespecífico, dolores de cabeza , cambios de personalidad, náuseas , síntomas similares a un accidente cerebrovascular [1] |
| Inicio habitual | ~64 años [2] [3] |
| Causas | Generalmente poco claro [2] |
| Factores de riesgo | Trastornos genéticos ( neurofibromatosis , síndrome de Li-Fraumeni ), radioterapia previa [2] [3] |
| Método de diagnóstico | Tomografía computarizada , resonancia magnética , biopsia de tejido [1] |
| Prevención | Desconocido [3] |
| Tratamiento | Cirugía , quimioterapia , radiación [3] |
| Medicamento | Temozolomida , esteroides [1] [4] |
| Pronóstico | Esperanza de vida ~ 12 meses con tratamiento (supervivencia a 5 años <10%) [2] [5] |
| Frecuencia | 3 por 100.000 al año [3] |
El glioblastoma , anteriormente conocido como glioblastoma multiforme ( GBM ), es el tipo de cáncer más agresivo y más común que se origina en el cerebro , y tiene un pronóstico muy malo para la supervivencia. [6] [7] [8] Los signos y síntomas iniciales del glioblastoma son inespecíficos. [1] Pueden incluir dolores de cabeza , cambios de personalidad, náuseas y síntomas similares a los de un accidente cerebrovascular . [1] Los síntomas a menudo empeoran rápidamente y pueden progresar hasta la pérdida del conocimiento . [2]
La causa de la mayoría de los casos de glioblastoma no se conoce. [2] Los factores de riesgo poco comunes incluyen trastornos genéticos , como la neurofibromatosis y el síndrome de Li-Fraumeni , y radioterapia previa . [2] [3] Los glioblastomas representan el 15% de todos los tumores cerebrales . [1] Se cree que surgen de los astrocitos . [9] El diagnóstico generalmente se realiza mediante una combinación de una tomografía computarizada , una resonancia magnética y una biopsia de tejido . [1]
No se conoce ningún método para prevenir el cáncer. [3] El tratamiento suele consistir en cirugía , tras lo cual se utilizan quimioterapia y radioterapia. [3] El medicamento temozolomida se utiliza con frecuencia como parte de la quimioterapia. [3] [4] [10] Se pueden utilizar esteroides en dosis altas para ayudar a reducir la hinchazón y disminuir los síntomas. [1] La extirpación quirúrgica (descompresión) del tumor está relacionada con una mayor supervivencia, pero solo por algunos meses. [11]
A pesar del máximo tratamiento, el cáncer casi siempre recurre. [3] La duración típica de la supervivencia después del diagnóstico es de 10 a 13 meses, y menos del 5 al 10 % de las personas sobreviven más de cinco años. [12] [13] [5] Sin tratamiento, la supervivencia suele ser de tres meses. [14] Es el cáncer más común que comienza dentro del cerebro y el segundo tumor cerebral más común, después del meningioma , que es benigno en la mayoría de los casos. [6] [15] Aproximadamente 3 de cada 100 000 personas desarrollan la enfermedad por año. [3] La edad promedio en el momento del diagnóstico es de 64 años y la enfermedad se presenta con mayor frecuencia en hombres que en mujeres. [2] [3]
Los tumores del sistema nervioso central son la décima causa principal de muerte en todo el mundo, y hasta el 90 % son tumores cerebrales. [16] El glioblastoma multiforme (GBM) se deriva de los astrocitos y representa el 49 % de todos los tumores malignos del sistema nervioso central, lo que lo convierte en la forma más común de cáncer del sistema nervioso central. A pesar de los innumerables esfuerzos para desarrollar nuevas terapias para el GBM a lo largo de los años, la tasa de supervivencia media de los pacientes con GBM en todo el mundo es de 8 meses; el tratamiento estándar de radioterapia y quimioterapia que comienza poco después del diagnóstico mejora la duración media de la supervivencia a alrededor de 14 meses y una tasa de supervivencia a cinco años del 5 al 10 %. La tasa de supervivencia a cinco años para las personas con cualquier forma de tumor cerebral maligno primario es del 20 %. [17] Incluso cuando se eliminan todos los rastros detectables del tumor mediante cirugía, la mayoría de los pacientes con GBM experimentan una recurrencia de su cáncer.
Signos y síntomas
Los síntomas más comunes incluyen convulsiones , dolores de cabeza, náuseas y vómitos , pérdida de memoria , cambios en la personalidad, el estado de ánimo o la concentración y problemas neurológicos localizados. [18] Los tipos de síntomas producidos dependen más de la ubicación del tumor que de sus propiedades patológicas. El tumor puede comenzar a producir síntomas rápidamente, pero en ocasiones es una afección asintomática hasta que alcanza un tamaño enorme. [19]
Factores de riesgo
La causa de la mayoría de los casos no está clara. [2] El factor de riesgo más conocido es la exposición a la radiación ionizante, y la radiación de la tomografía computarizada es una causa importante. [20] [21] Alrededor del 5% se desarrollan a partir de ciertos síndromes hereditarios. [18]
Genética
Los factores de riesgo poco comunes incluyen trastornos genéticos como la neurofibromatosis, el síndrome de Li-Fraumeni, la esclerosis tuberosa o el síndrome de Turcot . [18] La radioterapia previa también es un riesgo. [2] [3] Por razones desconocidas, se presenta con mayor frecuencia en varones. [22]
Ambiental
Otras asociaciones incluyen la exposición al tabaco , a los pesticidas y el trabajo en la refinación de petróleo o en la fabricación de caucho . [18]
El glioblastoma se ha asociado con los virus SV40 , [23] HHV-6 , [24] [25] y citomegalovirus (CMV). [26] La infección con un CMV oncogénico puede incluso ser necesaria para el desarrollo del glioblastoma. [27] [28]
Otro
Se han realizado investigaciones para ver si el consumo de carne curada es un factor de riesgo. Hasta 2003 no se había confirmado ningún riesgo. [29] De manera similar, la exposición al formaldehído y a los campos electromagnéticos residenciales , como los de los teléfonos celulares y el cableado eléctrico dentro de las casas, se han estudiado como factores de riesgo. Hasta 2015, no se había demostrado que causaran GBM. [18] [30] [31]
Patogenesia
Se desconoce el origen celular del glioblastoma. Debido a las similitudes en la inmunotinción de las células gliales y el glioblastoma, se ha asumido durante mucho tiempo que los gliomas como el glioblastoma se originan a partir de células madre de tipo glial que se encuentran en la zona subventricular . Estudios más recientes sugieren que los astrocitos , las células progenitoras de oligodendrocitos y las células madre neurales podrían servir como células de origen. [32] [33]
Los GBM suelen formarse en la sustancia blanca cerebral, crecen rápidamente y pueden llegar a ser muy grandes antes de producir síntomas. Dado que la función de las células gliales en el cerebro es dar soporte a las neuronas, tienen la capacidad de dividirse, agrandarse y extender proyecciones celulares a lo largo de las neuronas y los vasos sanguíneos. Una vez cancerosas, estas células están predispuestas a propagarse a lo largo de las vías existentes en el cerebro, típicamente a lo largo de los tractos de sustancia blanca, los vasos sanguíneos y el espacio perivascular . [34] El tumor puede extenderse a las meninges o la pared ventricular , lo que lleva a un alto contenido de proteínas en el líquido cefalorraquídeo (LCR) (> 100 mg/dl), así como a una pleocitosis ocasional de 10 a 100 células, principalmente linfocitos . Las células malignas transportadas en el LCR pueden propagarse (raramente) a la médula espinal o causar gliomatosis meníngea. Sin embargo, la metástasis de GBM más allá del sistema nervioso central es extremadamente inusual. Alrededor del 50% de los GBM ocupan más de un lóbulo de un hemisferio o son bilaterales. Los tumores de este tipo suelen surgir del cerebro y pueden presentar la clásica infiltración a través del cuerpo calloso , lo que produce un glioma en mariposa (bilateral) . [35]
Clasificación del glioblastoma
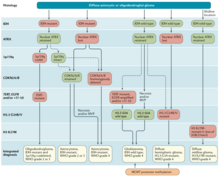
La clasificación de los tumores cerebrales se ha basado tradicionalmente en la histopatología a nivel macroscópico, medida en cortes de hematoxilina-eosina . La Organización Mundial de la Salud publicó la primera clasificación estándar en 1979 [36] y ha seguido haciéndolo desde entonces. La Clasificación de Tumores del Sistema Nervioso Central de la OMS de 2007 [37] fue la última clasificación basada principalmente en características microscópicas. La nueva Clasificación de Tumores del Sistema Nervioso Central de la OMS de 2016 [38] supuso un cambio de paradigma: algunos de los tumores se definieron también por su composición genética, así como por su morfología celular.
En 2021 se publicó la quinta edición de la Clasificación de Tumores del Sistema Nervioso Central de la OMS. Esta actualización eliminó la clasificación de glioblastoma secundario y reclasificó esos tumores como Astrocitoma, IDH mutante, grado 4. Ahora solo los tumores que son de tipo salvaje IDH se clasifican como glioblastoma. [39]
| Sinónimos | Glioblastoma, GBM |
| Célula de origen | Astrocito |
| Edad media en el momento del diagnóstico | ~62 años |
| Relación hombres:mujeres | 1.42:1 |
| Duración media de la historia clínica en el momento del diagnóstico | 4 meses |
| Supervivencia global media | |
| Cirugía + radioterapia | 9,9 meses |
| Cirugía + radioterapia + quimioterapia | 15 meses |
| Ubicación | Generalmente supratentorial, rara vez cerebelo o columna vertebral. |
| Necrosis y proliferación microvascular | Extenso |
| Mutaciones moleculares/genéticas asociadas | Mutación del promotor TERT, ganancia combinada del cromosoma 7 y pérdida del cromosoma 10; amplificación del EGFR |
Alteraciones moleculares
Actualmente existen tres subtipos moleculares de glioblastoma que se identificaron según la expresión genética: [41]
- Clásico: Alrededor del 97% de los tumores en este subtipo tienen copias adicionales del gen del receptor del factor de crecimiento epidérmico ( EGFR ), y la mayoría tienen una expresión más alta de lo normal de EGFR , mientras que el gen TP53 (p53), que a menudo está mutado en el glioblastoma, rara vez está mutado en este subtipo. [ 42] La pérdida de heterocigosidad en el cromosoma 10 también se observa con frecuencia en el subtipo clásico junto con la amplificación del cromosoma 7. [43]
- El subtipo proneural a menudo presenta altas tasas de alteraciones en TP53 (p53) y en PDGFRA, el gen que codifica el receptor del factor de crecimiento derivado de plaquetas de tipo a . [44]
- El subtipo mesenquimal se caracteriza por altas tasas de mutaciones u otras alteraciones en NF1 , el gen que codifica la neurofibromina 1 y menos alteraciones en el gen EGFR y menos expresión de EGFR que otros tipos. [45]
Los análisis iniciales de la expresión genética habían revelado un cuarto subtipo neuronal. [44] Sin embargo, análisis posteriores revelaron que este subtipo no es específico del tumor y es una posible contaminación causada por las células normales. [41]
Se han descrito muchas otras alteraciones genéticas en el glioblastoma, y la mayoría de ellas se agrupan en dos vías, la RB y la PI3K/AKT . [46] Entre el 68-78% y el 88% de los glioblastomas tienen alteraciones en estas vías, respectivamente. [6]
Otra alteración importante es la metilación de MGMT , una enzima "suicida" de reparación del ADN. La metilación altera la transcripción del ADN y la expresión del gen MGMT. Dado que la enzima MGMT puede reparar solo una alquilación del ADN debido a su mecanismo de reparación suicida, la capacidad de reserva es baja y la metilación del promotor del gen MGMT afecta en gran medida la capacidad de reparación del ADN. [47] [48] La metilación de MGMT se asocia con una mejor respuesta al tratamiento con quimioterapéuticos que dañan el ADN, como la temozolomida. [49]
Los estudios que utilizan perfiles de todo el genoma han revelado que los glioblastomas tienen una notable variedad genética. [50]
Con ayuda de investigaciones moleculares se han identificado al menos tres vías distintas en el desarrollo de glioblastomas.
- La primera vía implica la amplificación y activación mutacional de los genes de la tirosina quinasa del receptor (RTK), lo que conduce a la desregulación de la señalización del factor de crecimiento. El factor de crecimiento epitelial (EGF), el factor de crecimiento endotelial vascular ( VEGF ) y el factor de crecimiento derivado de plaquetas ( PDGF ) son reconocidos por proteínas transmembrana llamadas RTK. Además, pueden funcionar como receptores de hormonas, citocinas y otras vías de señalización.
- El segundo método implica la activación del sistema de señalización intracelular conocido como fosfatidilinositol-3-OH quinasa ( PI3K )/ AKT / mTOR , que es crucial para controlar la supervivencia celular.
- La tercera vía está definida por la inactivación de la vía supresora de tumores p53 y retinoblastoma (Rb). [51]
Células madre cancerosas
Se han encontrado células de glioblastoma con propiedades similares a las células progenitoras ( células madre de cáncer de glioblastoma ) en glioblastomas. Su presencia, junto con la naturaleza difusa del glioblastoma, hace que sea difícil extirparlas por completo mediante cirugía, y por lo tanto se cree que es la posible causa de la resistencia a los tratamientos convencionales y la alta tasa de recurrencia. [52] Las células madre de cáncer de glioblastoma comparten cierta semejanza con las células progenitoras neuronales, ambas expresan el receptor de superficie CD133 . [53] El CD44 también se puede utilizar como marcador de células madre cancerosas en un subconjunto de células tumorales de glioblastoma. [54] Las células madre de cáncer de glioblastoma parecen exhibir una resistencia mejorada a la radioterapia y la quimioterapia mediada, al menos en parte, por la regulación positiva de la respuesta al daño del ADN . [55]
Metabolismo
El gen IDH1 codifica la enzima isocitrato deshidrogenasa 1 y no está mutado en el glioblastoma. Por ello, estos tumores se comportan de forma más agresiva en comparación con los astrocitomas con mutación en IDH1. [48]
Canales iónicos
Además, el GBM presenta numerosas alteraciones en los genes que codifican los canales iónicos , incluida la regulación positiva de los canales de potasio gBK y los canales de cloruro ClC-3 . Al regular positivamente estos canales iónicos, se plantea la hipótesis de que las células tumorales de glioblastoma facilitan un mayor movimiento de iones sobre la membrana celular, lo que aumenta el movimiento de H 2 O a través de la ósmosis, lo que ayuda a las células de glioblastoma a cambiar el volumen celular muy rápidamente. Esto es útil en su comportamiento invasivo extremadamente agresivo porque las adaptaciones rápidas en el volumen celular pueden facilitar el movimiento a través de la matriz extracelular sinuosa del cerebro. [56]
MicroARN
A partir de 2012, la interferencia de ARN , generalmente microARN, estaba bajo investigación en cultivos de tejidos, muestras de patología y modelos animales preclínicos de glioblastoma. [57] Además, las observaciones experimentales sugieren que el microARN-451 es un regulador clave de la señalización LKB1 / AMPK en células de glioma cultivadas [58] y que la agrupación de miARN controla las vías epigenéticas en la enfermedad. [59]
Vasculatura tumoral
El GBM se caracteriza por vasos anormales que presentan una morfología y funcionalidad alteradas. [60] La alta permeabilidad y la mala perfusión de la vasculatura dan lugar a un flujo sanguíneo desorganizado dentro del tumor y pueden conducir a un aumento de la hipoxia, lo que a su vez facilita la progresión del cáncer al promover procesos como la inmunosupresión. [60] [61]
Diagnóstico


Cuando se observan con resonancia magnética, los glioblastomas a menudo aparecen como lesiones que se realzan en anillo. Sin embargo, la apariencia no es específica, ya que otras lesiones como abscesos , metástasis , esclerosis múltiple tumefacta y otras entidades pueden tener una apariencia similar. [63] El diagnóstico definitivo de un GBM sospechoso en TC o RMN requiere una biopsia estereotáctica o una craneotomía con resección del tumor y confirmación patológica. Debido a que el grado del tumor se basa en la porción más maligna del tumor, la biopsia o la resección subtotal del tumor pueden dar como resultado una subclasificación de la lesión. La obtención de imágenes del flujo sanguíneo del tumor mediante RMN de perfusión y la medición de la concentración de metabolitos del tumor con espectroscopia de RM pueden agregar valor diagnóstico a la RMN estándar en casos seleccionados al mostrar un aumento del volumen sanguíneo cerebral relativo y un aumento del pico de colina, respectivamente, pero la patología sigue siendo el estándar de oro para el diagnóstico y la caracterización molecular. [ cita requerida ]
Es importante distinguir el glioblastoma del astrocitoma de alto grado. Estos tumores se producen espontáneamente ( de novo ) y no han progresado a partir de un glioma de grado inferior, como en los astrocitomas de alto grado [6] Los glioblastomas tienen un peor pronóstico y una biología tumoral diferente, y pueden tener una respuesta diferente a la terapia, lo que hace que esta sea una evaluación crítica para determinar el pronóstico y la terapia del paciente. [47] [64] Los astrocitomas tienen una mutación en IDH1 o IDH2 , mientras que esta mutación no está presente en el glioblastoma. Por lo tanto, las mutaciones IDH1 e IDH2 son una herramienta útil para distinguir los glioblastomas de los astrocitomas, ya que histopatológicamente son similares y la distinción sin biomarcadores moleculares no es confiable. [48] Los glioblastomas de tipo salvaje IDH generalmente tienen una expresión de OLIG2 menor en comparación con los astrocitomas de grado inferior con mutación IDH. [65] En pacientes mayores de 55 años con un glioblastoma histológicamente típico, sin un glioma de grado inferior preexistente, con una localización tumoral no en la línea media y con expresión nuclear retenida de ATRX , la negatividad inmunohistoquímica para IDH1 R132H es suficiente para la clasificación como glioblastoma de tipo salvaje IDH. [62] En todos los demás casos de gliomas difusos, la falta de inmunopositividad para IDH1 R132H debe ser seguida por la secuenciación de ADN de IDH1 e IDH2 para detectar o excluir la presencia de mutaciones no canónicas. [62] Los gliomas astrocíticos difusos de tipo salvaje IDH sin proliferación o necrosis microvascular deben analizarse para la amplificación de EGFR, mutación del promotor TERT y una firma citogenética +7/–10 como características moleculares de los glioblastomas de tipo salvaje IDH. [62]
- Histopatología del glioblastoma, que muestra características de astrocitoma de alto grado de pleomorfismo nuclear marcado, mitosis múltiples (una en la flecha blanca) y células multinucleadas (una en la flecha negra), con células que tienen una disposición sin patrón en un fondo fibrilar rosado en la tinción H&E.
- Histopatología de menor aumento que muestra necrosis rodeada de pseudoempalizadas de células tumorales, lo que confiere un diagnóstico de glioblastoma en lugar de astrocitoma anaplásico.
Prevención
No se conocen métodos para prevenir el glioblastoma. [3] A diferencia de otras formas de cáncer, la mayoría de los gliomas aparecen sin previo aviso y no se conocen formas de prevenirlos. [66]
Tratamiento

El tratamiento del glioblastoma es difícil debido a varios factores que lo complican: [67]
- Las células tumorales son resistentes a las terapias convencionales.
- El cerebro es susceptible a sufrir daños por la terapia convencional.
- El cerebro tiene una capacidad limitada para repararse a sí mismo.
- Muchos medicamentos no pueden atravesar la barrera hematoencefálica para actuar sobre el tumor.
El tratamiento de los tumores cerebrales primarios consiste en cuidados paliativos (sintomáticos) y terapias destinadas a mejorar la supervivencia.
Terapia sintomática
El tratamiento de apoyo se centra en aliviar los síntomas y mejorar la función neurológica del paciente. Los principales agentes de apoyo son los anticonvulsivos y los corticosteroides .
- Históricamente, alrededor del 90% de los pacientes con glioblastoma se sometieron a tratamiento anticonvulsivo, aunque se estima que solo el 40% de los pacientes requirieron este tratamiento. Los neurocirujanos han recomendado que no se administren anticonvulsivos de manera profiláctica y que se debe esperar hasta que se presente una convulsión antes de recetar este medicamento. [68] Aquellos que reciben fenitoína simultáneamente con radiación pueden tener reacciones cutáneas graves, como eritema multiforme y síndrome de Stevens-Johnson .
- Los corticosteroides, generalmente dexametasona , pueden reducir el edema peritumoral (a través de la reorganización de la barrera hematoencefálica), disminuyendo el efecto de masa y bajando la presión intracraneal, con una disminución del dolor de cabeza o la somnolencia.
Cirugía

La cirugía es la primera etapa del tratamiento del glioblastoma. Un tumor GBM promedio contiene 10 11 células, que se reducen en promedio a 10 9 células después de la cirugía (una reducción del 99%). Los beneficios de la cirugía incluyen la resección para un diagnóstico patológico, el alivio de los síntomas relacionados con el efecto de masa y la posible eliminación de la enfermedad antes de que se presente una resistencia secundaria a la radioterapia y la quimioterapia. [69]
Cuanto mayor sea la extensión de la extirpación del tumor, mejor. En análisis retrospectivos, la extirpación del 98% o más del tumor se ha asociado con un tiempo de vida más saludable significativamente más largo que si se extirpa menos del 98% del tumor. [70] Las probabilidades de una extirpación inicial casi completa del tumor pueden aumentar si la cirugía se guía por un tinte fluorescente conocido como ácido 5-aminolevulínico . [71] [72] Las células de GBM son ampliamente infiltrantes a través del cerebro en el momento del diagnóstico y, a pesar de una "resección total" de todo el tumor obvio, la mayoría de las personas con GBM desarrollan posteriormente tumores recurrentes, ya sea cerca del sitio original o en lugares más distantes dentro del cerebro. Otras modalidades, típicamente radiación y quimioterapia, se utilizan después de la cirugía en un esfuerzo por suprimir y ralentizar la enfermedad recurrente al dañar el ADN de las células de GBM de proliferación rápida. [73]
Entre el 60 y el 85% de los pacientes con glioblastoma informan deterioro cognitivo relacionado con el cáncer después de la cirugía, que se refiere a problemas con el funcionamiento ejecutivo, la fluidez verbal, la atención y la velocidad de procesamiento. [74] [75] [76] Estos síntomas pueden controlarse con terapia cognitiva conductual, [77] [75] ejercicio físico, yoga y meditación. [77] [75] [78]
Radioterapia

Después de la cirugía, la radioterapia se convierte en el pilar del tratamiento para las personas con glioblastoma. Por lo general, se realiza junto con la administración de temozolomida . [10] Un ensayo clínico fundamental realizado a principios de la década de 1970 mostró que entre 303 pacientes con GBM asignados al azar a radiación o la mejor terapia médica, aquellos que recibieron radiación tuvieron una supervivencia media de más del doble de aquellos que no la recibieron. [79] La investigación clínica posterior ha intentado aprovechar la columna vertebral de la cirugía seguida de radiación. La radioterapia de cerebro completo no mejora cuando se compara con la radioterapia conformada tridimensional más precisa y dirigida. [80] Se ha descubierto que una dosis total de radiación de 60 a 65 Gy es óptima para el tratamiento. [81]
Se sabe que los tumores GBM contienen zonas de tejido que presentan hipoxia , que son altamente resistentes a la radioterapia. Se han aplicado varios enfoques a los radiosensibilizadores de quimioterapia, con un éxito limitado a partir de 2016. [actualizar]A partir de 2010 [actualizar], los enfoques de investigación más nuevos incluyeron investigaciones preclínicas y clínicas sobre el uso de un compuesto que mejora la difusión de oxígeno , como el crocetinato de sodio trans , como radiosensibilizadores , [82] y a partir de 2015 [actualizar]se estaba realizando un ensayo clínico. [83] La terapia de captura de neutrones de boro se ha probado como un tratamiento alternativo para el glioblastoma, pero no es de uso común.
Quimioterapia
La mayoría de los estudios no muestran ningún beneficio de la adición de quimioterapia. Sin embargo, un gran ensayo clínico de 575 participantes asignados al azar a radiación estándar versus radiación más quimioterapia con temozolomida mostró que el grupo que recibió temozolomida sobrevivió una mediana de 14,6 meses en comparación con 12,1 meses para el grupo que recibió radiación sola. [10] [84] Este régimen de tratamiento ahora es estándar para la mayoría de los casos de glioblastoma donde la persona no está inscrita en un ensayo clínico . [85] [86] La temozolomida parece funcionar sensibilizando las células tumorales a la radiación y parece ser más eficaz para los tumores con metilación del promotor MGMT . [87] Las dosis altas de temozolomida en gliomas de alto grado producen baja toxicidad, pero los resultados son comparables a las dosis estándar. [88] La terapia antiangiogénica con medicamentos como bevacizumab controla los síntomas, pero no parece afectar la supervivencia general en aquellos con glioblastoma. Una revisión sistemática de 2018 encontró que el beneficio general de las terapias antiangiogénicas no estaba claro. [89] En personas mayores con glioblastoma recién diagnosticado que están razonablemente en forma, la quimiorradioterapia concurrente y adyuvante brinda la mejor supervivencia general, pero se asocia con un mayor riesgo de eventos adversos hematológicos que la radioterapia sola. [90]
Inmunoterapia
Los ensayos clínicos de fase 3 de tratamientos de inmunoterapia para el glioblastoma han fracasado en gran medida. [91]
Otros procedimientos
La terapia con campos eléctricos alternos es una terapia aprobada por la FDA para el glioblastoma de diagnóstico reciente [92] y recurrente. [93] En 2015, los resultados iniciales de un ensayo clínico aleatorizado de fase III de terapia con campos eléctricos alternos más temozolomida en glioblastoma de diagnóstico reciente informaron una mejora de tres meses en la supervivencia libre de progresión y una mejora de cinco meses en la supervivencia general en comparación con la terapia con temozolomida sola, [94] [95] lo que representa el primer ensayo a gran escala en una década que muestra una mejora de la supervivencia en este entorno. [95] A pesar de estos resultados, la eficacia de este enfoque sigue siendo controvertida entre los expertos médicos. [96] Sin embargo, una mayor comprensión de la base mecanística a través de la cual la terapia con campos eléctricos alternos ejerce efectos anticancerígenos y los resultados de los ensayos clínicos de fase III en curso en cánceres extracraneales pueden ayudar a facilitar una mayor aceptación clínica para tratar el glioblastoma en el futuro. [97]
Pronóstico
La duración más común de supervivencia después del diagnóstico es de 10 a 13 meses (aunque investigaciones recientes apuntan a una tasa de supervivencia media de 15 meses), [98] [99] [8] con menos del 1-3% de las personas que sobreviven más de cinco años. [2] [5] [100] En los Estados Unidos entre 2012 y 2016 la supervivencia a cinco años fue del 6,8%. [5] Sin tratamiento, la supervivencia suele ser de tres meses. [14] Las curaciones completas son extremadamente raras, pero se han reportado. [101] [102]
La edad avanzada (> 60 años) conlleva un peor riesgo pronóstico. La muerte suele deberse a una infiltración tumoral generalizada con edema cerebral y aumento de la presión intracraneal . [103]
Una buena puntuación inicial de desempeño de Karnofsky (KPS) y la metilación de MGMT se asocian con una supervivencia más prolongada. [103] Se puede realizar una prueba de ADN en glioblastomas para determinar si el promotor del gen MGMT está metilado o no . Los pacientes con un promotor MGMT metilado tienen una supervivencia más prolongada que aquellos con un promotor MGMT no metilado, debido en parte a una mayor sensibilidad a la temozolomida. [104]
Los beneficios a largo plazo también se han asociado con aquellos pacientes que reciben cirugía, radioterapia y quimioterapia con temozolomida. [103] Sin embargo, aún se desconoce mucho acerca de por qué algunos pacientes sobreviven más tiempo con glioblastoma. La edad menor de 50 años está relacionada con una mayor supervivencia en el GBM, al igual que la resección del 98 % o más y el uso de quimioterapia con temozolomida y mejores KPS. Un estudio reciente confirma que una edad más joven está asociada con un pronóstico mucho mejor, con una pequeña fracción de pacientes menores de 40 años que logran una curación basada en la población. Se cree que la curación ocurre cuando el riesgo de muerte de una persona vuelve al de la población normal, y en el GBM, se cree que esto ocurre después de 10 años. [102]
El departamento de neurooncología de la UCLA publica datos de supervivencia en tiempo real de pacientes con este diagnóstico. [105]
Según un estudio de 2003, el pronóstico del GBM se puede dividir en tres subgrupos según el KPS, la edad del paciente y el tratamiento. [106]
| Clase de análisis de particionamiento recursivo (RPA) | Definición | Tiempo de supervivencia medio histórico | Supervivencia histórica de 1 año | Supervivencia histórica de 3 años | Supervivencia histórica de 5 años |
|---|---|---|---|---|---|
| III | Edad < 50, KPS ≥ 90 | 17,1 meses | 70% | 20% | 14% |
| IV | Edad < 50, KPS < 90 | 11,2 meses | 46% | 7% | 4% |
| Edad ≥ 50, KPS ≥ 70, extirpación quirúrgica con buena función neurológica | |||||
| V + VI | Edad ≥ 50, KPS ≥ 70, sin extirpación quirúrgica | 7,5 meses | 28% | 1% | 0% |
| Edad ≥ 50, KPS < 70 |
Epidemiología
Aproximadamente tres de cada 100.000 personas desarrollan la enfermedad al año, [3] aunque la frecuencia regional puede ser mucho mayor. [107] La frecuencia en Inglaterra se duplicó entre 1995 y 2015. [108]
Es el segundo tumor más común del sistema nervioso central después del meningioma . [15] Se presenta con mayor frecuencia en hombres que en mujeres. [2] [3] Aunque la edad media en el momento del diagnóstico es de 64 años, [2] [3] en 2014, la amplia categoría de cánceres cerebrales fue superada solo por la leucemia en personas en los Estados Unidos menores de 20 años. [109]
Historia
El término glioblastoma multiforme fue introducido en 1926 por Percival Bailey y Harvey Cushing , basándose en la idea de que el tumor se origina a partir de precursores primitivos de células gliales ( glioblastos ), y la apariencia altamente variable debido a la presencia de necrosis, hemorragia y quistes (multiforme). [110]
Investigación
Terapia génica
La terapia génica se ha explorado como un método para tratar el glioblastoma, y aunque los modelos animales y los ensayos clínicos de fase temprana han tenido éxito, a partir de 2017, todos los medicamentos de terapia génica que se habían probado en ensayos clínicos de fase III para el glioblastoma habían fallado. [111] [112] [113] Los científicos han desarrollado el LPLNP-PPT ( nanopartículas de luminiscencia persistente larga) nanoestructurado de núcleo-capa . PPT se refiere a polieterimida, PEG y transactivador de la transcripción, y TRAIL es el ligando inducido por apoptosis relacionado con el factor de necrosis tumoral humano [114] ) para la administración y el seguimiento efectivos de genes, con resultados positivos. Este es un ligando TRAIL que se ha codificado para inducir la apoptosis de las células cancerosas, más específicamente los glioblastomas. Aunque este estudio todavía estaba en ensayos clínicos en 2017, ha demostrado funcionalidades diagnósticas y terapéuticas, y abrirá un gran interés para aplicaciones clínicas en la terapia basada en células madre. [115]
También se han explorado otros enfoques de terapia génica en el contexto del glioblastoma, incluida la terapia génica suicida. La terapia génica suicida es un enfoque de dos pasos que incluye la administración de un gen enzimático extraño a las células cancerosas seguida de la activación con un profármaco que causa toxicidad en las células cancerosas e induce la muerte celular. Este enfoque ha tenido éxito en modelos animales y en estudios clínicos pequeños, pero no pudo mostrar beneficios en la supervivencia en estudios clínicos más amplios. El uso de nuevos vectores de administración más eficientes y sistemas de profármacos y genes suicidas podría mejorar el beneficio clínico de este tipo de terapias. [116]
Viroterapia oncolítica
La viroterapia oncolítica es un tratamiento novedoso que está surgiendo y que se encuentra en fase de investigación tanto preclínica como clínica. Actualmente, se están probando en las fases I y II de ensayos clínicos varios virus, entre ellos el virus del herpes simple, el adenovirus, el poliovirus y el reovirus, para el tratamiento del glioblastoma, y se ha demostrado que mejoran la supervivencia general. [117]
Administración intranasal de fármacos
Se está estudiando la administración directa de fármacos de la nariz al cerebro como un medio para lograr concentraciones más altas y, con suerte, más efectivas en el cerebro. [118] [119] Un estudio clínico de fase I/II con pacientes con glioblastoma en Brasil investigó el compuesto natural alcohol perílico para administración intranasal como aerosol . Los resultados fueron alentadores [118] [120] [121] y, a partir de 2016, se ha iniciado un ensayo similar en los Estados Unidos. [122]
Véase también
Referencias
- ^ abcdefgh Young RM, Jamshidi A, Davis G, Sherman JH (junio de 2015). "Tendencias actuales en el tratamiento y manejo quirúrgico del glioblastoma en adultos". Annals of Translational Medicine . 3 (9): 121. doi :10.3978/j.issn.2305-5839.2015.05.10. PMC 4481356 . PMID 26207249.
- ^ abcdefghijklm "Capítulo 5.16". Informe mundial sobre el cáncer 2014. Organización Mundial de la Salud. 2014. ISBN 978-92-832-0429-9.
- ^ abcdefghijklmnopq Gallego O (agosto de 2015). "Tratamiento no quirúrgico del glioblastoma recurrente". Oncología actual . 22 (4): e273–e281. doi :10.3747/co.22.2436. PMC 4530825 . PMID 26300678.
- ^ ab Hart MG, Garside R, Rogers G, Stein K, Grant R (abril de 2013). "Temozolomida para el glioma de alto grado". Base de datos Cochrane de revisiones sistemáticas . 2013 (4): CD007415. doi : 10.1002 /14651858.CD007415.pub2. PMC 6457743. PMID 23633341.
- ^ abcd Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. (noviembre de 2019). "Informe estadístico CBTRUS: tumores cerebrales primarios y otros tumores del sistema nervioso central diagnosticados en los Estados Unidos en 2012-2016". Neuro-Oncology . 21 (Supl 5): v1–v100. doi :10.1093/neuonc/noz150. PMC 6823730 . PMID 31675094.
- ^ abcd Bleeker FE, Molenaar RJ, Leenstra S (mayo de 2012). "Avances recientes en la comprensión molecular del glioblastoma". Journal of Neuro-Oncology . 108 (1): 11–27. doi :10.1007/s11060-011-0793-0. PMC 3337398 . PMID 22270850.
- ^ Tan AC, Ashley DM, López GY, Malinzak M, Friedman HS, Khasraw M (julio de 2020). "Manejo del glioblastoma: estado del arte y direcciones futuras". CA . 70 (4). Wiley: 299–312. doi :10.3322/caac.21613. hdl : 10536/DRO/DU:30138185 . PMID 32478924. S2CID 219170898.
- ^ ab Tran B, Rosenthal MA (abril de 2010). "Comparación de supervivencia entre el glioblastoma multiforme y otros cánceres incurables". Journal of Clinical Neuroscience . 17 (4): 417–421. doi :10.1016/j.jocn.2009.09.004. PMID 20167494. S2CID 5492993.
- ^ "Capítulo 3.8". Informe mundial sobre el cáncer 2014. Organización Mundial de la Salud. 2014. ISBN 978-92-832-0429-9.
- ^ abc Khosla D (febrero de 2016). "Terapia concurrente para mejorar los resultados radioterapéuticos en el glioblastoma". Annals of Translational Medicine . 4 (3): 54. doi :10.3978/j.issn.2305-5839.2016.01.25. PMC 4740000 . PMID 26904576.
- ^ Van Meir EG, Hadjipanayis CG, Norden AD, Shu HK, Wen PY, Olson JJ (2010). "Nuevos y emocionantes avances en neurooncología: el camino hacia una cura para el glioma maligno". California . 60 (3): 166-193. doi :10.3322/caac.20069. PMC 2888474 . PMID 20445000.
- ^ McKenney AS, Weg E, Bale TA, Wild AT, Um H, Fox MJ, et al. (6 de febrero de 2022). "Análisis radiómico para predecir la pseudoprogresión confirmada histopatológicamente en pacientes con glioblastoma". Avances en oncología radioterápica . 8 (1): 100916. doi :10.1016/j.adro.2022.100916. PMC 9873493. PMID 36711062. S2CID 246647975 .
- ^ Stupp R, Hegi ME, Mason WP, van den Bent MJ, Taphoorn MJ, Janzer RC, et al. (mayo de 2009). "Efectos de la radioterapia con temozolomida concomitante y adyuvante frente a la radioterapia sola sobre la supervivencia en el glioblastoma en un estudio de fase III aleatorizado: análisis de 5 años del ensayo EORTC-NCIC". The Lancet. Oncología . 10 (5): 459–466. doi :10.1016/S1470-2045(09)70025-7. PMID 19269895. S2CID 25150249.
- ^ ab Schapira AH (2007). Neurología y neurociencia clínica. Filadelfia: Mosby Elsevier. p. 1336. ISBN 978-0-323-07053-9Archivado desde el original el 29 de julio de 2017.
- ^ ab McNeill KA (noviembre de 2016). "Epidemiología de los tumores cerebrales". Neurologic Clinics . 34 (4): 981–998. doi :10.1016/j.ncl.2016.06.014. PMID 27720005.
- ^ Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS (octubre de 2020). "Informe estadístico de CBTRUS: tumores cerebrales primarios y otros tumores del sistema nervioso central diagnosticados en los Estados Unidos en 2013-2017". Neuro-Oncology . 22 (12 Suppl 2): iv1–iv96. doi :10.1093/neuonc/noaa200. PMC 7596247 . PMID 33123732.
- ^ Visser O, Ardanaz E, Botta L, Sant M, Tavilla A, Minicozzi P (octubre de 2015). "Supervivencia de adultos con tumores cerebrales malignos primarios en Europa; resultados del estudio EUROCARE-5". Revista Europea del Cáncer . 51 (15): 2231–2241. doi :10.1016/j.ejca.2015.07.032. PMID 26421825.
- ^ abcde Alifieris C, Trafalis DT (agosto de 2015). "Glioblastoma multiforme: patogénesis y tratamiento". Farmacología y terapéutica . 152 : 63–82. doi :10.1016/j.pharmthera.2015.05.005. PMID 25944528.
- ^ Iacob G, Dinca EB (25 de noviembre de 2009). "Datos actuales y estrategia en el glioblastoma multiforme". Revista de Medicina y Vida . 2 (4): 386–393. PMC 3019011 . PMID 20108752.
- ^ Smoll NR, Brady Z, Scurrah KJ, Lee C, Berrington de González A, Mathews JD (6 de julio de 2023). "Radiación de la tomografía computarizada e incidencia de cáncer cerebral". Neuro-Oncology . 25 (7): 1368–1376. doi :10.1093/neuonc/noad012. PMC 10326490 . PMID 36638155.
- ^ Smoll NR, Brady Z, Scurrah K, Mathews JD (junio de 2016). "Exposición a la radiación ionizante e incidencia de cáncer cerebral: cohorte del estudio Life Span". Epidemiología del cáncer . 42 : 60–65. doi :10.1016/j.canep.2016.03.006. PMID 27038588. ProQuest 1797583676.
- ^ Ohgaki H, Kleihues P (junio de 2005). "Estudios poblacionales sobre incidencia, tasas de supervivencia y alteraciones genéticas en gliomas astrocíticos y oligodendrogliales". Revista de neuropatología y neurología experimental . 64 (6): 479–489. doi : 10.1093/jnen/64.6.479 . PMID: 15977639.
- ^ Vilchez RA, Kozinetz CA, Arrington AS, Madden CR, Butel JS (junio de 2003). "Virus simio 40 en cánceres humanos". The American Journal of Medicine . 114 (8): 675–684. doi :10.1016/S0002-9343(03)00087-1. PMID 12798456.
- ^ Crawford JR, Santi MR, Thorarinsdottir HK, Cornelison R, Rushing EJ, Zhang H, et al. (septiembre de 2009). "Detección de variantes del virus del herpes humano-6 en tumores cerebrales pediátricos: asociación del antígeno viral en gliomas de bajo grado". Journal of Clinical Virology . 46 (1): 37–42. doi :10.1016/j.jcv.2009.05.011. PMC 2749001 . PMID 19505845.
- ^ Chi J, Gu B, Zhang C, Peng G, Zhou F, Chen Y, et al. (noviembre de 2012). "Infección latente por virus del herpes humano 6 en pacientes con glioma". The Journal of Infectious Diseases . 206 (9): 1394–1398. doi : 10.1093/infdis/jis513 . PMID 22962688.
- ^ McFaline-Figueroa JR, Wen PY (febrero de 2017). "La conexión viral con el glioblastoma". Current Infectious Disease Reports . 19 (2): 5. doi :10.1007/s11908-017-0563-z. PMID 28233187. S2CID 30446699.
- ^ El Baba R, Pasquereau S, Haidar Ahmad S, Monnien F, Abad M, Bibeau F, et al. (9 de junio de 2023). "Glioblastoma impulsado por EZH2-Myc provocado por infección por citomegalovirus de astrocitos humanos". Oncogene . 42 (24): 2031–2045. doi :10.1038/s41388-023-02709-3. PMC 10256614 . PMID 37147437.
- ^ Guyon J, Haidar Ahmad S, El Baba R, Le Quang M, Bikfalvi A, Daubon T, et al. (29 de marzo de 2024). "Generación de glioblastoma en ratones injertados con astrocitos infectados con citomegalovirus humano". Terapia génica del cáncer . 31 (7): 1070–1080. doi : 10.1038/s41417-024-00767-7 . PMC 11257955 . PMID 38553638.
- ^ Huncharek M, Kupelnick B, Wheeler L (2003). "Carne curada en la dieta y riesgo de glioma en adultos: un metaanálisis de nueve estudios observacionales". Revista de patología ambiental, toxicología y oncología . 22 (2): 129–137. doi :10.1615/JEnvPathToxOncol.v22.i2.60. PMID 14533876.
- ^ Kan P, Simonsen SE, Lyon JL, Kestle JR (enero de 2008). "Uso de teléfonos celulares y tumores cerebrales: un metaanálisis". Journal of Neuro-Oncology . 86 (1): 71–78. doi :10.1007/s11060-007-9432-1. PMID 17619826. S2CID 23460254.
- ^ Hardell L, Carlberg M, Hansson Mild K (agosto de 2009). "Evidencia epidemiológica de una asociación entre el uso de teléfonos inalámbricos y enfermedades tumorales". Fisiopatología . 16 (2–3): 113–122. doi :10.1016/j.pathophys.2009.01.003. PMID 19268551.
- ^ Zong H, Verhaak RG, Canoll P (mayo de 2012). "El origen celular del glioma maligno y perspectivas de avances clínicos". Revisión experta de diagnóstico molecular . 12 (4): 383–394. doi :10.1586/erm.12.30. PMC 3368274. PMID 22616703 .
- ^ Zong H, Parada LF, Baker SJ (enero de 2015). "Célula de origen de los gliomas malignos y su implicación en el desarrollo terapéutico". Cold Spring Harbor Perspectives in Biology . 7 (5): a020610. doi :10.1101/cshperspect.a020610. PMC 4448618 . PMID 25635044.
- ^ Seker-Polat F, Pinarbasi Degirmenci N, Solaroglu I, Bagci-Onder T (2022). "Infiltración de células tumorales en el cerebro en el glioblastoma: de los mecanismos a las perspectivas clínicas". Cánceres . 14 (2): 443. doi : 10.3390/cancers14020443 . PMC 8773542 . PMID 35053605.
- ^ Kazi AZ, Joshi PC, Kelkar AB, Mahajan MS, Ghawate AS (octubre de 2013). "Evaluación por resonancia magnética de patologías que afectan al cuerpo calloso: un ensayo ilustrado". The Indian Journal of Radiology & Imaging . 23 (4): 321–332. doi : 10.4103/0971-3026.125604 . PMC 3932574 . PMID 24604936.
- ^ Kleihues P, Burger PC, Scheithauer BW (1993). "Introducción". Tipificación histológica de tumores del sistema nervioso central . págs. 1–3. doi :10.1007/978-3-642-84988-6_1. ISBN 978-3-540-56971-8.
- ^ Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. (agosto de 2007). "La clasificación de la OMS de 2007 de tumores del sistema nervioso central". Acta Neuropathologica . 114 (2): 97–109. doi :10.1007/s00401-007-0243-4. PMC 1929165 . PMID 17618441.
- ^ Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. (junio de 2016). "La clasificación de la Organización Mundial de la Salud de 2016 de los tumores del sistema nervioso central: un resumen". Acta Neuropathologica . 131 (6): 803–820. doi : 10.1007/s00401-016-1545-1 . PMID 27157931.
- ^ Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. (agosto de 2021). "La clasificación de la OMS de 2021 de los tumores del sistema nervioso central: un resumen". Neuro-Oncology . 23 (8): 1231–1251. doi :10.1093/neuonc/noab106. PMC 8328013 . PMID 34185076.
- ^ Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. (2 de agosto de 2021). "La clasificación de la OMS de 2021 de los tumores del sistema nervioso central: un resumen". Neuro-Oncology . 23 (8): 1231–1251. doi :10.1093/neuonc/noab106. PMC 8328013 . PMID 34185076.
- ^ ab Wang Q, Hu B, Hu X, Kim H, Squatrito M, Scarpace L, et al. (julio de 2017). "La evolución tumoral de los subtipos de expresión génica intrínseca del glioma se asocia con cambios inmunológicos en el microambiente". Cancer Cell . 32 (1): 42–56.e6. doi :10.1016/j.ccell.2017.06.003. PMC 5599156 . PMID 28697342.
- ^ Hayden EC (enero de 2010). "La genómica potencia el trabajo sobre el cáncer cerebral". Nature . 463 (7279): 278. doi : 10.1038/463278a . PMID 20090720.
- ^ Sasmita AO, Wong YP, Ling AP (febrero de 2018). "Biomarcadores y avances terapéuticos en el glioblastoma multiforme". Revista de Oncología Clínica de Asia y el Pacífico . 14 (1): 40–51. doi : 10.1111/ajco.12756 . PMID 28840962.
- ^ ab Verhaak RG, Hoadley KA, Purdom E, Wang V, Qi Y, Wilkerson MD, et al. (enero de 2010). "El análisis genómico integrado identifica subtipos clínicamente relevantes de glioblastoma caracterizados por anomalías en PDGFRA, IDH1, EGFR y NF1". Cancer Cell . 17 (1): 98–110. doi :10.1016/j.ccr.2009.12.020. PMC 2818769 . PMID 20129251.
- ^ Kuehn BM (marzo de 2010). "La genómica arroja luz sobre un cáncer cerebral mortal". JAMA . 303 (10): 925–927. doi :10.1001/jama.2010.236. PMID 20215599.
- ^ Bleeker FE, Lamba S, Zanon C, Molenaar RJ, Hulsebos TJ, Troost D, et al. (septiembre de 2014). "Perfil mutacional de quinasas en glioblastoma". Cáncer BMC . 14 (1): 718. doi : 10.1186/1471-2407-14-718 . PMC 4192443 . PMID 25256166.
- ^ ab Molenaar RJ, Verbaan D, Lamba S, Zanon C, Jeuken JW, Boots-Sprenger SH, et al. (septiembre de 2014). "La combinación de mutaciones de IDH1 y el estado de metilación de MGMT predice la supervivencia en el glioblastoma mejor que IDH1 o MGMT por separado". Neuro-Oncology . 16 (9): 1263–1273. doi :10.1093/neuonc/nou005. PMC 4136888 . PMID 24510240.
- ^ abc Molenaar RJ, Radivoyevitch T, Maciejewski JP, van Noorden CJ, Bleeker FE (diciembre de 2014). "Los efectos del conductor y del pasajero de las mutaciones de la isocitrato deshidrogenasa 1 y 2 en la oncogénesis y la prolongación de la supervivencia". Biochimica et Biophysica Acta (BBA) - Reseñas sobre el cáncer . 1846 (2): 326–341. doi :10.1016/j.bbcan.2014.05.004. PMID 24880135.
- ^ Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, et al. (marzo de 2005). "Silenciamiento del gen MGMT y beneficio de la temozolomida en el glioblastoma". The New England Journal of Medicine . 352 (10): 997–1003. doi : 10.1056/NEJMoa043331 . PMID 15758010.
- ^ Furnari FB, Fenton T, Bachoo RM, Mukasa A, Stommel JM, Stegh A, et al. (noviembre de 2007). "Glioma astrocítico maligno: genética, biología y vías de tratamiento". Genes y desarrollo . 21 (21): 2683–2710. doi :10.1101/gad.1596707. PMID 17974913.
- ^ Greenberg MS (2016). Manual de neurocirugía . doi :10.1055/b-006-149702. ISBN 978-1-62623-242-6.[ página necesaria ]
- ^ Murat A, Migliavacca E, Gorlia T, Lambiv WL, Shay T, Hamou MF, et al. (junio de 2008). "Firma de "autorrenovación" relacionada con células madre y alta expresión del receptor del factor de crecimiento epidérmico asociada con la resistencia a la quimiorradioterapia concomitante en el glioblastoma". Journal of Clinical Oncology . 26 (18): 3015–3024. doi : 10.1200/JCO.2007.15.7164 . PMID 18565887.
- ^ Gilbertson RJ, Rich JN (octubre de 2007). "Creación del lecho de un tumor: células madre del glioblastoma y el nicho vascular". Nature Reviews. Cancer . 7 (10): 733–736. doi :10.1038/nrc2246. PMID 17882276. S2CID 2634215.
- ^ Brown DV, Stylli SS, Kaye AH, Mantamadiotis T (2019). "Heterogeneidad multicapa de células madre de glioblastoma: importancia biológica y clínica". Heterogeneidad de células madre en el cáncer . Avances en medicina y biología experimental. Vol. 1139. págs. 1–21. doi :10.1007/978-3-030-14366-4_1. ISBN 978-3-030-14365-7. Número de identificación personal 31134492. Número de identificación personal 167220115.
- ^ Annovazzi L, Mellai M, Schiffer D (mayo de 2017). "Medicamentos quimioterapéuticos: daño y reparación del ADN en el glioblastoma". Cánceres . 9 (6): 57. doi : 10.3390/cancers9060057 . PMC 5483876 . PMID 28587121.
- ^ Molenaar RJ (2011). "Canales iónicos en el glioblastoma". ISRN Neurology . 2011 : 590249. doi : 10.5402/2011/590249 . PMC 3263536 . PMID 22389824.
- ^ Møller HG, Rasmussen AP, Andersen HH, Johnsen KB, Henriksen M, Duroux M (febrero de 2013). "Una revisión sistemática de microARN en glioblastoma multiforme: micromoduladores en el modo mesenquimal de migración e invasión". Neurobiología molecular . 47 (1): 131–144. doi :10.1007/s12035-012-8349-7. PMC 3538124 . PMID 23054677.
- ^ Godlewski J, Nowicki MO, Bronisz A, Nuovo G, Palatini J, De Lay M, et al. (marzo de 2010). "El microARN-451 regula la señalización LKB1/AMPK y permite la adaptación al estrés metabólico en células de glioma". Molecular Cell . 37 (5): 620–632. doi :10.1016/j.molcel.2010.02.018. PMC 3125113 . PMID 20227367.
- ^ Bhaskaran V, Nowicki MO, Idriss M, Jiménez MA, Lugli G, Hayes JL, et al. (Enero de 2019). "La sinergia funcional de la agrupación de microARN proporciona una interferencia epigenética terapéuticamente relevante en el glioblastoma". Comunicaciones de la naturaleza . 10 (1): 442. Código bibliográfico : 2019NatCo..10..442B. doi :10.1038/s41467-019-08390-z. PMC 6347618 . PMID 30683859.
- ^ ab Dimberg A (diciembre de 2014). "La vasculatura del glioblastoma como objetivo para la terapia del cáncer" (PDF) . Biochemical Society Transactions . 42 (6): 1647–1652. doi :10.1042/BST20140278. PMID 25399584.
- ^ Jain RK (junio de 2013). "Normalización del microambiente tumoral para tratar el cáncer: desde el laboratorio hasta la cabecera del paciente y los biomarcadores". Journal of Clinical Oncology . 31 (17): 2205–2218. doi :10.1200/JCO.2012.46.3653. PMC 3731977 . PMID 23669226.
- ^ abcde Weller M, van den Bent M, Preusser M, Le Rhun E, Tonn JC, Minniti G, et al. (marzo de 2021). "Directrices de la EANO sobre el diagnóstico y el tratamiento de los gliomas difusos de la edad adulta". Nature Reviews. Oncología clínica . 18 (3): 170–186. doi :10.1038/s41571-020-00447-z. PMC 7904519 . PMID 33293629.
- ^ Smirniotopoulos JG, Murphy FM, Rushing EJ, Rees JH, Schroeder JW (2007). "Patrones de realce de contraste en el cerebro y las meninges". Radiographics . 27 (2): 525–551. doi :10.1148/rg.272065155. PMID 17374867.
- ^ Eibl RH, Schneemann M (febrero de 2023). "Biopsia líquida y glioblastoma". Exploración de la terapia antitumoral dirigida . 4 (1): 28–41. doi :10.37349/etat.2023.00121. PMC 10017188. PMID 36937320 .
- ^ Mo H, Magaki S, Deisch JK, Raghavan R (agosto de 2022). "Las mutaciones de la isocitrato deshidrogenasa se asocian con diferentes patrones de expresión y metilación del ADN de OLIG2 en gliomas adultos". Revista de neuropatología y neurología experimental . 81 (9): 707–716. doi :10.1093/jnen/nlac059. PMC 9614687 . PMID 35856894.
- ^ "Prevención de gliomas". The James Cancer Hospital . Universidad Estatal de Ohio . Archivado desde el original el 9 de octubre de 2021 . Consultado el 9 de octubre de 2021 .
- ^ Lawson HC, Sampath P, Bohan E, Park MC, Hussain N, Olivi A, et al. (mayo de 2007). "Quimioterapia intersticial para gliomas malignos: la experiencia de Johns Hopkins". Journal of Neuro-Oncology . 83 (1): 61–70. doi :10.1007/s11060-006-9303-1. PMC 4086528 . PMID 17171441.
- ^ Stevens GH (julio de 2006). "Terapia antiepiléptica en pacientes con neoplasias malignas del sistema nervioso central". Current Neurology and Neuroscience Reports . 6 (4): 311–318. doi :10.1007/s11910-006-0024-9. PMID 16822352. S2CID 37712742.
- ^ Das S, Marsden PA (octubre de 2013). Phimister EG (ed.). "Angiogénesis en glioblastoma". The New England Journal of Medicine . 369 (16): 1561–1563. doi :10.1056/NEJMcibr1309402. PMC 5378489 . PMID 24131182.
- ^ Lacroix M, Abi-Said D, Fourney DR, Gokaslan ZL, Shi W, DeMonte F, et al. (agosto de 2001). "Un análisis multivariado de 416 pacientes con glioblastoma multiforme: pronóstico, extensión de la resección y supervivencia". Journal of Neurosurgery . 95 (2): 190–198. doi :10.3171/jns.2001.95.2.0190. PMID 11780887.
- ^ Stummer W, Pichlmeier U, Meinel T, Wiestler OD, Zanella F, Reulen HJ (mayo de 2006). "Cirugía guiada por fluorescencia con ácido 5-aminolevulínico para la resección de gliomas malignos: un ensayo multicéntrico, controlado y aleatorizado de fase III". The Lancet. Oncología . 7 (5): 392–401. doi :10.1016/S1470-2045(06)70665-9. PMID 16648043.
- ^ Schatlo B, Fandino J, Smoll NR, Wetzel O, Remonda L, Marbacher S, et al. (diciembre de 2015). "Resultados después del uso combinado de resonancia magnética intraoperatoria y ácido 5-aminolevulínico en cirugía de glioma de alto grado". Neuro-Oncology . 17 (12): 1560–1567. doi :10.1093/neuonc/nov049. PMC 4633924 . PMID 25858636.
- ^ Rominiyi O, Collis SJ (enero de 2022). "Glioblastoma con DDRugging: comprensión y focalización de la respuesta al daño del ADN para mejorar las terapias futuras". Oncología molecular . 16 (1): 11–41. doi :10.1002/1878-0261.13020. PMC 8732357 . PMID 34036721.
- ^ Sinha R, Stephenson JM, Price SJ (marzo de 2020). "Una revisión sistemática de la función cognitiva en pacientes con glioblastoma sometidos a cirugía". Neuro-Oncology Practice . 7 (2): 131–142. doi :10.1093/nop/npz018. PMC 7318858 . PMID 32626582.
- ^ abc Pendergrass JC, Targum SD, Harrison JE (febrero de 2018). "Deterioro cognitivo asociado con el cáncer: una breve revisión". Innovaciones en neurociencia clínica . 15 (1–2): 36–44. PMC 5819720 . PMID 29497579.
- ^ Janelsins MC, Kesler SR, Ahles TA, Morrow GR (febrero de 2014). "Prevalencia, mecanismos y tratamiento del deterioro cognitivo relacionado con el cáncer". Revista Internacional de Psiquiatría . 26 (1): 102–113. doi :10.3109/09540261.2013.864260. PMC 4084673 . PMID 24716504.
- ^ ab Lange M, Joly F, Vardy J, Ahles T, Dubois M, Tron L, et al. (diciembre de 2019). "Deterioro cognitivo relacionado con el cáncer: una actualización sobre el estado del arte, la detección y las estrategias de manejo en sobrevivientes de cáncer". Anales de Oncología . 30 (12): 1925–1940. doi :10.1093/annonc/mdz410. PMC 8109411 . PMID 31617564.
- ^ Biegler KA, Chaoul MA, Cohen L (2009). "Cáncer, deterioro cognitivo y meditación". Acta Oncológica . 48 (1): 18–26. doi :10.1080/02841860802415535. PMID 19031161.
- ^ Walker MD, Alexander E, Hunt WE, MacCarty CS, Mahaley MS, Mealey J, et al. (septiembre de 1978). "Evaluación de BCNU y/o radioterapia en el tratamiento de gliomas anaplásicos. Un ensayo clínico cooperativo". Journal of Neurosurgery . 49 (3): 333–343. doi :10.3171/jns.1978.49.3.0333. PMID 355604.
- ^ Showalter TN, Andrel J, Andrews DW, Curran WJ, Daskalakis C, Werner-Wasik M (noviembre de 2007). "Glioblastoma multiforme multifocal: factores pronósticos y patrones de progresión". Revista internacional de oncología radioterápica, biología y física . 69 (3): 820–824. doi :10.1016/j.ijrobp.2007.03.045. PMID 17499453.
- ^ Fulton DS, Urtasun RC, Scott-Brown I, Johnson ES, Mielke B, Curry B, et al. (septiembre de 1992). "Aumento de la intensidad de la dosis de radiación mediante hiperfraccionamiento en pacientes con glioma maligno. Informe final de un estudio prospectivo de respuesta a la dosis de fase I-II". Journal of Neuro-Oncology . 14 (1): 63–72. doi :10.1007/BF00170946. PMID 1335044. S2CID 24245934.
- ^ Sheehan JP, Shaffrey ME, Gupta B, Larner J, Rich JN, Park DM (octubre de 2010). "Mejora de la radiosensibilidad del glioblastoma radioresistente e hipóxico". Future Oncology . 6 (10): 1591–1601. doi :10.2217/fon.10.123. PMID 21062158.
- ^ Número de ensayo clínico NCT01465347 para "Estudio de seguridad y eficacia del crocetinato de sodio trans (TSC) con radioterapia concomitante y temozolomida en glioblastoma (GBM) de diagnóstico reciente" en ClinicalTrials.gov , consultado el 1 de febrero de 2016
- ^ Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al. (Grupos de radioterapia para tumores cerebrales de la Organización Europea para la Investigación y el Tratamiento del Cáncer, Grupo de Ensayos Clínicos del Instituto Nacional del Cáncer de Canadá) (marzo de 2005). "Radioterapia más temozolomida concomitante y adyuvante para el glioblastoma". The New England Journal of Medicine . 352 (10): 987–996. doi : 10.1056/NEJMoa043330 . PMID 15758009. S2CID 41340212.
- ^ Mason WP, Mirimanoff RO, Stupp R (2006). "Radioterapia con temozolomida concurrente y adyuvante: un nuevo estándar de atención para el glioblastoma multiforme". Progreso en neuroterapia y neuropsicofarmacología . 1 : 37–52. doi :10.1017/S1748232105000054.
- ^ "La temozolomida más la radiación ayuda a combatir el cáncer cerebral – Instituto Nacional del Cáncer". Archivado desde el original el 15 de agosto de 2007. Consultado el 15 de septiembre de 2007 .
- ^ Chamberlain MC, Glantz MJ, Chalmers L, Van Horn A, Sloan AE (marzo de 2007). "Necrosis temprana después de la administración concurrente de Temodar y radioterapia en pacientes con glioblastoma". Journal of Neuro-Oncology . 82 (1): 81–83. doi :10.1007/s11060-006-9241-y. PMID 16944309. S2CID 6262668.
- ^ Dall'oglio S, D'Amico A, Pioli F, Gabbani M, Pasini F, Passarin MG, et al. (diciembre de 2008). "Intensidad de la dosis de temozolomida después de la quimiorradioterapia concurrente en gliomas de alto grado operados". Journal of Neuro-Oncology . 90 (3): 315–319. doi :10.1007/s11060-008-9663-9. PMID 18688571. S2CID 21517366.
- ^ Ameratunga M, Pavlakis N, Wheeler H, Grant R, Simes J, Khasraw M (noviembre de 2018). "Terapia antiangiogénica para glioma de alto grado". Base de datos Cochrane de revisiones sistemáticas . 2018 (11): CD008218. doi :10.1002/14651858.CD008218.pub4. PMC 6516839. PMID 30480778. El
uso de terapia antiangiogénica no mejora significativamente la supervivencia general en personas con diagnóstico reciente de glioblastoma. Por lo tanto, no hay evidencia suficiente para respaldar el uso de terapia antiangiogénica para personas con diagnóstico reciente de glioblastoma en este momento.
- ^ Hanna C, Lawrie TA, Rogozińska E, Kernohan A, Jefferies S, Bulbeck H, et al. (marzo de 2020). "Tratamiento del glioblastoma de diagnóstico reciente en ancianos: un metanálisis en red". Base de datos Cochrane de revisiones sistemáticas . 2020 (3): CD013261. doi :10.1002/14651858.cd013261.pub2. PMC 7086476. PMID 32202316 .
- ^ Habashy KJ, Mansour R, Moussalem C, Sawaya R, Massaad MJ (octubre de 2022). "Desafíos en la inmunoterapia del glioblastoma: mecanismos de resistencia y enfoques terapéuticos para superarlos". British Journal of Cancer . 127 (6): 976–987. doi :10.1038/s41416-022-01864-w. PMC 9470562 . PMID 35662275.
- ^ "La FDA aprueba la indicación ampliada de un dispositivo médico para tratar una forma de cáncer cerebral". Administración de Alimentos y Medicamentos . Archivado desde el original el 23 de marzo de 2016. Consultado el 19 de marzo de 2016 .
- ^ "Carta de aprobación de la FDA: sistema NovoTTF-100A" (PDF) . www.fda.gov . Archivado (PDF) del original el 22 de septiembre de 2015 . Consultado el 26 de diciembre de 2014 .
- ^ Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, et al. (diciembre de 2015). "Terapia de mantenimiento con campos de tratamiento tumoral más temozolomida frente a temozolomida sola para el glioblastoma: un ensayo clínico aleatorizado". JAMA . 314 (23): 2535–2543. doi : 10.1001/jama.2015.16669 . PMID 26670971.
- ^ ab Sampson JH (diciembre de 2015). "Campos eléctricos alternos para el tratamiento del glioblastoma". JAMA . 314 (23): 2511–2513. doi :10.1001/jama.2015.16701. PMID 26670969.
- ^ Wick W (marzo de 2016). "TTFields: ¿de dónde viene todo el escepticismo?". Neuro-Oncology . 18 (3): 303–305. doi :10.1093/neuonc/now012. PMC 4767251 . PMID 26917587.
- ^ Rominiyi O, Vanderlinden A, Clenton SJ, Bridgewater C, Al-Tamimi Y, Collis SJ (febrero de 2021). "Campos de tratamiento tumoral: terapia para el glioblastoma: avances actuales y direcciones futuras". British Journal of Cancer . 124 (4): 697–709. doi :10.1038/s41416-020-01136-5. PMC 7884384 . PMID 33144698.
- ^ Grochans S, Cybulska AM, Simińska D, Korbecki J, Kojder K, Chlubek D, et al. (mayo de 2022). "Epidemiología del glioblastoma multiforme: revisión de la literatura". Cánceres . 14 (10): 2412. doi : 10.3390/cancers14102412 . PMC 9139611 . PMID 35626018.
- ^ Koshy M, Villano JL, Dolecek TA, Howard A, Mahmood U, Chmura SJ, et al. (marzo de 2012). "Tendencias de tiempo de supervivencia mejoradas para glioblastoma utilizando los registros poblacionales SEER 17". Journal of Neuro-Oncology . 107 (1): 207–212. doi :10.1007/s11060-011-0738-7. PMC 4077033 . PMID 21984115.
- ^ Smoll NR, Schaller K, Gautschi OP (mayo de 2013). "Supervivencia a largo plazo de pacientes con glioblastoma multiforme (GBM)". Revista de neurociencia clínica . 20 (5): 670–675. doi :10.1016/j.jocn.2012.05.040. PMID 23352352. S2CID 5088829.
- ^ Caruso R, Pesce A, Wierzbicki V (20 de febrero de 2017). "Informe de un caso muy raro de supervivencia a largo plazo: un paciente operado en 1994 de glioblastoma multiforme y que actualmente se encuentra en perfecto estado de salud". International Journal of Surgery Case Reports . 33 : 41–43. doi :10.1016/j.ijscr.2017.02.025. PMC 5338899 . PMID 28273605.
- ^ ab Smoll NR, Schaller K, Gautschi OP (2012). "La fracción de curación del glioblastoma multiforme". Neuroepidemiología . 39 (1): 63–69. doi : 10.1159/000339319 . PMID 22776797.
- ^ abc Krex D, Klink B, Hartmann C, von Deimling A, Pietsch T, Simon M, et al. (octubre de 2007). "Supervivencia a largo plazo con glioblastoma multiforme". Brain . 130 (Pt 10): 2596–2606. doi : 10.1093/brain/awm204 . PMID 17785346.
- ^ Martinez R, Schackert G, Yaya-Tur R, Rojas-Marcos I, Herman JG, Esteller M (mayo de 2007). "Hipermetilación frecuente del gen de reparación del ADN MGMT en sobrevivientes a largo plazo del glioblastoma multiforme". Journal of Neuro-Oncology . 83 (1): 91–93. doi :10.1007/s11060-006-9292-0. PMID 17164975. S2CID 34370292.
- ^ "Neurooncología de la Universidad de California en Los Ángeles: cómo se desempeñan nuestros pacientes: glioblastoma multiforme [GBM]". Archivado desde el original el 9 de junio de 2012.. Neurooncology.ucla.edu. Recuperado el 19 de octubre de 2010.
- ^ Shaw EG, Seiferheld W, Scott C, Coughlin C, Leibel S, Curran W, et al. (2003). "Reexaminando el análisis de partición recursiva (RPA) del grupo de oncología radioterapéutica (RTOG) para pacientes con glioblastoma multiforme (GBM)". Revista internacional de oncología radioterapéutica, biología y física . 57 (2): S135–36. doi : 10.1016/S0360-3016(03)00843-5 .
- ^ Xu H, Chen J, Xu H, Qin Z (2017). "Variaciones geográficas en la incidencia del glioblastoma y factores pronósticos predictivos de supervivencia general en adultos estadounidenses de 2004 a 2013". Frontiers in Aging Neuroscience . 9 : 352. doi : 10.3389/fnagi.2017.00352 . PMC 5681990 . PMID 29163134.
- ^ Philips A, Henshaw DL, Lamburn G, O'Carroll MJ (2018). "Tumores cerebrales: el aumento de la incidencia del glioblastoma multiforme en Inglaterra entre 1995 y 2015 sugiere un factor ambiental o de estilo de vida adverso". Journal of Environmental and Public Health . 2018 : 7910754. doi : 10.1155/2018/7910754 . PMC 6035820 . PMID 30034480.
- ^ Siegel DA, Li J, Henley SJ, Wilson RJ, Lunsford NB, Tai E, et al. (junio de 2018). "Variación geográfica en la incidencia del cáncer pediátrico: Estados Unidos, 2003-2014". MMWR. Informe semanal de morbilidad y mortalidad . 67 (25): 707–713. doi :10.15585/mmwr.mm6725a2. PMC 6023185. PMID 29953430 .
- ^ Bailey & Cushing: Tumores del grupo de los gliomas . JB Lippincott, Filadelfia, 1926. [ página necesaria ]
- ^ Rajesh Y, Pal I, Banik P, Chakraborty S, Borkar SA, Dey G, et al. (mayo de 2017). "Perspectivas sobre la terapia molecular del glioma: desafíos actuales y plan de próxima generación". Acta Pharmacologica Sinica . 38 (5): 591–613. doi :10.1038/aps.2016.167. PMC 5457688 . PMID 28317871.
- ^ Tobias A, Ahmed A, Moon KS, Lesniak MS (febrero de 2013). "El arte de la terapia génica para el glioma: una revisión del difícil camino hacia la cabecera del paciente". Revista de neurología, neurocirugía y psiquiatría . 84 (2): 213–222. doi :10.1136/jnnp-2012-302946. PMC 3543505 . PMID 22993449.
- ^ Fulci G, Chiocca EA (febrero de 2007). "El estado de la terapia génica para tumores cerebrales". Opinión de expertos sobre terapia biológica . 7 (2): 197–208. doi :10.1517/14712598.7.2.197. PMC 2819130 . PMID 17250458.
- ^ Borchers A, Pieler T (noviembre de 2010). "Programación de células precursoras pluripotentes derivadas de embriones de Xenopus para generar tejidos y órganos específicos". Genes . 1 (3). MDPI AG: 413–426. doi : 10.3390/chemosensors8040117 . PMC 3966229 . PMID 24710095.
- ^ Wu SQ, Yang CX, Yan XP (marzo de 2017). "Un nanocompuesto persistentemente luminiscente de doble función permite la ingeniería de células madre mesenquimales para la localización y la terapia génica del glioblastoma". Materiales funcionales avanzados . 27 (11): 1604992. doi :10.1002/adfm.201604992. S2CID 99147218.
- ^ Hossain JA, Marchini A, Fehse B, Bjerkvig R, Miletic H (1 de enero de 2020). "Terapia génica suicida para el tratamiento del glioma de alto grado: lecciones pasadas, tendencias actuales y perspectivas futuras". Avances en neurooncología . 2 (1): vdaa013. doi :10.1093/noajnl/vdaa013. PMC 7212909 . PMID 32642680.
- ^ Suryawanshi YR, Schulze AJ (julio de 2021). "Virus oncolíticos para el glioma maligno: ¿al borde del éxito?". Viruses . 13 (7): 1294. doi : 10.3390/v13071294 . PMC 8310195 . PMID 34372501.
- ^ ab van Woensel M, Wauthoz N, Rosière R, Amighi K, Mathieu V, Lefranc F, et al. (agosto de 2013). "Formulaciones para administración intranasal de agentes farmacológicos para combatir enfermedades cerebrales: ¿una nueva oportunidad para abordar el GBM?". Cánceres . 5 (3): 1020–1048. doi : 10.3390/cancers5031020 . PMC 3795377 . PMID 24202332.
- ^ Pardeshi CV, Belgamwar VS (julio de 2013). "Administración directa de fármacos desde la nariz al cerebro a través de vías nerviosas integradas que evitan la barrera hematoencefálica: una excelente plataforma para la focalización cerebral". Opinión de expertos sobre administración de fármacos . 10 (7): 957–972. doi :10.1517/17425247.2013.790887. PMID 23586809. S2CID 8020921.
- ^ Peterson A, Bansal A, Hofman F, Chen TC, Zada G (febrero de 2014). "Una revisión sistemática de la terapia intranasal inhalada para neoplasias del sistema nervioso central: una opción terapéutica emergente". Journal of Neuro-Oncology . 116 (3): 437–446. doi :10.1007/s11060-013-1346-5. PMID 24398618. S2CID 2414770.
- ^ Chen TC, Fonseca CO, Schönthal AH (2015). "Desarrollo preclínico y uso clínico del alcohol perílico para la quimioprevención y la terapia del cáncer". Revista estadounidense de investigación sobre el cáncer . 5 (5): 1580–1593. PMC 4497427 . PMID 26175929.
- ^ Número de ensayo clínico NCT02704858 para "Estudio de seguridad y eficacia en glioma recurrente de grado IV" en ClinicalTrials.gov
Enlaces externos
- Información sobre el glioblastoma Archivado el 5 de febrero de 2024 en Wayback Machine de la Asociación Estadounidense de Tumores Cerebrales

.jpg/440px-Glioblastoma_(1).jpg)

