Cloruro de cromo (III)
-chloride-purple-anhydrous-sunlight.jpg/440px-Chromium(III)-chloride-purple-anhydrous-sunlight.jpg) Anhidro | |
 Hexahidrato | |
| Nombres | |
|---|---|
Nombre IUPAC
| |
| Otros nombres Cloruro crómico | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos |
|
| Tarjeta informativa de la ECHA | 100.030.023 |
| 1890 130477 532690 | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CrCl3 | |
| Masa molar | 158,36 g/mol (anhidro) 266,45 g/mol (hexahidrato) [1] |
| Apariencia | Púrpura (anhidro), verde oscuro (hexahidrato) |
| Densidad | 2,87 g/cm 3 (anhidro) 1,760 g/cm 3 (hexahidrato) |
| Punto de fusión | 1.152 °C (2.106 °F; 1.425 K) (anhidro) 81 °C (hexahidrato) [2] |
| Punto de ebullición | 1.300 °C (2.370 °F; 1.570 K) se descompone |
| ligeramente soluble (anhidro) 585 g/L (hexahidrato) | |
| Solubilidad | insoluble en etanol insoluble en éter , acetona |
| Acidez (p K a ) | 2.4 (solución 0,2 M) |
| +6890,0·10 −6 cm3 / mol | |
| Estructura | |
| Estructura del YCl3 | |
| Octaédrico | |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H302 , H314 , H411 | |
| P260 , P264 , P270 , P273 , P280 , P301+P312 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P330 , P363 , P391 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 1870 mg/kg (oral, rata) [4] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 1 mg/m3 [ 3] |
REL (recomendado) | Valor de exposición promedio ponderado (TWA) 0,5 mg/m3 [ 3] |
IDLH (Peligro inmediato) | 250 mg/m3 [ 3] |
| Ficha de datos de seguridad (FDS) | ICSC 1316 (anhidro) ICSC 1532 (hexahidrato) |
| Compuestos relacionados | |
Otros aniones | |
Otros cationes | |
Compuestos relacionados | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de cromo (III) (también llamado cloruro crómico ) es un compuesto químico inorgánico con la fórmula química Cr Cl 3 . Forma varios hidratos con la fórmula CrCl 3 · n H 2 O , entre los que se encuentran los hidratos donde n puede ser 5 (cloruro de cromo (III) pentahidrato CrCl 3 · 5H 2 O ) o 6 (cloruro de cromo (III) hexahidrato CrCl 3 · 6H 2 O ). El compuesto anhidro con la fórmula CrCl 3 son cristales violetas , mientras que la forma más común del cloruro de cromo (III) son los cristales verde oscuro de hexahidrato, CrCl 3 · 6H 2 O . Los cloruros de cromo encuentran uso como catalizadores y como precursores de tintes para lana.
Estructura
El cloruro de cromo (III) anhidro adopta la estructura YCl 3 , [6] con Cr 3+ ocupando un tercio de los intersticios octaédricos en capas alternas de una red compacta pseudocúbica de iones Cl − . La ausencia de cationes en capas alternas conduce a una unión débil entre capas adyacentes. Por esta razón, los cristales de CrCl 3 se escinden fácilmente a lo largo de los planos entre capas, lo que da como resultado la apariencia escamosa ( micácea ) de las muestras de cloruro de cromo (III). [7] [8] El CrCl 3 anhidro es exfoliable hasta el límite de monocapa. [6] Si se presuriza a 9,9 GPa , sufre una transición de fase. [9]
- Modelo de relleno espacial de empaquetamiento cúbico cerrado de iones cloruro en la estructura cristalina de CrCl 3
- Modelo de bolas y palos de parte de una capa
- Apilamiento de capas
Hidratos de cloruro de cromo (III)
Los cloruros de cromo(III) hidratados presentan la propiedad algo inusual de existir en varias formas químicas distintas (isómeros), que difieren en términos del número de aniones cloruro que están coordinados con Cr(III) y el agua de cristalización . Las diferentes formas existen tanto como sólidos como en soluciones acuosas . Se conocen varios miembros de la serie de [CrCl 3− q (H 2 O) n ] q + . El hexahidrato común se puede describir con mayor precisión como [CrCl 2 (H 2 O) 4 ]Cl·2H 2 O . Consiste en el catión trans - [CrCl 2 (H 2 O) 4 ] + y moléculas adicionales de agua y un anión cloruro en la red. [10] Se conocen otros dos hidratos, el verde pálido [CrCl(H 2 O) 5 ]Cl 2 ·H 2 O y el violeta [Cr(H 2 O) 6 ]Cl 3 . Se observa una isomería de hidratación similar con otros compuestos de cromo (III). [ cita requerida ]
Preparación
El cloruro de cromo (III) anhidro se puede preparar mediante cloración del metal cromo directamente, o indirectamente mediante cloración carbotérmica del óxido de cromo (III) a 650–800 °C [11] [12]
- Cr 2 O 3 + 3 C + 3 Cl 2 → 2 CrCl 3 + 3 CO
Los cloruros hidratados se preparan mediante el tratamiento del cromato con ácido clorhídrico y metanol acuoso.
Reacciones
Las velocidades de reacción lentas son comunes con los complejos de cromo (III). La baja reactividad del ion d 3 Cr 3+ se puede explicar utilizando la teoría del campo cristalino . Una forma de abrir CrCl 3 a la sustitución en solución es reducir incluso una cantidad traza a CrCl 2 , por ejemplo utilizando zinc en ácido clorhídrico . Este compuesto de cromo (II) sufre sustitución fácilmente y puede intercambiar electrones con CrCl 3 a través de un puente de cloruro , lo que permite que todo el CrCl 3 reaccione rápidamente. Con la presencia de algo de cromo (II), el CrCl 3 sólido se disuelve rápidamente en agua. De manera similar, las reacciones de sustitución de ligando de soluciones de [CrCl 2 (H 2 O) 4 ] + se aceleran con catalizadores de cromo (II).
Con cloruros de metales alcalinos fundidos como el cloruro de potasio , CrCl 3 da sales del tipo M 3 [CrCl 6 ] y K 3 [Cr 2 Cl 9 ] , que también es octaédrico pero donde los dos cromos están unidos a través de tres puentes de cloruro.
El hexahidrato también se puede deshidratar con cloruro de tionilo : [13]
- CrCl 3 ·6H 2 O + 6 SOCl 2 → CrCl 3 + 6 SO 2 + 12 HCl
Complejos con ligandos orgánicos
El CrCl 3 es un ácido de Lewis , clasificado como "duro" según la teoría de ácido-base duro-blando . Forma una variedad de aductos del tipo [CrCl 3 L 3 ] q + , donde L es una base de Lewis . Por ejemplo, reacciona con piridina ( C 5 H 5 N ) para formar el complejo de piridina :
- CrCl 3 + 3 C 5 H 5 N → CrCl 3 (C 5 H 5 N) 3
El tratamiento con cloruro de trimetilsililo en THF produce el complejo de THF anhidro: [14]
- CrCl 3 ·6H 2 O + 12 (CH 3 ) 3 SiCl → CrCl 3 (THF) 3 + 6 ((CH 3 ) 3 Si) 2 O + 12 HCl
Precursor de complejos organocromáticos
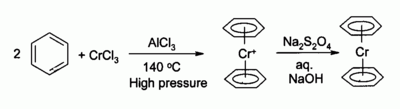
El cloruro de cromo (III) se utiliza como precursor de muchos compuestos organocromados , por ejemplo el bis(benceno)cromo , un análogo del ferroceno :
Los complejos de fosfina derivados de CrCl 3 catalizan la trimerización de etileno a 1-hexeno . [15] [16]
Uso en síntesis orgánica
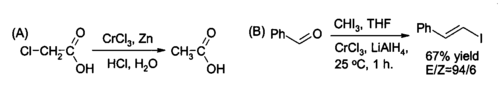
Un uso específico del CrCl 3 en la síntesis orgánica es la preparación in situ de cloruro de cromo (II) , un reactivo para la reducción de haluros de alquilo y para la síntesis de haluros de ( E )-alquenilo. La reacción se realiza habitualmente utilizando dos moles de CrCl 3 por mol de hidruro de litio y aluminio , aunque si las condiciones ácidas acuosas son adecuadas, el cinc y el ácido clorhídrico pueden ser suficientes.
El cloruro de cromo (III) también se ha utilizado como ácido de Lewis en reacciones orgánicas, por ejemplo para catalizar la reacción nitroso-Diels-Alder . [17]
Colorantes
En el mercado se utilizan para la lana diversos colorantes que contienen cromo. Los más habituales son los triarilmetanos , que están compuestos por derivados del ácido ortohidroxibenzoico. [18]
Precauciones
Aunque el cromo trivalente es mucho menos venenoso que el hexavalente , las sales de cromo generalmente se consideran tóxicas.
Referencias
- ^ "Sublimación de cloruro de cromo (III), 99 10025-73-7".
- ^ "Cloruro de cromo (III) hexahidrato Technipur™ | Sigma-Aldrich" . Consultado el 16 de agosto de 2022 .
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0141". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Compuestos de cromo (III) [como Cr (III)]". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Hoja de datos de seguridad de productos químicos Cameo
- ^ ab Kazim, S; Ali, M; Palleschi, S; D'Olimpio, G; Mastrippolito, D; Politano, A; Gunella, R; Di Cicco, A; Renzelli, M; Moccia, G; Cacioppo, OA; Alfonsetti, R; Strychalska-Nowak, J; Klimczuk, T; J Cava, R (6 de julio de 2020). "Exfoliación mecánica e identificación del número de capa de CrCl3 monoclínico monocristalino". Nanotecnología . 31 (39): 395706. doi : 10.1088/1361-6528/ab7de6. hdl : 11581/438597 . ISSN 0957-4484.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 1020. ISBN 978-0-08-037941-8.
- ^ AF Wells, Química inorgánica estructural , 5.ª ed., Oxford University Press, Oxford, Reino Unido, 1984.
- ^ Meiling Hong (2022). "Transición de fase estructural inducida por presión y metalización de CrCl3 en diferentes entornos hidrostáticos hasta 50,0 GPa". Inorg. Chem . 61 (12): 4852–4864. doi :10.1021/acs.inorgchem.1c03486. PMID 35289613. S2CID 247452267.
- ^ Ian G. Dance, Hans C. Freeman "La estructura cristalina del cloruro de diclorotetraaquocromo (III) dihidrato: hidratación primaria y secundaria de iones metálicos" Inorganic Chemistry 1965, volumen 4, 1555–1561. doi :10.1021/ic50033a006
- ^ D. Nicholls, Complejos y elementos de transición de primera fila , Macmillan Press, Londres, 1973.
- ^ Brauer, Georg (1965) [1962]. Handbuch Der Präparativen Anorganischen Chemie [ Manual de química inorgánica preparativa ] (en alemán). vol. 2.Stuttgart; Nueva York, Nueva York: Ferdinand Enke Verlag; Prensa académica, Inc. pág. 1340.ISBN 978-0-32316129-9. Recuperado el 10 de enero de 2014 .
- ^ Pray, AP (1990). "Cloruros metálicos anhidros". Síntesis inorgánica . Síntesis inorgánica. Vol. 28. págs. 321-2. doi :10.1002/9780470132401.ch36. ISBN 9780470132401.
- ^ Boudjouk, Philip; So, Jeung-Ho (1992). "Cloruros metálicos anhidros solvatados y no solvatados a partir de hidratos de cloruro metálico". Síntesis inorgánica . Síntesis inorgánica. Vol. 29. págs. 108-111. doi :10.1002/9780470132609.ch26. ISBN 9780470132609.
- ^ John T. Dixon, Mike J. Green, Fiona M. Hess, David H. Morgan "Avances en la trimerización selectiva de etileno: una visión crítica" Journal of Organometallic Chemistry 2004, Volumen 689, págs. 3641-3668. doi :10.1016/j.jorganchem.2004.06.008
- ^ Feng Zheng, Akella Sivaramakrishna, John R. Moss "Estudios térmicos sobre metalocicloalcanos" Coordination Chemistry Reviews 2007, Volumen 251, 2056-2071. doi :10.1016/j.ccr.2007.04.008
- ^ Calvet, G.; Dussaussois, M.; Blanchard, N.; Kouklovsky, C. (2004). "Cicloadición de hetero-Diels-Alder de dienófilos α-acetoxinitroso promovida por ácido Lewis". Organic Letters . 6 (14): 2449–2451. doi :10.1021/ol0491336. PMID 15228301.
- ^ Thomas Gessner y Udo Mayer "Tintes de triarilmetano y diarilmetano" en la Enciclopedia de química industrial de Ullmann 2002, Wiley-VCH , Weinheim. doi :10.1002/14356007.a27_179
Lectura adicional
- Manual de química y física , 71.a edición, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index , 7ª edición, Merck & Co, Rahway, Nueva Jersey, EE. UU., 1960.
- J. March, Química orgánica avanzada , 4ª ed., pág. 723, Wiley, Nueva York, 1992.
- K. Takai, en Manual de reactivos para síntesis orgánica, volumen 1: reactivos, auxiliares y catalizadores para la formación de enlaces CC , (RM Coates, SE Dinamarca, eds.), págs. 206-211, Wiley, Nueva York, 1999.
Enlaces externos
- Ficha internacional de seguridad química 1316 ( CrCl3 anhidro )
- Ficha internacional de seguridad química 1532 ( CrCl3 · 6H2O )
- Inventario Nacional de Contaminantes – Hoja informativa sobre compuestos de cromo (III)
- Guía de bolsillo del NIOSH sobre peligros químicos
- Monografía del IARC "Cromo y compuestos de cromo"