Química del organopaladio
La química del organopaladio es una rama de la química organometálica que se ocupa de los compuestos orgánicos de paladio y sus reacciones. El paladio se utiliza a menudo como catalizador en la reducción de alquenos y alquinos con hidrógeno . Este proceso implica la formación de un enlace covalente paladio-carbono . El paladio también es importante en las reacciones de acoplamiento carbono-carbono , como se demuestra en las reacciones en tándem . [1]
Cronología de la química del organopaladio
- 1873 - AN Zaitsev informa sobre la reducción de benzofenona sobre paladio con hidrógeno.
- 1894 - Phillips informa que el cloruro de paladio (II) se reduce a paladio metálico por contacto con etileno . [2]
- 1907 - La tecnología de autoclave introducida por Vladimir Ipatieff permite realizar la hidrogenación a alta presión.
- 1956 - En el proceso Wacker, el etileno y el oxígeno reaccionan para formar acetaldehído con el catalizador PdCl 2 /CuCl 2
- 1957 - Malatesta y Angoletta informan sobre el tetrakis(trifenilfosfina)paladio(0).
- 1972 - La reacción de Heck es una reacción de acoplamiento de un haluro con una olefina. Están implicados intermediarios de Pd(0).
- 1973 - La alquilación alílica asimétrica de Trost es una sustitución nucleofílica .
- 1975 - El acoplamiento Sonogashira es una reacción de acoplamiento de alquinos terminales con haluros de arilo o vinilo.
- 1994 - La aminación de Buchwald-Hartwig catalizada por Pd para reacciones de formación de enlaces CN.
sample.jpg/440px-PdCl2(cod)sample.jpg)
Paladio (II)
Complejos de alquenos
A diferencia del Ni(II), pero similares al Pt(II), los haluros de Pd(II) forman una variedad de complejos de alquenos. El principal ejemplo es el dicloro(1,5‐ciclooctadieno)paladio . En este complejo, el dieno se desplaza fácilmente, lo que lo convierte en un precursor favorito para los catalizadores. En el proceso Wacker , de importancia industrial , el etileno se convierte en acetaldehído mediante un ataque nucleofílico del hidróxido sobre un intermediario de Pd(II)-etileno seguido de la formación de un complejo de alcohol vinílico. Los ligandos de fulereno también se unen con el paladio(II).

El acetato de paladio (II) y los compuestos relacionados son reactivos comunes porque los carboxilatos son buenos grupos salientes con propiedades básicas. Por ejemplo, se ha demostrado que el trifluoroacetato de paladio es eficaz en la descarboxilación aromática : [3]
Complejos alílicos
El complejo icónico de esta serie es el dímero de cloruro de alilpaladio (APC). Los compuestos alílicos con grupos salientes adecuados reaccionan con sales de paladio (II) para formar complejos pi-alílicos que tienen una hapticidad de 3. Estos intermediarios también reaccionan con nucleófilos, por ejemplo, carbaniones derivados de ésteres de malonato [4] o con aminas en aminación alílica [5], como se muestra a continuación [6].
Los intermedios de alilpaladio también aparecen en la alquilación alílica asimétrica de Trost y en el reordenamiento de Carroll y en una variación oxo en la oxidación de Saegusa .
Complejos de paladio-carbono con enlaces sigma
Varios grupos orgánicos pueden unirse al paladio y formar complejos estables con enlaces sigma. La estabilidad de los enlaces en términos de energía de disociación de enlace sigue la tendencia: Pd-Alquinilo > Pd-Vinilo ≈ Pd-Arilo > Pd-Alquilo y la longitud del enlace metal-carbono cambia en la dirección opuesta: Pd-Alquinilo < Pd-Vinilo ≈ Pd-Arilo < Pd-Alquilo. [7]
Compuestos de paladio(0)
Los compuestos de Pd(0) de valencia cero incluyen tris(dibencilidenoacetona)dipaladio(0) y tetrakis(trifenilfosfina)paladio(0) . Estos complejos reaccionan con el halocarbono RX en adición oxidativa a intermediarios R-Pd-X con enlaces covalentes Pd-C. Esta química forma la base de una gran clase de reacciones orgánicas llamadas reacciones de acoplamiento (ver reacciones de acoplamiento catalizadas por paladio ). Un ejemplo es la reacción de Sonogashira :
Organopaladio (IV)
El primer compuesto de organopaladio (IV) se describió en 1986. Este complejo es Me 3 Pd(IV)(I)bpy (bpy = ligando bidentado 2,2'-bipiridina ) [8] Se sintetizó por adición oxidativa de yoduro de metilo a Me 2 Pd(II)bpy.
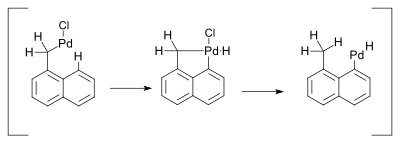
Los compuestos de paladio deben su reactividad a la facilidad de interconversión entre los intermediarios Pd(0) y paladio(II). Sin embargo, no hay evidencia concluyente de la participación de las conversiones de Pd(II) a Pd(IV) en las reacciones organometálicas mediadas por paladio. [9] Una reacción que invoca dicho mecanismo fue descrita en 2000 y se refería a una reacción de Heck . Esta reacción estuvo acompañada por un desplazamiento de 1,5-hidrógeno en presencia de aminas: [10]
Se consideró que el cambio de hidruro se produciría a través de un metalociclo de Pd(IV) :
En un trabajo relacionado, el intermediario asociado con el desplazamiento del hidruro sigue siendo Pd(II): [11]
y en otro trabajo (una nueva síntesis de indoles con dos migraciones de Pd) se postulan equilibrios entre diferentes paladaciclos: [12] [13]
y en ciertos acoplamientos intramoleculares se demostró valor sintético independientemente del estado de oxidación: [14]
Véase también
Referencias
- ^ Manual de química del organopaladio para síntesis orgánica Ei-Negishi John Wiley (2002) ISBN 0-471-31506-0
- ^ Phillips, FC; Revista de Química Am. 1894, 16, 255.
- ^ Joshua S. Dickstein; Carol A. Mulrooney; Erin M. O'Brien; Barbara J. Morgan y Marisa C. Kozlowski (2007). "Desarrollo de una reacción catalítica de descarboxilación aromática". Org. Lett. 9 (13): 2441–2444. doi :10.1021/ol070749f. PMID 17542594.
- ^ Jan-E. Bäckvall y Jan O. Vågberg (1993). "Funcionalizaciones estereoselectivas 1,4 de dienos conjugados: cis- y trans-1-acetoxi-4-(dicarbometoximetil)-2-ciclohexeno". Síntesis orgánicas; Volúmenes recopilados , vol. 8, pág. 5.
- ^ Igor Dubovyk; Iain DG Watson y Andrei K. Yudin (2007). "En busca del protón culpable de la aminación alílica catalizada por paladio". J. Am. Chem. Soc. 129 (46): 14172–14173. doi :10.1021/ja076659n. PMID 17960935.
- ^ Reactivos: ligando de fosfito de trietilo , DBU (se informa que absorbe los protones de amina que de otro modo desencadenarían la isomerización) en THF
- ^ VP Ananikov et al., Organometálicos, 2005, 24, 715 doi :10.1021/om0490841
- ^ Peter K. Byers; Allan J. Canty; Brian W. Skelton; Allan H. White (1986). "La adición oxidativa de yodometano a [PdMe2(bpy)] y la estructura de rayos X del producto de organopaladio(IV) fac-[PdMe3(bpy)l](bpy = 2,2-bipiridilo)". Química Común. (23): 1722–1724. doi :10.1039/C39860001722.
- ^ Antonio J. Mota y Alain Dedieu (2007). "Reordenamiento intramolecular de paladio a través del espacio en complejos de arilo sustituido: estudio teórico del proceso de migración de arilo a alquilpaladio". J. Org. Chem. 72 (25): 9669–9678. doi :10.1021/jo701701s. PMID 18001098.
- ^ Liansheng Wang; Yi Pan; Xin Jiang; Hongwen Hu (2000). "Reacción catalizada por paladio de α-clorometilnaftaleno con olefinas". Tetrahedron Letters . 41 (5): 725–727. doi :10.1016/S0040-4039(99)02154-1.
- ^ Activación de CH y migración de paladio en biarilos en condiciones de reacción de Heck Gunter Karig, Maria-Teresa Moon, Nopporn Thasana y Timothy Gallagher Org. Lett., Vol. 4, No. 18, 2002 3116 doi :10.1021/ol026426v
- ^ Síntesis de carbazoles sustituidos mediante una migración de vinílico a aril paladio que implica procesos de activación de CH dominó Jian Zhao y Richard C. Larock Org. Lett. , Vol. 7, No. 4, 701 2005 doi :10.1021/ol0474655
- ^ Reactivos: difenilacetileno , acetato de paladio , bis(difenilfosfino)metano (dppm) y la sal de cesio del ácido piválico (CsPiv)
- ^ Migración y ciclización de alquilo a arilo catalizada por Pd: una síntesis eficiente de policiclos fusionados mediante la activación de múltiples CH Qinhua Huang, Alessia Fazio, Guangxiu Dai, Marino A. Campo y Richard C. Larock J. Am. Chem. Soc. 2004 , 126, 7460-7461 doi :10.1021/ja047980y