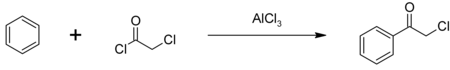Cloruro de fenacilo
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 2-Cloro-1-feniletan-1-ona | |
| Otros nombres 2-Cloro-1-feniletanona α-Cloroacetofenona 2-Cloroacetofenona Clorometilfenilcetona Fenilclorometilcetona CN Gas supurante [1] Mace | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.007.757 |
| |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C8H7ClO | |
| Masa molar | 154,59 g·mol −1 |
| Apariencia | Sólido cristalino de color blanco a gris [2] |
| Olor | picante e irritante [2] |
| Densidad | 1,324 g/ cm3 |
| Punto de fusión | 54 a 56 °C (129 a 133 °F; 327 a 329 K) |
| Punto de ebullición | 244,5 °C (472,1 °F; 517,6 K) |
| insoluble | |
| Presión de vapor | 0,005 mmHg (20 °C) [2] |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Combustible [2] |
| Etiquetado SGA : [4] | |
   | |
| Peligro | |
| H300 , H311+H331 , H315 , H318 , H334 , H335 | |
| P280 , P301+P310+P330 , P302+P352+P312 , P304+P340+P311 , P305+P351+P338+P310 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 88 °C (190 °F; 361 K) |
| Dosis o concentración letal (LD, LC): | |
LC Lo ( valor más bajo publicado ) | 417 mg/ m3 (rata, 15 min) 600 mg/ m3 (ratón, 15 min) 465 mg/ m3 (conejo, 20 min) 490 mg/ m3 (conejillo de indias, 30 min) 159 mg/m3 ( humano, 20 min) 850 mg/ m3 (humano, 10 min) [3] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 0,3 mg/m3 ( 0,05 ppm) [2] |
REL (recomendado) | TWA 0,3 mg/m3 ( 0,05 ppm) [2] |
IDLH (Peligro inmediato) | 15 mg/m3 [ 2] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de fenacilo , también conocido comúnmente como cloroacetofenona , es una acetofenona sustituida . Es un componente básico útil en la química orgánica . Aparte de eso, se ha utilizado históricamente como agente de control de disturbios , donde se designa CN . [5] No debe confundirse con el cianuro , otro agente utilizado en la guerra química, que tiene la estructura química CN − . La cloroacetofenona es térmicamente estable y es el único agente lacrimógeno que se puede destilar en condiciones ambientales.
Preparación
La cloroacetofenona fue sintetizada por primera vez por Graebe en 1871 al pasar cloro en acetofenona hirviendo . [6]
El cloruro de fenacilo está fácilmente disponible y se preparó por primera vez mediante cloración de vapor de acetofenona . [7] También se puede sintetizar mediante la acilación de Friedel-Crafts de benceno usando cloruro de cloroacetilo , con un catalizador de cloruro de aluminio : [8]
Agente antidisturbios
Fue investigado, pero no utilizado, durante la Primera y la Segunda Guerra Mundial (fue utilizado como "agente verde" por el antiguo ejército japonés durante la guerra chino-japonesa).
Debido a la toxicidad significativamente mayor del CN, [9] el CN ha sido reemplazado en gran medida por el gas CS para uso militar . Aunque el CN todavía se suministra a las fuerzas paramilitares y policiales en un pequeño aerosol presurizado conocido como “ Mace ” o gas lacrimógeno , el uso del CN está disminuyendo porque el gas pimienta funciona y se dispersa más rápidamente que el CN y es menos tóxico que este último.
El término "Mace" surgió porque fue la marca inventada por uno de los primeros fabricantes estadounidenses de aerosoles de gas lacrimógeno. Posteriormente, en los Estados Unidos, Mace se convirtió en sinónimo de aerosoles de gas lacrimógeno, de la misma manera que Kleenex se ha asociado fuertemente con los pañuelos faciales (un fenómeno conocido como marca comercial genérica ).
Al igual que el gas CS, este compuesto irrita las mucosas (oral, nasal, conjuntival y traqueobronquial ). En ocasiones puede dar lugar a reacciones más generalizadas como síncope , pérdida temporal del equilibrio y de la orientación. [9] Más raramente, se han observado brotes irritativos cutáneos y dermatitis alérgica de contacto permanente . [5]
En altas concentraciones, el CN puede causar daño epitelial corneal y quemosis . También ha sido responsable de al menos cinco muertes, que se han producido por lesión pulmonar y/o asfixia . [10]
El canal iónico TRPA1 (Transient Receptor Potential-Ankyrin 1) expresado en los nociceptores (especialmente el trigémino ) se ha implicado como el sitio de acción de CN, in vivo e in vitro. [11] [12]
Referencias
- ^ Verma, KS Cengage Química física Parte 1 Archivado el 6 de mayo de 2021 en Wayback Machine , Ilustración 5.65
- ^ abcdefg Guía de bolsillo del NIOSH sobre peligros químicos. "#0119". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "alfa-cloroacetofenona". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ GHS: GESTIS 037810
- ^ ab Treudler, R.; Tebbe, B.; Blume-Peytavi, U.; Krasagakis, K.; Orfanos, CE (1999). "Dermatitis de contacto ocupacional debida al gas lacrimógeno 2-cloracetofenona". British Journal of Dermatology . 140 (3): 531–534. doi :10.1046/j.1365-2133.1999.02724.x. PMID 10233281. S2CID 45123933.
- ^ Graebe, C. (1871), Ueber eine neue Klasse von Alkoholen. Ber. Alemán. Química. Gés., 4: 34-35.
- ^ "Cetonas del grupo aromático". Revista de la Sociedad Química, Resúmenes . 34 : 419. 1878. doi : 10.1039/CA8783400392 .
- ^ Levin, N.; Hartung, WH (1955). "ω-Cloroisonitrosoacetofenona". Síntesis orgánicas; Volúmenes recopilados , vol. 3, pág. 191.
- ^ ab Ballantyne, B.; Swanston, DW (1978). "La toxicidad aguda comparativa en mamíferos de 1-cloroacetofenona (CN) y 2-clorobencilideno malononitrilo (CS)". Archivos de toxicología . 40 (2): 75–95. Bibcode :1978ArTox..40...75B. doi :10.1007/BF01891962. PMID 350195. S2CID 35150415.
- ^ Blain, PG (2003). "Gases lacrimógenos e incapacitantes irritantes: 1-cloroacetofenona, 2-clorobencilideno malononitrilo y dibenz[b,f]-1,4-oxazepina". Toxicological Reviews . 22 (2): 103–110. doi :10.2165/00139709-200322020-00005. PMID 15071820. S2CID 21164652.
- ^ doi=10.1096/fj.08-117812
- ^ doi=10.1016/j.taap.2008.04.005