Cloruro de cobre (II)
 | |
_chloride.jpg/440px-Copper(II)_chloride.jpg) Anhidro | |
 Dihidrato | |
| Nombres | |
|---|---|
| Nombre IUPAC Cloruro de cobre (II) | |
| Otros nombres Cloruro cúprico | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 8128168 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos |
|
| Tarjeta informativa de la ECHA | 100.028.373 |
| Número CE |
|
| 9300 | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 2802 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CuCl2 | |
| Masa molar | 134,45 g/mol (anhidro) 170,48 g/mol (dihidrato) |
| Apariencia | sólido marrón oscuro (anhidro) sólido azul claro (dihidrato) |
| Olor | inodoro |
| Densidad | 3,386 g/cm 3 (anhidro) 2,51 g/cm 3 (dihidrato) |
| Punto de fusión | 630 °C (1166 °F; 903 K) (extrapolado) 100 °C (deshidratación de dihidrato) |
| Punto de ebullición | 993 °C (1819 °F; 1266 K) (anhidro, se descompone) |
| 70,6 g/(100 ml) (0 °C) 75,7 g/(100 ml) (25 °C) 107,9 g/(100 ml) (100 °C) | |
| Solubilidad | metanol: 68 g/(100 mL) (15 °C)
|
| +1080·10 −6 cm3 / mol | |
| Estructura [1] [2] | |
| monoclínico (β = 121°) (anhidro) ortorrómbico (dihidrato) | |
| C2/m (anhidro) Pbmn (dihidrato) | |
a = 6,85 Å (anhidro) 7,41 Å (dihidrato), b = 3,30 Å (anhidro) 8,09 Å (dihidrato), c = 6,70 Å (anhidro) 3,75 Å (dihidrato) | |
| Octaédrico | |
| Peligros | |
| Etiquetado SGA : | |
    | |
| Peligro | |
| H301 , H302 , H312 , H315 , H318 , H319 , H335 , H410 , H411 | |
| P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P322 , P330 , P332+P313 , P337+P313 , P362 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 1 mg/m3 ( como Cu) [3] |
REL (recomendado) | TWA 1 mg/m3 ( como Cu) [3] |
IDLH (Peligro inmediato) | TWA 100 mg/m3 ( como Cu) [3] |
| Ficha de datos de seguridad (FDS) | Científico Fisher |
| Compuestos relacionados | |
Otros aniones | Fluoruro de cobre (II) Bromuro de cobre (II) |
Otros cationes | Cloruro de cobre (I) Cloruro de plata Cloruro de oro (III) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de cobre (II) , también conocido como cloruro cúprico , es un compuesto inorgánico con la fórmula química CuCl2 . La forma anhidra monoclínica de color marrón amarillento absorbe lentamente la humedad para formar el dihidrato ortorrómbico de color azul verdoso CuCl2 ·2H2O , con dos moléculas de agua de hidratación . Se produce industrialmente para su uso como cocatalizador en el proceso Wacker .
Tanto la forma anhidra como la dihidrato se presentan de forma natural como los minerales raros tolbachita y eriocalcita , respectivamente.
Estructura

El cloruro de cobre(II) anhidro adopta una estructura de yoduro de cadmio distorsionada . En esta estructura, los centros de cobre son octaédricos . La mayoría de los compuestos de cobre(II) presentan distorsiones con respecto a la geometría octaédrica idealizada debido al efecto Jahn-Teller , que en este caso describe la localización de un electrón d en un orbital molecular que es fuertemente antienlazante con respecto a un par de ligandos de cloruro. En CuCl 2 ·2H 2 O , el cobre nuevamente adopta una geometría octaédrica altamente distorsionada, en la que los centros de Cu(II) están rodeados por dos ligandos de agua y cuatro ligandos de cloruro, que forman puentes asimétricos con otros centros de Cu. [4] [5]
El cloruro de cobre (II) es paramagnético . De interés histórico, el CuCl 2 ·2H 2 O fue utilizado en las primeras mediciones de resonancia paramagnética electrónica por Yevgeny Zavoisky en 1944. [6] [7]
Propiedades y reacciones
Las soluciones acuosas preparadas a partir de cloruro de cobre (II) contienen una variedad de complejos de cobre (II) que dependen de la concentración , la temperatura y la presencia de iones de cloruro adicionales . Estas especies incluyen el color azul de [Cu(H 2 O) 6 ] 2+ y el color amarillo o rojo de los complejos de haluro de fórmula [CuCl 2+ x ] x − . [5]
Hidrólisis
Cuando las soluciones de cloruro de cobre (II) se tratan con una base , se produce una precipitación de hidróxido de cobre (II) : [8]
- CuCl 2 + 2 NaOH → Cu(OH) 2 + 2 NaCl
La hidrólisis parcial produce trihidróxido de cloruro de dicobre , Cu 2 (OH) 3 Cl , un fungicida popular. [8] Cuando una solución acuosa de cloruro de cobre (II) se deja en el aire y no se estabiliza con una pequeña cantidad de ácido, es propensa a sufrir una ligera hidrólisis. [5]
Redox y descomposición
El cloruro de cobre (II) es un oxidante suave . Comienza a descomponerse en cloruro de cobre (I) y gas cloro alrededor de los 400 °C (752 °F) y se descompone por completo cerca de los 1000 °C (1830 °F): [8] [9] [10] [11]
- 2CuCl2 → 2CuCl + Cl2
El punto de fusión informado del cloruro de cobre (II) de 498 °C (928 °F) es una fusión de una mezcla de cloruro de cobre (I) y cloruro de cobre (II). El verdadero punto de fusión de 630 °C (1166 °F) se puede extrapolar utilizando los puntos de fusión de las mezclas de CuCl y CuCl 2 . [12] [13] El cloruro de cobre (II) reacciona con varios metales para producir cobre metálico o cloruro de cobre (I) (CuCl) con oxidación del otro metal. Para convertir el cloruro de cobre (II) en cloruro de cobre (I), puede ser conveniente reducir una solución acuosa con dióxido de azufre como reductor : [8]
- 2CuCl2 + SO2 + 2 H2O → 2 CuCl + 2 HCl + H2SO4
Complejos de coordinación
El CuCl 2 reacciona con HCl u otras fuentes de cloruro para formar iones complejos: el rojo [CuCl 3 ] − (que se encuentra en el triclorurocuprato de potasio (II) K[CuCl 3 ] ) ( en realidad es un dímero , [Cu 2 Cl 6 ] 2− , un par de tetraedros que comparten un borde), y el verde o amarillo [CuCl 4 ] 2− (que se encuentra en el tetraclorurocuprato de potasio (II) K 2 [CuCl 4 ] ). [5] [14] [15]
- CuCl2 + Cl − ⇌[ CuCl3 ] −
- CuCl2 +2Cl − ⇌ [ CuCl4 ] 2−
Algunos de estos complejos pueden cristalizarse a partir de soluciones acuosas y adoptan una amplia variedad de estructuras. [14]
El cloruro de cobre (II) también forma una variedad de complejos de coordinación con ligandos como amoníaco , piridina y óxido de trifenilfosfina : [8] [5] [16]
- CuCl2 + 2C5H5N → [ CuCl2 ( C5H5N ) 2 ] ( tetragonal )
- CuCl2 +2( C6H5 ) 3P = O → [CuCl2 ( ( C6H5 ) 3P = O ) 2 ] ( tetraédrico )
Sin embargo, los ligandos "blandos" como las fosfinas (por ejemplo, trifenilfosfina ), el yoduro y el cianuro , así como algunas aminas terciarias, inducen la reducción para dar complejos de cobre (I). [5]
Preparación
El cloruro de cobre (II) se prepara comercialmente mediante la cloración del cobre. El cobre al rojo vivo (300-400 °C) se combina directamente con el gas cloro, dando lugar al cloruro de cobre (II) (fundido). La reacción es muy exotérmica . [8] [15]
- Cu(s) + Cl 2 (g) → CuCl 2 (l)
Se produce comercialmente una solución de cloruro de cobre (II) añadiendo gas cloro a una mezcla circulante de ácido clorhídrico y cobre. A partir de esta solución, se puede producir el dihidrato por evaporación. [8] [10]
Aunque el metal de cobre en sí no puede oxidarse con ácido clorhídrico, las bases que contienen cobre, como el hidróxido, el óxido o el carbonato de cobre (II) pueden reaccionar para formar CuCl 2 en una reacción ácido-base que posteriormente puede calentarse por encima de 100 °C (212 °F) para producir el derivado anhidro. [8] [10]
Una vez preparada, una solución de CuCl2 se puede purificar por cristalización . Un método estándar toma la solución mezclada en ácido clorhídrico diluido caliente y hace que los cristales se formen enfriándolos en un baño de hielo de cloruro de calcio ( CaCl2 ) . [17] [18]
Existen métodos indirectos y poco utilizados para utilizar iones de cobre en solución para formar cloruro de cobre (II). La electrólisis de cloruro de sodio acuoso con electrodos de cobre produce (entre otras cosas) una espuma verde azulada que se puede recolectar y convertir en hidrato. Si bien esto no se hace habitualmente debido a la emisión de gas de cloro tóxico y la prevalencia del proceso cloro-álcali más general , la electrólisis convertirá el metal de cobre en iones de cobre en solución formando el compuesto. De hecho, cualquier solución de iones de cobre se puede mezclar con ácido clorhídrico y convertir en cloruro de cobre eliminando cualquier otro ion. [19]
Usos
Co-catalizador en el proceso Wacker
Una de las principales aplicaciones industriales del cloruro de cobre (II) es como cocatalizador junto con el cloruro de paladio (II) en el proceso Wacker . En este proceso, el eteno (etileno) se convierte en etanal (acetaldehído) utilizando agua y aire. Durante la reacción, el PdCl 2 se reduce a Pd , y el CuCl 2 sirve para reoxidarlo a PdCl 2 . Luego, el aire puede oxidar el CuCl resultante a CuCl 2 , completando el ciclo. [20]
- C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
- Pd + 2CuCl2 → 2 CuCl + PdCl2
- 4 CuCl + 4 HCl + O 2 → 4 CuCl 2 + 2 H 2 O
El proceso general es: [20]
- 2 C 2 H 4 + O 2 → 2 CH 3 CHO
En síntesis orgánica
El cloruro de cobre (II) tiene algunas aplicaciones altamente especializadas en la síntesis de compuestos orgánicos . [17] Afecta la cloración de hidrocarburos aromáticos , que a menudo se realiza en presencia de óxido de aluminio . Es capaz de clorar la posición alfa de los compuestos carbonílicos : [20] [21]
Esta reacción se realiza en un disolvente polar como la dimetilformamida , a menudo en presencia de cloruro de litio , que acelera la reacción. [20]
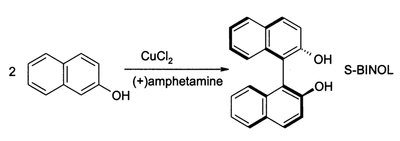
El CuCl 2 , en presencia de oxígeno , también puede oxidar fenoles . El producto principal puede dirigirse para dar una quinona o un producto acoplado a partir de la dimerización oxidativa. El último proceso proporciona una ruta de alto rendimiento para obtener 1,1-binaftol : [22]
Estos compuestos son intermedios en la síntesis de BINAP y sus derivados. [20]
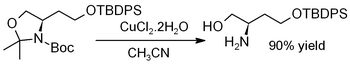
El cloruro de cobre (II) dihidrato promueve la hidrólisis de acetónidos , es decir, la desprotección para regenerar dioles [23] o aminoalcoholes , como en este ejemplo (donde TBDPS = terc -butildifenilsililo ): [24]
El CuCl2 también cataliza la adición de radicales libres de cloruros de sulfonilo a alquenos ; la alfa-clorosulfona puede entonces sufrir eliminación con una base para dar un producto de vinilsulfona . [20]
Catalizador en la producción de cloro
El cloruro de cobre (II) se utiliza como catalizador en diversos procesos que producen cloro mediante oxicloración . El proceso Deacon se lleva a cabo a unos 400 a 450 °C en presencia de cloruro de cobre: [8]
- 4HCl + O2 → 2Cl2 + 2H2O
El cloruro de cobre (II) cataliza la cloración en la producción de cloruro de vinilo y diclorometano . [8]
El cloruro de cobre (II) se utiliza en el ciclo cobre-cloro , donde reacciona con vapor para formar dicloruro de óxido de cobre (II) y cloruro de hidrógeno, y luego se recupera en el ciclo a partir de la electrólisis del cloruro de cobre (I). [11]
Usos de nicho
El cloruro de cobre (II) se utiliza en pirotecnia como colorante azul/verde. En una prueba de llama , los cloruros de cobre, como todos los compuestos de cobre, emiten una luz verde-azulada. [25]
En las tarjetas indicadoras de humedad (HIC), se pueden encontrar en el mercado HIC de color marrón a azul (base de cloruro de cobre (II)) sin cobalto. [26] En 1998, la Comunidad Europea clasificó los artículos que contenían cloruro de cobalto (II) de 0,01 a 1% p/p como T (tóxicos), con la frase R correspondiente de R49 (puede causar cáncer si se inhala). En consecuencia, se han desarrollado nuevas tarjetas indicadoras de humedad sin cobalto que contienen cobre. [27]
El cloruro de cobre (II) se utiliza como mordiente en la industria textil, edulcorante de petróleo , conservante de madera y limpiador de agua . [8] [28]
Ocurrencia natural

El cloruro de cobre (II) se presenta de forma natural como el mineral anhidro muy raro tolbachita y el dihidrato eriochalcita. [29] Ambos se encuentran cerca de fumarolas y en algunas minas de cobre. [30] [31] [32] Los cloruros de oxihidróxido mixtos como la atacamita ( Cu 2 (OH) 3 Cl ) son más comunes y surgen entre las zonas de oxidación de los yacimientos de mineral de Cu en climas áridos. [33]
Seguridad e impacto biológico
El cloruro de cobre (II) puede ser tóxico. La Agencia de Protección Ambiental de los Estados Unidos solo permite concentraciones inferiores a 1,3 ppm de iones de cobre acuosos en el agua potable . [34] Si se absorbe cloruro de cobre, produce dolor de cabeza, diarrea, caída de la presión arterial y fiebre. La ingestión de grandes cantidades puede provocar intoxicación por cobre , trastornos del sistema nervioso central y hemólisis . [35] [36]
Se ha demostrado que el cloruro de cobre (II) causa aberraciones cromosómicas y alteraciones del ciclo mitótico en las células de A. cepa (cebolla). [37] Estas alteraciones celulares provocan genotoxicidad . El cloruro de cobre (II) también se ha estudiado como un contaminante ambiental nocivo. A menudo presente en el agua de riego, puede afectar negativamente a los microbios del agua y del suelo. [38] En concreto, se descubrió que las bacterias desnitrificantes eran muy sensibles a la presencia de cloruro de cobre (II). A una concentración de 0,95 mg/L, se descubrió que el cloruro de cobre (II) causaba una inhibición del 50% (CI50) de la actividad metabólica de los microbios desnitrificantes. [39]
Véase también
Referencias
- ^ AF Wells (1947). "La estructura cristalina del cloruro cúprico anhidro y la estereoquímica del átomo cúprico". Journal of the Chemical Society : 1670–1675. doi :10.1039/JR9470001670.
- ^ Sídney Brownstein; Nam Fong Han; Eric Gabe; Yvon LePage (1989). "Una redeterminación de la estructura cristalina del cloruro cúprico dihidrato". Zeitschrift für Kristallographie . 189 (1): 13-15. Código Bib : 1989ZK....189...13B. doi :10.1524/zkri.1989.189.1-2.13.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0150". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Wells, AF (1984). Química inorgánica estructural . Oxford: Clarendon Press. pág. 253. ISBN 0-19-855370-6.
- ^ abcdef Greenwood, NN y Earnshaw, A. (1997). Química de los elementos (2.ª ed.), Oxford: Butterworth-Heinemann. pág. 1183–1185 ISBN 0-7506-3365-4 .
- ^ Peter Baláž (2008). Mecanoquímica en nanociencia e ingeniería de minerales. Springer. pág. 167. ISBN 978-3-540-74854-0.
- ^ Carlo Corvaja (2009). Resonancia paramagnética electrónica: un conjunto de herramientas para profesionales. John Wiley and Sons. p. 3. ISBN 978-0-470-25882-8.
- ^ abcdefghijk Zhang, J.; Richardson, HW (2016). "Compuestos de cobre". Ullmann's Encyclopedia of Industrial Chemistry . págs. 1–31. doi :10.1002/14356007.a07_567.pub2. ISBN 978-3-527-30673-2.
- ^ Shuiliang Zhou; Shaobo Shen; Dalong Zhao; Zhitao Zhang; Shiyu Yan (2017). "Evaporación y descomposición de eutécticos de cloruro cúprico y cloruro de sodio". Revista de análisis térmico y calorimetría . 129 (3): 1445–1452. doi :10.1007/s10973-017-6360-y. S2CID 99924382.
- ^ abc Richardson, HW (2003). "Compuestos de cobre". Enciclopedia Kirk-Othmer de tecnología química . doi :10.1002/0471238961.0315161618090308.a01.pub2. ISBN 0471238961.
- ^ ab Z. Wang; G. Marin; GF Naterer; KS Gabriel (2015). "Termodinámica y cinética de la descomposición térmica del cloruro cúprico en su reacción de hidrólisis" (PDF) . Revista de análisis térmico y calorimetría . 119 (2): 815–823. doi :10.1007/s10973-014-3929-6. S2CID 93668361.
- ^ Guillermo Biltz; Werner Fischer (1927). "Beiträge zur systematischen Verwandtschaftslehre. XLIII. Über das System Cupro-/Cuprichlorid". Zeitschrift für anorganische und allgemeine Chemie (en alemán). 166 (1): 290–298. doi :10.1002/zaac.19271660126.
- ^ AG Massey; NR Thompson; BFG Johnson (1973). La química del cobre, la plata y el oro . Elsevier Science. pág. 42. ISBN 9780080188607.
- ^ ab Naida S. Gill; FB Taylor (1967). Complejos tetrahalo de metales dipositivos en la primera serie de transición . Síntesis inorgánica. Vol. 9. págs. 136-142. doi :10.1002/9780470132401.ch37. ISBN 978-0-470-13240-1.
- ^ ab H. Wayne Richardson (1997). Manual de compuestos de cobre y aplicaciones . CRC Press. págs. 24–68. ISBN 9781482277463.
- ^ W. Libus; SK Hoffmann; M. Kluczkowski; H. Twardowska (1980). "Equilibrios de solución de cloruro de cobre (II) en piridina y mezclas de piridina-diluyente". Química inorgánica . 19 (6): 1625–1632. doi :10.1021/ic50208a039.
- ^ ab SH Bertz, EH Fairchild, en Manual de reactivos para síntesis orgánica, volumen 1: reactivos, auxiliares y catalizadores para la formación de enlaces CC , (RM Coates, SE Dinamarca, eds.), págs. 220–223, Wiley, Nueva York, 1738.
- ^ WLF Armarego; Christina Li Lin Chai (22 de mayo de 2009). Purificación de productos químicos de laboratorio ( extracto de Google Books ) (6.ª ed.). Butterworth-Heinemann. pág. 461. ISBN 978-1-85617-567-8.
- ^ J. Ji; WC Cooper (1990). "Preparación electroquímica de polvo de óxido cuproso: Parte I. Electroquímica básica". Revista de electroquímica aplicada . 20 (5): 818–825. doi :10.1007/BF01094312. S2CID 95677720.
- ^ abcdef Nicholas DP Cosford; Pauline Pei Li; Thierry Ollevier (2015). "Cloruro de cobre (II)". Enciclopedia de reactivos para síntesis orgánica : 1–8. doi :10.1002/047084289X.rc214.pub3. ISBN 9780470842898.
- ^ CE Castro; EJ Gaughan; DC Owsley (1965). "Halogenaciones de haluro cúprico". Revista de química orgánica . 30 (2): 587. doi :10.1021/jo01013a069.
- ^ J. Brussee; JLG Groenendijk; JM Koppele; ACA Jansen (1985). "Sobre el mecanismo de formación de s(−)-(1, 1'-binaftaleno)-2,2'-diol a través de complejos de cobre(II)amina". Tetrahedron . 41 (16): 3313. doi :10.1016/S0040-4020(01)96682-7.
- ^ Chandrasekhar, M.; Kusum L. Chandra; Vinod K. Singh (2003). "Síntesis total de (+)-boronólido, (+)-desacetilboronólido y (+)-dideacetilboronólido". Journal of Organic Chemistry . 68 (10): 4039–4045. doi :10.1021/jo0269058. PMID 12737588.
- ^ Krishna, Palakodety Radha; G. Dayaker (2007). "Una síntesis total estereoselectiva de (-) -andraccinidina mediante un protocolo de metátesis cruzada de olefinas". Letras de tetraedro . 48 (41). Elsevier: 7279–7282. doi :10.1016/j.tetlet.2007.08.053.
- ^ Clark, Jim (agosto de 2018). «Flame Tests» (Pruebas de llama). chemguide.co.uk . Archivado desde el original el 27 de noviembre de 2020. Consultado el 10 de enero de 2021 .
- ^ US 20150300958 A1, Evan Koon Lun Yuuji Hajime, "Indicadores de humedad colorimétricos ajustables", publicado en 2015
- ^ "Dicloruro de cobalto". Agencia Europea de Sustancias y Mezclas Químicas . ECHA . Consultado el 30 de mayo de 2023 .
- ^ BH Patel (2011). "11 - Tintes naturales". En Clark, M. (ed.). Manual de teñido textil e industrial. Woodhead Publishing. págs. 412–413. ISBN 9781845696955. Recuperado el 2 de junio de 2023 .
- ^ Marlene C. Morris, Howard F. McMurdie, Eloise H. Evans, Boris Paretzkin, Harry S. Parker y Nicolas C. Panagiotopoulos (1981) Hidrato de cloruro de cobre (eriocalcita) , en Patrones estándar de difracción de rayos X en polvo, Oficina Nacional de Normas, Monografía 25, Sección 18; página 33.
- ^ "Tolbachite". mindat.org . Consultado el 24 de agosto de 2023 .
- ^ "Eriochalcita". mindat.org . Consultado el 24 de agosto de 2023 .
- ^ "La nueva lista de minerales de la IMA". Università degli studi di Trieste . Asociación Mineralógica Internacional . Consultado el 24 de agosto de 2023 .
- ^ "Atacamite". mindat.org . Consultado el 30 de mayo de 2023 .
- ^ "Reglamento nacional sobre agua potable primaria". EPA . 30 de noviembre de 2015 . Consultado el 29 de mayo de 2023 .
- ^ "Cobre: Resumen de información sobre la salud" (PDF) . Hoja informativa medioambiental . Departamento de Servicios Ambientales de New Hampshire. 2005. ARD-EHP-9. Archivado desde el original (PDF) el 20 de enero de 2017.
- ^ "Ficha de datos de seguridad". Sigma Aldrich . Consultado el 30 de junio de 2023 .
- ^ Macar, Tuğçe Kalefetoğlu (2020). "El resveratrol mejora las toxicidades fisiológicas, bioquímicas, citogenéticas y anatómicas inducidas por la exposición al cloruro de cobre (II) en Allium cepa L." Environmental Science and Pollution Research . 27 (1): 657–667. doi :10.1007/s11356-019-06920-2. PMID 31808086. S2CID 208649491.
- ^ Shiyab, Safwan (2018). "Fitoacumulación de cobre del agua de riego y su efecto en la estructura interna de la lechuga". Agricultura . 8 (2): 29. doi : 10.3390/agriculture8020029 .
- ^ Ochoa-Herrera, Valeria (2011). "Toxicidad de los iones de cobre (II) para microorganismos en sistemas de tratamiento biológico de aguas residuales". Science of the Total Environment . 412 (1): 380–385. Bibcode :2011ScTEn.412..380O. doi :10.1016/j.scitotenv.2011.09.072. PMID 22030247.
Lectura adicional
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Lide, David R. (1990). Manual de química y física del CRC: un libro de referencia rápida de datos químicos y físicos . Boca Raton: CRC Press. ISBN 0-8493-0471-7.
- The Merck Index , 7ª edición, Merck & Co, Rahway, Nueva Jersey, EE. UU., 1960.
- D. Nicholls, Complejos y elementos de transición de primera fila , Macmillan Press, Londres, 1973.
- AF Wells, ' Química inorgánica estructural ' , 5.ª ed., Oxford University Press, Oxford, Reino Unido, 1984.
- J. March, Química orgánica avanzada , 4ª ed., pág. 723, Wiley, Nueva York, 1992.
- Reactivos Fieser & Fieser para síntesis orgánica Volumen 5, p158, Wiley, Nueva York, 1975.
- DW Smith (1976). "Clorocupratos(II)". Coordination Chemistry Reviews . 21 (2–3): 93–158. doi :10.1016/S0010-8545(00)80445-2.
Enlaces externos
- Cloruro de cobre en la tabla periódica de vídeos (Universidad de Nottingham)
- Cloruro de cobre (II) – Descripción e imágenes
- Inventario Nacional de Contaminantes – Hoja informativa sobre cobre y compuestos