Dicianoaurato de potasio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Dicianoaurato de potasio (I) | |
| Otros nombres cianoaurato de potasio [1] cianuro de potasio y oro dicianuro de potasio y oro | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| 6235525 | |
| EBICh |
|
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.034.303 |
| Número CE |
|
| 37363 | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
| Número de la ONU | 1588 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| KAu(CN) 2 | |
| Masa molar | 288,101 g/mol |
| Apariencia | cristal blanco [1] |
| Densidad | 3,45 g/cm3 [ 1] |
| Punto de ebullición | se descompone |
| 140 g/L [1] | |
| Estructura | |
| Romboédrica , hR54 , n.º 148 | |
| R3 | |
a = 0,728 nm, b = 0,728 nm, c = 2,636 nm | |
Volumen reticular ( V ) | 1,2099 nm 3 |
Unidades de fórmula ( Z ) | 9 |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | tóxico |
| Etiquetado SGA : | |
   | |
| Advertencia | |
| H290 , H300 , H310 , H315 , H317 , H318 , H330 , H410 | |
| P260 , P264 , P273 , P280 , P284 , P301+P310 | |
| Compuestos relacionados | |
Otros aniones | Argentocianuro de potasio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El dicianoaurato de potasio (o cianuro de potasio y oro ) es un compuesto inorgánico con la fórmula K[Au(CN) 2 ]. Es un sólido incoloro a blanco que es soluble en agua y ligeramente soluble en alcohol. La sal en sí no suele aislarse, pero se generan soluciones del ion dicianoaurato ([Au(CN) 2 ] − ) a gran escala en la extracción de oro de sus menas. [3]
Producción
En la extracción de oro a partir de fuentes diluidas, el oro se extrae selectivamente mediante disolución en soluciones acuosas de cianuro, obtenidas disolviendo cianuro de sodio, cianuro de potasio y/o cianuro de calcio . La reacción para la disolución del oro, la "ecuación de Elsner", es:
- 4 Au + 8 KCN + O 2 + 2 H 2 O → 4 K[Au(CN) 2 ] + 4 KOH
En este proceso, el oxígeno es el oxidante. [4]
También se puede producir por reacción de sales de oro (I) con exceso de cianuro de potasio.
- AuCl + 2 KCN → K[Au(CN) 2 ] + KCl
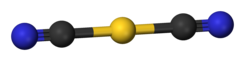
Estructura

El dicianoaurato es un anión con forma de varilla.
El dicianoaurato de potasio es una sal. El anión dicianoaurato es lineal según la cristalografía de rayos X. [3] Según la espectroscopia infrarroja , el anión dicianoaurato adopta una estructura muy similar al dicianoaurato de sodio (NaAu(CN) 2 ). [5]
Usos
El dicianoaurato es la especie soluble que constituye el objetivo de la cianuración del oro , el proceso hidrometalúrgico para extraer oro de minerales diluidos. De hecho, el cianuro de sodio, no la sal de potasio, es el que se utiliza más ampliamente en los procesos comerciales. [6]
Además de su uso principal como intermedio en la extracción de oro, el dicianoaurato de potasio se utiliza a menudo en aplicaciones de enchapado de oro .
Compuestos relacionados
El compuesto que contiene cianuro de oro (III) también se conoce como tetracianoaurato de potasio (III), K[Au(CN) 4 ]. Su uso es menos común.
El ion potasio se puede reemplazar con cationes de amonio cuaternario como en el dicianoaurato de tetrabutilamonio . [7]
Seguridad
La ingestión de cantidades de gramos de dicianoaurato de potasio puede provocar la muerte debido al oro que inhibe la enzima rodanasa , que el cuerpo utiliza para desintoxicar el cianuro. [8]
Referencias
- ^ abcd Haynes, William M., ed. (2011). Manual de química y física del CRC (92.ª edición). CRC Press . pág. 4.82. ISBN 978-1439855119.
- ^ Greenwood, NN; y Earnshaw, A. (1997). Química de los elementos (2.ª edición), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4 .
- ^ ab Rosenzweig, A.; Cromer, DT (1959). "La estructura cristalina de KAu(CN)2". Acta Crystallographica . 12 (10): 709–712. Código Bibliográfico :1959AcCry..12..709R. doi : 10.1107/S0365110X59002109 .
- ^ Tratamiento de minerales que contienen sulfuros de hierro reactivos. Sistemas de mezcla múltiple
- ^ Chadwick, BM; Frankiss, SG (1976). "Espectros vibracionales y estructuras de algunos complejos de dicianoaurato(I)". Journal of Molecular Structure . 31 (1): 1–9. Bibcode :1976JMoSt..31....1C. doi :10.1016/0022-2860(76)80113-5.
- ^ Rubo, Andrés; Kellens, Raf; Reddy, Jay; Steier, Norberto; Hasenpusch, Wolfgang (2006). "Cianuros de metales alcalinos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.i01_i01. ISBN 978-3527306732.
- ^ Stender, Matthias; Olmstead, Marilyn M.; Balch, Alan L.; Rios, Daniel; Attar, Saeed (2003). "Efectos de los enlaces catiónicos e hidrógeno en la autoasociación y luminiscencia del ion dicianoaurato, Au(CN) 2 − ". Dalton Transactions (22): 4282. doi :10.1039/b310085e.
- ^ Wright, IH; Vesey, CJ (septiembre de 1986). "Intoxicación aguda con cianuro de oro". Anestesia . 41 (9): 936–939. doi : 10.1111/j.1365-2044.1986.tb12920.x . PMID 3022615.