Receptor Fc
| Receptor similar a la inmunoglobulina | |
|---|---|
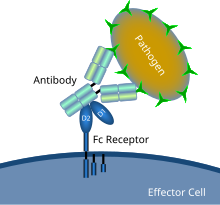 Diagrama esquemático que muestra la interacción del receptor Fc con un patógeno microbiano recubierto de anticuerpos | |
| Identificadores | |
| Símbolo | Receptor Fc |
| Membranoma | 10 |
En inmunología , un receptor Fc es una proteína que se encuentra en la superficie de ciertas células –incluyendo, entre otras, linfocitos B , células dendríticas foliculares , células asesinas naturales , macrófagos , neutrófilos , eosinófilos , basófilos , plaquetas humanas y mastocitos– que contribuyen a las funciones protectoras del sistema inmunitario . Su nombre se deriva de su especificidad de unión por una parte de un anticuerpo conocida como región Fc (fragmento cristalizable) . Los receptores Fc se unen a los anticuerpos que están unidos a las células infectadas o patógenos invasores . Su actividad estimula a las células fagocíticas o citotóxicas para destruir microbios , o células infectadas mediante fagocitosis mediada por anticuerpos o citotoxicidad mediada por células dependiente de anticuerpos . Algunos virus como los flavivirus utilizan receptores Fc para ayudarlos a infectar células, mediante un mecanismo conocido como mejora de la infección dependiente de anticuerpos . [1]
Clases
Existen varios tipos diferentes de receptores Fc (abreviados como FcR), que se clasifican según el tipo de anticuerpo que reconocen. La letra latina que se utiliza para identificar un tipo de anticuerpo se convierte en la letra griega correspondiente, que se coloca después de la parte "Fc" del nombre. Por ejemplo, los que se unen a la clase más común de anticuerpo, IgG , se denominan receptores Fc-gamma (FcγR), los que se unen a IgA se denominan receptores Fc-alfa (FcαR) y los que se unen a IgE se denominan receptores Fc-épsilon (FcεR). Las clases de FcR también se distinguen por las células que las expresan (macrófagos, granulocitos, células asesinas naturales, células T y B) y las propiedades de señalización de cada receptor. [2]
Receptores Fc-gamma
Todos los receptores Fcγ (FcγR) pertenecen a la superfamilia de inmunoglobulinas y son los receptores Fc más importantes para inducir la fagocitosis de microbios opsonizados (marcados). [3] Esta familia incluye varios miembros, FcγRI (CD64), FcγRIIA ( CD32 ), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b), que difieren en sus afinidades de anticuerpos debido a su diferente estructura molecular . [4] Por ejemplo, FcγRI se une a IgG con más fuerza que FcγRII o FcγRIII. FcγRI también tiene una porción extracelular compuesta por tres dominios similares a inmunoglobulina (Ig) , un dominio más que FcγRII o FcγRIII. Esta propiedad permite que FcγRI se una a una sola molécula de IgG (o monómero ), pero todos los receptores Fcγ deben unirse a múltiples moléculas de IgG dentro de un complejo inmune para activarse. [5]
Los receptores Fc-gamma difieren en su afinidad por IgG y, de la misma manera, las diferentes subclases de IgG tienen afinidades únicas por cada uno de los receptores Fc-gamma. [6] Estas interacciones se ajustan aún más mediante el glicano (oligosacárido) en la posición CH2-84.4 de IgG. [6] Por ejemplo, al crear un impedimento estérico, los glicanos CH2-84.4 que contienen fucosa reducen la afinidad de IgG por FcγRIIIA. [6] Por el contrario, los glicanos G0, que carecen de galactosa y terminan en su lugar con fracciones GlcNAc, tienen una mayor afinidad por FcγRIIIA. [6]
Receptor Fc neonatal
Otro FcR se expresa en múltiples tipos de células y es similar en estructura al MHC clase I. Este receptor también se une a IgG y está involucrado en la preservación de este anticuerpo. [7] Sin embargo, dado que este receptor Fc también está involucrado en la transferencia de IgG de una madre ya sea a través de la placenta a su feto o en la leche a su bebé lactante , se llama receptor Fc neonatal ( FcRn ). [8] [9] Recientemente, la investigación sugirió que este receptor juega un papel en la homeostasis de los niveles séricos de IgG.
Receptores Fc-alfa
Solo un receptor Fc pertenece al subgrupo FcαR, que se llama FcαRI (o CD89). [10] FcαRI se encuentra en la superficie de los neutrófilos , eosinófilos, monocitos, algunos macrófagos (incluidas las células de Kupffer ) y algunas células dendríticas . [10] Está compuesto por dos dominios extracelulares similares a Ig y es miembro tanto de la superfamilia de inmunoglobulinas como de la familia del receptor de reconocimiento inmunológico multicadena (MIRR). [3] Señaliza asociándose con dos cadenas de señalización FcRγ. [10] Otro receptor también puede unirse a IgA, aunque tiene mayor afinidad por otro anticuerpo llamado IgM . [11] Este receptor se llama receptor Fc-alfa/mu (Fcα/μR) y es una proteína transmembrana tipo I. Con un dominio similar a Ig en su porción extracelular, este receptor Fc también es miembro de la superfamilia de inmunoglobulinas. [12]
Receptores Fc-épsilon
Se conocen dos tipos de FcεR: [3]
- El receptor de alta afinidad FcεRI es un miembro de la superfamilia de inmunoglobulinas (tiene dos dominios similares a Ig). FcεRI se encuentra en las células epidérmicas de Langerhans , eosinófilos, mastocitos y basófilos. [13] [14] Como resultado de su distribución celular, este receptor juega un papel importante en el control de las respuestas alérgicas . FcεRI también se expresa en las células presentadoras de antígenos y controla la producción de mediadores inmunes importantes llamados citocinas que promueven la inflamación . [15]
- El receptor de baja afinidad FcεRII ( CD23 ) es una lectina de tipo C. FcεRII tiene múltiples funciones como receptor soluble o unido a la membrana; controla el crecimiento y la diferenciación de las células B y bloquea la unión de IgE de eosinófilos, monocitos y basófilos. [16]
Tabla resumen
| Nombre del receptor | Ligando principal del anticuerpo | Afinidad por el ligando | Distribución celular | Efecto tras la unión al anticuerpo |
|---|---|---|---|---|
| FcγRI ( CD64 ) | IgG1 y IgG3 | Alto (Kd ~ 10 −9 M) | Macrófagos Neutrófilos Eosinófilos Células dendríticas | Fagocitosis Activación celular Activación del estallido respiratorio Inducción de la muerte de microbios |
| FcγRIIA ( CD32 ) | IgG | Bajo (Kd > 10 −7 M) | Macrófagos Neutrófilos Eosinófilos Plaquetas Células de Langerhans | Fagocitosis Desgranulación (eosinófilos) |
| FcγRIIB1 (CD32) | IgG | Bajo (Kd > 10 −7 M) | Células B Mastocitos | No fagocitosis Inhibición de la actividad celular |
| FcγRIIB2 (CD32) | IgG | Bajo (Kd > 10 −7 M) | Macrófagos Neutrófilos Eosinófilos | Fagocitosis Inhibición de la actividad celular. |
| FcγRIIIA ( CD16a ) | IgG | Bajo (Kd > 10 −6 M) | Células NK Macrófagos (ciertos tejidos) | Inducción de citotoxicidad celular dependiente de anticuerpos (ADCC) Inducción de la liberación de citocinas por macrófagos |
| FcγRIIIB ( CD16b ) | IgG | Bajo (Kd > 10 −6 M) | Eosinófilos Macrófagos Neutrófilos Mastocitos Células dendríticas foliculares | Inducción de la muerte de microbios |
| FcεRI | IgE | Alto (Kd ~ 10 −10 M) | Mastocitos Eosinófilos Basófilos Células de Langerhans Monocitos | Fagocitosis por desgranulación |
| FcεRII ( CD23 ) | IgE | Bajo (Kd > 10 −7 M) | Células B Eosinófilos Células de Langerhans | Posible transporte de moléculas de adhesión IgE a través del epitelio intestinal humano Mecanismo de retroalimentación positiva para mejorar la sensibilización alérgica (células B) |
| FcαRI ( CD89 ) | IgA | Bajo (Kd > 10 −6 M) | Monocitos Macrófagos Neutrófilos Eosinófilos | Fagocitosis Inducción de la muerte de microbios |
| Fcα/μR (CD351) | IgA y IgM | Alto para IgM, medio para IgA | Células B Células mesangiales Macrófagos | Endocitosis Inducción de la muerte de microbios |
| FcμR [17] | IgM | (desconocido) | El FcμR humano se expresa predominantemente en linfocitos, pero no en fagocitos [18] | La función no ha sido completamente dilucidada / diversa [19] |
| FcRn | IgG | Alto contenido de endosomas celulares ácidos y bajo contenido de pH neutro en el entorno extracelular. | Monocitos Macrófagos Células dendríticas Células epiteliales Células endoteliales Hepatocitos | Transfiere IgG de una madre al feto a través de la placenta. Transfiere IgG de una madre al bebé en la leche. Protege la IgG de la degradación. Transfiere IgG a través de las capas endoteliales/epiteliales. |
Funciones

Los receptores Fc se encuentran en varias células del sistema inmunológico, incluidos los fagocitos como los macrófagos y monocitos , los granulocitos como los neutrófilos y los eosinófilos y los linfocitos del sistema inmunológico innato ( células asesinas naturales ) o del sistema inmunológico adaptativo (p. ej., las células B ). [20] [21] [22] Permiten que estas células se unan a los anticuerpos que están adheridos a la superficie de los microbios o de las células infectadas por microbios, lo que ayuda a estas células a identificar y eliminar patógenos microbianos . Los receptores Fc se unen a los anticuerpos en su región Fc (o cola), una interacción que activa la célula que posee el receptor Fc. [23] La activación de los fagocitos es la función más común atribuida a los receptores Fc. Por ejemplo, los macrófagos comienzan a ingerir y matar un patógeno recubierto de IgG por fagocitosis después de la activación de sus receptores Fcγ. [24] Otro proceso que involucra a los receptores Fc se llama citotoxicidad mediada por células dependiente de anticuerpos (ADCC). Durante la ADCC, los receptores FcγRIII en la superficie de las células asesinas naturales (NK) estimulan a las células NK para que liberen moléculas citotóxicas de sus gránulos para matar las células diana cubiertas de anticuerpos. [25] FcεRI tiene una función diferente. FcεRI es el receptor Fc en los granulocitos , que está involucrado en las reacciones alérgicas y la defensa contra infecciones parasitarias . Cuando está presente un antígeno alérgico o parásito apropiado, la reticulación de al menos dos moléculas de IgE y sus receptores Fc en la superficie de un granulocito activará la célula para liberar rápidamente mediadores preformados de sus gránulos. [3]
Mecanismos de señalización - Receptores Fc gamma
Activación
Los receptores Fc gamma pertenecen al grupo de receptores no catalíticos fosforilados en tirosina que comparten una vía de señalización similar que implica la fosforilación de residuos de tirosina. [26] Los receptores generan señales dentro de sus células a través de un motivo de activación importante conocido como motivo de activación basado en tirosina del inmunorreceptor (ITAM). [27] Un ITAM es una secuencia específica de aminoácidos (YXXL) que aparece dos veces en estrecha sucesión en la cola intracelular de un receptor. Cuando se añaden grupos fosfato al residuo de tirosina (Y) del ITAM mediante enzimas ancladas a la membrana de la familia de las quinasas Src , se genera una cascada de señalización dentro de la célula. Esta reacción de fosforilación suele seguir a la interacción de un receptor Fc con su ligando . Un ITAM está presente en la cola intracelular de FcγRIIA, y su fosforilación induce la fagocitosis en los macrófagos. FcγRI y FcγRIIIA no tienen un ITAM, pero pueden transmitir una señal activadora a sus fagocitos al interactuar con otra proteína que sí lo tiene. Esta proteína adaptadora se denomina subunidad Fcγ y, al igual que FcγRIIA, contiene las dos secuencias YXXL características de un ITAM.
Inhibición
La presencia de un solo motivo YXXL no es suficiente para activar las células, y representa un motivo (I/VXXYXXL) conocido como motivo inhibidor basado en tirosina del inmunorreceptor (ITIM). FcγRIIB1 y FcγRIIB2 tienen una secuencia ITIM y son receptores inhibidores de Fc; no inducen fagocitosis. Las acciones inhibidoras de estos receptores están controladas por enzimas que eliminan los grupos fosfato de los residuos de tirosina; las fosfatasas SHP-1 y SHIP-1 inhiben la señalización de los receptores Fcγ. [28] La unión del ligando a FcγRIIB conduce a la fosforilación de la tirosina del motivo ITAM. Esta modificación genera el sitio de unión para la fosfatasa, un dominio de reconocimiento SH2. La abrogación de la señalización de activación de ITAM es causada por la inhibición de las proteínas tirosina quinasas de la familia Src y por la hidrolización de la membrana PIP3 interrumpiendo la señalización posterior de los receptores activadores, como los FcγR activadores, TCR, BCR y receptores de citocinas (por ejemplo, c-Kit). [29]
La señalización negativa de FcγRIIB es principalmente importante para la regulación de las células B activadas. La señalización positiva de las células B se inicia mediante la unión de un antígeno extraño a la inmunoglobulina de superficie. Se secreta el mismo anticuerpo específico del antígeno y puede suprimir por retroalimentación o promover la señalización negativa. Esta señalización negativa la proporciona FcγRIIB. [30] Los experimentos que utilizan mutantes de deleción de células B y enzimas dominantes negativas han establecido firmemente un papel importante para la inositol 5-fosfatasa (SHIP) que contiene el dominio SH2 en la señalización negativa. La señalización negativa a través de SHIP parece inhibir la vía Ras a través de la competencia del dominio SH2 con Grb2 y Shc y puede implicar el consumo de mediadores lipídicos intracelulares que actúan como activadores enzimáticos alostéricos o que promueven la entrada de Ca2+ extracelular. [31]
Activación celular

Sobre los fagocitos
Cuando las moléculas de IgG , específicas para un cierto antígeno o componente de superficie, se unen al patógeno con su región Fab (región de unión al antígeno del fragmento), sus regiones Fc apuntan hacia afuera, al alcance directo de los fagocitos . Los fagocitos unen esas regiones Fc con sus receptores Fc. [24] Se forman muchas interacciones de baja afinidad entre el receptor y el anticuerpo que trabajan juntas para unir firmemente el microbio recubierto de anticuerpo. La baja afinidad individual evita que los receptores Fc se unan a los anticuerpos en ausencia de antígeno y, por lo tanto, reduce la posibilidad de activación de células inmunes en ausencia de infección. Esto también evita la aglutinación (coagulación) de los fagocitos por el anticuerpo cuando no hay antígeno. Después de que un patógeno se ha unido, las interacciones entre la región Fc del anticuerpo y los receptores Fc del fagocito dan como resultado el inicio de la fagocitosis . El patógeno es engullido por el fagocito mediante un proceso activo que implica la unión y liberación del complejo región Fc/receptor Fc, hasta que la membrana celular del fagocito encierra completamente al patógeno. [32]
Sobre las células NK
El receptor Fc de las células NK reconoce la IgG que está unida a la superficie de una célula diana infectada por un patógeno y se denomina CD16 o FcγRIII. [33] La activación de FcγRIII por IgG provoca la liberación de citocinas como IFN-γ que envían señales a otras células inmunitarias y mediadores citotóxicos como la perforina y la granzima que entran en la célula diana y promueven la muerte celular al desencadenar la apoptosis . Este proceso se conoce como citotoxicidad mediada por células dependiente de anticuerpos (ADCC). FcγRIII en las células NK también puede asociarse con IgG monomérica (es decir, IgG que no está unida al antígeno). Cuando esto ocurre, el receptor Fc inhibe la actividad de la célula NK. [34]
Sobre los mastocitos

Los anticuerpos IgE se unen a los antígenos de los alérgenos . Estas moléculas de IgE unidas a los alérgenos interactúan con los receptores Fcε en la superficie de los mastocitos . La activación de los mastocitos tras la activación de FcεRI da lugar a un proceso denominado desgranulación , mediante el cual el mastocito libera moléculas preformadas de sus gránulos citoplasmáticos ; estas son una mezcla de compuestos que incluyen histamina , proteoglicanos y serina proteasas . [35] Los mastocitos activados también sintetizan y secretan mediadores derivados de lípidos (como prostaglandinas , leucotrienos y factor activador de plaquetas ) y citocinas (como interleucina 1 , interleucina 3 , interleucina 4 , interleucina 5 , interleucina 6 , interleucina 13 , factor de necrosis tumoral alfa , GM-CSF y varias quimiocinas ) . [36] [37] Estos mediadores contribuyen a la inflamación al atraer a otros leucocitos .
Sobre los eosinófilos
Los parásitos grandes como el helminto (gusano) Schistosoma mansoni son demasiado grandes para ser ingeridos por los fagocitos. También tienen una estructura externa llamada tegumento que es resistente al ataque de sustancias liberadas por macrófagos y mastocitos. Sin embargo, estos parásitos pueden recubrirse con IgE y ser reconocidos por FcεRII en la superficie de los eosinófilos . Los eosinófilos activados liberan mediadores preformados como la proteína básica mayor y enzimas como la peroxidasa , contra las cuales los helmintos no son resistentes. [38] [39] La interacción del receptor FcεRII con la porción Fc de la IgE unida al helminto hace que el eosinófilo libere estas moléculas en un mecanismo similar al de la célula NK durante ADCC. [40]
Sobre los linfocitos T
Las células T CD4+ ( células T maduras ) ayudan a las células B que producen anticuerpos. Se observan varios subconjuntos de células T CD4+ efectoras activadas en la patología de la enfermedad. Estudios anteriores resumidos por Sanders y Lynch en 1993 sugirieron funciones críticas para los FcR en las respuestas inmunes mediadas por células T CD4+ y propusieron la formación de un complejo de señalización conjunto entre los FcR y el TCR en la superficie celular. [41] [42] [43] [44] Chauhan y colaboradores informaron la colocalización de los IC marcados con el complejo CD3 en la superficie de las células T CD4+ activadas, lo que sugiere la coexistencia de los FcR junto con el complejo TCR. [45] Se observa que ambos receptores forman una estructura apical en la membrana de las células T CD4+ activadas, lo que sugiere el movimiento lateral de estos receptores. [46] Se observa la co-migración de FcRs con el complejo TCR y BCR en la superficie de las células y los citoconjugados de células T:B muestran esta coexistencia en el punto de contacto. [47] Una revisión anterior sugirió que la expresión de FcRs en células T CD4+ es una pregunta abierta. [48] Esto estableció el paradigma actual de que las células T no expresan FcRs y estos hallazgos nunca fueron cuestionados ni probados experimentalmente. [49] Chauhan y colaboradores demostraron la unión de complejos inmunes (CI), el ligando de FcR a células T CD4+ activadas. [49] La expresión de CD16a se induce en las células T CD4+ humanas activadas, que expresan CD25, CD69 y CD98 y la ligadura a los CI conduce a la generación de células de memoria efectoras. [50] La señalización de CD16a está mediada por la fosforilación de Syk (pSyk). [50] [51] [52]
Un estudio sugiere ahora una expresión inducida de CD32a tras la activación de células T CD4+ humanas, similar a CD16a. [51] [53] La expresión de CD32a en células T CD4+ también fue sugerida por tres estudios independientes de investigadores del VIH-1. Ahora se confirma la expresión de CD16a y CD32a en un subconjunto de células T CD4+ activadas. [51] [53] Los FcR en la superficie celular al unirse a IC compuestos de ácidos nucleicos desencadenan la producción de citocinas y regulan positivamente las vías de detección de ácidos nucleicos. Los FcR están presentes tanto en la superficie celular como en el citosol. La señalización de CD16a regula positivamente la expresión de receptores tipo toll que detectan ácidos nucleicos y los reubica en la superficie celular. [50] [54] CD16a es una nueva señal coestimuladora para células T CD4+ humanas, que sustituyen con éxito el requisito de CD28 durante la autoinmunidad. [55] En un contexto autoinmunitario, las células T CD4+ pasan por alto el requisito de la co-señalización CD28 para activarse por completo. [55] Además, el bloqueo de la co-señalización CD28 no inhibe el desarrollo de células TFH, un subconjunto clave para la generación de células B plasmáticas autorreactivas productoras de autoanticuerpos. [56] Se requiere un equilibrio entre las señales coestimuladoras e inhibidoras para la homeostasis inmunitaria. La coestimulación excesiva y/o la co-inhibición insuficiente conducen a la ruptura de la tolerancia y a la autoinmunidad. La coestimulación mediada por CD16a proporciona una señal positiva en las células T CD4+ activadas y no en las células inactivas que carecen de expresión de FcγR. [51]
Véase también
Referencias
- ^ Anderson R (2003). "Manipulación de macromoléculas de la superficie celular por flavivirus". Advances in Virus Research . 59 : 229–74. doi :10.1016/S0065-3527(03)59007-8. ISBN 9780120398591. PMC 7252169 . PMID 14696331.
- ^ Owen J, Punt J, Stranford S, Jones P (2009). Inmunología (7.ª ed.). Nueva York: WH Freeman and Company. pág. 423. ISBN 978-14641-3784-6.
- ^ abcd Fridman WH (septiembre de 1991). "Receptores Fc y factores de unión a inmunoglobulina". FASEB Journal . 5 (12): 2684–90. doi : 10.1096/fasebj.5.12.1916092 . PMID 1916092. S2CID 16805557.
- ^ Indik ZK, Park JG, Hunter S, Schreiber AD (diciembre de 1995). "La disección molecular de la fagocitosis mediada por el receptor Fc gamma". Blood . 86 (12): 4389–99. doi : 10.1182/blood.V86.12.4389.bloodjournal86124389 . PMID 8541526.
- ^ Harrison PT, Davis W, Norman JC, Hockaday AR, Allen JM (septiembre de 1994). "La unión de la inmunoglobulina G monomérica desencadena la endocitosis mediada por Fc gamma RI". The Journal of Biological Chemistry . 269 (39): 24396–402. doi : 10.1016/S0021-9258(19)51097-3 . PMID 7929100.
- ^ abcd Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (febrero de 2015). "Glicanos en el sistema inmunológico y la teoría de los glicanos alterados de la autoinmunidad: una revisión crítica". Revista de autoinmunidad . 57 (6): 1–13. doi :10.1016/j.jaut.2014.12.002. PMC 4340844 . PMID 25578468.
- ^ Zhu X, Meng G, Dickinson BL, Li X, Mizoguchi E, Miao L, Wang Y, Robert C, Wu B, Smith PD, Lencer WI, Blumberg RS (marzo de 2001). "El receptor Fc neonatal relacionado con el MHC de clase I para IgG se expresa funcionalmente en monocitos, macrófagos intestinales y células dendríticas". Journal of Immunology . 166 (5): 3266–76. doi :10.4049/jimmunol.166.5.3266. PMC 2827247 . PMID 11207281.
- ^ Firan M, Bawdon R, Radu C, Ober RJ, Eaken D, Antohe F, Ghetie V, Ward ES (agosto de 2001). "El receptor relacionado con el MHC de clase I, FcRn, desempeña un papel esencial en la transferencia maternofetal de gammaglobulina en humanos". Inmunología internacional . 13 (8): 993–1002. doi : 10.1093/intimm/13.8.993 . PMID 11470769.
- ^ Simister NE, Jacobowitz Israel E, Ahouse JC, Story CM (mayo de 1997). "Nuevas funciones del receptor Fc relacionado con el MHC de clase I, FcRn". Biochemical Society Transactions . 25 (2): 481–6. doi :10.1042/bst0250481. PMID 9191140.
- ^ abc Otten MA, van Egmond M (marzo de 2004). "El receptor Fc para IgA (FcalphaRI, CD89)". Immunology Letters . 92 (1–2): 23–31. doi :10.1016/j.imlet.2003.11.018. PMID 15081523.
- ^ Shibuya A, Honda S (diciembre de 2006). "Características moleculares y funcionales del receptor Fcalpha/muR, un nuevo receptor Fc para IgM e IgA". Springer Seminars in Immunopathology . 28 (4): 377–82. doi :10.1007/s00281-006-0050-3. PMID 17061088. S2CID 23794895.
- ^ Cho Y, Usui K, Honda S, Tahara-Hanaoka S, Shibuya K, Shibuya A (junio de 2006). "Características moleculares de la unión de IgA e IgM Fc a Fcalpha / muR". Comunicaciones de investigación bioquímica y biofísica . 345 (1): 474–8. doi :10.1016/j.bbrc.2006.04.084. hdl : 2241/102010 . PMID 16681999.
- ^ Ochiai K, Wang B, Rieger A, Kilgus O, Maurer D, Födinger D, Kinet JP, Stingl G, Tomioka H (1994). "Una revisión sobre Fc epsilon RI en células de Langerhans epidérmicas humanas". Archivos internacionales de alergia e inmunología . 104 Suppl 1 (1): 63–4. doi :10.1159/000236756. PMID 8156009.
- ^ Prussin C, Metcalfe DD (febrero de 2006). "5. IgE, mastocitos, basófilos y eosinófilos". The Journal of Allergy and Clinical Immunology . 117 (2 Suppl Mini–Primer): S450-6. doi :10.1016/j.jaci.2005.11.016. PMID 16455345.
- ^ von Bubnoff D, Novak N, Kraft S, Bieber T (marzo de 2003). "El papel central de FcepsilonRI en la alergia". Dermatología clínica y experimental . 28 (2): 184–7. doi :10.1046/j.1365-2230.2003.01209.x. PMID 12653710. S2CID 2080598.
- ^ Kikutani H, Yokota A, Uchibayashi N, Yukawa K, Tanaka T, Sugiyama K, Barsumian EL, Suemura M, Kishimoto T (2007). "Estructura y función del receptor II Fc ε (Fc ε RII / CD23): un punto de contacto entre la fase efectora de la alergia y la diferenciación de células B". Simposio de la Fundación Ciba 147 - IgE, mastocitos y la respuesta alérgica . Simposios de la Fundación Novartis. vol. 147, págs. 23–35. doi :10.1002/9780470513866.ch3. ISBN 9780470513866. Número de identificación personal 2695308.
- ^ "Receptor FCMR Fc mu [Homo sapiens (humano)] - Gen - NCBI".
- ^ Kubagawa H, Oka S, Kubagawa Y, Torii I, Takayama E, Kang DW, et al. (2009). "Identidad del esquivo receptor IgMFc (FcmuR) en humanos". J. Exp. Med . 206 (12): 2779–93. doi :10.1084/jem.20091107. PMC 2806608. PMID 19858324 .
- ^ Liu J, Wang Y, Xiong E, Hong R, Lu Q, Ohno H, Wang JY (2019). "El papel del receptor Fc de IgM en la inmunidad y la tolerancia". Frontiers in Immunology . 10 : 529. doi : 10.3389/fimmu.2019.00529 . PMC 6438924 . PMID 30967868.
- ^ Selvaraj P, Fifadara N, Nagarajan S, Cimino A, Wang G (2004). "Regulación funcional de los receptores gamma Fc de neutrófilos humanos". Investigación inmunológica . 29 (1–3): 219–30. doi :10.1385/IR:29:1-3:219. PMID 15181284. S2CID 85351071.
- ^ Sulica A, Chambers WH, Manciulea M, Metes D, Corey S, Rabinowich H, Whiteside TL, Herberman RB (1995). "Vías de transducción de señales divergentes y efectos sobre las funciones de las células asesinas naturales inducidas por la interacción de los receptores Fc con ligandos fisiológicos o anticuerpos antirreceptores". Inmunidad natural . 14 (3): 123–33. PMID 8832896.
- ^ Sarfati M, Fournier S, Wu CY, Delespesse G (1992). "Expresión, regulación y función del antígeno Fc épsilon RII (CD23) humano". Investigación inmunológica . 11 (3–4): 260–72. doi :10.1007/BF02919132. PMID 1287120. S2CID 83698996.
- ^ Raghavan M, Bjorkman PJ (1996). "Receptores Fc y sus interacciones con inmunoglobulinas" (PDF) . Revisión anual de biología celular y del desarrollo . 12 : 181–220. doi :10.1146/annurev.cellbio.12.1.181. PMID 8970726.
- ^ ab Swanson JA, Hoppe AD (diciembre de 2004). "La coordinación de la señalización durante la fagocitosis mediada por el receptor Fc". Journal of Leukocyte Biology . 76 (6): 1093–103. doi :10.1189/jlb.0804439. hdl : 2027.42/141562 . PMID 15466916. S2CID 13912335.
- ^ Sun PD (2003). "Estructura y función de los receptores de células asesinas naturales". Investigación inmunológica . 27 (2–3): 539–48. doi :10.1385/IR:27:2-3:539. PMID 12857997. S2CID 29921323.
- ^ Dushek O, Goyette J, van der Merwe PA (noviembre de 2012). "Receptores fosforilados de tirosina no catalíticos". Revisiones inmunológicas . 250 (1): 258–276. doi :10.1111/imr.12008. PMID 23046135. S2CID 1549902.
- ^ Cambier JC (febrero de 1995). "Nueva nomenclatura para el motivo Reth (o ARH1/TAM/ARAM/YXXL)". Inmunología hoy . 16 (2): 110. doi :10.1016/0167-5699(95)80105-7. PMID 7888063.
- ^ Huang ZY, Hunter S, Kim MK, Indik ZK, Schreiber AD (junio de 2003). "El efecto de las fosfatasas SHP-1 y SHIP-1 en la señalización de los receptores Fcgamma que contienen ITIM e ITAM, FcgammaRIIB y FcgammaRIIA". Journal of Leukocyte Biology . 73 (6): 823–9. doi : 10.1189/jlb.0902454 . PMID 12773515. S2CID 14502303.
- ^ Cambier JC (junio de 1997). "¿Abundan los receptores inhibidores?". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (12): 5993–5. Bibcode :1997PNAS...94.5993C. doi : 10.1073/pnas.94.12.5993 . PMC 33673 . PMID 9177155.
- ^ Takai T, Ono M, Hikida M, Ohmori H, Ravetch JV (enero de 1996). "Respuestas humorales y anafilácticas aumentadas en ratones deficientes en Fc gamma RII". Nature . 379 (6563): 346–9. Bibcode :1996Natur.379..346T. doi :10.1038/379346a0. PMID 8552190. S2CID 4364705.
- ^ Coggeshall KM (junio de 1998). "Señalización inhibitoria por Fc gamma RIIb de células B". Current Opinion in Immunology . 10 (3): 306–12. doi :10.1016/s0952-7915(98)80169-6. PMID 9638367.
- ^ Joshi T, Butchar JP, Tridandapani S (octubre de 2006). "Señalización del receptor Fcgamma en fagocitos". Revista Internacional de Hematología . 84 (3): 210–6. doi :10.1532/IJH97.06140. PMID 17050193. S2CID 6501210.
- ^ Trinchieri G, Valiante N (1993). "Receptores para el fragmento Fc de IgG en células asesinas naturales". Natural Immunity . 12 (4–5): 218–34. PMID 8257828.
- ^ Sulica A, Galatiuc C, Manciulea M, Bancu AC, DeLeo A, Whiteside TL, Herberman RB (abril de 1993). "Regulación de la citotoxicidad natural humana por IgG. IV. Asociación entre la unión de IgG monomérica a los receptores Fc en linfocitos granulares grandes y la inhibición de la actividad de las células asesinas naturales (NK)". Inmunología celular . 147 (2): 397–410. doi :10.1006/cimm.1993.1079. PMID 8453679.
- ^ Yamasaki S, Saito T (2005). "Regulación de la activación de los mastocitos a través de FcepsilonRI". Inmunología química y alergia . 87 : 22–31. doi :10.1159/000087568. ISBN . 3-8055-7948-9. Número de identificación personal 16107760.
- ^ Wakahara S, Fujii Y, Nakao T, Tsuritani K, Hara T, Saito H, Ra C (noviembre de 2001). "Perfiles de expresión génica para Fc epsilon RI, citocinas y quimiocinas tras la activación de Fc epsilon RI en mastocitos humanos cultivados derivados de sangre periférica". Citocina . 16 (4): 143–52. doi :10.1006/cyto.2001.0958. PMID 11792124.
- ^ Metcalfe DD, Baram D, Mekori YA (octubre de 1997). "Mast cells". Physiological Reviews . 77 (4): 1033–79. doi :10.1152/physrev.1997.77.4.1033. PMID 9354811.
- ^ David JR, Butterworth AE, Vadas MA (septiembre de 1980). "Mecanismo de interacción que media la muerte de Schistosoma mansoni por eosinófilos humanos". The American Journal of Tropical Medicine and Hygiene . 29 (5): 842–8. doi :10.4269/ajtmh.1980.29.842. PMID 7435788.
- ^ Capron M, Soussi Gounni A, Morita M, Truong MJ, Prin L, Kinet JP, Capron A (1995). "Eosinófilos: de receptores de inmunoglobulina E de baja a alta afinidad". Allergy . 50 (25 Suppl): 20–3. doi :10.1111/j.1398-9995.1995.tb04270.x. PMID 7677229. S2CID 36197719.
- ^ Gounni AS, Lamkhioued B, Ochiai K, Tanaka Y, Delaporte E, Capron A, Kinet JP, Capron M (enero de 1994). "El receptor de IgE de alta afinidad en los eosinófilos está involucrado en la defensa contra los parásitos". Nature . 367 (6459): 183–6. Bibcode :1994Natur.367..183S. doi :10.1038/367183a0. PMID 8114916. S2CID 4331405.
- ^ Pichler WJ, Lum L, Broder S (1978). "Receptores Fc en linfocitos T humanos. I. Transición de células Tgamma a células Tmu". J Immunol . 121 (4): 1540–1548. doi :10.4049/jimmunol.121.4.1540. PMID 308968.
- ^ Sandor M, Lynch RG (mayo de 1993). "Receptores Fc de linfocitos: el caso especial de las células T". Immunol. Today . 14 (5): 227–31. doi :10.1016/0167-5699(93)90168-K. PMID 8517922.
- ^ Engelhardt W, Matzke J, Schmidt RE (1995). "Expresión dependiente de la activación de los receptores de IgG de baja afinidad Fc gamma RII(CD32) y Fc gamma RIII(CD16) en subpoblaciones de linfocitos T humanos". Inmunobiología . 192 (5): 297–320. doi :10.1016/s0171-2985(11)80172-5. PMID 7649565.
- ^ Moretta L, Webb SR, Grossi CE, Lydyard PM, Cooper MD (1977). "Análisis funcional de dos subpoblaciones de células T humanas: ayuda y supresión de las respuestas de las células B por parte de las células T que portan receptores para IgM o IgG". J Exp Med . 146 (1): 184–200. doi :10.1084/jem.146.1.184. PMC 2180738 . PMID 301544.
- ^ Chauhan AK, Moore TL (2011). "Activación de células T por complejo terminal del complemento y complejos inmunes". The Journal of Biological Chemistry . 286 (44): 38627–38637. doi : 10.1074/jbc.M111.266809 . PMC 3207419 . PMID 21900254.
- ^ Chauhan AK, Moore TL (2011). "Activación de células T por complejo terminal del complemento y complejos inmunes". The Journal of Biological Chemistry . 286 (44): 38627–38637. doi : 10.1074/jbc.M111.266809 . PMC 3207419 . PMID 21900254.
- ^ Sandor M, Lynch RG (1993). "Receptores Fc de linfocitos: el caso especial de las células T". Inmunología Hoy . 14 (5): 227–231. doi :10.1016/0167-5699(93)90168-K. PMID 8517922.
- ^ Nimmerjahn F, Ravetch JV (enero de 2008). "Receptores Fcgamma como reguladores de las respuestas inmunitarias". Nat. Rev. Immunol . 8 (1): 34–47. doi :10.1038/nri2206. PMID 18064051. S2CID 34597359.
- ^ ab Bruhns P, Jönsson F (noviembre de 2015). "Funciones efectoras del receptor de FcR en ratones y humanos". Immunol. Rev. 268 ( 1): 25–51. doi :10.1111/imr.12350. PMID 26497511. S2CID 19544801.
- ^ abc Chauhan AK, Moore TL, Bi Y, Chen C (enero de 2016). "La coseñal FcγRIIIa-Syk modula la respuesta de las células T CD4+ y regula positivamente la expresión del receptor tipo Toll (TLR)". J. Biol. Chem . 291 (3): 1368–86. doi : 10.1074/jbc.M115.684795 . PMC 4714221. PMID 26582197 .
- ^ abcd Chauhan AK, Chen C, Moore TL, DiPaolo RJ (febrero de 2015). "La expresión inducida de FcγRIIIa (CD16a) en las células T CD4+ desencadena la generación del subconjunto IFN-γhigh". J. Biol. Chem . 290 (8): 5127–40. doi : 10.1074/jbc.M114.599266 . PMC 4335247. PMID 25556651 .
- ^ Chauhan AK, Moore TL (2012). "Los complejos inmunes y las proteínas tardías del complemento desencadenan la activación de la tirosina quinasa Syk en las células T CD4(+) humanas". Clin Exp Immunol . 167 (2): 235–245. doi :10.1111/j.1365-2249.2011.04505.x. PMC 3278689 . PMID 22235999.
- ^ ab Holgado MP, Sananez I, Raiden S, Geffner JR, Arruvito L (2018). "La ligación de CD32 promueve la activación de las células T CD4+". Front Immunol . 9 : 2814. doi : 10.3389/fimmu.2018.02814 . PMC 6284025 . PMID 30555482.
- ^ Chauhan AK (2017). "La señalización de FcgammaRIIIa modula las respuestas TLR endosómicas en las células T CD4+ humanas". J Immunol . 198 (12): 4596–4606. doi :10.4049/jimmunol.1601954. PMC 5505339 . PMID 28500073.
- ^ ab Bour-Jordan H, Esensten JH, Martinez-Llordella M, Penaranda C, Stumpf M, Bluestone JA (2011). "Control intrínseco y extrínseco de la tolerancia periférica de las células T por moléculas coestimulantes de la familia CD28/B7". Immunol Rev . 241 (1): 180–205. doi :10.1111/j.1600-065X.2011.01011.x. PMC 3077803 . PMID 21488898.
- ^ Weber JP, Fuhrmann F, Feist RK, Lahmann A, Al Baz MS, Gentz LJ, Vu Van D, Mages HW, Haftmann C, Riedel R, Grun JR, Schuh W, Kroczek RA, Radbruch A, Mashreghi MF, Hutloff A (2015). "ICOS mantiene el fenotipo de las células T foliculares auxiliares mediante la regulación negativa del factor 2 similar a Kruppel". Revista de Medicina Experimental . 212 (2): 217–233. doi :10.1084/jem.20141432. PMC 4322049 . PMID 25646266.
Lectura adicional
- Janeway CA, Travers P, Waldport M, Shlomchik MJ (2001). "Capítulo 9. La respuesta inmunitaria humoral". Inmunobiología: el sistema inmunitario en la salud y la enfermedad (5.ª ed.). Nueva York: Garland. ISBN 978-0-8153-3642-6.
- Abbas AK, Lichtman AH, Pillai S (2012). "Capítulo 12: Mecanismos efectores de la inmunidad humoral". Inmunología celular y molecular (7.ª ed.). Filadelfia: Elsevier/Saunders. ISBN 978-1-4377-1528-6.
- Gerber JS, Mosser DM (febrero de 2001). "Señales estimuladoras e inhibidoras que se originan en los receptores Fcgamma de los macrófagos". Microbes and Infection . 3 (2): 131–9. doi :10.1016/s1286-4579(00)01360-5. PMID 11251299.
- Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (febrero de 2015). "Glicanos en el sistema inmunológico y la teoría de los glicanos alterados de la autoinmunidad: una revisión crítica". Journal of Autoimmunity . 57 : 1–13. doi :10.1016/j.jaut.2014.12.002. PMC 4340844 . PMID 25578468.
Enlaces externos
- Receptor Fc+ en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.