Ácido isociánico
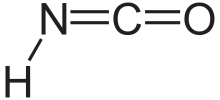 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Ácido isociánico | |
| Otros nombres Carbimida [1] Imida carbónica | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.109.068 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Oficial de alto rango | |
| Masa molar | 43,025 g·mol −1 |
| Apariencia | Gas incoloro (se condensa cerca de la temperatura ambiente) |
| Densidad | 1,14 g/cm3 [ 2] |
| Punto de fusión |
|
| Punto de ebullición | 23,5 °C (74,3 °F; 296,6 K) (extrapolado) [2] |
| Se disuelve; polimeriza si se concentra | |
| Solubilidad | Soluble en benceno , tolueno , éter dietílico. |
| Acidez (p K a ) | 3.7 [4] |
| Ácido conjugado | Oxometaniminio [5] |
| Base conjugada | Cianato |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Venenoso |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido isociánico es un compuesto químico con la fórmula estructural HNCO, que a menudo se escribe como H−N=C=O . Es un gas incoloro, volátil y venenoso , que se condensa a 23,5 °C. Es el tautómero predominante y un isómero del ácido cianúrico (también conocido como cianol) ( H−O−C≡N ) .
El anión derivado del ácido isociánico es el mismo que el anión derivado del ácido cianhídrico, y ese anión es [N=C=O] − , que se llama cianato . El grupo funcional relacionado −N=C=O es isocianato ; es distinto del cianato ( −O−C≡N ), fulminato ( −O−N + ≡C − ) y óxido de nitrilo ( −C≡N + −O − ). [6]
El ácido isociánico fue descubierto en 1830 por Justus von Liebig y Friedrich Wöhler . [7]
El ácido isociánico es el compuesto químico estable más simple que contiene carbono , hidrógeno , nitrógeno y oxígeno , los cuatro elementos más comunes en la química orgánica y la biología. Es el único bastante estable de los cuatro isómeros lineales con fórmula molecular HOCN que se han sintetizado, los otros son el ácido cianico (cianol, H−O−C≡N ) y el esquivo ácido fulmínico ( H−C≡N + −O − ) [8] y el ácido isofulmínico H−O−N + ≡C − . [6] [9]
Estructura
Ácido isociánico (HNCO)
Aunque la estructura electrónica según la teoría del enlace de valencia se puede escribir como H−N=C=O, el espectro vibracional tiene una banda en 2268,8 cm −1 en la fase gaseosa, que algunos dicen que indica un triple enlace carbono-nitrógeno. [10] [11] Si es así, entonces la forma canónica H−N + ≡C−O − es la estructura de resonancia principal .
Sin embargo, el análisis vibracional clásico indicaría que 2268,8 cm −1 es el estiramiento asimétrico N=C=O, según Colthup et al., [12] así como el NIST Chemistry WebBook, [13] que también informa que el estiramiento simétrico N=C=O correspondiente (débil en infrarrojo, pero fuerte en Raman) es 1327 cm −1 . Con base en estas asignaciones clásicas, no hay necesidad de invocar un estado de carga completa para los átomos de N y O, para explicar los datos espectrales vibracionales.
Ácido ciánico (HOCN)
El tautómero , conocido como ácido cianico, HOCN, en el que el átomo de oxígeno está protonado, existe en equilibrio con el ácido isociánico en una proporción de aproximadamente el 3%. [ cita requerida ] [ dudoso – discutir ] El espectro vibracional es indicativo de la presencia de un triple enlace entre los átomos de nitrógeno y carbono. [11]
Propiedades
En solución acuosa es un ácido débil , con un p K a de 3,7: [4]
- HNCO ⇌ H + + NCO −
El ácido isociánico se hidroliza a dióxido de carbono y amoniaco :
- HNCO2 + H2O → CO2 + NH3
Las soluciones diluidas de ácido isociánico son estables en disolventes inertes , por ejemplo, éter e hidrocarburos clorados . [2]
En altas concentraciones, el ácido isociánico se oligomeriza para dar lugar al trímero ácido cianúrico y ciamelida , un polímero. Estas especies suelen separarse fácilmente de los productos de reacción en fase líquida o gaseosa. [2]
El ácido isociánico reacciona con aminas para dar ureas (carbamidas):
- HNCO2 + RNH2 → RNH2HC(O) NH2
Esta reacción se denomina carbamilación . El exceso de ácido isociánico puede reaccionar con las ureas para dar lugar a alofanatos . [2]
El HNCO se agrega a través de enlaces dobles ricos en electrones, como los éteres vinílicos , para dar los isocianatos correspondientes.
El ácido isociánico, HNCO, es un ácido de Lewis cuyos cambios de energía libre , entalpía y entropía para su asociación 1:1 con varias bases en solución de tetracloruro de carbono a 25 °C han sido reportados. [14] Las propiedades aceptoras del HNCO se comparan con otros ácidos de Lewis en el modelo ECW .
La fotólisis a baja temperatura de sólidos que contienen HNCO crea el ácido cianico tautómero H−O−C≡N , también llamado cianato de hidrógeno. [15] El ácido cianico puro no ha sido aislado, y el ácido isociánico es la forma predominante en todos los solventes. [2] A veces, la información presentada para el ácido cianico en los libros de referencia es en realidad para el ácido isociánico. [ cita requerida ]
Preparación
El ácido isociánico se puede fabricar mediante protonación del anión cianato , por ejemplo a partir de sales como el cianato de potasio , ya sea por cloruro de hidrógeno gaseoso o ácidos como el ácido oxálico . [16]
- H ++ NCO− → HNCO
El HNCO también se puede producir mediante la descomposición térmica a alta temperatura del ácido cianúrico trimérico :
- C3H3N3O3 → 3HNCO
En todos los casos, el ácido resultante debe mantenerse muy frío o en forma gaseosa, ya que el ácido isociánico concentrado polimeriza rápidamente por encima de -20 °C. [2]
En el reverso de la famosa síntesis de urea de Friedrich Wöhler ,
- CO(NH2 ) 2 → HNCO + NH3
Se produce ácido isociánico y se trimeriza rápidamente a ácido cianúrico.
Aparición
Se ha detectado ácido isociánico en muchos tipos de entornos interestelares . [9]
El ácido isociánico también está presente en diversas formas de humo , incluido el smog y el humo del cigarrillo . Se detectó mediante espectrometría de masas y se disuelve fácilmente en agua , lo que representa un riesgo para la salud de los pulmones. [17]
Véase también
Referencias
- ^ La cianamida también tiene este nombre, y por lo que es más sistemáticamente correcto.
- ^ abcdefgh Narula, Acharan S.; Ramachandran, Kishore (2001). "Ácido isociánico". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri072m. ISBN 0-471-93623-5.
- ^ Pradyot Patnaik. Manual de productos químicos inorgánicos . McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ ab Pettit, Gwyneth; Pettit, Leslie. "SC-Database" (base de datos patentada). Timble, Yorks: Academic Software — a través de un ejecutable propietario.
- ^ "Oxometaniminio | CH2NO | ChemSpider". www.chemspider.com . Consultado el 27 de enero de 2019 .
- ^ ab Martin, William R.; Ball, David W. (2019). "Pequeños fulminatos orgánicos como materiales de alta energía. Fulminatos de acetileno, etileno y aleno". Revista de materiales energéticos . 37 (1): 70–79. Código Bibliográfico :2019JEnM...37...70M. doi :10.1080/07370652.2018.1531089.
- ^ Liebig, J.; Wöhler, F. (1830). "Untersuchungen über die Cyansäuren". Ana. Física . 20 (11): 394. Código bibliográfico : 1830AnP....96..369L. doi : 10.1002/andp.18300961102.
- ^ Kurzer, Frederick (2000). "Ácido fulmínico en la historia de la química orgánica". Revista de educación química . 77 (7): 851–857. Código Bibliográfico :2000JChEd..77..851K. doi :10.1021/ed077p851.
- ^ ab Quan, Donghui; Herbst, Eric; Osamura, Yoshihiro; Roueff, Evelyne (2010). "Modelado de grano de gas de ácido isociánico (Hnco), ácido cianhídrico (Hocn), ácido fulmínico (Hcno) y ácido isofulmínico (Honc) en diversos entornos interestelares". The Astrophysical Journal . 725 (2): 2101–2109. Bibcode :2010ApJ...725.2101Q. doi :10.1088/0004-637X/725/2/2101. hdl : 1811/47796 .
- ^ Nakamoto, parte A, pág. 190
- ^ ab Teles, Joaquim Henrique; Maier, Günther; Andes Hess, B.; Schaad, Lawrence J.; Winnewisser, Manfred; Winnewisser, Brenda P. (1989). "Los isómeros CHNO". Chemische Berichte . 122 (4): 753–766. doi :10.1002/cber.19891220425.
- ^ Colthup, Norman B.; Daly, Lawrence H.; Wiberley, Stephen E. (1990). Introducción a la espectroscopia infrarroja y Raman. Academic Press (Elsevier). ISBN 978-0-12-182554-6.
- ^ "Ácido isociánico". Instituto Nacional de Normas y Tecnología (Departamento de Comercio de EE. UU.) . Consultado el 20 de abril de 2023 .
- ^ Nelson, J. (1970) Complejos de ácido isociánico unidos por enlaces de hidrógeno: espectros infrarrojos y mediciones termodinámicas. Spectrochimica Acta Part A: Molecular Spectroscopy 26,109-120.
- ^ Jacox, ME; Milligan, DE (1964). "Estudio infrarrojo a baja temperatura de intermediarios en la fotólisis de HNCO y DNCO". Journal of Chemical Physics . 40 (9): 2457–2460. Código Bibliográfico :1964JChPh..40.2457J. doi :10.1063/1.1725546.
- ^ Fischer, G.; Geith, J.; Klapötke, TM; Krumm B. (2002). "Síntesis, propiedades y estudio de dimerización del ácido isociánico" (PDF) . Z. Naturforsch . 57b (1): 19–25. doi :10.1515/znb-2002-0103. S2CID 37461221.
- ^ Preidt, Robert. "Un producto químico presente en el humo puede suponer un riesgo para la salud". MyOptumHealth . AccuWeather . Consultado el 14 de septiembre de 2011 .
Enlaces externos
- Walter, Wolfgang (1997). Química orgánica: texto y libro de consulta para la licenciatura. Chichester: Albion Publishing. pág. 364. ISBN 978-1-898563-37-2. Consultado el 21 de junio de 2008 .
- Ácido cianhídrico del NIST Chemistry WebBook (consultado el 9 de septiembre de 2006)


