EA-4056
 | |
 | |
| Nombres | |
|---|---|
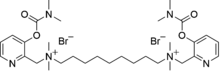
| Nombre IUPAC Dimetobromuro de 1,9-bis[metil-2(3-dimetilcarbamoxipiridil)metilamino]nonano | |
| Nombre IUPAC preferido Dibromuro de N 1 , N 9 -Bis({3-[(dimetilcarbamoil)oxi]piridin-2-il}metil)-N 1 , N 1 , N 9 , N 9 -tetrametilnonano -1,9-bis(aminio) | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
Identificador de centro de PubChem |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C31H52N6O4 · Br2 | |
| Masa molar | 732,6 g/mol |
| Apariencia | sólido cristalino |
| Punto de fusión | 100–105 °C |
| Solubilidad | soluble en agua y alcoholes |
| Peligros | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 11 µg/kg para ratones y 2,7 µg/kg para conejos por vía intravenosa |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El EA-4056 es un agente nervioso carbamato letal porque inhibe la acetilcolinesterasa . [1] La inhibición provoca una acumulación excesiva de acetilcolina entre las células nerviosas y musculares . Esto paraliza los músculos al impedir su relajación. Los músculos paralizados incluyen los músculos que se utilizan para respirar. [2]
La patente asignada al Ejército de los EE. UU. para EA-4056, entre otros agentes nerviosos similares, se presentó el 7 de diciembre de 1967. [3] Patenta derivados con 3 a 11 carbonos en la cadena de alcanos de conexión.
Letalidad
Los carbamatos como el EA-4056 se absorben bien en los pulmones, el tracto gastrointestinal y la piel. Los signos y síntomas de la exposición a dichos carbamatos son similares a los de otros agentes nerviosos. En general, su penetración a través de la barrera hematoencefálica es difícil debido a los nitrógenos cuaternarios de estas moléculas . [4] A pesar de esto, se afirma que el EA-4056 es aproximadamente tres veces más tóxico que el VX (otro agente nervioso). [1] Para el VX, la dosis letal media (LD 50 ) para hombres de 70 kg a través de la exposición a la piel se estima en 10 mg, y el tiempo de concentración letal (LCt 50 ), que mide la concentración del vapor por longitud de tiempo de exposición, se estima en 30-50 mg·min/m 3 . [5] Estos valores para el EA-4056 pueden estimarse en 3,3 mg y 10-16,7 mg·min/m 3 por división .
La LD50 intravenosa para EA-4056 es 0,0011 mg/kg para ratones y 0,0027 mg/kg para conejos. [3]
Propiedades
El CAS del EA-4056 es 110913-96-7, su masa es de 732,6 g/mol, su punto de fusión es de 100 a 105 °C y es soluble en agua y alcoholes. Es un sólido cristalino. [1] El EA-4056 se evapora lentamente en el aire, por lo que puede clasificarse como extremadamente persistente en el medio ambiente si se descuidan los posibles efectos de factores externos como la luz solar y el agua ( humedad del aire ). Se han descrito otras sales además de las sales de bromo . [1]
Síntesis
Se prepara el precursor de 2-dimetilaminometil-3-dimetilcarbamoxipiridina. Se elabora mediante la reacción de Mannich utilizando 3-piridol (CAS 109-00-2), dimetilamina y formaldehído . El 2-((Dimetilamino)metil)piridin-3-ol (CAS 2168-13-0) resultante se carbamoila luego con cloruro de dimetilcarbamoilo . Para obtener un producto diferente, se pueden utilizar otras aminas secundarias distintas de la dimetilamina, como las que contienen grupos metilo , etilo , propilo , isopropilo , butilo y bencilo . [6]
Se calientan 2 moles de 2-dimetilaminometil-3-dimetilcarbamoxipiridina y aproximadamente 1 mol de α,ω -dihalo alcano (por ejemplo, 1,9-dibromononano en este caso) en acetonitrilo en un baño de vapor durante 6 horas. Luego se deja reposar durante la noche a temperatura ambiente. El producto cristalino se recoge por filtración y luego se tritura con acetona . Si no se separa ningún sólido, se agrega acetato de etilo para precipitar el producto crudo. Luego, el producto se disuelve en etanol caliente y se trata con carbón decolorante . Se agrega acetato de etilo a la solución filtrada para precipitar el producto cristalino. Luego, se recoge el producto E-4056 y se seca. El rendimiento es del 95%. [3] [6]
Se pueden obtener otras sales estables de EA-4056 distintas del bromuro , como sulfato , nitrato , hidrógeno , oxalato y perclorato . Se pueden utilizar otros α,ω-dihaloalcanos para obtener moléculas similares con diferentes longitudes de cadena de carbono. [6]
Véase también
Referencias
- ^ abcd Hank ED (2008). Manual de agentes de guerra química y biológica (2.ª ed.). Boca Raton: CRC Press. págs. 116-117. ISBN 9780849314346.OCLC 82473582 .
- ^ Colović MB, Krstić DZ, Lazarević-Pašti TD, Bondžić AM, Vasić VM (mayo de 2013). "Inhibidores de la acetilcolinesterasa: farmacología y toxicología". Neurofarmacología actual . 11 (3): 315–35. doi :10.2174/1570159X11311030006. PMC 3648782 . PMID 24179466.
- ^ abc Patente estadounidense 04512246, Harold Z. Sommer, Havre De Grace, John Krenzer, Oak Park, Omer O. Owens, Jacob I. Miller, "Agentes químicos", expedida el 30 de junio de 1987, asignada al Secretario del Ejército de los EE. UU.
- ^ Gupta RC (2015). "Carbamatos". Manual de toxicología de agentes de guerra química (2.ª ed.). Ámsterdam: Elsevier/Academic Press. págs. 338-339. ISBN 9780128004944.OCLC 433545336 .
- ^ Personal de la FAS (2013). «Tipos de armas químicas: agentes nerviosos [Tabla. Datos toxicológicos]». Washington, DC: Federación de Científicos Estadounidenses [FAS]. Archivado desde el original el 26 de noviembre de 2016. Consultado el 20 de marzo de 2018 .
- ^ abc Patente estadounidense 4677204A, Harold Z. Sommer, Havre de Grace, Omer O. Owens, "Agentes químicos", expedida el 30 de junio de 1987, asignada al Secretario del Ejército de los EE. UU.