Óxido nitroso
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombres IUPAC Óxido nitroso [1] (no recomendado) Óxido de dinitrógeno [2] (nombre alternativo) | |
| Nombre sistemático de la IUPAC Oxodiazina-2-io-1-ida | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 8137358 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.030.017 |
| Número E | E942 (agentes de recubrimiento, ...) |
| 2153410 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1070 (comprimido) 2201 (líquido) |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| norte 2Oh | |
| Masa molar | 44,013 g/mol |
| Apariencia | gas incoloro |
| Densidad | 1,977 g/L (gas) |
| Punto de fusión | −90,86 °C (−131,55 °F; 182,29 K) |
| Punto de ebullición | -88,48 °C (-127,26 °F; 184,67 K) |
| 1,5 g/l (15 °C) | |
| Solubilidad | soluble en alcohol , éter , ácido sulfúrico |
| registro P | 0,35 |
| Presión de vapor | 5150 kPa (20 °C) |
| −18,9·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1,000516 (0 °C, 101,325 kPa) |
| Viscosidad | 14,90 μPa·s [3] |
| Estructura | |
| lineal, C ∞v | |
| 0,166 D | |
| Termoquímica | |
Entropía molar estándar ( S ⦵ 298 ) | 219,96 J/(K·mol) |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | +82,05 kJ/mol |
| Farmacología | |
| N01AX13 ( OMS ) | |
| Inhalación | |
| Farmacocinética : | |
| 0,004% | |
| 5 minutos | |
| Respiratorio | |
| Peligros | |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H270 , H280 , H281 | |
| P220 , P244 , P282 , P317 , P336 , P370+P376 , P403 , P410+P403 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Ficha de datos de seguridad (FDS) | Ilo.org, ICSC 0067 |
| Compuestos relacionados | |
| Óxido nítrico Trióxido de dinitrógeno Dióxido de nitrógeno Tetróxido de dinitrógeno Pentóxido de dinitrógeno | |
Compuestos relacionados | Azida de nitrato de amonio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El óxido nitroso (óxido de dinitrógeno o monóxido de dinitrógeno), conocido comúnmente como gas de la risa , nitroso , aire facticio , entre otros, [4] es un compuesto químico , un óxido de nitrógeno con la fórmula N
2O . A temperatura ambiente, es un gas incoloro, no inflamable y tiene un aroma y sabor ligeramente dulces. [4] A temperaturas elevadas, el óxido nitroso es un oxidante potente similar al oxígeno molecular. [4]
El óxido nitroso tiene importantes usos médicos , especialmente en cirugía y odontología , por sus efectos anestésicos y analgésicos , [5] y está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [6] Su nombre coloquial, "gas de la risa", acuñado por Humphry Davy , describe los efectos eufóricos al inhalarlo, que hacen que se use como una droga recreativa que induce un breve " subidón ". [5] [7] Cuando se abusa de forma crónica, puede causar daño neurológico a través de la inactivación de la vitamina B 12 . También se utiliza como oxidante en propulsores de cohetes y combustibles de carreras de autos , y como gas espumoso para crema batida.
El óxido nitroso también es un contaminante atmosférico , con una concentración de 333 partes por mil millones (ppb) en 2020, aumentando a un ritmo de 1 ppb anualmente. [8] [9] Es un importante eliminador de ozono estratosférico , con un impacto comparable al de los CFC . [10] Alrededor del 40% de las emisiones causadas por los humanos provienen de la agricultura , [11] [12] ya que los fertilizantes nitrogenados son digeridos en óxido nitroso por microorganismos del suelo. [13] Como tercer gas de efecto invernadero más importante , el óxido nitroso contribuye sustancialmente al calentamiento global . [14] [15] La reducción de las emisiones es un objetivo importante en la política del cambio climático . [16]
Usos
Motores de cohetes
El óxido nitroso puede utilizarse como oxidante en un motor de cohete . En comparación con otros oxidantes, es mucho menos tóxico y más estable a temperatura ambiente, lo que hace que sea más fácil de almacenar y más seguro de llevar en un vuelo. Su alta densidad y baja presión de almacenamiento (cuando se mantiene a bajas temperaturas) lo hacen altamente competitivo con los sistemas de gas almacenado a alta presión. [17] Además, puede descomponerse para formar aire respirable.
En una patente de 1914, el pionero estadounidense de los cohetes Robert Goddard sugirió el óxido nitroso y la gasolina como posibles propulsores para un cohete de combustible líquido. [18] El óxido nitroso ha sido el oxidante de elección en varios diseños de cohetes híbridos (que utilizan combustible sólido con un oxidante líquido o gaseoso). La combinación de óxido nitroso con combustible de polibutadieno con terminación hidroxilo ha sido utilizada por SpaceShipOne y otros. También se utiliza notablemente en cohetería amateur y de alta potencia con diversos plásticos como combustible.
El óxido nitroso también se puede utilizar como monopropelente . En presencia de un catalizador calentado a una temperatura de 1070 °F (577 °C), N
2El O se descompone exotérmicamente en nitrógeno y oxígeno inofensivos. [19] Debido a la gran liberación de calor, la acción catalítica rápidamente se vuelve secundaria, ya que la autodescomposición térmica se vuelve dominante. En un propulsor de vacío, esto puede proporcionar un impulso específico monopropelente ( I sp ) de hasta 180 s. Si bien es notablemente menor que el I sp disponible en los propulsores de hidracina (monopropelente o bipropelente con tetróxido de dinitrógeno ), la menor toxicidad hace que el óxido nitroso sea una opción que vale la pena.
La ignición del óxido nitroso depende críticamente de la presión. Deflagra aproximadamente a 600 °C (1112 °F) a una presión de 309 psi (21 atmósferas). [20] A 600 psi , la energía de ignición requerida es de solo 6 julios, mientras que a 130 psi, una entrada de energía de ignición de 2500 julios es insuficiente. [21] [22]
Motor de combustión interna
En las carreras de vehículos , el óxido nitroso (a menudo llamado " nitroso ") aumenta la potencia del motor al proporcionar más oxígeno durante la combustión, lo que permite que el motor queme más combustible. Es un agente oxidante aproximadamente equivalente al peróxido de hidrógeno y mucho más fuerte que el oxígeno molecular. El óxido nitroso no es inflamable a baja presión/temperatura, pero a unos 570 grados F (300 C), su descomposición proporciona más oxígeno que el aire atmosférico. A menudo se mezcla con otro combustible que es más fácil de deflagrar.
El óxido nitroso se almacena como un líquido comprimido. En el colector de admisión de un motor , la evaporación y expansión del líquido provoca una gran caída en la temperatura de la carga de admisión, lo que da como resultado una carga más densa y permite que ingrese más mezcla de aire y combustible al cilindro. A veces, el óxido nitroso se inyecta en el colector de admisión (o antes de él), mientras que otros sistemas lo inyectan directamente justo antes del cilindro (inyección directa en el puerto).
La técnica fue utilizada durante la Segunda Guerra Mundial por los aviones de la Luftwaffe con el sistema GM-1 para aumentar la potencia de salida de los motores de las aeronaves . Originalmente pensada para proporcionar a los aviones estándar de la Luftwaffe un rendimiento superior a gran altitud, las consideraciones tecnológicas limitaron su uso a altitudes extremadamente altas. En consecuencia, solo se utilizó en aviones especializados, como aviones de reconocimiento de gran altitud , bombarderos de alta velocidad y aviones interceptores de gran altitud . A veces se podía encontrar en aviones de la Luftwaffe también equipados con otro sistema de refuerzo del motor, MW 50 , una forma de inyección de agua para motores de aviación que usaban metanol para sus capacidades de refuerzo.
Uno de los principales problemas del oxidante óxido nitroso en un motor alternativo es el exceso de potencia: si la estructura mecánica del motor no está debidamente reforzada, puede resultar gravemente dañada o destruida. Es importante, en el caso de la adición de óxido nitroso a los motores de gasolina, mantener unas temperaturas de funcionamiento y unos niveles de combustible adecuados y uniformemente distribuidos para evitar la preignición (también llamada detonación o detonación). [23] Sin embargo, la mayoría de los problemas asociados con el óxido nitroso no se deben al exceso de potencia, sino a una presión excesiva, ya que el gas acumula una carga mucho más densa en el cilindro. El aumento de la presión y la temperatura pueden derretir, agrietar o deformar el pistón, la válvula y la culata.
El óxido nitroso líquido de grado automotriz difiere levemente del de grado médico. Una pequeña cantidad de dióxido de azufre ( SO
2) se añade para prevenir el abuso de sustancias. [24]
Propelente de aerosol para alimentos

2Oh, cargadores de crema batida
El gas está aprobado para su uso como aditivo alimentario ( número E : E942), específicamente como propulsor de aerosoles . Se utiliza habitualmente en latas de crema batida en aerosol y aerosoles para cocinar .
El gas es extremadamente soluble en compuestos grasos. En la nata montada en aerosol presurizada, se disuelve en la nata grasa hasta que sale de la lata, cuando se convierte en gaseoso y crea espuma. Esto produce nata montada con un volumen cuatro veces mayor que el líquido, mientras que al batir aire en la nata solo se obtiene el doble de volumen. A diferencia del aire, el óxido nitroso inhibe el enranciamiento de la grasa de la mantequilla. El dióxido de carbono no se puede utilizar para la nata montada porque es ácido en el agua, lo que cuajaría la nata y le daría un "brillo" similar al del agua carbonatada.
La crema batida extra espumosa producida con óxido nitroso es inestable y volverá a estar líquida en media hora o una hora. [25] Por lo tanto, no es adecuada para decorar alimentos que no se servirán inmediatamente.
En diciembre de 2016, hubo escasez de crema batida en aerosol en los Estados Unidos, y el uso de crema batida enlatada alcanzó su pico durante la temporada navideña y festiva , debido a una explosión en la planta de óxido nitroso de Air Liquide en Florida a fines de agosto. La empresa priorizó el suministro restante de óxido nitroso para clientes médicos en lugar de para la fabricación de alimentos. [26]
Además, el aceite en aerosol para cocinar, elaborado a partir de diversos aceites con emulsionante de lecitina , puede usar óxido nitroso como propulsor o, alternativamente, alcohol de grado alimenticio o propano .
Médico

2Tanques de oxígeno utilizados en odontología
El óxido nitroso se ha utilizado en odontología y cirugía, como anestésico y analgésico, desde 1844. [27] En los primeros tiempos, el gas se administraba a través de inhaladores simples que consistían en una bolsa de respiración hecha de tela de goma. [28] Hoy en día, el gas se administra en los hospitales por medio de una máquina de analgesia relativa automatizada , con un vaporizador de anestesia y un ventilador médico , que proporciona un flujo de óxido nitroso dosificado con precisión y activado por la respiración mezclado con oxígeno en una proporción de 2:1.
El óxido nitroso es un anestésico general débil , por lo que no suele utilizarse solo en la anestesia general, sino como gas portador (mezclado con oxígeno) para fármacos anestésicos generales más potentes, como el sevoflurano o el desflurano . Tiene una concentración alveolar mínima del 105% y un coeficiente de reparto sangre/gas de 0,46. El uso de óxido nitroso en la anestesia puede aumentar el riesgo de náuseas y vómitos posoperatorios. [29] [30] [31]
Los dentistas utilizan una máquina más sencilla que sólo emite una N
2Sobre / Sobre
2mezcla para que el paciente la inhale mientras está consciente, pero debe seguir siendo un caudalímetro analgésico relativo dedicado y diseñado para un propósito reconocido con un mínimo del 30 % de oxígeno en todo momento y un límite superior máximo del 70 % de óxido nitroso. El paciente se mantiene consciente durante todo el procedimiento y conserva las facultades mentales adecuadas para responder a las preguntas e instrucciones del dentista. [32]
La inhalación de óxido nitroso se utiliza con frecuencia para aliviar el dolor asociado con el parto , los traumatismos , la cirugía oral y el síndrome coronario agudo (incluidos los ataques cardíacos). Se ha demostrado que su uso durante el parto es una ayuda segura y eficaz para las mujeres que dan a luz. [33] Se desconoce el beneficio de su uso para el síndrome coronario agudo. [34]
En Canadá y el Reino Unido, los equipos de ambulancias (incluidos los profesionales no registrados) utilizan habitualmente Entonox y Nitronox como gases analgésicos rápidos y muy eficaces.
El óxido nitroso al 50% puede ser considerado para su uso por personal de primeros auxilios no profesional capacitado en entornos prehospitalarios, dada la relativa facilidad y seguridad de administrar óxido nitroso al 50% como analgésico. La rápida reversibilidad de su efecto también evitaría que impida el diagnóstico. [35]
Recreativo



La inhalación recreativa de óxido nitroso , para inducir euforia y ligeras alucinaciones , comenzó entre la clase alta británica en 1799 en reuniones conocidas como "fiestas del gas de la risa". [36]
A partir del siglo XIX, la amplia disponibilidad del gas para fines médicos y culinarios permitió que su uso recreativo se expandiera enormemente a nivel mundial. En el Reino Unido, en 2014, se estimaba que casi medio millón de jóvenes consumían óxido nitroso en locales nocturnos, festivales y fiestas. [37]
El uso recreativo generalizado de la droga en todo el Reino Unido fue presentado en el documental de Vice de 2017 Inside The Laughing Gas Black Market , en el que el periodista Matt Shea se reunió con traficantes de la droga que la robaban de los hospitales. [38]
Un tema importante citado en la prensa de Londres es el efecto de la basura arrojada por los botes de óxido nitroso, que es muy visible y causa quejas significativas de las comunidades. [39]
Antes del 8 de noviembre de 2023, en el Reino Unido, el óxido nitroso estaba sujeto a la Ley de Sustancias Psicoactivas de 2016, por la que era ilegal producir, suministrar, importar o exportar óxido nitroso para uso recreativo. La ley actualizada prohibía la posesión de óxido nitroso y lo clasificaba como una droga de clase C según la Ley de Uso Indebido de Drogas de 1971. [40]
Si bien la mayoría de los usuarios recreativos entienden que el óxido nitroso produce un "subidón seguro", muchos desconocen que el consumo excesivo puede causar daños neurológicos que, si no se tratan, pueden causar daños neurológicos permanentes. [41] En Australia, el uso recreativo se convirtió en un problema de salud pública tras un aumento de los informes de neurotoxicidad y de los ingresos a urgencias . En el estado de Australia del Sur, en 2020 se aprobó una legislación para restringir las ventas de envases. [42]
En 2024, bajo el nombre callejero de “Galaxy Gas”, el óxido nitroso se ha vuelto muy popular entre los jóvenes para uso recreativo. La mayor parte de esta popularidad se ha fomentado a través de TikTok . [43]
Seguridad
El óxido nitroso es un riesgo ocupacional importante para cirujanos, dentistas y enfermeras. Debido a que el gas se metaboliza mínimamente en humanos (con una tasa de 0,004%), conserva su potencia cuando el paciente lo exhala en la habitación y puede intoxicar al personal clínico si la habitación está mal ventilada, con una posible exposición crónica. Un sistema de ventilación de aire fresco de flujo continuo o N
2Puede ser necesario un sistema de depuración para evitar la acumulación de gases residuales. [ cita requerida ]
El Instituto Nacional de Seguridad y Salud Ocupacional recomienda que se controle la exposición de los trabajadores al óxido nitroso durante la administración de gas anestésico en operadores médicos, dentales y veterinarios. [44] Estableció un límite de exposición recomendado (REL) de 25 ppm (46 mg/m 3 ) para el anestésico escapado. [45]
Discapacidad mental y manual
La exposición al óxido nitroso provoca un deterioro a corto plazo de la cognición, la agudeza audiovisual y la destreza manual, así como desorientación espacial y temporal, [46] poniendo al usuario en riesgo de sufrir lesiones accidentales. [47]
Neurotoxicidad y neuroprotección
El óxido nitroso es neurotóxico y el consumo habitual a mediano o largo plazo de cantidades significativas puede causar daño neurológico con potencial de daño permanente si no se trata. [42] [41]
Se cree que, al igual que otros antagonistas del receptor NMDA , N
2El óxido nitroso produce lesiones de Olney en roedores tras una exposición prolongada (varias horas). [48] [49] [50] [51]
Sin embargo, debido a que normalmente se expulsa del cuerpo rápidamente, es menos probable que sea neurotóxico que otros antagonistas de NMDAR. [52] En roedores, la exposición a corto plazo produce solo una lesión leve que es rápidamente reversible, y la muerte neuronal ocurre solo después de una exposición constante y sostenida. [48] El óxido nitroso también puede causar neurotoxicidad después de una exposición prolongada debido a la hipoxia . Esto es especialmente cierto en el caso de formulaciones no médicas como los cargadores de crema batida ("whippits" o "nangs"), [53] que no contienen gas oxígeno. [54]
En los informes a los centros de control de intoxicaciones, los grandes consumidores (≥400 g o ≥200 L de gas N2O en una sesión) o los consumidores frecuentes (regulares, es decir, a diario o semanalmente) han desarrollado signos de neuropatía periférica : ataxia (anomalías en la marcha) o parestesia (percepción de sensaciones como hormigueo, entumecimiento o picor, principalmente en las extremidades). Estos signos tempranos de daño neurológico indican toxicidad crónica . [55]
El óxido nitroso podría tener un uso terapéutico en el tratamiento del accidente cerebrovascular . En un modelo de roedores, el óxido nitroso al 75% en volumen redujo la muerte neuronal inducida por isquemia inducida por la oclusión de la arteria cerebral media y disminuyó la afluencia de Ca 2+ inducida por NMDA en cultivos de células neuronales, una causa de excitotoxicidad . [52]
Daño del ADN
La exposición ocupacional al óxido nitroso ambiental se ha asociado con daño al ADN, debido a interrupciones en la síntesis de ADN. [56] Esta correlación depende de la dosis [57] [58] y no parece extenderse al uso recreativo ocasional; sin embargo, se necesitan más investigaciones para confirmar el nivel de exposición necesario para causar daño.
Privación de oxígeno
La inhalación de óxido nitroso puro provoca una falta de oxígeno, lo que provoca presión arterial baja, desmayos e incluso ataques cardíacos. Esto puede ocurrir si el usuario inhala grandes cantidades de forma continua, como ocurre con una máscara con correa conectada a una bombona de gas u otro sistema de inhalación, o si contiene la respiración durante un tiempo prolongado. [ cita requerida ]
Vitamina B12deficiencia
La exposición prolongada al óxido nitroso puede causar deficiencia de vitamina B12 . Esto puede causar neurotoxicidad grave si el usuario tiene una deficiencia preexistente de vitamina B12 . [ 59] Inactiva la forma de cobalamina de la vitamina B12 por oxidación. Los síntomas de deficiencia de vitamina B12 , que incluyen neuropatía sensorial , mielopatía y encefalopatía , pueden ocurrir en cuestión de días o semanas después de la exposición a la anestesia con óxido nitroso en personas con deficiencia subclínica de vitamina B12 .
Los síntomas se tratan con altas dosis de vitamina B 12 , pero la recuperación puede ser lenta e incompleta. [60]
Las personas con niveles normales de vitamina B12 tienen reservas que hacen que los efectos del óxido nitroso sean insignificantes, a menos que la exposición sea repetida y prolongada (abuso de óxido nitroso). Se deben controlar los niveles de vitamina B12 en personas con factores de riesgo de deficiencia de vitamina B12 antes de utilizar anestesia con óxido nitroso. [61]
Desarrollo prenatal
Varios estudios experimentales en ratas indican que la exposición crónica de hembras preñadas al óxido nitroso puede tener efectos adversos en el feto en desarrollo. [62] [63] [64]
Riesgos químicos/físicos
A temperatura ambiente (20 °C [68 °F]), la presión de vapor saturado es de 50,525 bar, y aumenta hasta 72,45 bar a 36,4 °C (97,5 °F), la temperatura crítica . Por lo tanto, la curva de presión es inusualmente sensible a la temperatura. [65]
Al igual que con muchos oxidantes fuertes, la contaminación de piezas con combustibles se ha visto implicada en accidentes de cohetería, donde pequeñas cantidades de mezclas de nitroso/combustible explotan debido a efectos similares a los de un " golpe de ariete " (a veces llamado "dieselización": el calentamiento debido a la compresión adiabática de los gases puede alcanzar temperaturas de descomposición). [66] Algunos materiales de construcción comunes, como el acero inoxidable y el aluminio, pueden actuar como combustibles con oxidantes fuertes como el óxido nitroso, al igual que los contaminantes que pueden encenderse debido a la compresión adiabática. [67]
También se han producido incidentes en los que la descomposición de óxido nitroso en las tuberías ha provocado la explosión de grandes tanques. [20]
Mecanismo de acción
El mecanismo de acción farmacológico del N inhalado
2No se conoce completamente el efecto del O. Sin embargo, se ha demostrado que modula directamente una amplia gama de canales iónicos controlados por ligando , lo que probablemente desempeña un papel importante. Bloquea moderadamente los canales NMDAR y nACh que contienen la subunidad β 2 , inhibe débilmente los receptores AMPA , kainato , GABA C y 5-HT 3 , y potencia ligeramente los receptores GABA A y glicina . [68] [69] También se ha demostrado que activa los receptores K de dos dominios de poro .+
canales . [70] Mientras que N
2El O afecta a varios canales iónicos, sus efectos anestésicos, alucinógenos y euforizantes probablemente se deben principalmente a la inhibición de las corrientes mediadas por el receptor NMDA. [68] [71] Además de sus efectos sobre los canales iónicos, el N
2El O puede actuar de manera similar al óxido nítrico (NO) en el sistema nervioso central. [71] El óxido nitroso es de 30 a 40 veces más soluble que el nitrógeno.
Los efectos de la inhalación de dosis subanestésicas de óxido nitroso pueden variar de manera impredecible según los entornos y las diferencias individuales; [72] [73] sin embargo, Jay (2008) [47] sugiere que induce de manera confiable los siguientes estados y sensaciones:
- Intoxicación
- Euforia/disforia
- Desorientación espacial
- Desorientación temporal
- Sensibilidad reducida al dolor
Una minoría de usuarios también experimenta vocalizaciones incontroladas y espasmos musculares. Estos efectos generalmente desaparecen minutos después de retirar la fuente de óxido nitroso. [47]
Efecto ansiolítico
En pruebas de comportamiento de ansiedad , una dosis baja de N
2El O es un ansiolítico eficaz . Este efecto ansiolítico se asocia con una mayor actividad de los receptores GABA A , ya que se revierte parcialmente con antagonistas de los receptores de benzodiazepinas . En consonancia con esto, los animales que han desarrollado tolerancia a los efectos ansiolíticos de las benzodiazepinas son parcialmente tolerantes al N
2O . [74] De hecho, en humanos a los que se les administró un 30% de N
2Los antagonistas de los receptores de benzodiazepinas redujeron los informes subjetivos de sentirse "colocado", pero no alteraron el rendimiento psicomotor . [75] [76]
Efecto analgésico
Los efectos analgésicos del N
2Los O están relacionados con la interacción entre el sistema opioide endógeno y el sistema noradrenérgico descendente . Cuando se administra morfina crónicamente a los animales, estos desarrollan tolerancia a sus efectos analgésicos, y esto también los vuelve tolerantes a los efectos analgésicos del N
2O. [77] La administración de anticuerpos que se unen y bloquean la actividad de algunos opioides endógenos (no la β-endorfina ) también bloquean los efectos antinociceptivos de N
2O. [78] Los fármacos que inhiben la descomposición de los opioides endógenos también potencian los efectos antinociceptivos de N
2O . [78] Varios experimentos han demostrado que los antagonistas de los receptores opioides aplicados directamente al cerebro bloquean los efectos antinociceptivos del N
2Oh , pero estos medicamentos no tienen efecto cuando se inyectan en la médula espinal .
Además de una acción indirecta, el óxido nitroso, al igual que la morfina [79], también interactúa directamente con el sistema opioide endógeno al unirse a los sitios de unión del receptor opioide. [80] [81]
Por el contrario, los antagonistas de los receptores adrenérgicos α2 bloquean los efectos analgésicos del N
2O cuando se administra directamente a la médula espinal, pero no cuando se aplica directamente al cerebro. [82] De hecho, los ratones knock out del receptor α2B o los animales con deficiencia de noradrenalina son casi completamente resistentes a los efectos antinociceptivos del N
2O . [83] Aparentemente N
2La liberación inducida por O de opioides endógenos provoca la desinhibición de las neuronas noradrenérgicas del tronco encefálico , que liberan noradrenalina en la médula espinal e inhiben la señalización del dolor. [84] Exactamente cómo N
2Aún no se sabe con certeza cómo provoca la liberación de péptidos opioides endógenos.
Propiedades y reacciones químicas
El óxido nitroso es un gas incoloro con un ligero olor dulce.
El óxido nitroso favorece la combustión liberando el radical de oxígeno unido mediante enlaces dipolares , y puede así volver a encender una tablilla incandescente .
norte
2El O es inerte a temperatura ambiente y tiene pocas reacciones. A temperaturas elevadas, su reactividad aumenta. Por ejemplo, el óxido nitroso reacciona con NaNH
2a 187 °C (369 °F) para dar NaN
3:
- 2 NaNH 2 + N 2 O → NaN 3 + NaOH + NH 3
La reacción anterior es la ruta adoptada por la industria química comercial para producir sales de azida , que se utilizan como detonadores. [85]
Historia
El gas fue sintetizado por primera vez en 1772 por el filósofo natural y químico inglés Joseph Priestley , quien lo llamó aire nitroso desflogistizado (ver teoría del flogisto ) [86] o aire nitroso inflamable . [87] Priestley publicó su descubrimiento en el libro Experimentos y observaciones sobre diferentes tipos de aire (1775) , donde describió cómo producir la preparación de "aire nitroso disminuido", calentando limaduras de hierro humedecidas con ácido nítrico . [88]
Uso temprano

El primer uso importante del óxido nitroso fue posible gracias a Thomas Beddoes y James Watt , quienes trabajaron juntos para publicar el libro Consideraciones sobre el uso médico y sobre la producción de aires facticios (1794) . Este libro fue importante por dos razones. En primer lugar, James Watt había inventado una nueva máquina para producir " aires facticios " (incluido el óxido nitroso) y un nuevo "aparato respiratorio" para inhalar el gas. En segundo lugar, el libro también presentó las nuevas teorías médicas de Thomas Beddoes, de que la tuberculosis y otras enfermedades pulmonares podían tratarse mediante la inhalación de "aires facticios". [27]

La máquina para producir "Aires facticios" tenía tres partes: un horno para quemar el material necesario, un recipiente con agua por donde pasaba el gas producido a través de un tubo en espiral (para "lavarse" las impurezas) y, finalmente, el cilindro de gas con un gasómetro donde el gas producido, "aire", podía introducirse en bolsas de aire portátiles (fabricadas con seda aceitosa hermética). El aparato respiratorio consistía en una de las bolsas de aire portátiles conectada con un tubo a una boquilla. Con este nuevo equipo diseñado y producido en 1794, se allanó el camino para los ensayos clínicos , [ aclaración necesaria ] que comenzaron en 1798 cuando Thomas Beddoes estableció la " Institución neumática para aliviar enfermedades por aires médicos" en Hotwells ( Bristol ). En el sótano del edificio, una máquina a gran escala producía los gases bajo la supervisión de un joven Humphry Davy, a quien se animó a experimentar con nuevos gases para que los pacientes los inhalaran. [27] El primer trabajo importante de Davy fue el estudio del óxido nitroso y la publicación de sus resultados en el libro: Investigaciones químicas y filosóficas (1800) . En esa publicación, Davy señala el efecto analgésico del óxido nitroso en la página 465 y su potencial para ser utilizado en operaciones quirúrgicas en la página 556. [89] Davy acuñó el nombre de "gas de la risa" para el óxido nitroso. [90]
A pesar del descubrimiento de Davy de que la inhalación de óxido nitroso podía aliviar el dolor de una persona consciente, transcurrieron otros 44 años antes de que los médicos intentaran utilizarlo como anestesia . El uso de óxido nitroso como droga recreativa en las "fiestas de gas hilarante", organizadas principalmente para la clase alta británica , se convirtió en un éxito inmediato a partir de 1799. Si bien los efectos del gas generalmente hacen que el usuario parezca estuporoso, soñador y sedado, algunas personas también "se ríen" en un estado de euforia y con frecuencia estallan en carcajadas. [91]
Uno de los primeros productores comerciales en los EE. UU. fue George Poe , primo del poeta Edgar Allan Poe , quien también fue el primero en licuar el gas. [92]
Uso de anestesia
La primera vez que se utilizó óxido nitroso como fármaco anestésico en el tratamiento de un paciente fue cuando el dentista Horace Wells , con la ayuda de Gardner Quincy Colton y John Mankey Riggs , demostró insensibilidad al dolor tras una extracción dental el 11 de diciembre de 1844. [93] En las semanas siguientes, Wells trató a los primeros 12 a 15 pacientes con óxido nitroso en Hartford, Connecticut , y, según su propio historial, solo fracasó en dos casos. [94] A pesar de que Wells informó de estos resultados convincentes a la sociedad médica de Boston en diciembre de 1844, este nuevo método no fue adoptado inmediatamente por otros dentistas. La razón de esto fue muy probablemente que Wells, en enero de 1845, en su primera demostración pública ante la facultad de medicina de Boston, había tenido un éxito parcial, lo que dejó a sus colegas con dudas sobre su eficacia y seguridad. [95] El método no se generalizó hasta 1863, cuando Gardner Quincy Colton comenzó a utilizarlo con éxito en todas sus clínicas de la "Colton Dental Association", que acababa de establecer en New Haven y la ciudad de Nueva York . [27] Durante los tres años siguientes, Colton y sus asociados administraron con éxito óxido nitroso a más de 25.000 pacientes. [28] Hoy en día, el óxido nitroso se utiliza en odontología como ansiolítico, como complemento de la anestesia local .
Sin embargo, no se encontró que el óxido nitroso fuera un anestésico lo suficientemente fuerte para su uso en cirugías mayores en entornos hospitalarios. En su lugar, se demostró y aceptó el uso del éter dietílico , al ser un anestésico más fuerte y potente, en octubre de 1846, junto con el cloroformo en 1847. [27] Sin embargo, cuando Joseph Thomas Clover inventó el "inhalador de gas-éter" en 1876, se convirtió en una práctica común en los hospitales iniciar todos los tratamientos anestésicos con un flujo suave de óxido nitroso y luego aumentar gradualmente la anestesia con el éter más fuerte o el cloroformo. El inhalador de gas-éter de Clover fue diseñado para suministrar al paciente óxido nitroso y éter al mismo tiempo, y la mezcla exacta era controlada por el operador del dispositivo. Siguió utilizándose en muchos hospitales hasta la década de 1930. [28] Aunque hoy en día los hospitales utilizan una máquina de anestesia más avanzada , estas máquinas todavía utilizan el mismo principio iniciado con el inhalador de gas-éter de Clover, para iniciar la anestesia con óxido nitroso, antes de la administración de un anestésico más potente.
Como medicamento patentado
La popularización del óxido nitroso por parte de Colton condujo a su adopción por parte de varios curanderos poco respetables , que lo promocionaban como una cura para la tuberculosis , la escrófula , el catarro y otras enfermedades de la sangre, la garganta y los pulmones. El tratamiento con óxido nitroso fue administrado y autorizado como medicamento patentado por personas como CL Blood y Jerome Harris en Boston y Charles E. Barney en Chicago. [96] [97]
Producción
Se utilizan varios métodos para producir óxido nitroso. [98]
Métodos industriales
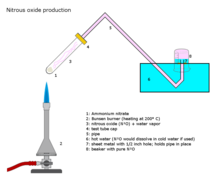
El óxido nitroso se prepara a escala industrial calentando cuidadosamente el nitrato de amonio [98] a unos 250 °C, que se descompone en óxido nitroso y vapor de agua. [99]
- NH4NO3 → 2H2O + N2O
La adición de diversas sales de fosfato favorece la formación de un gas más puro a temperaturas ligeramente más bajas. Esta reacción puede ser difícil de controlar, lo que da lugar a una detonación . [100]
Métodos de laboratorio
La descomposición del nitrato de amonio también es un método de laboratorio común para preparar el gas. De manera equivalente, se puede obtener calentando una mezcla de nitrato de sodio y sulfato de amonio : [101]
- 2 NaNO 3 + (NH 4 ) 2 SO 4 → Na 2 SO 4 + 2 N 2 O + 4 H 2 O
Otro método implica la reacción de urea, ácido nítrico y ácido sulfúrico: [102]
- 2 (NH 2 ) 2 CO + 2 HNO 3 + H 2 SO 4 → 2 N 2 O + 2 CO 2 + (NH 4 ) 2 SO 4 + 2 H 2 O
Se ha informado sobre la oxidación directa de amoníaco con un catalizador de dióxido de manganeso y óxido de bismuto : [103] cf. Proceso de Ostwald .
- 2 NH 3 + 2 O 2 → N 2 O + 3 H 2 O
El cloruro de hidroxilamonio reacciona con el nitrito de sodio para formar óxido nitroso. Si se añade el nitrito a la solución de hidroxilamina, el único subproducto que queda es agua salada. Sin embargo, si se añade la solución de hidroxilamina a la solución de nitrito (hay un exceso de nitrito), también se forman óxidos de nitrógeno superiores tóxicos:
- NH3OHCl + NaNO2 → N2O + NaCl + 2 H2O
Tratamiento del HNO
3con SnCl
2Y también se ha demostrado que el HCl:
- 2 HNO 3 + 8 HCl + 4 SnCl 2 → 5 H 2 O + 4 SnCl 4 + N 2 O
El ácido hiponitroso se descompone en N 2 O y agua con una vida media de 16 días a 25 °C a pH 1-3. [104]
- H2N2O2 → H2O + N2O
Ocurrencia atmosférica
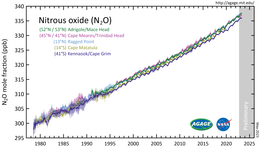



El óxido nitroso es un componente menor de la atmósfera de la Tierra y es una parte activa del ciclo planetario del nitrógeno . Según el análisis de muestras de aire recogidas en sitios de todo el mundo, su concentración superó las 330 ppb en 2017. [8] La tasa de crecimiento de aproximadamente 1 ppb por año también se ha acelerado durante las últimas décadas. [9] La abundancia atmosférica de óxido nitroso ha crecido más del 20% desde un nivel base de aproximadamente 270 ppb en el año 1750. [106]
Propiedades atmosféricas importantes del N
2Los O se resumen en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Potencial de agotamiento de la capa de ozono (PAO) | 0,017 [ 107] ( CCl3F = 1 ) |
| Potencial de calentamiento global (GWP: 100 años) | 273 [108] ( CO2 = 1 ) |
| Vida útil atmosférica | 116 ± 9 años [109] |
En 2022, el IPCC informó que: "La perturbación humana del ciclo natural del nitrógeno mediante el uso de fertilizantes sintéticos y estiércol, así como la deposición de nitrógeno resultante de la agricultura terrestre y la quema de combustibles fósiles, ha sido el principal impulsor del aumento del N2O atmosférico de 31,0 ± 0,5 ppb (10%) entre 1980 y 2019". [109]
Emisiones por fuente
17,0 (12,2 a 23,5) millones de toneladas de nitrógeno promedio anual total en N
2Se emitieron O en 2007-2016. [109] Alrededor del 40% de N
2Las emisiones de O provienen de los seres humanos y el resto es parte del ciclo natural del nitrógeno . [110] El N
2El O emitido cada año por los humanos tiene un efecto invernadero equivalente a unos 3 mil millones de toneladas de dióxido de carbono: a modo de comparación, los humanos emitieron 37 mil millones de toneladas de dióxido de carbono real en 2019, y metano equivalente a 9 mil millones de toneladas de dióxido de carbono. [111]
La mayor parte de la N
2El O emitido a la atmósfera, de fuentes naturales y antropogénicas, es producido por microorganismos como bacterias desnitrificantes y hongos en suelos y océanos. [112] Los suelos bajo vegetación natural son una fuente importante de óxido nitroso, representando el 60% de todas las emisiones producidas naturalmente. Otras fuentes naturales incluyen los océanos (35%) y las reacciones químicas atmosféricas (5%). [113] Los humedales también pueden ser emisores de óxido nitroso . [114] [115] Las emisiones del deshielo del permafrost pueden ser significativas, pero a partir de 2022 esto no es seguro. [109]
Los principales componentes de las emisiones antropogénicas son los suelos agrícolas fertilizados y el estiércol del ganado (42%), la escorrentía y lixiviación de fertilizantes (25%), la quema de biomasa (10%), la combustión de combustibles fósiles y los procesos industriales (10%), la degradación biológica de otras emisiones atmosféricas que contienen nitrógeno (9%) y las aguas residuales humanas (5%). [116] [117] [118] [119] [120] La agricultura mejora la producción de óxido nitroso mediante el cultivo del suelo, el uso de fertilizantes nitrogenados y el manejo de desechos animales. [121] Estas actividades estimulan a las bacterias naturales a producir más óxido nitroso. Las emisiones de óxido nitroso del suelo pueden ser difíciles de medir, ya que varían notablemente con el tiempo y el espacio, [122] y la mayoría de las emisiones de un año pueden ocurrir cuando las condiciones son favorables durante los "momentos calientes" [123] [124] y/o en lugares favorables conocidos como "puntos calientes". [125]
Entre las emisiones industriales, la producción de ácido nítrico y ácido adípico son las mayores fuentes de emisiones de óxido nitroso. Las emisiones de ácido adípico surgen específicamente de la degradación del intermedio ácido nitroso derivado de la nitración de ciclohexanona. [116] [126] [127]
Procesos biológicos
Los procesos microbianos que generan óxido nitroso pueden clasificarse como nitrificación y desnitrificación . En concreto, incluyen:
- nitrificación autótrofa aeróbica, la oxidación gradual del amoníaco ( NH
3) a nitrito ( NO−
2) y al nitrato ( NO−
3) - Desnitrificación heterotrófica anaeróbica, la reducción gradual de NO−
3A NO−
2, óxido nítrico (NO), N
2O y finalmente N
2, donde las bacterias anaerobias facultativas utilizan NO−
3como aceptor de electrones en la respiración de material orgánico en condiciones de oxígeno insuficiente ( O
2) - desnitrificación nitrificante, que se lleva a cabo por NH autótrofo
3-bacterias oxidantes y la vía por la que el amoníaco ( NH
3) se oxida a nitrito ( NO−
2), seguido de la reducción de NO−
2al óxido nítrico (NO), N
2O y nitrógeno molecular ( N
2) - nitrificación heterotrófica
- desnitrificación aeróbica por los mismos nitrificadores heterotróficos
- desnitrificación fúngica
- Quimiodesnitrificación no biológica
Estos procesos se ven afectados por las propiedades químicas y físicas del suelo, como la disponibilidad de nitrógeno mineral y materia orgánica , la acidez y el tipo de suelo, así como por factores relacionados con el clima, como la temperatura del suelo y el contenido de agua.
La emisión del gas a la atmósfera está limitada en gran medida por su consumo dentro de las células, mediante un proceso catalizado por la enzima óxido nitroso reductasa . [128]
Impacto ambiental
Contabilidad global de N
2El estudio de las fuentes y sumideros de nitrógeno durante el decenio que finalizó en 2016 indica que aproximadamente el 40% de los 17 TgN/año ( teragramos o millones de toneladas métricas de nitrógeno por año) promedio de emisiones se originaron en la actividad humana, y muestra que el crecimiento de las emisiones provino principalmente de la expansión de la agricultura . [11] [12]
Efecto invernadero

El óxido nitroso tiene un potencial significativo de calentamiento global como gas de efecto invernadero . En términos de moléculas, durante un período de 100 años, el óxido nitroso tiene 265 veces la capacidad de atrapar el calor atmosférico del dióxido de carbono ( CO
2). [108] Sin embargo, debido a su baja concentración (menos de 1/1.000 de la del CO
2), su contribución al efecto invernadero es menos de un tercio de la del dióxido de carbono, y también menor que la del metano . [129] Por otra parte, dado que aproximadamente el 40% del N
2El óxido nitroso que entra a la atmósfera es el resultado de la actividad humana, [116] el control del óxido nitroso es parte de los esfuerzos para reducir las emisiones de gases de efecto invernadero. [130]
La mayor parte del óxido nitroso liberado a la atmósfera por los seres humanos es una emisión de gases de efecto invernadero provenientes de la agricultura , cuando los agricultores añaden fertilizantes a base de nitrógeno a los campos, y a través de la descomposición del estiércol animal. La reducción de las emisiones puede ser un tema candente en la política del cambio climático . [131]
El óxido nitroso también se libera como subproducto de la quema de combustibles fósiles, aunque la cantidad liberada depende del combustible utilizado. También se emite a través de la fabricación de ácido nítrico , que se utiliza en la síntesis de fertilizantes nitrogenados. La producción de ácido adípico, un precursor del nailon y otras fibras sintéticas para la ropa, también libera óxido nitroso. [132]
Se ha implicado a un aumento en las concentraciones de óxido nitroso atmosférico como un posible contribuyente al calentamiento global extremadamente intenso durante el evento del límite Cenomaniano-Turoniano . [133]
Agotamiento de la capa de ozono
El óxido nitroso también se ha relacionado con el debilitamiento de la capa de ozono . Un estudio de 2009 sugirió que el óxido nitroso
2La emisión de O fue la emisión más importante que daña la capa de ozono y se esperaba que siguiera siendo la mayor a lo largo del siglo XXI. [10] [134]
Legalidad
India
La transferencia de óxido nitroso desde cilindros a granel a tanques tipo E más pequeños y transportables, con capacidad para 1.590 litros [135], es legal cuando se destina a anestesia médica.
Nueva Zelanda
El Ministerio de Salud ha advertido que el óxido nitroso es un medicamento de prescripción cuya venta o posesión sin receta constituye un delito según la Ley de Medicamentos. [136] Esto aparentemente prohibiría todos los usos no medicinales del óxido nitroso, aunque se da a entender que solo se apuntará al uso recreativo.
Reino Unido
En agosto de 2015, el Consejo del distrito londinense de Lambeth ( Reino Unido ) prohibió el uso de la droga con fines recreativos, exponiendo a los infractores a una multa inmediata de hasta 1.000 libras esterlinas. [137]
En septiembre de 2023, el Gobierno anunció que el óxido nitroso sería ilegalizado a finales de año y que su posesión podría conllevar una pena de hasta dos años de prisión o una multa ilimitada. [138]
A NOSOTROS
La posesión de óxido nitroso es legal según la ley federal y no está sujeta a la jurisdicción de la DEA . [139] Sin embargo, está regulada por la Administración de Alimentos y Medicamentos según la Ley de Alimentos, Medicamentos y Cosméticos; el procesamiento es posible según sus cláusulas de "etiquetado incorrecto", que prohíben la venta o distribución de óxido nitroso con fines de consumo humano sin una licencia médica adecuada. Muchos estados tienen leyes que regulan la posesión, venta y distribución de óxido nitroso. Dichas leyes generalmente prohíben la distribución a menores o limitan la cantidad que se puede vender sin una licencia especial. [ cita requerida ] Por ejemplo, en California, la posesión para uso recreativo está prohibida y se califica como un delito menor. [140]
Véase también
Referencias
- ^ "[Óxido nitroso]". Degruyter.com . Consultado el 24 de julio de 2022 .
- ^ Nomenclatura IUPAC de química inorgánica 2005 . PDF, pág. 317.
- ^ Takahashi M, Shibasaki-Kitakawa N, Yokoyama C, Takahashi S (1996). "Viscosidad del óxido nitroso gaseoso de 298,15 K a 398,15 K a presiones de hasta 25 MPa". Journal of Chemical & Engineering Data . 41 (6): 1495–1498. doi :10.1021/je960060d. ISSN 0021-9568.
- ^ abc «Óxido nitroso». PubChem, Biblioteca Nacional de Medicina de EE. UU. 14 de septiembre de 2024. Consultado el 20 de septiembre de 2024 .
- ^ ab Quax ML, Van Der Steenhoven TJ, Bronkhorst MW, Emmink BL (julio de 2020). "Lesión por congelación: un riesgo desconocido al usar óxido nitroso como droga de fiesta". Acta Chirurgica Belgica . 120 (1–4). Taylor & Francis en representación de la Real Sociedad Belga de Cirugía: 140–143. doi :10.1080/00015458.2020.1782160. ISSN 0001-5458. PMID 32543291. S2CID 219702849.
- ^ Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21.ª lista de 2019. Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 .
- ^ Turner S (30 de agosto de 2024). "Óxido nitroso: ¿para qué sirve?". Drug Science . Consultado el 3 de octubre de 2024 .
- ^ ab "Fracción molar de óxido nitroso (N2O)" (PDF) . Instituto Tecnológico de Massachusetts. Archivado (PDF) del original el 9 de octubre de 2022 . Consultado el 15 de febrero de 2021 .
- ^ ab "Tendencias del óxido nitroso atmosférico". National Oceanic and Atmospheric Administration / Earth System Research Laboratories . Consultado el 15 de febrero de 2021 .
- ^ ab Ravishankara AR, Daniel JS, Portmann RW (2009). "Óxido nitroso (N2O): la principal sustancia que agota la capa de ozono emitida en el siglo XXI". Science . 326 (5949): 123–5. Bibcode :2009Sci...326..123R. doi : 10.1126/science.1176985 . PMID 19713491. S2CID 2100618.
- ^ ab Tian H, Xu R, Canadell JG, Thompson RL, Winiwarter W, Suntharalingam P, et al. (octubre de 2020). "Una cuantificación integral de las fuentes y sumideros globales de óxido nitroso". Nature . 586 (7828): 248–256. Código Bibliográfico :2020Natur.586..248T. doi :10.1038/s41586-020-2780-0. hdl : 1871.1/c74d4b68-ecf4-4c6d-890d-a1d0aaef01c9 . ISSN 1476-4687. PMID 33028999. S2CID 222217027. Archivado desde el original el 3 de diciembre de 2020 . Recuperado el 9 de noviembre de 2020 .
{{cite journal}}: CS1 maint: bot: original URL status unknown (link) - ^ ab Thompson, RL, Lassaletta, L., Patra, PK (2019). "Aceleración de las emisiones globales de N2O observadas a partir de dos décadas de inversión atmosférica". Nat. Cambio climático . 9 (12): 993–998. Bibcode :2019NatCC...9..993T. doi :10.1038/s41558-019-0613-7. hdl : 11250/2646484 . S2CID 208302708.
- ^ "Reducir las emisiones de óxido nitroso". Ag Matters . 13 de diciembre de 2021 . Consultado el 1 de abril de 2024 .
- ^ "Capítulo 8". Informe de Evaluación del Cambio Climático 2013: Bases científicas físicas. págs. 677–678.
- ^ "Las emisiones de óxido nitroso suponen una amenaza climática cada vez mayor, según un estudio". phys.org . Consultado el 9 de noviembre de 2020 .
- ^ Mundschenk S (3 de agosto de 2022). «Los Países Bajos están demostrando cómo no hay que abordar el cambio climático | The Spectator». www.spectator.co.uk . Consultado el 28 de agosto de 2022 .
- ^ Berger, Bruno (5 de octubre de 2007). "¿Es seguro el óxido nitroso?" (PDF) . Swiss Propulsion Laboratory. pp. 1–2. Archivado (PDF) del original el 9 de octubre de 2022.
...Autopresurizante (la presión de vapor a 20 °C es de ~50,1 bar... No tóxico, baja reactividad -> manejo seguro relativo (¿Seguridad general?)... Energía adicional por descomposición (como monopropelente: ISP de 170 s)... El impulso específico no cambia mucho con O/F... [página 2] El N
2
O es un monopropelente (como H
2
O
2
o hidracina...)
- ^ Goddard, RH (1914) "Aparato cohete" Patente estadounidense 1.103.503
- ^ Seguridad del óxido nitroso. Space Propulsion Group (2012)
- ^ ab Munke, Konrad (2 de julio de 2001) Rotura de un remolque de óxido nitroso, informe en el seminario de la CGA "Seguridad y confiabilidad de los gases, equipos e instalaciones industriales", 15-17 de octubre de 2001, St. Louis, Missouri
- ^ "Pautas de seguridad para N2O en materiales compuestos a escala" (PDF) . Materiales compuestos a escala. 17 de junio de 2009. Archivado desde el original (PDF) el 12 de julio de 2011 . Consultado el 29 de diciembre de 2013 .
Por ejemplo, el N2O que fluye a 130 psi en una tubería de material compuesto de epoxi no reaccionaría ni siquiera con una entrada de energía de ignición de 2500 J. Sin embargo, a 600 psi, la energía de ignición requerida era de solo 6 J.
- ^ FR-5904. Aeronaves Pratt & Whitney.
- ^ Cline, Allen W. (enero de 2000) "Conceptos básicos del motor: detonación y preignición". Revista CONTACT!
- ^ "Productos de alto rendimiento Holley, preguntas frecuentes sobre sistemas de óxido nitroso". Holley . Consultado el 18 de diciembre de 2013 .
- ^ "Explora Science | Uso del óxido nitroso como propulsor y en la cocina". Archivado desde el original el 27 de febrero de 2019. Consultado el 19 de febrero de 2019 .
- ^ Dewey C (21 de diciembre de 2016). "La verdadera razón por la que los supermercados se están quedando sin crema batida esta Navidad". The Washington Post . Consultado el 22 de diciembre de 2016 .
- ^ abcde Sneader W (2005). "Medicina sistemática". Descubrimiento de fármacos: una historia. John Wiley and Sons. págs. 74–87. ISBN 978-0-471-89980-8.
- ^ abc Miller AH (1941). "Desarrollo técnico de la anestesia con gas". Anestesiología . 2 (4): 398–409. doi : 10.1097/00000542-194107000-00004 . S2CID 71117361.
- ^ Divatia JV, Vaidya JS, Badwe RA, Hawaldar RW (1996). "La omisión de óxido nitroso durante la anestesia reduce la incidencia de náuseas y vómitos posoperatorios". Anestesiología . 85 (5): 1055–1062. doi : 10.1097/00000542-199611000-00014 . PMID 8916823. S2CID 41549796.
- ^ Hartung J (1996). "Veinticuatro de veintisiete estudios muestran una mayor incidencia de emesis asociada con óxido nitroso que con anestésicos alternativos". Anesthesia & Analgesia . 83 (1): 114–116. doi :10.1213/00000539-199607000-00020.
- ^ Tramèr M, Moore A, McQuay H (febrero de 1996). "Omisión de óxido nitroso en anestesia general: metaanálisis de la conciencia intraoperatoria y la emesis posoperatoria en ensayos controlados aleatorizados". British Journal of Anaesthesia . 76 (2): 186–193. doi : 10.1093/bja/76.2.186 . PMID 8777095.
- ^ Council on Clinical Affairs (2013). "Guideline on use of nitrous oxide for pediatric dental patients" (PDF) (Guía sobre el uso de óxido nitroso para pacientes odontológicos pediátricos) (PDF) (en inglés) . Manual de referencia V37 . 6 : 206–210. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ Copeland C. "Analgesia con óxido nitroso para el parto". Pregnancy.org . Archivado desde el original el 25 de mayo de 2011.
- ^ O'Connor RE, Brady W, Brooks SC, Diercks D, Egan J, Ghaemmaghami C, et al. (2010). "Parte 10: síndromes coronarios agudos: Pautas de la American Heart Association de 2010 para reanimación cardiopulmonar y atención cardiovascular de emergencia". Circulation . 122 (18 Suppl 3): S787–817. doi : 10.1161/CIRCULATIONAHA.110.971028 . PMID 20956226.
- ^ Faddy SC, Garlick SR (1 de diciembre de 2005). "Una revisión sistemática de la seguridad de la analgesia con óxido nitroso al 50 %: ¿pueden los profesionales sanitarios no profesionales utilizar gases analgésicos en el ámbito prehospitalario?". Emergency Medicine Journal . 22 (12): 901–908. doi :10.1136/emj.2004.020891. PMC 1726638 . PMID 16299211.
- ^ Davy H (1800). Investigaciones químicas y filosóficas: principalmente sobre el óxido nitroso, o aire nitroso diflogistizado, y su respiración. Biblioteca de Medicina Francis A. Countway. Londres: impreso para J. Johnson, St. Paul's Church-Yard, por Biggs y Cottle, Bristol.
- ^ "Advertencia sobre el uso indebido del gas hilarante". The Guardian . Londres. Press Association . 9 de agosto de 2014 . Consultado el 9 de agosto de 2014 .
- ^ VICE (7 de febrero de 2017), Inside The Laughing Gas Black Market, archivado del original el 29 de octubre de 2021 , consultado el 29 de marzo de 2019
- ^ "Reciclar cartuchos de gas hilarante usados para obtener dinero en efectivo podría ayudar a crear una Gran Bretaña más limpia". Metro . 10 de julio de 2018 . Consultado el 15 de julio de 2019 .
- ^ "Prohibición del óxido nitroso: orientación". GOV.UK . Consultado el 6 de diciembre de 2023 .
- ^ ab "Óxido nitroso: los usuarios de gas hilarante corren el riesgo de sufrir daños en la columna, según los médicos" . Consultado el 26 de marzo de 2023 .
- ^ ab Evans EB, Evans MR (noviembre de 2021). "Nangs, globos y petardos: neurotoxicidad recreativa por óxido nitroso". Aust J Gen Pract (revisión). 50 (11): 834–838. doi : 10.31128/AJGP-10-20-5668 . PMID 34713284. S2CID 240153502.
- ^ Rakowitz R (27 de septiembre de 2024). "Todo lo que los padres de adolescentes deben saber sobre la droga que se está volviendo viral en TikTok". SheKnows . Consultado el 30 de septiembre de 2024 .
- ^ CDC.gov Alerta del NIOSH: Control de la exposición al óxido nitroso durante la administración de anestesia. Cincinnati, OH: Departamento de Salud y Servicios Humanos de los EE. UU., Servicio de Salud Pública, Centros para el Control de Enfermedades, Instituto Nacional de Seguridad y Salud Ocupacional, DHHS (NIOSH) Publicación N.° 94-100
- ^ "Guía de bolsillo del NIOSH sobre peligros químicos: óxido nitroso". CDC . Consultado el 21 de noviembre de 2015 .
- ^ Criterios para una norma recomendada: exposición ocupacional a gases y vapores anestésicos residuales. Cincinnati, OH: Departamento de Salud, Educación y Bienestar de los EE. UU., Servicio de Salud Pública, Centro para el Control de Enfermedades, Instituto Nacional de Seguridad y Salud Ocupacional, DHEW (NIOSH) Publicación N.° 77B140.
- ^ abc Jay M (1 de septiembre de 2008). "Óxido nitroso: uso recreativo, regulación y reducción de daños". Drugs and Alcohol Today . 8 (3): 22–25. doi :10.1108/17459265200800022.
- ^ ab Jevtovic-Todorovic V, Beals J, Benshoff N, Olney JW (2003). "La exposición prolongada al óxido nitroso anestésico por inhalación mata neuronas en el cerebro de ratas adultas". Neurociencia . 122 (3): 609–16. doi :10.1016/j.neuroscience.2003.07.012. PMID 14622904. S2CID 9407096.
- ^ Nakao S, Nagata A, Masuzawa M, Miyamoto E, Yamada M, Nishizawa N, et al. (2003). "Neurotoxicidad y actividad psicotomimética de los antagonistas del receptor NMDA". Masui. The Japanese Journal of Anesthesiology (en japonés). 52 (6): 594–602. PMID 12854473.
- ^ Jevtovic-Todorovic V, Benshoff N, Olney JW (2000). "La ketamina potencia el daño corticoespinal inducido por el agente anestésico común óxido nitroso en ratas adultas". British Journal of Pharmacology . 130 (7): 1692–8. doi :10.1038/sj.bjp.0703479. PMC 1572233 . PMID 10928976.
- ^ Jevtovic-Todorovic V, Carter LB, Carter (2005). "Los anestésicos óxido nitroso y ketamina son más neurotóxicos para el cerebro de ratas viejas que para el de ratas jóvenes". Neurobiología del envejecimiento . 26 (6): 947–56. doi :10.1016/j.neurobiolaging.2004.07.009. PMID 15718054. S2CID 25095727.
- ^ ab Abraini JH, David HN, Lemaire M (2005). "Propiedades potencialmente neuroprotectoras y terapéuticas del óxido nitroso y el xenón". Anales de la Academia de Ciencias de Nueva York . 1053 (1): 289–300. Bibcode :2005NYASA1053..289A. doi :10.1111/j.1749-6632.2005.tb00036.x. PMID 16179534. S2CID 34160112.
- ^ De Vasconcellos K, Sneyd JR (2013). "Óxido nitroso: ¿seguimos en equilibrio? Una revisión cualitativa de las controversias actuales". British Journal of Anaesthesia . 111 (6): 877–85. doi : 10.1093/bja/aet215 . PMID 23801743.
- ^ Middleton B (2012). Física en anestesia . Banbury, Oxfordshire, Reino Unido: Scion Pub. Ltd. ISBN 978-1-904842-98-9.
- ^ van Riel A (2022). "Aumento alarmante de intoxicaciones por uso recreativo de óxido nitroso tras un cambio en la legislación de la UE, consultas al Centro de Información sobre Venenos de los Países Bajos". Revista Internacional de Políticas de Drogas . 100 : 103519. doi : 10.1016/j.drugpo.2021.103519 . PMID 34753046.
- ^ Randhawa G, Bodenham A (1 de marzo de 2016). "El creciente uso recreativo del óxido nitroso: una revisión de la historia". British Journal of Anaesthesia . págs. 321–324. doi :10.1093/bja/aev297. PMID 26323292.
- ^ Wrońska-Nofer T, Nofer JR, Jajte J, Dziubałtowska E, Szymczak W, Krajewski W, et al. (1 de marzo de 2012). "Daño oxidativo del ADN y estrés oxidativo en sujetos ocupacionalmente expuestos al óxido nitroso (N 2 O)". Investigación de mutaciones/Mecanismos fundamentales y moleculares de la mutagénesis . 731 (1): 58–63. doi :10.1016/j.mrfmmm.2011.10.010. PMID 22085808.
- ^ Wrońska-Nofer T, Palus J, Krajewski W, Jajte J, Kucharska M, Stetkiewicz J, et al. (18 de junio de 2009). "Daño en el ADN inducido por óxido nitroso: Estudio en personal médico de quirófanos". Investigación de mutaciones/Mecanismos fundamentales y moleculares de la mutagénesis . 666 (1–2): 39–43. Código Bib : 2009MRFMM.666...39W. doi :10.1016/j.mrfmmm.2009.03.012. PMID 19439331.
- ^ Flippo TS, Holder WD Jr (1993). "Degeneración neurológica asociada con anestesia con óxido nitroso en pacientes con deficiencia de vitamina B12". Archivos de cirugía . 128 (12): 1391–5. doi :10.1001/archsurg.1993.01420240099018. PMID 8250714.
- ^ Giannini A (1999). Abuso de drogas . Los Ángeles: Health Information Press. ISBN 978-1-885987-11-2.
- ^ Conrad M (4 de octubre de 2006). "Pernicious Anemia". Medscape . Consultado el 2 de junio de 2008 .
- ^ Vieira E, Cleaton-Jones P, Austin J, Moyes D, Shaw R (1980). "Efectos de bajas concentraciones de óxido nitroso en fetos de rata". Anestesia y analgesia . 59 (3): 175–7. doi : 10.1213/00000539-198003000-00002 . PMID 7189346. S2CID 41966990.
- ^ Vieira E (1979). "Efecto de la administración crónica de óxido nitroso al 0,5% a ratas grávidas". British Journal of Anaesthesia . 51 (4): 283–7. doi : 10.1093/bja/51.4.283 . PMID 465253.
- ^ Vieira E, Cleaton-Jones P, Moyes D (1983). "Efectos de concentraciones bajas e intermitentes de óxido nitroso en el feto de rata en desarrollo". British Journal of Anaesthesia . 55 (1): 67–9. doi : 10.1093/bja/55.1.67 . PMID 6821624.
- ^ Óxido nitroso Archivado el 30 de marzo de 2016 en Wayback Machine . Enciclopedia de gas Air Liquide.
- ^ "La vaselina provocó la explosión de un cohete híbrido". Ukrocketman.com.
- ^ "Safetygram 20: Óxido nitroso" (PDF) . Airproducts.com. Archivado desde el original (PDF) el 1 de septiembre de 2006.
- ^ ab Yamakura T, Harris RA (2000). "Efectos de los anestésicos gaseosos óxido nitroso y xenón sobre los canales iónicos regulados por ligando. Comparación con isoflurano y etanol". Anestesiología . 93 (4): 1095–101. doi : 10.1097/00000542-200010000-00034 . PMID 11020766. S2CID 4684919.
- ^ Mennerick S, Jevtovic-Todorovic V, Todorovic SM, Shen W, Olney JW, Zorumski CF (1998). "Efecto del óxido nitroso en la transmisión sináptica excitatoria e inhibidora en cultivos de hipocampo". Journal of Neuroscience . 18 (23): 9716–26. doi :10.1523/JNEUROSCI.18-23-09716.1998. PMC 6793274 . PMID 9822732.
- ^ Gruss M, Bushell TJ, Bright DP, Lieb WR, Mathie A, Franks NP (2004). " Los canales de K + de dos dominios de poro son un nuevo objetivo para los gases anestésicos xenón, óxido nitroso y ciclopropano". Farmacología molecular . 65 (2): 443–52. doi :10.1124/mol.65.2.443. PMID 14742687. S2CID 7762447.
- ^ ab Emmanouil DE, Quock RM (2007). "Avances en la comprensión de las acciones del óxido nitroso". Anesthesia Progress . 54 (1): 9–18. doi :10.2344/0003-3006(2007)54[9:AIUTAO]2.0.CO;2. PMC 1821130 . PMID 17352529.
- ^ Atkinson RM, Green JD, Chenoweth DE, Atkinson JH (1 de octubre de 1979). "Efectos subjetivos del óxido nitroso: experiencias cognitivas, emocionales, perceptuales y trascendentales". Journal of Psychedelic Drugs . 11 (4): 317–330. doi :10.1080/02791072.1979.10471415. PMID 522172.
- ^ Walker DJ, Zacny JP (1 de septiembre de 2001). "Variabilidad intra e interindividual en los efectos subjetivos y de refuerzo del óxido nitroso en voluntarios sanos". Dependencia de drogas y alcohol . 64 (1): 85–96. doi :10.1016/s0376-8716(00)00234-9. PMID 11470344.
- ^ Emmanouil DE, Johnson CH, Quock RM (1994). "Efecto ansiolítico del óxido nitroso en ratones en el laberinto en cruz elevada: mediación por los receptores de benzodiazepina". Psicofarmacología . 115 (1–2): 167–72. doi :10.1007/BF02244768. PMID 7862891. S2CID 21652496.
- ^ Zacny JP, Yajnik S, Coalson D, Lichtor JL, Apfelbaum JL, Rupani G, et al. (1995). "El flumazenil puede atenuar algunos efectos subjetivos del óxido nitroso en humanos: un informe preliminar". Farmacología, bioquímica y comportamiento . 51 (4): 815–9. doi :10.1016/0091-3057(95)00039-Y. PMID 7675863. S2CID 39068081.
- ^ Gillman MA (2022). "¿Qué es mejor para la psiquiatría: concentraciones fijas o tituladas de óxido nitroso?". Portada. Psiquiatría . 13 (773190): 460–3. doi : 10.3389/fpsyt.2022.773190 . PMC 9441863 . PMID 36072452.
- ^ Berkowitz BA, Finck AD, Hynes MD, Ngai SH (1979). "Tolerancia a la analgesia con óxido nitroso en ratas y ratones". Anestesiología . 51 (4): 309–12. doi : 10.1097/00000542-197910000-00006 . PMID 484891. S2CID 26281498.
- ^ ab Branda EM, Ramza JT, Cahill FJ, Tseng LF, Quock RM (2000). "Papel de la dinorfina cerebral en la antinocicepción por óxido nitroso en ratones". Farmacología, bioquímica y comportamiento . 65 (2): 217–21. doi :10.1016/S0091-3057(99)00202-6. PMID 10672972. S2CID 1978597.
- ^ Gillman MA [1986a]. Minirevisión: El óxido nitroso analgésico [subanestésico] interactúa con el sistema opioide endógeno: una revisión de la evidencia. Ciencias de la vida 39: 1209-1221
- ^ (Daras, C., Cantrill, RC, Gillman, MA [1983]. Desplazamiento de 3[H]-naloxona: evidencia del óxido nitroso como agonista opioide. Revista Europea de Farmacología 89: 177-8.
- ^ Ori, C., Ford-Rice, F., Londres, ED [1989]. Efectos del óxido nitroso y el halotano sobre los receptores opioides mu y kappa en el cerebro de cobayas. Anestesiología 70: 541-544.)
- ^ Guo TZ, Davies MF, Kingery WS, Patterson AJ, Limbird LE, Maze M (1999). "El óxido nitroso produce una respuesta antinociceptiva a través de los subtipos de receptores adrenérgicos alfa2B y/o alfa2C en ratones". Anestesiología . 90 (2): 470–6. doi : 10.1097/00000542-199902000-00022 . PMID 9952154.
- ^ Sawamura S, Kingery WS, Davies MF, Agashe GS, Clark JD, Koblika BK, et al. (2000). "La acción antinociceptiva del óxido nitroso está mediada por la estimulación de las neuronas noradrenérgicas en el tronco encefálico y la activación de los adrenoceptores [alfa]2B". J. Neurosci . 20 (24): 9242–51. doi :10.1523/JNEUROSCI.20-24-09242.2000. PMC 6773006 . PMID 11125002.
- ^ Maze M, Fujinaga M (2000). "Avances recientes en la comprensión de las acciones y la toxicidad del óxido nitroso". Anestesia . 55 (4): 311–4. doi : 10.1046/j.1365-2044.2000.01463.x . PMID 10781114. S2CID 39823627.
- ^ Housecroft, Catherine E., Sharpe, Alan G. (2008). "Capítulo 15: Los elementos del grupo 15". Química inorgánica (3.ª ed.). Pearson. pág. 464. ISBN 978-0-13-175553-6.
- ^ Keys T (1941). "El desarrollo de la anestesia". Anestesiología . 2 (5): 552–574. Bibcode :1982AmSci..70..522D. doi : 10.1097/00000542-194109000-00008 . S2CID 73062366.
- ^ McEvoy JG (6 de marzo de 2015). "Gases, Dios y el equilibrio de la naturaleza: un comentario sobre Priestley (1772) 'Observaciones sobre diferentes tipos de aire'". Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences . 373 (2039): 20140229. Bibcode :2015RSPTA.37340229M. doi :10.1098/rsta.2014.0229. PMC 4360083 . PMID 25750146.
- ^ Priestley J (1776). "Experimentos y observaciones sobre diferentes tipos de aire". Erowid .
- ^ Davy H (1800). Investigaciones químicas y filosóficas, principalmente sobre el óxido nitroso o aire nitroso desflogistizado y su respiración. Impreso para J. Johnson.
- ^ Hardman JG (2017). Oxford Textbook of Anaesthesia . Oxford University Press. pág. 529. ISBN 978-0-19-964204-5.
- ^ Brecher EM (1972). "Informe de la Unión de Consumidores sobre drogas lícitas e ilícitas, Parte VI: inhalantes, disolventes e inhalación de pegamento". Revista Consumer Reports . Consultado el 18 de diciembre de 2013 .
- ^ "George Poe ha muerto". Washington Post . 3 de febrero de 1914. Archivado desde el original el 1 de marzo de 2013 . Consultado el 29 de diciembre de 2007 .
- ^ Erving HW (1933). "El descubridor de la anestesia: el Dr. Horace Wells de Hartford". Revista de biología y medicina de Yale . 5 (5): 421–430. PMC 2606479. PMID 21433572 .
- ^ Wells H (1847). Historia del descubrimiento y la aplicación del gas de óxido nitroso, éter y otros vapores en operaciones quirúrgicas. J. Gaylord Wells.
- ^ Desai SP, Desai MS, Pandav CS (2007). "El descubrimiento de la anestesia moderna: contribuciones de Davy, Clarke, Long, Wells y Morton". Indian J Anaesth . 51 (6): 472–8.
- ^ "Supuesta falsificación". The Inter Ocean . 28 de septiembre de 1877. pág. 8 . Consultado el 26 de octubre de 2015 .
- ^ "Un hombre de nombre ominoso". The Inter Ocean . 19 de febrero de 1890. Consultado el 26 de octubre de 2015 .
- ^ ab Parmon VN, Panov GI, Uriarte A, Noskov AS (2005). "Óxido nitroso en química de oxidación y aplicación y producción de catálisis". Catalysis Today . 100 (2005): 115–131. doi :10.1016/j.cattod.2004.12.012.
- ^ Holleman AF, Wiberg, E. (2001). Química inorgánica . San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ "Planta de óxido nitroso". Organización Sanghi. Archivado desde el original el 27 de noviembre de 2013. Consultado el 18 de diciembre de 2013 .
- ^ "Familia del nitrógeno" Archivado el 21 de octubre de 2014 en Wayback Machine . chemistry.tutorvista.com
- ^ "Preparación de óxido nitroso a partir de urea, ácido nítrico y ácido sulfúrico".
- ^ Suwa T, Matsushima A, Suziki Y, Namina Y (1961). "Fabricación de Óxido Nitroso mediante Oxidación Catalítica de Amoníaco". Revista de la Sociedad de la Industria Química, Japón . 64 (11): 1879–1888. doi : 10.1246/nikkashi1898.64.11_1879 .
- ^ Egon Wiberg, Arnold Frederick Holleman (2001) Química inorgánica , Elsevier ISBN 0-12-352651-5
- ^ "Presupuesto de N2O". Proyecto Global de Carbono . Consultado el 9 de noviembre de 2020 .
- ^ "Capítulo 6". TAR Cambio climático 2001: La base científica. pág. 358.
- ^ Ravishankara AR, Daniel JS, Portmann RW (27 de agosto de 2009), "Material de apoyo en línea para - Óxido nitroso (N2O): la sustancia dominante que agota la capa de ozono emitida en el siglo XXI" (PDF) , Science , 326 (5949): 123–125, Bibcode :2009Sci...326..123R, doi :10.1126/science.1176985, PMID 19713491, S2CID 2100618, archivado (PDF) desde el original el 9 de octubre de 2022
- ^ ab Agencia de Protección Ambiental de Estados Unidos. 12 de enero de 2016.
- ^ abcd Capítulo 5: Ciclos y retroalimentaciones biogeoquímicas globales del carbono y otros. www.ipcc.ch (Informe) . Consultado el 6 de mayo de 2023 .
- ^ US EPA O (23 de diciembre de 2015). «Descripción general de los gases de efecto invernadero». www.epa.gov . Consultado el 4 de mayo de 2023 .
- ^ "| Emisiones de gases de efecto invernadero (GEI) | Climate Watch". www.climatewatchdata.org . Consultado el 4 de mayo de 2023 .
- ^ Sloss LL (1992). Libro de datos sobre tecnología de control de óxidos de nitrógeno. William Andrew. pág. 6. ISBN 978-0-8155-1294-3.
- ^ Agencia de Protección Ambiental de Estados Unidos (2010), "Emisiones de metano y óxido nitroso de fuentes naturales". Informe EPA 430-R-10-001.
- ^ Bange HW (2006). "Óxido nitroso y metano en aguas costeras europeas". Ciencia de estuarios, costas y plataformas . 70 (3): 361–374. Bibcode :2006ECSS...70..361B. doi :10.1016/j.ecss.2006.05.042.
- ^ Thompson AJ, Giannopoulos G, Pretty J, Baggs EM, Richardson DJ (2012). "Fuentes biológicas y sumideros de óxido nitroso y estrategias para mitigar las emisiones". Philosophical Transactions of the Royal Society B . 367 (1593): 1157–1168. doi :10.1098/rstb.2011.0415. PMC 3306631 . PMID 22451101.
- ^ abc KL Denman, G. Brasseur, et al. (2007), "Acoplamientos entre los cambios en el sistema climático y la biogeoquímica". En Cuarto Informe de Evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático , Cambridge University Press.
- ^ Steinfeld, H., Gerber, P., Wassenaar, T., Castel, V., Rosales, M., de Haan, C. (2006). La larga sombra del ganado: cuestiones ambientales y opciones. Fao.org . Consultado el 2 de febrero de 2008 .
- ^ "Descripción general de los gases de efecto invernadero: óxido nitroso". Agencia de Protección Ambiental de Estados Unidos. 23 de diciembre de 2015. Archivado desde el original el 12 de agosto de 2016 . Consultado el 31 de marzo de 2016 .
- ^ "Óxido nitroso: fuentes y emisiones". Agencia de Protección Ambiental de Estados Unidos. 2006. Archivado desde el original el 16 de enero de 2008. Consultado el 2 de febrero de 2008 .
- ^ IPCC. 2013. Cambio climático: la base física (GT I, informe completo). pág. 512.
- ^ Thompson RL, Lassaletta L, Patra PK, Wilson C, Wells KC, Gressent A, et al. (18 de noviembre de 2019). "Aceleración de las emisiones globales de N 2 O observada a partir de dos décadas de inversión atmosférica". Nature Climate Change . 9 (12): 993–998. Bibcode :2019NatCC...9..993T. doi :10.1038/s41558-019-0613-7. hdl : 11250/2646484 . ISSN 1758-6798. S2CID 208302708.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Molodovskaya M, Warland J, Richards BK, Öberg G, Steenhuis TS (2011). "Óxido nitroso de paisajes agrícolas heterogéneos: análisis de contribución de fuentes mediante covarianza de Eddy y Chambers". Revista de la Sociedad Americana de Ciencias del Suelo . 75 (5): 1829. Código Bibliográfico :2011SSASJ..75.1829M. doi :10.2136/SSSAJ2010.0415.
- ^ Molodovskaya M, Singurindy O, Richards BK, Warland JS, Johnson M, Öberg G, et al. (2012). "Variabilidad temporal del óxido nitroso de tierras de cultivo fertilizadas: análisis del momento caliente". Revista de la Sociedad Americana de Ciencias del Suelo . 76 (5): 1728–1740. Código Bibliográfico :2012SSASJ..76.1728M. doi :10.2136/sssaj2012.0039. S2CID 54795634.
- ^ Singurindy O, Molodovskaya M, Richards BK, Steenhuis TS (julio de 2009). "Emisión de óxido nitroso a bajas temperaturas de suelos mejorados con estiércol bajo maíz (Zea mays L.)". Agricultura, ecosistemas y medio ambiente . 132 (1–2): 74–81. Bibcode :2009AgEE..132...74S. doi :10.1016/j.agee.2009.03.001.
- ^ Mason C, Stoof C, Richards B, Das S, Goodale C, Steenhuis T (2017). "Puntos críticos de emisión de óxido nitroso en pastos perennes fertilizados y no fertilizados en tierras marginales propensas a la humedad en el estado de Nueva York". Revista de la Sociedad de Ciencias del Suelo de América . 81 (3): 450–458. Código Bibliográfico :2017SSASJ..81..450M. doi :10.2136/sssaj2016.08.0249.
- ^ Reimer RA, Slaten CS, Seapan M., Lower MW, Tomlinson PE (1994). "Reducción de las emisiones de N 2 O producidas en la industria del ácido adípico". Environmental Progress . 13 (2): 134–137. Bibcode :1994EnvPr..13..134R. doi :10.1002/ep.670130217.
- ^ Shimizu, A., Tanaka, K., Fujimori, M. (2000). "Reducción de las emisiones de N2O producidas en la industria del ácido adípico". Chemosphere – Global Change Science . 2 (3–4): 425–434. Bibcode :2000ChGCS...2..425S. doi :10.1016/S1465-9972(00)00024-6.
- ^ Schneider, Lisa K., Wüst, Anja, Pomowski, Anja, Zhang, Lin, Einsle, Oliver (2014). "No es un asunto de risa: la destrucción del gas de efecto invernadero monóxido de dinitrógeno por la reductasa de óxido nitroso". En Kroneck, Peter MH, Sosa Torres, Martha E. (eds.). La biogeoquímica impulsada por metales de compuestos gaseosos en el medio ambiente . Iones metálicos en las ciencias de la vida. Vol. 14. Springer. págs. 177–210. doi :10.1007/978-94-017-9269-1_8. ISBN 978-94-017-9268-4. Número de identificación personal 25416395.
- ^ Agencia de Protección Ambiental de Estados Unidos, documento web "Indicadores del cambio climático: concentraciones atmosféricas de gases de efecto invernadero", consultado el 14 de febrero de 2017
- ^ "4.1.1 Fuentes de gases de efecto invernadero". IPCC TAR WG1 2001. Archivado desde el original el 29 de octubre de 2012. Consultado el 21 de septiembre de 2012 .
- ^ Mundschenk S (3 de agosto de 2022). «Los Países Bajos están demostrando cómo no hay que abordar el cambio climático | The Spectator». www.spectator.co.uk . Consultado el 28 de agosto de 2022 .
- ^ "Descripción general de los gases de efecto invernadero: emisiones de óxido nitroso". Agencia de Protección Ambiental de los Estados Unidos. 6 de octubre de 2016. Consultado el 14 de julio de 2019 .
- ^ Naafs BD, Monteiro FM, Pearson A, Higgins MB, Pancost RD, Ridgwell A (10 de diciembre de 2019). "Ciclado global del nitrógeno marino fundamentalmente diferente en respuesta a una desoxigenación oceánica severa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (50): 24979–24984. Bibcode :2019PNAS..11624979N. doi : 10.1073/pnas.1905553116 . PMC 6911173 . PMID 31767742.
- ^ Grossman L (28 de agosto de 2009). "El gas hilarante es la mayor amenaza para la capa de ozono". New Scientist .
- ^ "Ohio Medical" (PDF) . www.ohiomedical.com . Archivado desde el original (PDF) el 17 de abril de 2016 . Consultado el 20 de septiembre de 2017 .
- ^ Anderton J (26 de junio de 2005). "Se acabó el tiempo de las ventas falsas de gas hilarante". Beehive.govt.nz. Archivado desde el original el 8 de enero de 2015.
- ^ "El Ayuntamiento de Lambeth prohíbe el gas hilarante como droga recreativa". BBC News . 17 de agosto de 2015 . Consultado el 17 de agosto de 2015 .
- ^ "Óxido nitroso: el gas hilarante será ilegal a finales de año". BBC News . 5 de septiembre de 2023 . Consultado el 5 de septiembre de 2023 .
- ^ "Leyes de óxido nitroso de EE. UU. (en orden alfabético) según una búsqueda en bases de datos legales gratuitas en línea. Realizada en mayo de 2002". Centro para la libertad cognitiva y la ética. Archivado desde el original el 24 de enero de 2008. Consultado el 27 de enero de 2008 .
- ^ "CAL. PEN. CODE § 381b: Código de California – Sección 381b". Lp.findlaw.com.
Enlaces externos
- Directrices de seguridad y salud ocupacional para el óxido nitroso
- Entrevista a Paul Crutzen Vídeo de Freeview de Paul Crutzen, Premio Nobel por su trabajo sobre la descomposición del ozono, hablando con Harry Kroto, Premio Nobel de Vega Science Trust.
- Inventario Nacional de Contaminantes – Hoja informativa sobre óxido de nitrógeno
- Instituto Nacional de Seguridad y Salud Ocupacional – Óxido nitroso
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos: óxido nitroso
- Preguntas frecuentes sobre el óxido nitroso
- Artículo de Erowid sobre el óxido nitroso
- El óxido nitroso, señalado como un enorme destructor del ozono Archivado el 29 de septiembre de 2012 en Wayback Machine , Science News
- Artículo de Dental Fear Central sobre el uso del óxido nitroso en odontología
- Base de datos de estados alterados





