N-acetiltransferasa
| Arilamina N-acetiltransferasa 2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Representación en 3D de la N-acetiltransferasa 2 humana | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.3.1.5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
La N -acetiltransferasa ( NAT ) es una enzima que cataliza la transferencia de grupos acetilo desde acetil-CoA a arilaminas , arilhidroxilaminas y arilhidrazinas. [1] [2] [3] Tienen una amplia especificidad para las aminas aromáticas , particularmente la serotonina , y también pueden catalizar la transferencia de acetilo entre arilaminas sin CoA. Las N -acetiltransferasas son enzimas citosólicas que se encuentran en el hígado y muchos tejidos de la mayoría de las especies de mamíferos, excepto el perro y el zorro , que no pueden acetilar xenobióticos . [4] Los grupos acetilo son importantes en la conjugación de metabolitos del hígado, para permitir la excreción de los subproductos ( metabolismo de fase II ). Esto es especialmente importante en el metabolismo y la excreción de productos farmacológicos ( metabolismo de fármacos ).
Mecanismo enzimático
Las enzimas NAT se diferencian por la presencia de una tríada catalítica conservada que favorece los sustratos de amina aromática e hidrazina . [5] [6] Las NAT catalizan la acetilación de moléculas pequeñas a través de una reacción de doble desplazamiento llamada reacción ping pong bi bi. [5] El mecanismo consta de dos reacciones secuenciales. [5] En la reacción uno, el acetil-CoA se une inicialmente a la enzima y acetila Cys 68. [5] En la reacción dos, después de que se libera el acetil-CoA , el aceptor de acetilo interactúa con la enzima acetilada para formar el producto. [5] Esta segunda reacción es independiente del donante de acetilo ya que abandona la enzima antes de que se una el aceptor de acetilo. [5] Sin embargo, como con muchas reacciones ping pong bi bi, es posible que haya competencia entre el donante de acetilo y el aceptor de acetilo por la enzima no acetilada. [5] Esto conduce a una inhibición dependiente del sustrato a altas concentraciones. [5]

Estructura de la enzima
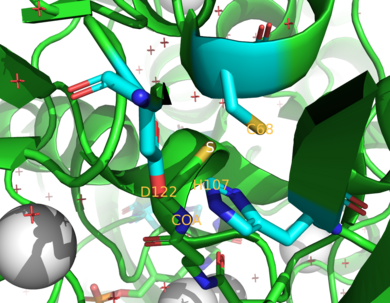
Las dos enzimas NAT en humanos son NAT1 y NAT2 . [4] Los ratones y ratas expresan tres enzimas, NAT1, NAT2 y NAT3. [4] Se ha descubierto que NAT1 y NAT2 están estrechamente relacionadas en las especies examinadas hasta ahora, ya que las dos enzimas comparten el 75-95% de su secuencia de aminoácidos . [9] [10] Ambas también tienen un residuo de cisteína del sitio activo (Cys 68 ) en la región N-terminal. [9] [10] Además, todas las enzimas NAT funcionales contienen una tríada de residuos catalíticamente esenciales compuestos por esta cisteína , histidina y asparagina . [7] Se ha planteado la hipótesis de que los efectos catalíticos del fármaco contra el cáncer de mama cisplatino están relacionados con Cys 68. [11] La inactivación de NAT1 por cisplatino es causada por una formación irreversible de un aducto de cisplatino con el residuo de cisteína del sitio activo . [11] El extremo C ayuda a unir acetil CoA y difiere entre los NAT, incluidos los homólogos procariotas. [12]
NAT1 y NAT2 tienen especificidades de sustrato diferentes pero superpuestas. [4] NAT1 humano acetila preferentemente ácido 4-aminobenzoico (PABA), ácido 4 aminosalicílico , sulfametoxazol y sulfanilamida . [4] NAT2 humano acetila preferentemente isoniazida (tratamiento para la tuberculosis ), hidralazina , procainamida , dapsona , aminoglutetimida y sulfametazina . [4]
Importancia biológica
NAT2 está involucrado en el metabolismo de xenobióticos , lo que puede conducir tanto a la inactivación de fármacos como a la formación de metabolitos tóxicos que pueden ser cancerígenos . [13] La biotransformación de xenobióticos puede ocurrir en tres fases. [13] En la fase I, se introducen grupos reactivos y polares en los sustratos. En la fase II, se produce la conjugación de xenobióticos con especies cargadas, y en la fase III se realizan modificaciones adicionales, con mecanismos de eflujo que conducen a la excreción por transportadores. [13] Un estudio de asociación de todo el genoma (GWAS) identificó a NAT2 humano como la principal señal de resistencia a la insulina , un marcador clave de diabetes y un importante factor de riesgo cardiovascular [13] y se ha demostrado que está asociado con la resistencia a la insulina de todo el cuerpo en ratones knock out de NAT1 . [14] Se cree que NAT1 tiene un papel endógeno , probablemente vinculado al metabolismo celular fundamental. [13] Esto puede estar relacionado con el motivo por el que NAT1 se distribuye más ampliamente entre los tejidos que NAT2. [13]
Importancia en los humanos
Cada individuo metaboliza xenobióticos a diferentes velocidades, como resultado de polimorfismos de los genes del metabolismo de xenobióticos . [13] Tanto NAT1 como NAT2 están codificados por dos genes altamente polimórficos ubicados en el cromosoma 8. [ 4] Los polimorfismos de NAT2 fueron una de las primeras variaciones para explicar esta variabilidad interindividual para el metabolismo de fármacos . [15] Estos polimorfismos modifican la estabilidad y/o la actividad catalítica de las enzimas que alteran las tasas de acetilación de fármacos y xenobióticos, un rasgo llamado fenotipo acetilador . [16] Para NAT2, el fenotipo acetilador se describe como lento, intermedio o rápido. [17] Más allá de modificar la actividad enzimática, los estudios epidemiológicos han encontrado una asociación de polimorfismos de NAT2 con varios cánceres, probablemente a partir de diversos carcinógenos ambientales . [13]
De hecho, NAT2 es altamente polimórfico en varias poblaciones humanas. [18] Los polimorfismos de NAT2 incluyen las sustituciones de un solo aminoácido R64Q, I114T, D122N, L137F, Q145P, R197Q y G286E. [18] Estos se clasifican como acetiladores lentos, mientras que el NAT2 de tipo salvaje se clasifica como un acetilador rápido. [18] Los acetiladores lentos tienden a estar asociados con la toxicidad de los fármacos y la susceptibilidad al cáncer. [18] Por ejemplo, el genotipo acetilador lento NAT2 está asociado con un mayor riesgo de cáncer de vejiga , especialmente entre los fumadores de cigarrillos. [19] Los polimorfismos de un solo nucleótido (SNP) de NAT1 incluyen R64W, V149I, R187Q, M205V, S214A, D251V, E26K e I263V, y están relacionados con la predisposición genética al cáncer , defectos de nacimiento y otras enfermedades. [20] El efecto de los SNP acetiladores lentos en la región codificante actúa predominantemente a través de la creación de una proteína inestable que se agrega intracelularmente antes de la ubiquitinación y degradación. [3]
El 50% de la población británica tiene deficiencia de N -acetiltransferasa hepática. Esto se conoce como estado acetilador negativo. Los medicamentos afectados por esto son:
- isoniazida
- procainamida
- hidralazina
- dapsona
- sulfasalazina
Los eventos adversos de esta deficiencia incluyen neuropatía periférica y hepatoxicidad . [21] El haplotipo acetilador más lento , NAT2*5B (la asociación más fuerte con el cáncer de vejiga ), parece haber sido seleccionado en los últimos 6.500 años en personas de Eurasia occidental y central, lo que sugiere que la acetilación lenta dio una ventaja evolutiva a esta población, a pesar de los datos recientes desfavorables de resultados de salud epidemiológicos. [22]
Ejemplos
La siguiente es una lista de genes humanos que codifican enzimas N-acetiltransferasas:
| Símbolo | Nombre |
|---|---|
| AANAT | aralquilamina N-acetiltransferasa |
| ARD1A | Homólogo A de ARD1, N-acetiltransferasa (S. cerevisiae) |
| GNPNAT1 | glucosamina-fosfato N-acetiltransferasa 1 |
| HGSNAT | heparán-alfa-glucosaminida N-acetiltransferasa |
| MAK10 | Homólogo de MAK10, subunidad de la N-acetiltransferasa del aminoácido (S. cerevisiae) |
| NAT1 | N-acetiltransferasa 1 (arilamina N-acetiltransferasa) |
| NAT2 | N-acetiltransferasa 2 (arilamina N-acetiltransferasa) |
| NAT5 | N-acetiltransferasa 5 (relacionada con GCN5, putativa) |
| NAT6 | N-acetiltransferasa 6 (relacionada con GCN5) |
| NAT8 | N-acetiltransferasa 8 (relacionada con GCN5, putativa) |
| NAT8L | Similar a N-acetiltransferasa 8 (relacionada con GCN5, presunta) |
| NAT9 | N-acetiltransferasa 9 (relacionada con GCN5, putativa) |
| NAT10 | N-acetiltransferasa 10 (relacionada con GCN5) |
| NAT11 | N-acetiltransferasa 11 (relacionada con GCN5, putativa) |
| NAT12 | N-acetiltransferasa 12 (relacionada con GCN5, putativa) |
| NAT13 | N-acetiltransferasa 13 (relacionada con GCN5) |
| NAT14 | N-acetiltransferasa 14 (relacionada con GCN5, putativa) |
| NAT15 | N-acetiltransferasa 15 (relacionada con GCN5, putativa) |
Referencias
- ^ Evans DA (1989). "N-acetiltransferasa". Farmacología y terapéutica . 42 (2): 157–234. doi :10.1016/0163-7258(89)90036-3. PMID 2664821.
- ^ Ma Y, Ghoshdastider U, Wang J, Ye W, Dötsch V, Filipek S, Bernhard F, Wang X (2012). "Expresión en células libres de la glucosamina 6-fosfato N-acetiltransferasa humana (HsGNA1) para la detección de inhibidores". Protein Expr. Purif . 86 (2): 120–6. doi :10.1016/j.pep.2012.09.011. PMID 23036358.
- ^ ab Sim, Edith ; Lack, Nathan; Wang, Chan-Ju; et al. (mayo de 2008). "N-acetiltransferasas de arilamina: implicaciones estructurales y funcionales de los polimorfismos". Toxicología . 254 (3): 170–183. doi :10.1016/j.tox.2008.08.022. PMID 18852012.
- ^ abcdefg Klaassen, Curtis D. (2008). Toxicología de Casarett y Doull: la ciencia básica de los venenos, 7.ª edición . McGraw-Hill. ISBN 978-0071470513.
- ^ abcdefgh Minchin, Rodney F.; Neville, Butcher J. (abril de 2015). "El papel de la lisina 100 en la unión de la acetilcoenzima A a la arilamina N-acetiltransferasa 1 humana: implicaciones para otras acetiltransferasas" (PDF) . Farmacología bioquímica . 94 (3): 195–202. doi :10.1016/j.bcp.2015.01.015. PMID 25660616.
- ^ Weber, WW; Cohen, SN; Steinberg, MS (1968). "Purificación y propiedades de la N-acetiltransferasa del hígado de mamíferos". Ann NY Acad Sci . 151 (2): 734–741. doi :10.1111/j.1749-6632.1968.tb11934.x. PMID 4984197. S2CID 44602517.
- ^ ab Westwood, IM; Kawamura, A.; Fullam, E.; et al. (2006). "Estructura y mecanismo de las N-acetiltransferasas de arilamina". Temas actuales en química medicinal . 6 (15): 1641–1654. doi :10.2174/156802606778108979. PMID 16918475.
- ^ Sinclair, JC; Sandy, J.; Delgoda, R.; Sim, E .; Noble, ME (2000). "La estructura de la arilamina N-acetiltransferasa revela una tríada catalítica". Nature Structural Biology . 7 (7): 560–564. doi :10.1038/76783. PMID 10876241. S2CID 23694257.
- ^ ab Grant, DM; Blum, M.; Meyer, UA (1992). "Polimorfismos de genes de N-acetiltransferasa". Xenobiotica . 22 (9–10): 1073–1081. doi :10.3109/00498259209051861. PMID 1441598.
- ^ ab Vatsis, KP; Weber, WW; Bell, DA (1995). "Nomenclatura para N-acetiltransferasas". Farmacogenética . 5 (1): 1–17. doi :10.1097/00008571-199502000-00001. PMID 7773298.
- ^ ab Ragunathan, Nilusha; Dairou, Julien; Pulvinage, Benjamin; et al. (junio de 2008). "Identificación de la enzima metabolizadora de xenobióticos arilamina N-acetiltransferasa 1 como un nuevo objetivo del cisplatino en células de cáncer de mama: mecanismos moleculares y celulares de inhibición". Farmacología molecular . 73 (6): 1761–1768. doi :10.1124/mol.108.045328. PMID 18310302. S2CID 9214220.
- ^ Sim, E. ; Abuhammad, A.; Ryan, A. (mayo de 2014). "Arilamina N-acetiltransferasas: desde el metabolismo de fármacos y la farmacogenética hasta el descubrimiento de fármacos". Br J Pharmacol . 171 (11): 2705–2725. doi :10.1111/bph.12598. PMC 4158862 . PMID 24467436.
- ^ abcdefgh Laureri, Nicola; Sim, Edith (2018). Arilamina N-acetiltransferasas en la salud y la enfermedad: de la farmacogenética al descubrimiento y diagnóstico de fármacos . World Scientific. ISBN 9789813232006.
- ^ Camporez, João Paulo; Wang, Yongliang; Faarkrog, Kasper; et al. (diciembre de 2017). "Mecanismo por el cual la ablación de la arilamina N-acetiltransferasa 1 causa resistencia a la insulina en ratones". PNAS . 114 (52): E11285–E11292. doi : 10.1073/pnas.1716990115 . PMC 5748223 . PMID 29237750.
- ^ McDonagh, EM; et al. (2014). "Resumen de PharmGKB: información farmacéu- tica muy importante para la N-acetiltransferasa 2". Pharmacogenet. Genomics . 24 (8): 409–425. doi :10.1097/FPC.0000000000000062. PMC 4109976 . PMID 24892773.
- ^ Evans, DA; White, TA (1964). "Polimorfismo de acetilación humana". J. Lab. Clin. Med . 63 : 394–403. PMID 14164493.
- ^ Hein, DW; Doll, MA (2012). "Precisión de varios paneles de genotipado de SNP NAT2 humanos para inferir fenotipos de acetiladores rápidos, intermedios y lentos". Farmacogenómica . 13 (1): 31–41. doi :10.2217/pgs.11.122. PMC 3285565 . PMID 22092036.
- ^ abcd Rajasekaran, M.; Abirami, Santhanam; Chen, Chinpan (2011). "Efectos de los polimorfismos de un solo nucleótido en la estructura y dinámica de la N-acetiltransferasa 2 humana mediante simulación de dinámica molecular". PLOS ONE . 6 (9): e25801. Bibcode :2011PLoSO...625801R. doi : 10.1371/journal.pone.0025801 . PMC 3183086 . PMID 21980537.
- ^ Hein, DW (2000). "Genética molecular y epidemiología de los polimorfismos de acetilación NAT1 y NAT2". Cancer Epidemiol. Biomarkers Prev . 9 (1): 29–42. PMID 10667461.
- ^ Walraven, Jason M.; Trent, John O.; Hein, David W. (2008). "Análisis de estructura-función de polimorfismos de un solo nucleótido en la N-acetiltransferasa 1 humana". Drug Metabolism Reviews . 40 (1): 169–184. doi :10.1080/03602530701852917. PMC 2265210 . PMID 18259988 – vía Informa Healthcare.
- ^ Unissa, Ameeruddin Nusrath; Subbiano, Selvakumar; Hanna, Lucas Elizabeth; Selvakumar, Nagamiah (2016). "Resumen de los mecanismos de acción y resistencia a la isoniazida en Mycobacterium tuberculosis". Infección, genética y evolución . 45 : 474–492. doi :10.1016/j.meegid.2016.09.004. PMID 27612406.
- ^ Patin, E.; Barreiro, LB; Sabeti, PC; et al. (2006). "Descifrando la antigua y compleja historia evolutiva de los genes de la arilamina N-acetiltransferasa humana". Am J Hum Genet . 78 (3): 423–436. doi :10.1086/500614. PMC 1380286 . PMID 16416399.
