21-Hidroxilasa
| Esteroide 21-hidroxilasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identificadores | |||||||||
| N.º CE | 1.14.14.16 | ||||||||
| N.º CAS | 9029-68-9 | ||||||||
| Nombres alternativos | "Citocromo P450, familia 21, subfamilia A, polipéptido 2", CYP21A2, CYP21, CYP21B, [1] P45021A2, citocromo P450c21, [2] [3] [4] esteroide 21-monooxigenasa, [5] 21-hidroxilasa, 21α-hidroxilasa, [6] [7] 21β-hidroxilasa [8] [9] | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
La esteroide 21-hidroxilasa es una proteína que en los humanos está codificada por el gen CYP21A2 . La proteína es una enzima que hidroxila los esteroides en la posición C21 de la molécula. [10] [11] Las convenciones de nomenclatura para las enzimas se basan en el sustrato sobre el que actúa y el proceso químico realizado. Bioquímicamente, esta enzima está involucrada en la biosíntesis de las hormonas de la glándula suprarrenal aldosterona y cortisol , que son importantes en la regulación de la presión arterial , la homeostasis del sodio y el control del azúcar en sangre . La enzima convierte la progesterona y la 17α-hidroxiprogesterona en 11-desoxicorticosterona y 11-desoxicortisol , respectivamente, [12] [13] dentro de las vías metabólicas que en los humanos finalmente conducen a la creación de aldosterona y cortisol; la deficiencia de la enzima puede causar hiperplasia suprarrenal congénita .
La esteroide 21-hidroxilasa es un miembro de la familia de enzimas monooxigenasas del citocromo P450 que utilizan un cofactor hemo que contiene hierro para oxidar sustratos.
En los seres humanos, la enzima se localiza en las membranas del retículo endoplasmático de las células de la corteza suprarrenal [14] [ 15] y está codificada por el gen CYP21A2 , que se encuentra cerca del pseudogén CYP21A1P , que tiene un alto grado de similitud de secuencia. Esta similitud dificulta el análisis del gen a nivel molecular y, a veces, conduce a mutaciones de pérdida de función del gen debido al intercambio intergénico de ADN .
Gene
| CYP21A2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | CYP21A2 , CA21H, CAH1, CPS1, CYP21, CYP21B, P450c21B, miembro 2 de la subfamilia A de la familia 21 del citocromo P450 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 613815; MGI : 88591; HomoloGene : 68063; Tarjetas genéticas : CYP21A2; OMA :CYP21A2 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CE | 1.14.14.16,1.14.14.16 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||

La esteroide 21-hidroxilasa en humanos está codificada por el gen CYP21A2 que puede estar acompañado por una o varias copias del pseudogén no funcional CYP21A1P , [20] [21] este pseudogén comparte el 98% de la identidad informativa exónica con el gen funcional real. [22] [23]
Los pseudogenes son comunes en los genomas y se originan como artefactos durante el proceso de duplicación. Aunque a menudo se los considera "ADN basura", las investigaciones han demostrado que conservar estas copias defectuosas puede tener un papel beneficioso, ya que a menudo regulan sus genes originales. [24]
En el genoma del ratón , el Cyp21a2 es un pseudogén y el Cyp21a1 es un gen funcional. [25] En el pollo y la codorniz , solo hay un único gen Cyp21 , cuyo locus se encuentra entre el componente del complemento C4 y el gen TNX, junto con Cenpa . [26]
El CYP21A2 en humanos se encuentra en el cromosoma 6 , en el complejo mayor de histocompatibilidad III (MHC clase III) [27] cerca de los genes del componente 4 del complemento C4A y C4B , el gen Tenascin X TNXB y STK19 . [28] El MHC clase III es la región con mayor densidad genética del genoma humano, que contiene muchos genes que tienen, a partir de 2023, funciones o estructuras desconocidas. [29] [27]
Dentro de la clase III del MHC , CYP21A2 se encuentra dentro del grupo RCCX (una abreviatura compuesta por los nombres de los genes RP (un nombre anterior para la serina/treonina quinasa 19 de STK19 ), [30] [31] C4 , CYP21 y TNX ), [32] que es el grupo de genes más complejo en el genoma humano. [33] El número de segmentos RCCX varía entre uno y cuatro en un cromosoma , [30] con una prevalencia de aproximadamente el 15% para monomodular, 75% para bimodular ( STK19-C4A-CYP21A1P-TNXA-STK19B-C4B-CYP21A2-TNXB ), [31] [34] y 10% para trimodular en europeos. [35] La estructura cuadrimodular de la unidad RCCX es muy rara. [36] [30] [35] En una estructura monomodular, todos los genes son funcionales, es decir, codifican proteínas , pero si el recuento de módulos es dos o más, solo hay una copia de cada gen funcional, siendo el resto pseudogenes no codificantes con la excepción del gen C4 que siempre tiene copias activas. [30] [35]
Debido al alto grado de homología entre el gen CYP21A2 y el pseudogén CYP21A1P y la complejidad del locus RCCX, es difícil realizar diagnósticos moleculares para CYP21A2 . El pseudogén puede tener polimorfismos de un solo nucleótido (SNP) que son idénticos o similares a los del gen funcional, lo que dificulta distinguirlos. El pseudogén también puede recombinarse con el gen funcional, creando genes híbridos que tienen características de ambos. Esto puede dar lugar a resultados falsos positivos o falsos negativos al realizar pruebas de SNP en el CYP21A2 . [37]
La tecnología de secuenciación del genoma completo se basa en dividir el ADN en pequeños fragmentos, secuenciarlos y luego ensamblarlos nuevamente en función de sus superposiciones. Sin embargo, debido a la alta homología y variabilidad del CYP21A2 y su pseudogén, los fragmentos no se pueden asignar de manera inequívoca a ninguna de las copias del gen. Esto puede provocar errores o lagunas en el ensamblaje, o la omisión de algunas variantes que están presentes en el gen. [38] [37]
El diagnóstico molecular mediante reacción en cadena de la polimerasa (PCR) utiliza iniciadores selectivos para amplificar segmentos específicos de la secuencia de ADN que son relevantes para diagnosticar o detectar una determinada enfermedad o afección. Si los iniciadores no están diseñados con cuidado, pueden unirse tanto al pseudogén CYP21A2 como al CYP21A1P , o a diferentes segmentos del grupo RCCX, lo que da como resultado resultados falsos positivos o falsos negativos. Por lo tanto, la PCR para el CYP21A2 requiere el uso de iniciadores específicos del locus que puedan distinguir entre el gen y el pseudogén, y entre diferentes módulos RCCX. Además, la PCR puede no ser capaz de detectar variantes complejas como grandes conversiones génicas , deleciones o duplicaciones , que son frecuentes en el caso del CYP21A2 . [39] [40] [38]
El Southern blotting , un método utilizado para detectar y cuantificar una secuencia de ADN específica en muestras de ADN, también tiene limitaciones en el análisis de CYP21A2 . Este método requiere mucho tiempo y una gran cantidad de ADN de buena calidad, lo que lo hace menos aplicable en entornos de diagnóstico de rutina. Este método viene con un riesgo biológico radiactivo, que plantea problemas de seguridad y lo hace laborioso. El Southern blotting no puede detectar los sitios de unión de las quimeras. El gen CYP21A2 es propenso a desajustes y reordenamientos, produciendo diferentes tipos de variaciones complejas que incluyen variantes del número de copias , grandes conversiones genéticas , pequeñas inserciones / deleciones y variantes de un solo nucleótido (SNP). El Southern blotting no es capaz de detectar todos estos tipos de variantes simultáneamente. Además de eso, el Southern blotting requiere un análisis genético de los padres, lo que no siempre es factible o práctico. [38] [41]
Por lo tanto, para analizar el gen CYP21A2 con precisión, se necesita un método más especializado y sensible, como la secuenciación de lectura larga dirigida , que puede secuenciar fragmentos de ADN más largos y capturar más información sobre la estructura y la variación del gen. Sin embargo, este método no está ampliamente disponible o no es asequible para uso clínico. [42] [43] [44]
Proteína
La esteroide 21-hidroxilasa es un miembro de la familia de enzimas monooxigenasas del citocromo P450 . La proteína tiene 494 residuos de aminoácidos con un peso molecular de 55.000. Esta enzima es como máximo un 28% homóloga a otras enzimas P-450 que se han estudiado. [45]
Estructuralmente, la proteína contiene un núcleo conservado evolutivamente de cuatro haces de hélices α (la importancia de dicha conservación genética radica en demostrar la importancia funcional de este aspecto de la estructura de esta proteína). Además, tiene dos hélices alfa adicionales, dos conjuntos de láminas β y un bucle de unión al cofactor hemo . [46] Cada subunidad de la enzima humana consta de un total de 13 hélices α y 9 cadenas β que se pliegan en una estructura terciaria similar a un prisma triangular . [12]
El grupo hemo de hierro(III) que define el sitio activo se encuentra en el centro de cada subunidad. La enzima humana se une a un sustrato a la vez. [12] En cambio, la enzima bovina, bien caracterizada, puede unirse a dos sustratos. [47] La enzima humana y la bovina comparten un 80% de identidad en la secuencia de aminoácidos , pero son estructuralmente diferentes, en particular en las regiones de bucle, y también son evidentes en los elementos de estructura secundaria . [12]
Especies
Se pueden encontrar variaciones de la esteroide 21-hidroxilasa en todos los vertebrados . [48]
Cyp21 surgió por primera vez en cordados antes de la especiación entre cordados basales y vertebrados. [49] La lamprea marina , una especie temprana de pez sin mandíbula que se originó hace más de 500 millones de años, proporciona información valiosa sobre la evolución y el surgimiento de Cyp21 . Las lampreas marinas carecen de la enzima 11β-hidroxilasa responsable de convertir 11-desoxicortisol en cortisol como se observa en los mamíferos. En cambio, dependen del 11-desoxicortisol, un producto de una reacción catalizada por CYP21, como su principal hormona glucocorticoide con propiedades mineralocorticoides. Esto sugiere la presencia de una vía de señalización de corticosteroides compleja y altamente específica que surgió hace al menos 500 millones de años durante la evolución temprana de los vertebrados. [50]
En vertebrados, como peces, anfibios, reptiles, aves y mamíferos, Cyp21 participa en la biosíntesis de glucocorticoides y mineralocorticoides, por lo tanto, Cyp21 es esencial para la regulación de la respuesta al estrés, el equilibrio electrolítico y la presión arterial, el sistema inmunológico y el metabolismo en vertebrados. [51]
El Cyp21 está relativamente conservado entre los mamíferos y muestra algunas variaciones en su estructura, expresión y regulación. [51] Los macacos Rhesus y los orangutanes poseen dos copias del Cyp21 , mientras que los chimpancés tienen tres, aun así, un pseudogén ( CYP21A1P ) solo está presente en los humanos entre los primates. [52]
Distribución tisular y subcelular
La esteroide 21-hidroxilasa se localiza en los microsomas de las membranas del retículo endoplásmico dentro de la corteza suprarrenal . [10] Es una de las tres enzimas microsomales esteroidogénicas del citocromo P450, las otras son la esteroide 17-hidroxilasa y la aromatasa . [53]
A diferencia de otras enzimas de la superfamilia de enzimas del citocromo P450 que se expresan en múltiples tejidos, con expresión más abundante en el hígado, en los humanos adultos la esteroide 21-hidroxilasa, junto con la esteroide 11β-hidroxilasa y la aldosterona sintasa , se expresa casi exclusivamente en la glándula suprarrenal. [54] [55]
A partir de 2023, [actualizar]se desconoce la ubicación subcelular principal de la proteína codificada en las células humanas y está pendiente de análisis celular. [56]
Función

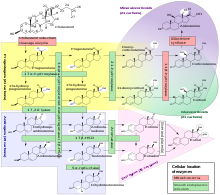
La enzima esteroide 21-hidroxilasa hidroxila los esteroides en la posición C21. [13] Los esteroides son un grupo de compuestos orgánicos naturales y sintéticos que comparten una estructura primaria de cuatro anillos. La enzima cataliza la reacción química en la que se añade el grupo hidroxilo (-OH) en la posición C21 de la biomolécula esteroide . Esta ubicación está en una cadena lateral del anillo D.
La enzima es miembro de la superfamilia de enzimas monooxigenasas del citocromo P450 . Las enzimas del citocromo P450 catalizan muchas reacciones involucradas en el metabolismo de fármacos y la síntesis de colesterol , esteroides y otros lípidos .
La esteroide 21-hidroxilasa es esencial para la biosíntesis de cortisol y aldosterona . [57] [58]
Mecanismo

La esteroide 21-hidroxilasa es una enzima del citocromo P450 que se destaca por su especificidad de sustrato y su eficiencia catalítica relativamente alta . [48]
Al igual que otras enzimas del citocromo P450, la esteroide 21-hidroxilasa participa en el ciclo catalítico del citocromo P450 y se encarga de la transferencia de un electrón con la NADPH - P450 reductasa . La esteroide 21-hidroxilasa es muy específica para la hidroxilación de la progesterona y la 17-hidroxiprogesterona. Esto contrasta marcadamente con la enzima P450 relacionada evolutiva y funcionalmente, la 17-hidroxilasa , que tiene una amplia gama de sustratos. [59]
La reacción química en la que la esteroide 21-hidroxilasa cataliza la adición de hidroxilo (-OH) a la posición C21 de la progesterona , 17α-hidroxiprogesterona y 21-desoxicortisona [60] se describió por primera vez en 1952. [61]
Los estudios de la enzima humana expresada en levadura clasificaron inicialmente a la 17-hidroxiprogesterona como el sustrato preferido para la esteroide 21-hidroxilasa, [59] [62] [63] sin embargo, un análisis posterior de la enzima humana purificada encontró una K M más baja y una mayor eficiencia catalítica para la progesterona sobre la 17-hidroxiprogesterona. [12]
La eficiencia catalítica de la esteroide 21-hidroxilasa para la conversión de progesterona en humanos es de aproximadamente 1,3 x 10 7 M −1 s −1 a 37 °C. Esto la convierte en la enzima P450 más eficiente catalíticamente de las descritas hasta la fecha, y catalíticamente más eficiente que la enzima esteroide 21-hidroxilasa bovina, estrechamente relacionada. [14] Se cree que la ruptura del enlace CH para crear un radical de carbono primario es el paso limitante de la velocidad en la hidroxilación. [12]
Importancia clínica
Hiperplasia suprarrenal congénita
Las variantes genéticas del gen CYP21A2 provocan una alteración en el desarrollo de la enzima, lo que conduce a la hiperplasia suprarrenal congénita (HSC) debido a la deficiencia de 21-hidroxilasa. Los eventos de conversión genética que involucran al gen funcional y al pseudogén son responsables de muchos casos de deficiencia de esteroide 21-hidroxilasa. [64] La HSC es un trastorno autosómico recesivo . Existen múltiples formas de HSC, definidas como formas clásicas y no clásicas según la cantidad de función enzimática aún presente en el paciente.
Las formas clásicas se presentan aproximadamente en 1 de cada 100010 000 a 1 en20 000 nacimientos a nivel mundial, [58] [65] e incluye tanto la forma perdedora de sal (excreción excesiva de sodio a través de la orina que causa hiponatremia y deshidratación) como la forma virilizante simple. La pérdida completa de la actividad enzimática causa la forma perdedora de sal. Las variaciones en la estructura de la esteroide 21-hidroxilasa están relacionadas con la gravedad clínica de la hiperplasia suprarrenal congénita. Los déficits de cortisol y aldosterona se asocian con una pérdida de sodio potencialmente mortal, ya que los esteroides desempeñan un papel en la regulación de la homeostasis del sodio . Los pacientes con CAH virilizante simple (~1-2% de función enzimática) [58] mantienen una homeostasis de sodio adecuada, pero presentan otros síntomas compartidos por la forma perdedora de sal, incluido el crecimiento acelerado en la infancia y genitales ambiguos en las neonatas femeninas .
La forma no clásica es la afección más leve y conserva entre el 20% y el 50% de la función enzimática. [58] Esta forma se asocia con un deterioro leve y clínicamente asintomático del cortisol, [65] pero con un exceso de andrógenos después de la pubertad. [66]
Hiperplasia suprarrenal congénita no clásica
La hiperplasia suprarrenal congénita no clásica causada por deficiencia de 21-hidroxilasa (NCCAH) es una hiperplasia suprarrenal congénita más leve y de aparición tardía. Su tasa de prevalencia en diferentes grupos étnicos varía de 1 en 100.1000 a 1 pulgada50. [58] Algunas personas afectadas por la enfermedad no presentan signos ni síntomas relevantes, mientras que otras experimentan síntomas de hiperandrogenismo . [58] [ 65] [66]
Las mujeres con NCCAH suelen tener genitales femeninos normales al nacer. En etapas posteriores de la vida, los signos y síntomas de la afección pueden incluir acné , hirsutismo , calvicie de patrón masculino, menstruación irregular e infertilidad. [58] [65] [25]
Se han publicado menos estudios sobre varones con NCCAH en comparación con los de mujeres, porque los varones generalmente son asintomáticos. [25] [58] Sin embargo, los varones pueden presentar acné [67] [68] y calvicie temprana. [69] [70]
Aunque los síntomas generalmente se diagnostican después de la pubertad, los niños pueden presentar adrenarquia prematura . [71]
Investigación sobre otras condiciones
Se están realizando investigaciones sobre cómo las variantes genéticas del gen CYP21A2 pueden provocar enfermedades patogénicas. Se ha informado que una variante de este gen causa catarata polar posterior autosómica dominante , lo que sugiere que la esteroide 21-hidroxilasa puede estar involucrada en la biosíntesis extrasuprarrenal de aldosterona y cortisol en el cristalino del ojo . [72]
Historia
En los años 1950 y 1960, se identificaron vías esteroidogénicas que incluían la conversión de colesterol en progesterona a través de una vía compleja que involucraba múltiples pasos y, entre ellas, una vía para la síntesis de cortisol que mostraba pasos enzimáticos específicos que incluían reacciones de hidroxilación en la posición 21 (21-hidroxilación) mediada por enzimas del citocromo P450. [73] Luego se describieron las enzimas del citocromo P450 y se asoció la 21-hidroxilación de esteroides con el citocromo P450. [74] [73]
En los años 1980 y 1990, se identificaron clones de ADNc de Cyp21 bovino de longitud parcial relacionados con el CYP21A2 humano . [75] [73] Los investigadores descubrieron mutaciones en el gen CYP21A2 asociadas con la hiperplasia suprarrenal congénita (CAH). [73]
A partir de la década de 1990, se correlacionaron mutaciones específicas con diferentes formas y niveles de gravedad de la hiperplasia suprarrenal congénita (CAH). Se investigaron las correlaciones genotipo/fenotipo para mejorar la precisión del diagnóstico. [73]
Véase también
Referencias
- ^ "UniProt". www.uniprot.org . Archivado desde el original el 28 de noviembre de 2023 . Consultado el 26 de noviembre de 2023 .
- ^ Marino S, Pérez Garrido N, Ramírez P, Pujana M, Dratler G, Belgorosky A, Marino R (2020). "Análisis molecular del gen CYP21A2 en muestras de sangre seca". Medicina . 80 (3): 197–202. PMID 32442933.
- ^ Kaewkot A, Boonkaewwan C, Noosud J, Kayan A (noviembre de 2017). "Nivel de expresión de la proteína citocromo P450c21 (CYP21) en correlación con la pérdida por goteo en cerdos". Animal Science Journal . 88 (11): 1855–1859. doi :10.1111/asj.12863. PMID 28677294.
- ^ Mizrachi D, Wang Z, Sharma KK, Gupta MK, Xu K, Dwyer CR, Auchus RJ (mayo de 2011). "Por qué el citocromo P450c21 humano es una progesterona 21-hidroxilasa". Bioquímica . 50 (19): 3968–74. doi :10.1021/bi102078e. PMC 3165045 . PMID 21446712.
- ^ "Información sobre EC 1.14.14.16 - esteroide 21-monooxigenasa - Base de datos de enzimas BRENDA". www.brenda-enzymes.org . Archivado desde el original el 11 de octubre de 2020 . Consultado el 21 de septiembre de 2020 .
- ^ Mukangwa M, Takizawa K, Aoki Y, Hamano S, Tetsuka M (febrero de 2020). "Expresión de genes que codifican enzimas biosintéticas mineralocorticoides y el receptor de mineralocorticoides, y niveles de mineralocorticoides en el folículo bovino y el cuerpo lúteo". La Revista de Reproducción y Desarrollo . 66 (1): 75–81. doi :10.1262/jrd.2019-127. PMC 7040213 . PMID 31839646.
- ^ Sarafoglou K, Lorentz CP, Otten N, Oetting WS, Grebe SK (julio de 2012). "Pruebas moleculares en hiperplasia suprarrenal congénita debida a deficiencia de 21α-hidroxilasa en la era del cribado neonatal". Genetics Clinical . 82 (1): 64–70. doi :10.1111/j.1399-0004.2011.01694.x. PMID 21534945. S2CID 7197547.
- ^ Bergamaschi R, Livieri C, Uggetti C, Candeloro E, Egitto MG, Pichiecchio A, Cosi V, Bastianello S (marzo de 2006). "Deterioro de la sustancia blanca del cerebro en la hiperplasia suprarrenal congénita". Archivos de Neurología . 63 (3): 413–6. doi :10.1001/archneur.63.3.413. PMID 16540460.
- ^ Marcol W, Kalina-Faska B, Wackermann-Ramos A, Koehler B (2000). "Hiperplasia suprarrenal congénita condicionada por deficiencia de 21beta-hidroxilasa - consideraciones clínicas". Endokrynologia, Diabetologia I Choroby Przemiany Materii Wieku Rozwojowego (en polaco). 6 (1): 67–9. PMID 14640134.
- ^ ab
 Este artículo incorpora material de dominio público de "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". Colección de secuencias de referencia . Centro Nacional de Información Biotecnológica . Consultado el 30 de noviembre de 2020 .
Este artículo incorpora material de dominio público de "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". Colección de secuencias de referencia . Centro Nacional de Información Biotecnológica . Consultado el 30 de noviembre de 2020 . Este gen codifica un miembro de la superfamilia de enzimas del citocromo P450. Las proteínas del citocromo P450 son monooxigenasas que catalizan muchas reacciones involucradas en el metabolismo de fármacos y la síntesis de colesterol, esteroides y otros lípidos. Esta proteína se localiza en el retículo endoplasmático e hidroxila esteroides en la posición 21. Su actividad es necesaria para la síntesis de hormonas esteroides, incluido el cortisol y la aldosterona. Las mutaciones en este gen causan hiperplasia suprarrenal congénita. Un pseudogén relacionado se encuentra cerca de este gen; se cree que los eventos de conversión génica que involucran al gen funcional y al pseudogén explican muchos casos de deficiencia de esteroide 21-hidroxilasa. Se han encontrado dos variantes de transcripción que codifican diferentes isoformas para este gen.
- ^ Ryan KJ, Engel LL (marzo de 1957). «Hidroxilación de esteroides en el carbono 21» (PDF) . The Journal of Biological Chemistry . 225 (1): 103–14. doi : 10.1016/S0021-9258(18)64913-0 . PMID 13416221. Archivado (PDF) desde el original el 25 de marzo de 2020. Consultado el 17 de octubre de 2009 .
- ^ abcdef Pallan PS, Wang C, Lei L, Yoshimoto FK, Auchus RJ, Waterman MR, Guengerich FP, Egli M (mayo de 2015). "Citocromo P450 21A2 humano, el principal esteroide 21-hidroxilasa: estructura del complejo de sustrato de la enzima progesterona y escisión del enlace ch limitante de la velocidad". The Journal of Biological Chemistry . 290 (21): 13128–43. doi : 10.1074/jbc.M115.646307 . PMC 4505568 . PMID 25855791.
- ^ ab Neunzig J, Milhim M, Schiffer L, Khatri Y, Zapp J, Sánchez-Guijo A, et al. (marzo de 2017). "El metabolito esteroide 16(β)-OH-androstenediona generado por CYP21A2 sirve como sustrato para CYP19A1". Revista de bioquímica y biología molecular de esteroides . 167 : 182–191. doi :10.1016/j.jsbmb.2017.01.002. PMID 28065637. S2CID 36860068.
- ^ ab Guengerich FP, Waterman MR, Egli M (agosto de 2016). "Información estructural reciente sobre la función del citocromo P450". Tendencias en ciencias farmacológicas . 37 (8): 625–40. doi :10.1016/j.tips.2016.05.006. PMC 4961565 . PMID 27267697.
- ^ Sushko TA, Gilep AA, Usanov SA (junio de 2012). "Mecanismo de interacciones intermoleculares de los citocromos P450 microsomales CYP17 y CYP21 involucrados en la biosíntesis de hormonas esteroides". Bioquímica. Biokhimiia . 77 (6): 585–92. doi :10.1134/S0006297912060041. PMID 22817457. S2CID 18927484.
- ^ abc ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 GRCh38: Versión 89 de Ensembl: ENSG00000198457, ENSG00000231852, ENSG00000206338, ENSG00000233151, ENSG00000232414, ENSG00000235134 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000024365 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^
 Este artículo incorpora material de dominio público de "CYP21A2 cytochrome P450 family 21 subfamily A member 2 [Homo sapiens (human)]". Colección de secuencias de referencia . Centro Nacional de Información Biotecnológica .
Este artículo incorpora material de dominio público de "CYP21A2 cytochrome P450 family 21 subfamily A member 2 [Homo sapiens (human)]". Colección de secuencias de referencia . Centro Nacional de Información Biotecnológica . - ^ Baumgartner-Parzer S, Witsch-Baumgartner M, Hoeppner W (octubre de 2020). "Directrices de mejores prácticas de EMQN para pruebas genéticas moleculares y notificación de deficiencia de 21-hidroxilasa". Revista Europea de Genética Humana . 28 (10): 1341–1367. doi : 10.1038/s41431-020-0653-5 . PMC 7609334 . PMID 32616876. S2CID 220295067.
- ^ Higashi Y, Yoshioka H, Yamane M, Gotoh O, Fujii-Kuriyama Y (mayo de 1986). "Secuencia de nucleótidos completa de dos genes de la esteroide 21-hidroxilasa dispuestos en tándem en el cromosoma humano: un pseudogén y un gen genuino". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 83 (9): 2841–5. Bibcode :1986PNAS...83.2841H. doi : 10.1073/pnas.83.9.2841 . PMC 323402 . PMID 3486422.
- ^ Concolino P, Rizza R, Costella A, Carrozza C, Zuppi C, Capoluongo E (junio de 2017). "Variantes intrónicas de CYP21A2 que causan deficiencia de 21-hidroxilasa". Metabolismo: clínico y experimental . 71 : 46–51. doi :10.1016/j.metabol.2017.03.003. PMID 28521877.
- ^ Witek J, Mohiuddin SS (2023). Bioquímica, Pseudogenes . Treasure Island (FL): StatPearls Publishing. PMID 31751022. NCBI NBK549832.
- ^ abc Parker KL, Chaplin DD, Wong M, Seidman JG, Smith JA, Schimmer BP (diciembre de 1985). "Expresión de la 21-hidroxilasa murina en glándulas suprarrenales de ratón y en células tumorales adrenocorticales Y1 transfectadas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 82 (23): 7860–4. Bibcode :1985PNAS...82.7860P. doi : 10.1073/pnas.82.23.7860 . PMC 390869 . PMID 2999780.
- ^ Shiina T, Shimizu S, Hosomichi K, Kohara S, Watanabe S, Hanzawa K, et al. (junio de 2004). "Análisis genómico comparativo de dos regiones MHC aviares (de codorniz y de pollo)". Journal of Immunology . 172 (11): 6751–63. doi : 10.4049/jimmunol.172.11.6751 . PMID 15153492.
- ^ ab Yu CY (1999). "Genética molecular del grupo de genes del complemento MHC humano". Inmunogenética experimental y clínica . 15 (4): 213–230. doi :10.1159/000019075. PMID 10072631. S2CID 25061446.
- ^ White PC, Grossberger D, Onufer BJ, Chaplin DD, New MI, Dupont B, Strominger JL (febrero de 1985). "Dos genes que codifican la esteroide 21-hidroxilasa se encuentran cerca de los genes que codifican el cuarto componente del complemento en el hombre". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 82 (4): 1089–1093. Bibcode :1985PNAS...82.1089W. doi : 10.1073/pnas.82.4.1089 . PMC 397199 . PMID 2983330.
- ^ Xie T, Rowen L, Aguado B, Ahearn ME, Madan A, Qin S, et al. (diciembre de 2003). "Análisis de la región de clase III del complejo mayor de histocompatibilidad denso en genes y su comparación con el ratón". Genome Research . 13 (12): 2621–2636. doi :10.1101/gr.1736803. PMC 403804 . PMID 14656967.
- ^ abcd Bánlaki Z, Doleschall M, Rajczy K, Fust G, Szilágyi A (octubre de 2012). "Caracterización precisa de las variantes del número de copias de RCCX y su relación con los haplotipos extendidos del MHC". Genes and Immunity . 13 (7): 530–535. doi : 10.1038/gene.2012.29 . PMID 22785613. S2CID 36582994.
- ^ ab Carrozza C, Foca L, De Paolis E, Concolino P (2021). "Genes y pseudogenes: complejidad del locus RCCX y enfermedad". Fronteras en Endocrinología . 12 : 709758. doi : 10.3389/fendo.2021.709758 . PMC 8362596 . PMID 34394006.
- ^ Sweeten TL, Odell DW, Odell JD, Torres AR (enero de 2008). "Los alelos nulos de C4B no están asociados con polimorfismos genéticos en el gen adyacente CYP21A2 en el autismo". BMC Medical Genetics . 9 : 1. doi : 10.1186/1471-2350-9-1 . PMC 2265260 . PMID 18179706.
- ^ Milner CM, Campbell RD (agosto de 2001). "Organización genética de la región de clase III del MHC humano". Frontiers in Bioscience . 6 : D914–D926. doi : 10.2741/milner . PMID 11487476.
- ^ Kim JH, Kim GH, Yoo HW, Choi JH (junio de 2023). "Base molecular y estrategias de pruebas genéticas para diagnosticar la deficiencia de 21-hidroxilasa, incluido el síndrome CAH-X". Anales de endocrinología y metabolismo pediátricos . 28 (2): 77–86. doi :10.6065/apem.2346108.054. PMC 10329939 . PMID 37401054.
- ^ abc Bánlaki Z, Szabó JA, Szilágyi Á, Patócs A, Prohászka Z, Füst G, Doleschall M (2013). "Evolución intraespecífica de la variación del número de copias de RCCX humano trazada por haplotipos del gen CYP21A2". Genoma Biol Evol . 5 (1): 98-112. doi : 10.1093/gbe/evs121. PMC 3595039 . PMID 23241443.
- ^ Tsai LP, Lee HH (septiembre de 2012). "Análisis de los genes CYP21A1P y CYP21A2 duplicados". Gene . 506 (1): 261–262. doi :10.1016/j.gene.2012.06.045. PMID 22771554.
- ^ ab Arriba M, Ezquieta B (2022). "Diagnóstico molecular de la deficiencia de esteroide 21-hidroxilasa: un enfoque práctico". Front Endocrinol . 13 : 834549. doi : 10.3389/fendo.2022.834549 . PMC 9001848 . PMID 35422767.
- ^ abc Karaoğlan M, Nacarkahya G, Aytaç EH, Keskin M (noviembre de 2021). "Desafíos de la genotipificación de CYP21A2 en niños con deficiencia de 21-hidroxilasa: determinación de la correlación genotipo-fenotipo mediante secuenciación de próxima generación en el sudeste de Anatolia". J Endocrinol Invest . 44 (11): 2395–2405. doi :10.1007/s40618-021-01546-z. PMID 33677812. S2CID 232133292.
- ^ Xu Z, Chen W, Merke DP, McDonnell NB (noviembre de 2013). "Análisis integral de mutaciones del gen CYP21A2: un enfoque eficiente de múltiples pasos para el diagnóstico molecular de la hiperplasia suprarrenal congénita". J Mol Diagn . 15 (6): 745–53. doi :10.1016/j.jmoldx.2013.06.001. PMC 5803549 . PMID 24071710.
- ^ "Hoja informativa sobre la reacción en cadena de la polimerasa (PCR)". Genome.gov . Archivado desde el original el 3 de diciembre de 2023 . Consultado el 3 de diciembre de 2023 .
- ^ "Southern blotting — Knowledge Hub". GeNotes . Archivado desde el original el 3 de diciembre de 2023 . Consultado el 3 de diciembre de 2023 .
- ^ Guo X, Zhang Y, Yu Y, Zhang L, Ullah K, Ji M, Jin B, Shu J (2023). "Corrección: Embarazo con hiperplasia suprarrenal congénita: reproducción asistida y complicaciones del embarazo. Una revisión sistemática y metanálisis". Front Endocrinol . 14 : 1269711. doi : 10.3389/fendo.2023.1269711 . PMC 10575760 . PMID 37842302.
- ^ Adachi E, Nakagawa R, Tsuji-Hosokawa A, Gau M, Kirino S, Yogi A, Nakatani H, Takasawa K, Yamaguchi T, Kosho T, Murakami M, Tajima T, Hasegawa T, Yamada T, Morio T, Ohara O, Kashimada K (octubre de 2023). "Una aplicación de secuenciación de lectura larga basada en MinION con PCR de un solo paso para el diagnóstico genético de la deficiencia de 21-hidroxilasa". J Clin Endocrinol Metab . 109 (3): 750–760. doi : 10.1210/clinem/dgad577 . PMID 37804107. S2CID 263742489.
- ^ Zhang X, Gao Y, Lu L, Cao Y, Zhang W, Sun B, Wu X, Tong A, Chen S, Wang X, Mao J, Nie M (2023). "Secuenciación de lectura larga dirigida para la detección integral de mutaciones de CYP21A2 en pacientes con deficiencia de 21-hidroxilasa". Revista de investigación endocrinológica . 47 (4): 833–841. doi :10.1007/s40618-023-02197-y. PMID 37815751. S2CID 263800944.
- ^ "Esteroide 21-hidroxilasa | DrugBank Online". go.drugbank.com . Archivado desde el original el 28 de noviembre de 2023 . Consultado el 27 de noviembre de 2023 .
- ^ Werck-Reichhart D, Feyereisen R (2000). "Citocromos P450: una historia de éxito". Genome Biology . 1 (6): REVIEWS3003. doi : 10.1186/gb-2000-1-6-reviews3003 . PMC 138896 . PMID 11178272.
- ^ Zhao B, Lei L, Kagawa N, Sundaramoorthy M, Banerjee S, Nagy LD, Guengerich FP, Waterman MR (marzo de 2012). "La estructura tridimensional de la esteroide 21-hidroxilasa (citocromo P450 21A2) con dos sustratos revela la ubicación de las variantes asociadas a la enfermedad". The Journal of Biological Chemistry . 287 (13): 10613–22. doi : 10.1074/jbc.M111.323501 . PMC 3323056 . PMID 22262854.
- ^ ab Graham SE, Peterson JA (2002). "Alineamientos de secuencias, variabilidades y caprichos". Cytochrome P450 Part C . Métodos en enzimología. Vol. 357. Academic Press. págs. 15-28. doi :10.1016/s0076-6879(02)57661-8. ISBN 978-0-12-182260-6. Número PMID 12424893.
- ^ Baker ME, Nelson DR, Studer RA (julio de 2015). "Origen de la respuesta a los esteroides suprarrenales y sexuales: funciones de la promiscuidad y la coevolución de las enzimas y los receptores de esteroides". J Steroid Biochem Mol Biol . 151 : 12–24. doi :10.1016/j.jsbmb.2014.10.020. PMID 25445914. S2CID 21649057.
- ^ Barany A, Shaughnessy CA, McCormick SD (marzo de 2021). "Control de la Na+/K+-ATPasa por corticosteroides en el intestino de la lamprea marina (Petromyzon marinus)". Endocrinología general y comparada . 307 : 113756. doi :10.1016/j.ygcen.2021.113756. PMID 33741310. S2CID 232296805.
- ^ ab Cameron PU, Tabarias HA, Pulendran B, Robinson W, Dawkins RL (1990). "Conservación del genoma central del MHC: mapeo PFGE y análisis RFLP de los genes del complemento, HSP70 y TNF en la cabra". Inmunogenética . 31 (4): 253–64. doi :10.1007/BF00204897. PMID 1970334. S2CID 22716959.
- ^ Kawashima A, Satta Y (2014). "Evolución dependiente del sustrato del citocromo P450: recambio rápido del tipo de desintoxicación y conservación del tipo de biosíntesis". PLOS ONE . 9 (6): e100059. Bibcode :2014PLoSO...9j0059K. doi : 10.1371/journal.pone.0100059 . PMC 4076195 . PMID 24977709.
- ^ Auchus RJ, Miller WL (2015). "Enzimas P450 en el procesamiento de esteroides". Citocromo P450: estructura, mecanismo y bioquímica (cuarta edición). Springer International Publishing. págs. 851–879. doi :10.1007/978-3-319-12108-6_12. ISBN 978-3-319-12107-9.
- ^ Korzekwa K (2014). "Cinética enzimática del metabolismo oxidativo: citocromos P450". Cinética enzimática en el metabolismo de fármacos . Métodos en biología molecular. Vol. 1113. Humana Press. págs. 149-166. doi :10.1007/978-1-62703-758-7_8. ISBN 978-1-62703-757-0. ISSN 1940-6029. PMID 24523112.
- ^ "Expresión tisular de CYP21A2". Atlas de proteínas humanas . Archivado desde el original el 28 de noviembre de 2023. Consultado el 27 de noviembre de 2023 .
- ^ "Expresión del ARN subcelular de CYP21A2". Atlas de proteínas humanas . Archivado desde el original el 28 de noviembre de 2023. Consultado el 27 de noviembre de 2023 .
- ^ Araújo RS, Mendonca BB, Barbosa AS, Lin CJ, Marcondes JA, Billerbeck AE, Bachega TA (octubre de 2007). "La microconversión entre las regiones promotoras de CYP21A2 y CYP21A1P causa la forma no clásica de la deficiencia de 21-hidroxilasa". The Journal of Clinical Endocrinology and Metabolism . 92 (10): 4028–34. doi : 10.1210/jc.2006-2163 . PMID 17666484.
- ^ abcdefgh Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. (noviembre de 2018). "Hiperplasia suprarrenal congénita debida a deficiencia de esteroide 21-hidroxilasa: una guía de práctica clínica de la Endocrine Society". The Journal of Clinical Endocrinology and Metabolism . 103 (11): 4043–4088. doi :10.1210/jc.2018-01865. PMC 6456929 . PMID 30272171.
- ^ ab Auchus RJ, Sampath Kumar A, Andrew Boswell C, Gupta MK, Bruce K, Rath NP, Covey DF (enero de 2003). "El enantiómero de progesterona (ent-progesterona) es un inhibidor competitivo de los citocromos humanos P450c17 y P450c21". Archivos de bioquímica y biofísica . 409 (1): 134–44. doi :10.1016/s0003-9861(02)00491-5. PMID 12464252.
- ^ Rosenfeld G, Ungar F, Dorfman RI, Pincus G (1955). "Irradiación y esteroidogénesis suprarrenal: transformaciones de esteroides por glándulas suprarrenales de ternera perfundidas aisladas irradiadas". Endocrinología . 56 (1): 24–9. doi :10.1210/endo-56-1-24. PMID 13220521.
- ^ Dorfman RI, Hayano M (marzo de 1952). "La acción de los homogeneizados suprarrenales sobre la progesterona, la 17-hidroxiprogesterona y la 21-desoxicortisona". Archivos de bioquímica y biofísica . 36 (1): 237–9. doi :10.1016/0003-9861(52)90397-4. PMID 14934270.
- ^ Lorence MC, Trant JM, Mason JI, Bhasker CR, Fujii-Kuriyama Y, Estabrook RW, Waterman MR (agosto de 1989). "Expresión de un ADNc de longitud completa que codifica el citocromo P450C21 suprarrenal bovino". Archivos de bioquímica y biofísica . 273 (1): 79–88. doi :10.1016/0003-9861(89)90164-1. PMID 2502949.
- ^ Wu DA, Hu MC, Chung BC (abril de 1991). "Expresión y estudio funcional del citocromo humano P450c21 de tipo salvaje y mutante en Saccharomyces cerevisiae". ADN y biología celular . 10 (3): 201–9. doi :10.1089/dna.1991.10.201. PMID 1707279.
- ^ "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". Centro Nacional de Información Biotecnológica. Archivado desde el original el 28 de octubre de 2020. Consultado el 30 de noviembre de 2020. Este gen codifica un miembro de la superfamilia de enzimas del citocromo P450 .
Las proteínas del citocromo P450 son monooxigenasas que catalizan muchas reacciones involucradas en el metabolismo de fármacos y la síntesis de colesterol, esteroides y otros lípidos. Esta proteína se localiza en el retículo endoplasmático e hidroxila esteroides en la posición 21. Su actividad es necesaria para la síntesis de hormonas esteroides, incluido el cortisol y la aldosterona. Las mutaciones en este gen causan hiperplasia suprarrenal congénita. Un pseudogén relacionado se encuentra cerca de este gen; se cree que los eventos de conversión génica que involucran al gen funcional y al pseudogén son responsables de muchos casos de deficiencia de esteroide 21-hidroxilasa. Se han encontrado dos variantes de transcripción que codifican diferentes isoformas para este gen.
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ abcd Merke DP, Auchus RJ (septiembre de 2020). "Hiperplasia suprarrenal congénita debida a deficiencia de 21-hidroxilasa". The New England Journal of Medicine . 383 (13): 1248–1261. doi :10.1056/NEJMra1909786. PMID 32966723. S2CID 221884108.
- ^ ab Miller WL, Auchus RJ (febrero de 2011). "Biología molecular, bioquímica y fisiología de la esteroidogénesis humana y sus trastornos". Endocrine Reviews . 32 (1): 81–151. doi :10.1210/er.2010-0013. PMC 3365799 . PMID 21051590.
- ^ Sharquie KE, Noaimi AA, Saleh BO, Anbar ZN (diciembre de 2009). "La frecuencia de la deficiencia de la enzima 21-alfa hidroxilasa y las hormonas sexuales relacionadas en sujetos iraquíes sanos en comparación con pacientes con acné vulgar". Revista Médica Saudí . 30 (12): 1547–50. PMID 19936418.
- ^ Falhammar H, Nordenström A (septiembre de 2015). "Hiperplasia suprarrenal congénita no clásica debida a deficiencia de 21-hidroxilasa: presentación clínica, diagnóstico, tratamiento y resultado". Endocrine . 50 (1): 32–50. doi :10.1007/s12020-015-0656-0. PMID 26082286. S2CID 23469344.
- ^ New MI (noviembre de 2006). "Experiencia clínica extensa: deficiencia no clásica de 21-hidroxilasa". The Journal of Clinical Endocrinology and Metabolism . 91 (11): 4205–14. doi : 10.1210/jc.2006-1645 . PMID 16912124.
La pérdida de cabello en el cuero cabelludo en mujeres y hombres es vergonzosa y requiere tratamiento con inhibidores de la 5α-reductasa.
- ^ Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, Grossman A, Hershman JM, Hofland J, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Purnell J, Singer F, Stratakis CA, Trence DL, Wilson DP, Yau M, Gujral J, New MI (abril de 2019). Hiperplasia suprarrenal congénita: diagnóstico y tratamiento de emergencia. MDText.com. PMID 25905311. Archivado desde el original el 14 de noviembre de 2020 . Consultado el 25 de marzo de 2021 .
- ^ Witchel SF, Azziz R (2010). "Hiperplasia suprarrenal congénita no clásica". Revista internacional de endocrinología pediátrica . 2010 : 625105. doi : 10.1155/2010/625105 . PMC 2910408. PMID 20671993 .
- ^ Berry V, Pontikos N, Ionides A, Kalitzeos A, Quinlan RA, Michaelides M (abril de 2022). "Las variantes patogénicas en el gen CYP21A2 causan cataratas polares posteriores congénitas autosómicas dominantes aisladas". Ophthalmic Genet . 43 (2): 218–223. doi : 10.1080/13816810.2021.1998556 . PMID 34748434. S2CID 243861798. Archivado desde el original el 2 de febrero de 2024 . Consultado el 2 de febrero de 2024 .
- ^ abcde Miller WL, White PC (enero de 2023). "Historia de la investigación suprarrenal: desde la anatomía antigua hasta la biología molecular contemporánea". Endocr Rev . 44 (1): 70–116. doi :10.1210/endrev/bnac019. PMC 9835964 . PMID 35947694.
- ^ Yamazaki H, ed. (2014). Cincuenta años de investigación sobre el citocromo P450 . doi :10.1007/978-4-431-54992-5. ISBN 978-4-431-54991-8. Número de identificación del sujeto 27237884.
- ^ Miller WL (2020). "Descubrimiento de tenascina-X e investigación temprana". Front Immunol . 11 : 612497. doi : 10.3389 /fimmu.2020.612497 . PMC 7829301. PMID 33505400.
Enlaces externos
- Entrada en GeneReviews/NCBI/NIH/UW sobre hiperplasia suprarrenal congénita con deficiencia de 21-hidroxilasa Archivado el 31 de mayo de 2010 en Wayback Machine
- Entrada de OMIM sobre hiperplasia suprarrenal congénita con deficiencia de 21-hidroxilasa Archivado el 29 de junio de 2011 en Wayback Machine
- Síntesis de desoxicorticosterona a partir de progesterona a través de la 21-hidroxilasa (imagen) Archivado el 26 de abril de 2021 en Wayback Machine.
- Esteroide+21-hidroxilasa en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Página de ubicación del genoma humano CPS1 y detalles del gen CPS1 en el navegador de genoma de la UCSC .
- Página de detalles del gen CYP21A2 y ubicación del genoma humano en el navegador de genoma UCSC .
- Resumen de toda la información estructural disponible en el PDB para UniProt : P08686 (Esteroide 21-hidroxilasa) en PDBe-KB .
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .







