Ácido siálico
 Ácido N -acetilneuramínico, el más común de los ácidos siálicos. |
Los ácidos siálicos son una clase de azúcares alfa-cetoácidos con una cadena principal de nueve carbonos . [1] El término "ácido siálico" (del griego σίαλον (síalon) ' saliva ') fue introducido por primera vez por el bioquímico sueco Gunnar Blix en 1952. El miembro más común de este grupo es el ácido N -acetilneuramínico (Neu5Ac o NANA) que se encuentra en animales y algunos procariotas .
Los ácidos siálicos se encuentran ampliamente distribuidos en los tejidos animales y formas relacionadas se encuentran en menor medida en otros organismos como en algunas microalgas , [2] bacterias y arqueas . [3] [4] [5] [6] Los ácidos siálicos son comúnmente parte de las glicoproteínas , glicolípidos o gangliósidos , donde decoran el final de las cadenas de azúcar en la superficie de las células o proteínas solubles. [7] Sin embargo, también se han observado ácidos siálicos en embriones de Drosophila y otros insectos. [8] Generalmente, las plantas parecen no contener ni mostrar ácidos siálicos. [9]
En los seres humanos, el cerebro tiene el mayor contenido de ácido siálico, donde estos ácidos juegan un papel importante en la transmisión neuronal y la estructura de los gangliósidos en la sinaptogénesis . [7] Se conocen más de 50 tipos de ácido siálico, todos los cuales pueden obtenerse a partir de una molécula de ácido neuramínico sustituyendo su grupo amino o uno de sus grupos hidroxilo. [1] En general, el grupo amino lleva un grupo acetilo o glicolilo, pero se han descrito otras modificaciones. Estas modificaciones junto con los enlaces han demostrado ser expresiones específicas de tejido y reguladas por el desarrollo , por lo que algunas de ellas solo se encuentran en ciertos tipos de glicoconjugados en células específicas. [8] Los sustituyentes hidroxilo pueden variar considerablemente; se han encontrado grupos acetilo , lactilo, metilo , sulfato y fosfato . [10]
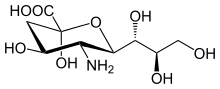
Estructura
La familia del ácido siálico incluye muchos derivados del ácido neuramínico , un azúcar de nueve carbonos , pero estos ácidos rara vez aparecen libres en la naturaleza. Normalmente se pueden encontrar como componentes de cadenas de oligosacáridos de mucinas, glicoproteínas y glicolípidos que ocupan posiciones terminales, no reductoras, de carbohidratos complejos tanto en áreas de membrana externa como interna donde están muy expuestos y desarrollan funciones importantes. [7]
La numeración de los átomos de carbono comienza en el carbono carboxilato y continúa a lo largo de la cadena. La configuración que coloca al carboxilato en posición axial es el anómero alfa.
El anómero alfa es la forma que se encuentra cuando el ácido siálico se une a los glicanos. Sin embargo, en solución, se encuentra principalmente (más del 90%) en la forma beta-anomérica. Se ha descubierto una enzima bacteriana con actividad mutarotasa del ácido siálico , NanM, que es capaz de equilibrar rápidamente las soluciones de ácido siálico hasta la posición de equilibrio en reposo de alrededor del 90% beta/10% alfa. [11]
A diferencia de otros animales, los humanos son genéticamente incapaces de producir la variante del ácido siálico, el ácido N-glicolilneuramínico (Neu5Gc). Sin embargo, pequeñas cantidades de Neu5Gc detectadas en el tejido humano pueden ser incorporadas a partir de fuentes exógenas (nutrientes). [12]
Biosíntesis
El ácido siálico es sintetizado por la glucosamina 6 fosfato y el acetil-CoA a través de una transferasa , dando como resultado N -acetilglucosamina-6-P. Esta se convierte en N -acetilmanosamina-6-P a través de la epimerización , que reacciona con el fosfoenolpiruvato produciendo N -acetilneuramínico-9-P (ácido siálico). Para que se active para entrar en el proceso de biosíntesis de oligosacáridos de la célula, se le añade un nucleósido monofosfato, que proviene de un trifosfato de citidina , convirtiendo el ácido siálico en citidina monofosfato-ácido siálico (CMP-ácido siálico). Este compuesto se sintetiza en el núcleo de la célula animal. [13] [14]
En los sistemas bacterianos, los ácidos siálicos también pueden ser biosintetizados por una aldolasa . Esta enzima utiliza, por ejemplo, un derivado de manosa como sustrato, insertando tres carbonos del piruvato en la estructura del ácido siálico resultante. Estas enzimas pueden utilizarse para la síntesis quimioenzimática de derivados del ácido siálico. [15]
Función
Las glucoproteínas que contienen ácido siálico ( sialoglicoproteínas ) se unen a la selectina en los seres humanos y otros organismos. Las células cancerosas metastásicas a menudo expresan una alta densidad de glucoproteínas ricas en ácido siálico. Esta sobreexpresión de ácido siálico en las superficies crea una carga negativa en las membranas celulares. Esto crea repulsión entre las células (oposición celular) [16] y ayuda a que estas células cancerosas en etapa avanzada ingresen al torrente sanguíneo. Experimentos recientes han demostrado la presencia de ácido siálico en la matriz extracelular secretada por el cáncer . [17]
Los oligosacáridos ricos en ácido siálico presentes en los glicoconjugados (glicolípidos, glicoproteínas, proteoglicanos) que se encuentran en las membranas superficiales ayudan a mantener el agua en la superficie de las células [ cita requerida ] . Las regiones ricas en ácido siálico contribuyen a crear una carga negativa en las superficies de las células. Dado que el agua es una molécula polar con cargas positivas parciales en ambos átomos de hidrógeno, es atraída por las superficies y membranas celulares. Esto también contribuye a la captación de fluidos celulares.
Los residuos de ácido siálico están presentes en las glicoproteínas de mucina del moco. [18]
El ácido siálico puede "ocultar" los antígenos de manosa en la superficie de las células huésped o bacterias de la lectina que se une a la manosa. [ cita requerida ] Esto evita la activación del complemento .
El ácido siálico en forma de ácido polisiálico es una modificación postraduccional inusual que se produce en las moléculas de adhesión celular neuronal (NCAM). En la sinapsis , la fuerte carga negativa del ácido polisiálico impide la reticulación de las NCAM en las células.
La administración de estrógenos a ratones castrados produce una reducción dosis-dependiente del contenido de ácido siálico en la vagina. Por el contrario, el contenido de ácido siálico en la vagina de los ratones es una medida de la potencia del estrógeno. Las sustancias de referencia son el estradiol para la aplicación subcutánea y el etinilestradiol para la administración oral. [19]
Inmunidad
Los ácidos siálicos se encuentran en todas las superficies celulares de los vertebrados y algunos invertebrados, y también en ciertas bacterias que interactúan con los vertebrados.
Muchos virus, como el serotipo Ad26 [20] de adenovirus ( Adenoviridae ), rotavirus ( Reoviridae ) y virus de la influenza ( Orthomyxoviridae ), pueden utilizar estructuras sialiladas del huésped para unirse a su célula huésped objetivo. Los ácidos siálicos proporcionan un buen objetivo para estos virus, ya que están altamente conservados y son abundantes en grandes cantidades en prácticamente todas las células. Como era de esperar, los ácidos siálicos también juegan un papel importante en varias infecciones virales humanas. Los virus de la influenza tienen glicoproteínas de actividad de hemaglutinina (HA) en sus superficies que se unen a los ácidos siálicos que se encuentran en la superficie de los eritrocitos humanos y en las membranas celulares del tracto respiratorio superior. Esta es la base de la hemaglutinación cuando los virus se mezclan con células sanguíneas y la entrada del virus en las células del tracto respiratorio superior. Los medicamentos antigripales ampliamente utilizados ( oseltamivir y zanamivir ) son análogos del ácido siálico que interfieren en la liberación de virus recién generados de las células infectadas al inhibir la enzima viral neuraminidasa . [21]
Algunas bacterias también utilizan estructuras sialiladas del huésped para la unión y el reconocimiento. Por ejemplo, la evidencia indica que los ácidos siálicos libres pueden comportarse como una señal para algunas bacterias específicas, como Pneumococcus . El ácido siálico libre posiblemente puede ayudar a la bacteria a reconocer que ha llegado a un entorno de vertebrados adecuado para su colonización. Las modificaciones de Sias, como el grupo N -glicolilo en la posición 5 o los grupos O -acetilo en la cadena lateral, pueden reducir la acción de las sialidasas bacterianas. [21]
Metabolismo
La síntesis y degradación del ácido siálico se distribuyen en diferentes compartimentos de la célula. La síntesis comienza en el citosol, donde la N -acetilmanosamina 6 fosfato y el fosfoenolpiruvato dan lugar al ácido siálico. Posteriormente, el fosfato Neu5Ac 9 es activado en el núcleo por un residuo de monofosfato de citidina (CMP) a través de la CMP-Neu5Ac sintasa. Aunque el enlace entre el ácido siálico y otros compuestos tiende a ser un enlace α, este en concreto es el único que es un enlace β. El CMP-Neu5Ac es luego transportado al retículo endoplasmático o al aparato de Golgi, donde puede ser transferido a una cadena de oligosacáridos, convirtiéndose en un nuevo glicoconjugado. Este enlace puede ser modificado por O- acetilación u O- metilación . Cuando el glicoconjugado está maduro es transportado a la superficie celular.
La sialidasa es una de las enzimas más importantes del catabolismo del ácido siálico. Puede provocar la eliminación de residuos de ácido siálico de la superficie celular o de sialoglicoconjugados séricos. Por lo general, en los animales superiores, los glicoconjugados que son propensos a degradarse son capturados por endocitosis. Después de la fusión del endosoma tardío con el lisosoma, las sialidasas lisosomales eliminan los residuos de ácido siálico. La actividad de estas sialidasas se basa en la eliminación de grupos O -acetilo. Las moléculas de ácido siálico libres son transportadas al citosol a través de la membrana del lisosoma. Allí, pueden reciclarse y activarse nuevamente para formar otra molécula de glicoconjugado naciente en el aparato de Golgi. Los ácidos siálicos también pueden degradarse a acilmanosamina y piruvato con la enzima citosólica acilneuraminato liasa.
Algunas enfermedades graves pueden depender de la presencia o ausencia de algunas enzimas relacionadas con el metabolismo del ácido siálico. La sialidosis y la deficiencia de ácido siálico con mutaciones en el gen NANS (ver más abajo) serían ejemplos de este tipo de trastorno. [22]
Desarrollo del cerebro
Las crías de rata suplementadas con ácido siálico mostraron un mejor aprendizaje y memoria cuando eran adultas. [23] Se observó una relación entre la suplementación dietética con ácido siálico y la función cognitiva en lechones que habían sido alimentados con altas dosis de ácido siálico. [24]

Enfermedades
Los ácidos siálicos están relacionados con varias enfermedades diferentes observadas en los seres humanos.
Deficiencia de ácido siálico con mutaciones en elNANÑOSgene
Las mutaciones recesivas bialélicas en el gen de síntesis de ácido siálico, la sintetasa del ácido N-acetil-neuramínico ( NANS ), en humanos pueden provocar una enfermedad grave que se caracteriza por discapacidad intelectual y baja estatura, lo que resalta la importancia del ácido siálico en el desarrollo cerebral. [25] Un ensayo terapéutico con una suplementación a corto plazo de ácido siálico administrada por vía oral no ha logrado demostrar un efecto beneficioso significativo sobre los parámetros bioquímicos [26]
Enfermedad de Salla
La enfermedad de Salla es una enfermedad extremadamente rara que se considera la forma más leve de los trastornos de acumulación de ácido siálico libre [27] aunque su forma infantil se considera una variante agresiva y las personas que la padecen tienen retraso mental. [ 28] Es un trastorno autosómico recesivo causado por una mutación del cromosoma 6. [29] Afecta principalmente al sistema nervioso [27] y es causado por una irregularidad de almacenamiento lisosomal que proviene de un déficit de un transportador de ácido siálico específico ubicado en la membrana lisosomal [30] Actualmente, no existe cura para esta enfermedad y el tratamiento es de apoyo, centrándose en el control de los síntomas. [27]
Aterosclerosis
Las subfracciones de colesterol LDL que están implicadas en la causa de la aterosclerosis tienen niveles reducidos de ácido siálico. [31] Estas incluyen partículas LDL pequeñas de alta densidad y LDL electronegativas. [31] Los niveles reducidos de ácido siálico en partículas LDL pequeñas de alta densidad aumentan la afinidad de esas partículas por los proteoglicanos en las paredes arteriales . [31]
Influenza
Todas las cepas del virus de la influenza A necesitan ácido siálico para conectarse con las células. Existen diferentes formas de ácidos siálicos que tienen diferente afinidad con la variedad del virus de la influenza A. Esta diversidad es un hecho importante que determina qué especies pueden ser infectadas. [32] Cuando un determinado virus de la influenza A es reconocido por un receptor de ácido siálico, la célula tiende a endocitar el virus, por lo que la célula se infecta.
Ácidos siálicos y otros ácidos no ulónicos (NulOs) en procariotas
Los ácidos siálicos son muy abundantes en los tejidos de los vertebrados, donde participan en muchos procesos biológicos diferentes. Originalmente descubiertos dentro del linaje de animales Deuterostome, los ácidos siálicos pueden considerarse en realidad como un subconjunto de una familia más antigua de monosacáridos de cadena principal de 9 carbonos llamados ácidos nonulosónicos (NulOs), que más recientemente también se han encontrado en Eubacteria y Archaea. [33] Muchas bacterias patógenas incorporan ácido siálico en las características de la superficie celular como su lipopolisacárido o polisacáridos de la cápsula, lo que les ayuda a evadir la respuesta inmune innata del huésped. [34] Un estudio reciente a nivel del genoma examinó un gran conjunto de genomas microbianos secuenciados, que indicó que las vías biosintéticas para producir ácidos nonulosónicos (NulOs) están mucho más ampliamente distribuidas a lo largo del árbol filogenético de la vida de lo que se creía anteriormente. [35] Este hallazgo está además respaldado por estudios recientes de tinción de lectina y un estudio a nivel molecular sobre ácidos no ulúsónicos procariotas, que muestran que también muchas cepas no patógenas y puramente ambientales producen ácidos siálicos bacterianos (NulOs). [36] [37] Algunas bacterias ( anammox ) producen NulOs que además del grupo alfa-cetoácido muy ácido también muestran grupos básicos (neutralizantes) (aminas libres). [38] Se han producido ácidos siálicos de superficie celular comparables mediante remodelación química para manipular la carga de la superficie celular produciendo una amina libre en C5, que neutraliza el grupo carboxilo cargado negativamente en C1. [39]
Véase también
Referencias
- ^ ab Varki, Ajit; Roland Schauer (2008). "Ácidos siálicos". en Fundamentos de glicobiología . Cold Spring Harbor Press. págs. Cap. 14. ISBN 9780879697709.
- ^ Wagstaff, Ben (2018). "La identificación de una vía de biosíntesis de Kdn en el haptofito Prymnesium parvum sugiere una biosíntesis generalizada de ácido siálico entre las microalgas". Journal of Biological Chemistry . 293 (42): 16277–16290. doi : 10.1074/jbc.RA118.004921 . PMC 6200933 . PMID 30171074.
- ^ Ajit, Varki (2017). "Ácidos siálicos y otros ácidos no ulosónicos". Ácidos siálicos y otros ácidos no ulosónicos." Fundamentos de glicobiología . Cold Spring Harbor Laboratory Press. doi :10.1101/glycobiology.3e.015 (inactivo 2024-09-12). PMID 28876847.
{{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ Kleikamp, Hugo (2020). "Abordar la diversidad química de los ácidos no ulásicos microbianos: un enfoque de estudio universal a gran escala". Chemical Science . 11 (11): 3074–3080. doi : 10.1039/c9sc06406k . PMC 8157484 . PMID 34122812.
- ^ Lewis, Amanda (2009). "Innovaciones en la biosíntesis de ácido siálico microbiano y hospedador reveladas por predicción filogenómica de la estructura del ácido no ulúsónico". Actas de la Academia Nacional de Ciencias . 106 (32): 13552–13557. Bibcode :2009PNAS..10613552L. doi : 10.1073/pnas.0902431106 . PMC 2726416 . PMID 19666579.
- ^ Schauer, Roland (2018). "Exploración del mundo del ácido siálico". Adv Carbohydr Chem Biochem . Avances en química y bioquímica de carbohidratos. 75 (75): 1–213. doi :10.1016/bs.accb.2018.09.001. ISBN 9780128152027. PMC 7112061 . PMID 30509400.
- ^ abc Wang, B.; Brand-Miller, J. (2003). "El papel y el potencial del ácido siálico en la nutrición humana". Revista Europea de Nutrición Clínica . 57 (11): 1351–1369. doi : 10.1038/sj.ejcn.1601704 . PMID 14576748.
- ^ ab Mandal, C. (1990). "Lectinas que se unen al ácido siálico". Experientia . 46 (5): 433–441. doi :10.1007/BF01954221. PMID 2189746. S2CID 27075067.
- ^ Varki, Ajit; Roland Schauer (2008). "Ácidos siálicos". en Fundamentos de glicobiología . Cold Spring Harbor Press. págs. Cap. 14. ISBN 9780879697709.
- ^ Schauer R. (2000). "Logros y desafíos de la investigación del ácido siálico". Glycoconj. J. 17 ( 7–9): 485–499. doi : 10.1023/A:1011062223612. PMC 7087979. PMID 11421344.
- ^ Severi E, Müller A, Potts JR, Leech A, Williamson D, Wilson KS, Thomas GH (2008). "La mutarrotación del ácido siálico es catalizada por la proteína beta-propeller YjhT de Escherichia coli". J Biol Chem . 283 (8): 4841–91. doi : 10.1074/jbc.M707822200 . PMID 18063573.
- ^ Tangvoranuntakul, Pam (14 de octubre de 2003). "Absorción e incorporación por parte de los seres humanos de un ácido siálico dietético no humano inmunogénico". PNAS . 100 (21): 12045–12050. Bibcode :2003PNAS..10012045T. doi : 10.1073/pnas.2131556100 . PMC 218710 . PMID 14523234.
- ^ Fulcher CA, "MetaCyc Chimeric Pathway: supervía de biosíntesis de ácido siálico y ácido CMP-siálico", "MetaCyc, marzo de 2009"
- ^ Warren, Leonard; Felsenfeld, Herbert (1962). "La biosíntesis de los ácidos siálicos" (PDF) . The Journal of Biological Chemistry . 237 (5): 1421. doi : 10.1016/S0021-9258(19)83718-3 .
- ^ Hai Yu; Harshal Chokhawala; Shengshu Huang y Xi Chen (2006). "Enfoque quimioenzimático de tres enzimas en un solo paso para la síntesis de sialósidos que contienen funcionalidades naturales y no naturales". Nature Protocols . 1 (5): 2485–2492. doi :10.1038/nprot.2006.401. PMC 2586341 . PMID 17406495.
- ^ Fuster, Mark M.; Esko, Jeffrey D. (2005). "Lo agridulce del cáncer: los glicanos como nuevos objetivos terapéuticos". Nature Reviews Cancer . 5 (7): 526–42. doi :10.1038/nrc1649. PMID 16069816. S2CID 10330140.
- ^ Dasgupta, Debayan; Amigo, Dharma; Saini, Deepak; Bhat, Ramray; Ghosh, Ambarish (2020). "Los nanomotores detectan heterogeneidades fisicoquímicas locales en microambientes tumorales". Angewandte Chemie . 59 (52): 23690–23696. doi : 10.1002/anie.202008681 . PMC 7756332 . PMID 32918839.
- ^ Cohen, Miriam (2013). "La influenza A penetra la mucosidad del huésped al escindir los ácidos siálicos con neuraminidasa". Virology Journal . 10 : 321. doi : 10.1186/1743-422X-10-321 . PMC 3842836 . PMID 24261589.
- ^ Jürgen Sandow; Ekkehard Scheiffele; Michael Haring; Günter Neef; Klaus Prezewowsky; Ulrich Stache (2007), "Hormonas", Enciclopedia de química industrial de Ullmann (7ª ed.), Wiley, págs. 1–81, doi :10.1002/14356007.a13_089, ISBN 978-3527306732
- ^ Baker, Alexander T.; Mundy, Rosie M.; Davies, James A.; Rizkallah, Pierre J.; Parker, Alan L. (septiembre de 2019). "El adenovirus humano tipo 26 utiliza glicanos portadores de ácido siálico como receptor primario de entrada celular". Science Advances . 5 (9): eaax3567. Bibcode :2019SciA....5.3567B. doi :10.1126/sciadv.aax3567. PMC 6726447 . PMID 31517055.
- ^ ab Varki A.; Gagneux P. (2012). "Multifaciales funciones de los ácidos siálicos en la inmunidad". Ann NY Acad Sci . 1253 (1): 16–36. Bibcode :2012NYASA1253...16V. doi :10.1111/j.1749-6632.2012.06517.x. PMC 3357316 . PMID 22524423.
- ^ Traving, C.; Schauer, R. (1998). "Estructura, función y metabolismo de los ácidos siálicos". Ciencias de la vida celular y molecular . 54 (12): 1330–1349. doi :10.1007/s000180050258. PMC 7082800 . PMID 9893709.
- ^ Oliveros E, Vázquez E, Barranco A, Ramírez M, Gruart A, Delgado-García JM, Buck R, Rueda R, Martín MJ (2018). "La suplementación con ácido siálico y oligosacáridos sialilados durante la lactancia mejora el aprendizaje y la memoria en ratas". Nutrientes . 10 (10): E1519. doi : 10.3390/nu10101519 . PMC 6212975 . PMID 30332832.
- ^ Wang B. (2012). "Mecanismo molecular subyacente al ácido siálico como nutriente esencial para el desarrollo cerebral y la cognición". Adv. Nutr . 3 (3): 465S–472S. doi :10.3945/an.112.001875. PMC 3649484 . PMID 22585926.
- ^ van Karnebeek, Clara DM; Bonafé, Luisa; Wen, Xiao-Yan; Tarailo-Graovac, Maja; Balzano, Sara; Royer-Bertrand, Beryl; Ashikov, Ángel; Garavelli, Livia; Mamá, Isabel; Turolla, Licia; Breen, Catherine (julio de 2016). "La síntesis de ácido siálico mediada por NANS es necesaria para el desarrollo del cerebro y el esqueleto". Genética de la Naturaleza . 48 (7): 777–784. doi :10.1038/ng.3578. hdl : 2066/174072 . ISSN 1546-1718. PMID 27213289. S2CID 24953080.
- ^ Tran C, Turolla L, Ballhausen D, Buros SC, Teav T, Gallart-Ayala H, Ivanisevic J, Faouzi M, Lefeber DJ, Ivanovski I, Giangiobbe S, Caraffi SG, Garavelli L, Superti-Furga A (2021). "El destino del ácido siálico administrado por vía oral: primeros conocimientos de pacientes con deficiencia de ácido N-acetilneuramínico sintasa y sujetos de control". Mol Genet Metab Rep . 28 : 100777. doi :10.1016/j.ymgmr.2021.100777. PMC 8251509. PMID 34258226 .
- ^ abc "Enfermedad de Salla | Centro de Información sobre Enfermedades Genéticas y Raras (GARD) – un programa del NCATS".
- ^ "Enfermedad por almacenamiento de ácido siálico libre". Orphanet . Consultado el 21 de febrero de 2019 .
- ^ Ponsot, G. (2007). "Enfermedades por depósito de ácido siálico libre: enfermedad de Salla (incluida su forma infantil grave) y sialuria". EMC - Pediatría (en español). 42 : 1–3. doi :10.1016/S1245-1789(07)70257-3.
- ^ "Enfermedades por depósito de ácido siálico libre: Enfermedad de Salla (incluida su forma infantil grave) y sialuria" (en español).
- ^ abc Ivanova EA, Myasoedova VA, Melnichenko AA, Grechko AV, Orekhov AN (2017). "Lipoproteínas pequeñas y densas de baja densidad como biomarcador de enfermedades ateroscleróticas". Medicina oxidativa y longevidad celular . 2017 (10): 1273042. doi : 10.1155/2017/1273042 . PMC 5441126. PMID 28572872 .
- ^ Racaniello, Vincent (5 de mayo de 2009). «Fijación del virus de la gripe a las células: función de diferentes ácidos siálicos». Virology Blog . Consultado el 10 de abril de 2019 .
- ^ Ajit, Varki (2015). "Ácidos siálicos y otros ácidos no ulosónicos". Ácidos siálicos y otros ácidos no ulosónicos, Essentials of Glycobiology (3.ª ed.). Capítulo 15.: Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press. págs. 2015–2017. doi :10.1101/glycobiology.3e.015 (inactivo 2024-09-12). PMID 28876847.
{{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) CS1 maint: ubicación ( enlace ) - ^ Severi E.; Hood DW; Thomas GH (2007). "Utilización del ácido siálico por patógenos bacterianos". Microbiología . 153 (9): 2817–2822. doi : 10.1099/mic.0.2007/009480-0 . PMID 17768226.
- ^ Amanda, Lewis (2009). "Innovaciones en la biosíntesis de ácido siálico microbiano y hospedador reveladas por predicción filogenómica de la estructura del ácido no ulosónico". Actas de la Academia Nacional de Ciencias . 106 (32): 13552–13557. Bibcode :2009PNAS..10613552L. doi : 10.1073/pnas.0902431106 . PMC 2726416 . PMID 19666579.
- ^ Kleikamp, Hugo (2020). "Abordar la diversidad química de los ácidos no ulásicos microbianos: un enfoque de estudio universal a gran escala". Chemical Science . 11 (11): 3074–3080. doi : 10.1039/C9SC06406K . PMC 8157484 . PMID 34122812.
- ^ Boleij, Marissa (31 de marzo de 2020). "Decorando la casa Anammox: ácidos siálicos y glicosaminoglicanos sulfatados en las sustancias poliméricas extracelulares del lodo granular Anammox". Environ. Sci. Technol . 54 (8): 5218–5226. Bibcode :2020EnST...54.5218B. doi : 10.1021/acs.est.9b07207 . PMC 7181257 . PMID 32227885.
- ^ Pabst, Martin; Grouzdev, Denis S.; Lawson, Christopher E.; Kleikamp, Hugo BC; de Ram, Carol; Louwen, Rogier; Lin, Yue Mei; Lücker, Sebastian; van Loosdrecht, Mark CM; Laureni, Michele (2021-08-02). "Un enfoque general para explorar la glicosilación de proteínas procariotas revela la modulación única de la capa superficial de una bacteria anammox". The ISME Journal . 16 (2): 346–357. doi :10.1038/s41396-021-01073-y. ISSN 1751-7370. PMC 8776859 . PMID 34341504.
- ^ Wang, Jie; Cheng, Bo; Li, Jie; Zhang, Zhaoyue; Hong, Weiyao; Chen, Xing; Chen, Peng R. (2015). "Remodelación química de ácidos siálicos de la superficie celular a través de una reacción de eliminación bioortogonal activada por paladio". Angewandte Chemie International Edition . 54 (18): 5364–5368. doi :10.1002/anie.201409145. ISSN 1521-3773. PMID 25765364.
Enlaces externos
- El ácido siálico en la evolución


