Ácido clorhídrico
 | |||
 | |||
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Clorano [3] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.210.665 | ||
| Número CE |
| ||
| Número E | E507 (reguladores de acidez, ...) | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1789 | ||
| |||
| Propiedades | |||
| HCl( ac .) | |||
| Masa molar | 36,46 g·mol −1 | ||
| Apariencia | Líquido incoloro y transparente, vapores en el aire si se concentra. | ||
| Olor | Característica picante | ||
| Densidad | 1,18 g/ cm3 | ||
| Punto de fusión | Depende de la concentración (ver tabla) | ||
| Punto de ebullición | Depende de la concentración (ver tabla) | ||
| registro P | 0,00 [4] | ||
| Acidez (p K a ) | −5,9 (gas HCl) [5] | ||
| Farmacología | |||
| A09AB03 ( OMS ) B05XA13 ( OMS ) | |||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| Peligro [6] | |||
| H290 , H314 , H335 [6] | |||
| P260 , P280 , P303+P361+P353 , P305+P351+P338 [6] | |||
| NFPA 704 (rombo cortafuegos) | |||
| Compuestos relacionados | |||
Otros aniones | |||
Compuestos relacionados | Cloruro de hidrógeno | ||
| Página de datos complementarios | |||
| Ácido clorhídrico (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido clorhídrico , también conocido como ácido muriático o alcohol de sal , es una solución acuosa de cloruro de hidrógeno (HCl). Es una solución incolora con un olor penetrante característico . Se clasifica como un ácido fuerte . Es un componente del ácido gástrico en los sistemas digestivos de la mayoría de las especies animales, incluidos los humanos. El ácido clorhídrico es un reactivo de laboratorio importante y un producto químico industrial. [7] [8]
Etimología
Debido a que se producía a partir de sal de roca según los métodos de Johann Rudolph Glauber , el ácido clorhídrico fue llamado históricamente por los alquimistas europeos espíritus de sal o acidum salis (ácido de sal). Ambos nombres todavía se utilizan, especialmente en otros idiomas, como alemán : Salzsäure , holandés : Zoutzuur , sueco : Saltsyra , finlandés : Suolahappo , español : Salfumán , turco : Tuz Ruhu , polaco : kwas solny , húngaro : sósav , checo : kyselina solná , japonés :塩酸( ensan ), chino :盐酸( yánsuān ) y coreano : 염산 ( yeomsan ).
El HCl gaseoso se denominaba aire ácido marino . El nombre ácido muriático tiene el mismo origen ( muriático significa "relativo a la salmuera o a la sal", de ahí que muriato signifique clorhidrato ), y este nombre todavía se utiliza a veces. [1] [9] El nombre ácido clorhídrico fue acuñado por el químico francés Joseph Louis Gay-Lussac en 1814. [10]
Historia
Siglo IX-X
A principios del siglo X, el médico y alquimista persa Abu Bakr al-Razi ( c. 865-925 , latín: Rhazes) realizó experimentos con sal amónica ( cloruro de amonio ) y vitriolo ( sulfatos hidratados de varios metales), que destiló juntos, produciendo así el gas cloruro de hidrógeno . [11] Al hacerlo, al-Razi puede haber tropezado con un método primitivo para producir ácido clorhídrico, [12] como tal vez se manifiesta en la siguiente receta de su Kitāb al-Asrār ("El libro de los secretos"):
Tomar partes iguales de sal dulce, sal amarga, sal de Tabarzad , sal de Andarānī , sal india, sal de Al-Qilī y sal de orina. Después de añadir un peso igual de sal amoniacal bien cristalizada, disolver con humedad y destilar (la mezcla). Se destilará sobre agua fuerte, lo que romperá la piedra ( sakhr ) instantáneamente. [13]
Sin embargo, parece que en la mayoría de sus experimentos al-Razi hizo caso omiso de los productos gaseosos, concentrándose en cambio en los cambios de color que podrían producirse en el residuo. [14] Según Robert P. Multhauf , el cloruro de hidrógeno se produjo muchas veces sin un claro reconocimiento de que, al disolverlo en agua, se puede producir ácido clorhídrico. [15]
Siglo XI-XIII
Basándose en los experimentos de al-Razi, el De aluminibus et salibus ("Sobre alumbres y sales"), un texto árabe del siglo XI o XII falsamente atribuido a al-Razi y traducido al latín por Gerardo de Cremona (1144-1187), describió el calentamiento de metales con varias sales, que en el caso del mercurio resultó en la producción de cloruro de mercurio (II) (sublimado corrosivo). [16] En este proceso, en realidad comenzó a formarse ácido clorhídrico, pero inmediatamente reaccionó con el mercurio para producir sublimado corrosivo. Los alquimistas latinos del siglo XIII, para quienes el De aluminibus et salibus era una de las principales obras de referencia, estaban fascinados por las propiedades clorantes del sublimado corrosivo, y pronto descubrieron que cuando los metales se eliminan del proceso de calentamiento de vitriolos, alumbres y sales, se pueden destilar directamente ácidos minerales fuertes. [17]
Siglo XIV-XV
Agua regia
Un invento importante que resultó del descubrimiento de los ácidos minerales es el agua regia , una mezcla de ácido nítrico y ácido clorhídrico en una proporción de 1:3, capaz de disolver el oro. Esto fue descrito por primera vez en De inventione veritatis ("Sobre el descubrimiento de la verdad", de pseudo -Geber , después de c. 1300 ), donde el agua regia se preparaba añadiendo cloruro de amonio al ácido nítrico. [18] El hecho de que el agua regia se defina típicamente como una mezcla de ácido nítrico y ácido clorhídrico no significa que el ácido clorhídrico se descubriera antes o simultáneamente con el agua regia . El aislamiento del ácido clorhídrico ocurrió unos 300 años después. La producción de ácido clorhídrico en sí (es decir, como una sustancia aislada en lugar de ya mezclada con ácido nítrico) dependía del uso de aparatos de refrigeración más eficientes, que solo se desarrollarían en los siglos posteriores. [19]
Siglo XVI-XVII
Aislamiento de ácido clorhídrico
Desde el punto de vista de la historia occidental de la química, el ácido clorhídrico fue el último de los tres ácidos minerales conocidos cuyo método de producción apareció en la literatura. [20] Las recetas para su producción comenzaron a aparecer a fines del siglo XVI. Las primeras recetas para la producción de ácido clorhídrico se encuentran en Magiae naturalis ("Magia natural") de Giovanni Battista Della Porta (1535-1615 ) y en las obras de otros químicos contemporáneos como Andreas Libavius ( c. 1550-1616 ), Jean Beguin (1550-1620) y Oswald Croll ( c. 1563-1609 ). [21] Entre los historiadores que han escrito sobre este tema se encuentran los químicos alemanes Hermann Franz Moritz Kopp (1845) y Edmund Oscar von Lippmann (1938), el ingeniero de minas (y futuro presidente de los Estados Unidos) Herbert Hoover con su esposa, la geóloga Lou Henry Hoover (1912), el químico holandés Robert Jacobus Forbes (1948), la química estadounidense Mary Elvira Weeks (1956) y los químicos británicos F. Sherwood Taylor (1957) y JR Partington (1960). El químico italiano Ladislao Reti ha resumido el resultado de sus esfuerzos de esta manera: [22]
El primer ejemplo claro de preparación de ácido clorhídrico aparece en los escritos de Della Porta (1589 y 1608), Libavius (1597), Pseudo-Basil (1604), van Helmont (1646) y Glauber (1648). Se encuentran referencias anteriores menos convincentes en el Plichto de Rosetti (1540) y en Agricola (1558). En cuanto al primer método práctico de preparación a partir de vitriolo y sal común, no hay duda de que Pseudo-Basil precede a Glauber, pero este último tiene el mérito incuestionable de haber indicado la forma de producir el ácido que más tarde adoptaría la industria química para operaciones en gran escala.
— Ladislao Reti, ¿Qué edad tiene el ácido clorhídrico?
Disolución de metales
El conocimiento de los ácidos minerales como el ácido clorhídrico sería de importancia clave para los químicos del siglo XVII como Daniel Sennert (1572-1637) y Robert Boyle (1627-1691), quienes utilizaron su capacidad para disolver rápidamente metales en sus demostraciones de la naturaleza compuesta de los cuerpos. [23]
Desarrollos industriales
Durante la Revolución Industrial en Europa, la demanda de sustancias alcalinas aumentó. Un nuevo proceso industrial desarrollado por Nicolas Leblanc de Issoudun, Francia , permitió la producción a gran escala y a bajo precio de carbonato de sodio (carbonato de sodio). En este proceso de Leblanc , la sal común se convierte en carbonato de sodio, utilizando ácido sulfúrico, piedra caliza y carbón, liberando cloruro de hidrógeno como subproducto. Hasta la Ley de Álcalis británica de 1863 y una legislación similar en otros países, el exceso de HCl a menudo se ventilaba al aire. Una excepción temprana fue Bonnington Chemical Works donde, en 1830, el HCl comenzó a capturarse y el ácido clorhídrico producido se utilizó para fabricar sal amoniacal ( cloruro de amonio ). [24] Después de la aprobación de la ley, los productores de carbonato de sodio se vieron obligados a absorber el gas residual en agua, produciendo ácido clorhídrico a escala industrial. [25] [26]
En el siglo XX, el proceso Leblanc fue reemplazado por el proceso Solvay , que no utilizaba ácido clorhídrico como subproducto. Como el ácido clorhídrico ya se había establecido como un producto químico importante en numerosas aplicaciones, el interés comercial dio lugar a otros métodos de producción, algunos de los cuales todavía se utilizan en la actualidad. Después del año 2000, el ácido clorhídrico se fabrica principalmente mediante la absorción del cloruro de hidrógeno como subproducto de la producción de compuestos orgánicos industriales. [25] [26] [7]
Propiedades químicas
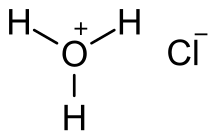
El cloruro de hidrógeno gaseoso es un compuesto molecular con un enlace covalente entre los átomos de hidrógeno y cloro. En soluciones acuosas, la disociación es completa, con la formación de iones de cloruro e iones de hidrógeno hidratados ( iones hidronio ). [27] Un estudio combinado de IR, Raman, rayos X y difracción de neutrones del ácido clorhídrico concentrado mostró que el ion hidronio forma complejos unidos por enlaces de hidrógeno con otras moléculas de agua. [28] (Véase Hidronio para una discusión más detallada de este tema).
Se estima teóricamente que el valor p K a del ácido clorhídrico en solución acuosa es -5,9. [5] Una solución de cloruro de hidrógeno en agua se comporta como un ácido fuerte : la concentración de moléculas de HCl es efectivamente cero.
Propiedades físicas
Fracción de masa | Concentración | Densidad | Molaridad | pH | Viscosidad | Calor específico | Presión de vapor | Punto de ebullición | Punto de fusión | |
|---|---|---|---|---|---|---|---|---|---|---|
| kg de HCl/kg | kg de HCl/ m3 | Baume | kilogramo/litro | prostituta | mPa·s | kJ/(kg·K) | kPa | °C | °C | |
| 10% | 104,80 | 6.6 | 1.048 | 2.87 | -0,5 | 1.16 | 3.47 | 1,95 | 103 | -18 |
| 20% | 219,60 | 13 | 1.098 | 6.02 | -0,8 | 1.37 | 2,99 | 1.40 | 108 | −59 |
| 30% | 344,70 | 19 | 1.149 | 9.45 | -1.0 | 1,70 | 2.60 | 2.13 | 90 | -52 |
| 32% | 370,88 | 20 | 1.159 | 10.17 | -1.0 | 1,80 | 2,55 | 3.73 | 84 | −43 |
| 34% | 397,46 | 21 | 1.169 | 10,90 | -1.0 | 1,90 | 2,50 | 7.24 | 71 | -36 |
| 36% | 424,44 | 22 | 1.179 | 11.64 | -1,1 | 1,99 | 2.46 | 14.5 | 61 | -30 |
| 38% | 451,82 | 23 | 1.189 | 12.39 | -1,1 | 2.10 | 2.43 | 28.3 | 48 | -26 |
| La temperatura y la presión de referencia para la tabla anterior son 20 °C y 1 atmósfera (101,325 kPa). Los valores de presión de vapor se toman de las Tablas Críticas Internacionales y se refieren a la presión de vapor total de la solución. | ||||||||||

Las propiedades físicas del ácido clorhídrico, como los puntos de ebullición y fusión , la densidad y el pH , dependen de la concentración o molaridad de HCl en la solución acuosa. Van desde las del agua en concentraciones muy bajas que se acercan al 0 % de HCl hasta los valores del ácido clorhídrico fumante en concentraciones superiores al 40 % de HCl. [31] [32] [33]
El ácido clorhídrico como mezcla binaria (de dos componentes) de HCl y H 2 O tiene un azeótropo de punto de ebullición constante al 20,2 % de HCl y 108,6 °C (381,8 K; 227,5 °F). Hay cuatro puntos eutécticos de cristalización constante para el ácido clorhídrico, entre la forma cristalina de [H 3 O]Cl (68 % de HCl), [H 5 O 2 ]Cl (51 % de HCl), [H 7 O 3 ]Cl (41 % de HCl), [H 3 O]Cl·5H 2 O (25 % de HCl) y hielo (0 % de HCl). También hay un punto eutéctico metaestable al 24,8 % entre el hielo y la cristalización de [H 7 O 3 ]Cl. [33] Todos ellos son sales de hidronio .
Producción
El ácido clorhídrico se suele preparar industrialmente disolviendo cloruro de hidrógeno en agua. El cloruro de hidrógeno se puede generar de muchas maneras, por lo que existen varios precursores del ácido clorhídrico. La producción a gran escala de ácido clorhídrico casi siempre está integrada con la producción a escala industrial de otros productos químicos , como en el proceso cloro-álcali que produce hidróxido , hidrógeno y cloro, este último puede combinarse para producir HCl. [31] [32]
El cloruro de hidrógeno se produce combinando cloro e hidrógeno :
- Cl2 + H2 → 2 HCl
Como la reacción es exotérmica , la instalación se denomina horno de HCl o quemador de HCl. El gas de cloruro de hidrógeno resultante se absorbe en agua desionizada , lo que da lugar a ácido clorhídrico químicamente puro. Esta reacción puede dar lugar a un producto muy puro, por ejemplo, para su uso en la industria alimentaria.
Mercado industrial
El ácido clorhídrico se produce en soluciones de hasta 38% de HCl (grado concentrado). Son químicamente posibles concentraciones más altas, de hasta poco más del 40%, pero la tasa de evaporación es tan alta que el almacenamiento y la manipulación requieren precauciones adicionales, como la presurización y el enfriamiento. Por lo tanto, el grado industrial a granel es del 30% al 35%, optimizado para equilibrar la eficiencia del transporte y la pérdida de producto por evaporación. En los Estados Unidos, las soluciones de entre el 20% y el 32% se venden como ácido muriático. Las soluciones para uso doméstico en los EE. UU., principalmente limpieza, suelen ser del 10% al 12%, con fuertes recomendaciones de diluir antes de usar. En el Reino Unido, donde se vende como "Spirits of Salt" para la limpieza doméstica, la potencia es la misma que la del grado industrial estadounidense. [25] En otros países, como Italia, el ácido clorhídrico para limpieza doméstica o industrial se vende como "Acido Muriatico", y su concentración varía del 5% al 32%.
Entre los principales productores a nivel mundial se encuentran Dow Chemical con 2 millones de toneladas anuales (Mt/año), calculadas como gas HCl, Georgia Gulf Corporation , Tosoh Corporation , Akzo Nobel y Tessenderlo con 0,5 a 1,5 Mt/año cada una. La producción mundial total, expresada como HCl a efectos comparativos, se estima en 20 Mt/año, de las cuales 3 Mt/año proceden de síntesis directa y el resto como producto secundario de síntesis orgánicas y similares. La mayor parte del ácido clorhídrico es consumido de forma cautiva por el productor. El tamaño del mercado mundial abierto se estima en 5 Mt/año. [25]
Aplicaciones
El ácido clorhídrico es un ácido inorgánico fuerte que se utiliza en muchos procesos industriales, como el refinado de metales. La aplicación suele determinar la calidad requerida del producto. [25] El cloruro de hidrógeno, no el ácido clorhídrico, se utiliza más ampliamente en la química orgánica industrial, por ejemplo, para el cloruro de vinilo y el dicloroetano . [8]
Decapado de acero
Una de las aplicaciones más importantes del ácido clorhídrico es el decapado del acero, para eliminar el óxido o las incrustaciones de óxido de hierro del hierro o el acero antes del procesamiento posterior, como la extrusión , el laminado , la galvanización y otras técnicas. [25] [7] El HCl de calidad técnica a una concentración típicamente del 18% es el agente de decapado más comúnmente utilizado para el decapado de grados de acero al carbono .
- Fe3O4 + Fe + 8 HCl → 4 FeCl2 + 4 H2O
El ácido gastado se ha reutilizado durante mucho tiempo como soluciones de cloruro de hierro (II) (también conocido como cloruro ferroso), pero los altos niveles de metales pesados en el licor de decapado han disminuido esta práctica.
La industria del decapado de acero ha desarrollado procesos de regeneración con ácido clorhídrico , como el proceso de tostado por aspersión o el proceso de regeneración con HCl en lecho fluidizado, que permiten recuperar el HCl del licor de decapado usado. El proceso de regeneración más común es el proceso de pirohidrólisis, que aplica la siguiente fórmula: [25]
- 4 FeCl2 + 4 H2O + O2 → 8 HCl + 2 Fe2O3
Mediante la recuperación del ácido gastado, se establece un circuito cerrado de ácido. [7] El óxido de hierro (III) subproducto del proceso de regeneración es valioso y se utiliza en una variedad de industrias secundarias. [25]
Producción de compuestos inorgánicos
De manera similar a su uso para el decapado, el ácido clorhídrico se utiliza para disolver muchos metales, óxidos metálicos y carbonatos metálicos. Las conversiones se representan a menudo en ecuaciones simplificadas:
- Zn + 2 HCl → ZnCl2 + H2
- NiO + 2 HCl → NiCl 2 + H 2 O
- CaCO 3 + 2 HCl → CaCl 2 + CO 2 + H 2 O
Estos procesos se utilizan para producir cloruros metálicos para análisis o producción posterior. [31] [32] [7]
Control y neutralización del pH
El ácido clorhídrico se puede utilizar para regular la acidez ( pH ) de las soluciones.
- HO − + HCl → H2O + Cl −
En las industrias que exigen pureza (alimentación, farmacéutica, agua potable), se utiliza ácido clorhídrico de alta calidad para controlar el pH de las corrientes de agua de proceso. En las industrias menos exigentes, el ácido clorhídrico de calidad técnica es suficiente para neutralizar las corrientes de desechos y controlar el pH de las piscinas. [7]
Regeneración de intercambiadores de iones
El ácido clorhídrico de alta calidad se utiliza en la regeneración de resinas de intercambio iónico . El intercambio catiónico se utiliza ampliamente para eliminar iones como Na + y Ca2 + de soluciones acuosas , produciendo agua desmineralizada . El ácido se utiliza para enjuagar los cationes de las resinas. [25] Na + se reemplaza con H + y Ca2 + con 2 H + .
Los intercambiadores de iones y el agua desmineralizada se utilizan en todas las industrias químicas, en la producción de agua potable y en muchas industrias alimentarias. [25]
Uso en laboratorio

De los ácidos minerales fuertes más comunes en química, el ácido clorhídrico es el ácido monoprótico que tiene menos probabilidades de sufrir una reacción de oxidación-reducción que interfiera . Es uno de los ácidos fuertes menos peligrosos de manipular; a pesar de su acidez, contiene el ion cloruro, que no es reactivo ni tóxico. Las soluciones de ácido clorhídrico de concentración intermedia son bastante estables durante el almacenamiento y mantienen sus concentraciones a lo largo del tiempo. Estos atributos, además del hecho de que está disponible como reactivo puro , hacen del ácido clorhídrico un excelente reactivo acidificante. Además, es económico.
El ácido clorhídrico es el ácido preferido en la titulación para determinar la cantidad de bases . Los titulantes de ácidos fuertes dan resultados más precisos debido a un punto final más claro. El ácido clorhídrico azeotrópico o de "punto de ebullición constante" (aproximadamente 20,2 %) se puede utilizar como estándar primario en el análisis cuantitativo , aunque su concentración exacta depende de la presión atmosférica cuando se prepara. [34]
Otro
El ácido clorhídrico se utiliza para una gran cantidad de aplicaciones a pequeña escala, como el procesamiento del cuero, la limpieza del hogar [35] y la construcción de edificios. [7] La producción de petróleo se puede estimular inyectando ácido clorhídrico en la formación rocosa de un pozo petrolero , disolviendo una parte de la roca y creando una estructura de poros grandes. La acidificación de pozos petrolíferos es un proceso común en la industria de producción de petróleo del Mar del Norte . [25]
El ácido clorhídrico se ha utilizado para disolver carbonato de calcio, por ejemplo, para desincrustar calderas y para limpiar mortero de mampostería. Cuando se utiliza en mampostería, la reacción con el mortero solo continúa hasta que el ácido se ha convertido por completo, lo que produce cloruro de calcio , dióxido de carbono y agua:
- CaCO 3 + 2 HCl → CaCl 2 + CO 2 + H 2 O
En la producción de alimentos, ingredientes alimentarios y aditivos alimentarios se utilizan muchas reacciones químicas que involucran ácido clorhídrico . Entre los productos típicos se incluyen aspartamo , fructosa , ácido cítrico , lisina , proteína vegetal hidrolizada como potenciador de alimentos y en la producción de gelatina . Se puede aplicar ácido clorhídrico de grado alimenticio (extra puro) cuando sea necesario para el producto final. [25] [7]
Presencia en organismos vivos

El ácido gástrico es una de las principales secreciones del estómago. Está compuesto principalmente de ácido clorhídrico y acidifica el contenido del estómago a un pH de 1 a 2. [36] [37] Los iones de cloruro (Cl − ) e hidrógeno (H + ) son secretados por separado en la región del fondo del estómago en la parte superior del estómago por las células parietales de la mucosa gástrica en una red secretora llamada canalículos antes de entrar en el lumen del estómago. [38]
El ácido gástrico actúa como barrera contra los microorganismos para prevenir infecciones y es importante para la digestión de los alimentos. Su bajo pH desnaturaliza las proteínas y, por lo tanto, las hace susceptibles a la degradación por enzimas digestivas como la pepsina . El bajo pH también activa el precursor enzimático pepsinógeno en la enzima activa pepsina por autoescisión. Después de salir del estómago, el ácido clorhídrico del quimo es neutralizado en el duodeno por el bicarbonato . [36]
El estómago está protegido del ácido fuerte por la secreción de una espesa capa de moco y por la acción tampón de la secretina con bicarbonato de sodio . Cuando estos mecanismos fallan, pueden aparecer ardor de estómago o úlceras pépticas . Los fármacos de las clases de antihistamínicos e inhibidores de la bomba de protones pueden inhibir la producción de ácido en el estómago, y se utilizan antiácidos para neutralizar el exceso de ácido existente. [36] [39]
Los osteoclastos también utilizan ácido clorhídrico junto con las proteasas para la resorción ósea . [40]
Seguridad
El ácido clorhídrico, al ser un ácido fuerte, es corrosivo para los tejidos vivos y para muchos materiales, pero no para el caucho. Por lo general, se utilizan guantes protectores de caucho y equipos de protección relacionados cuando se manipulan soluciones concentradas. [8]
Los vapores o las nieblas son un peligro respiratorio, que puede mitigarse parcialmente mediante el uso de un respirador equipado con cartuchos diseñados específicamente para capturar ácido clorhídrico. El ácido en suspensión es irritante para los ojos y puede requerir el uso de gafas protectoras o una mascarilla. [ cita requerida ]
Fracción de masa | Clasificación [41] | Lista de frases con H |
|---|---|---|
| 10% ≤ C < 25% | Provoca irritación cutánea, Provoca irritación ocular grave, | H315 , H319 |
| C ≥ 10% | Puede causar irritación respiratoria. | H335 |
| C ≥ 25% | Provoca quemaduras graves en la piel y daños oculares. | H314 |
Estatus legal
El ácido clorhídrico ha sido incluido como precursor de la Tabla II en la Convención de las Naciones Unidas contra el Tráfico Ilícito de Estupefacientes y Sustancias Psicotrópicas de 1988 debido a su uso en la producción de heroína , cocaína y metanfetamina . [42] [43]
Véase también
- Cloruro , sales inorgánicas del ácido clorhídrico.
- Clorhidrato , sales orgánicas de ácido clorhídrico a partir de hidróxido de sodio.
Referencias
- ^ ab «Ácido clorhídrico». Archivado desde el original el 15 de octubre de 2010. Consultado el 16 de septiembre de 2010 .
- ^ "espíritus de sal". Thefreedictionary.com . Consultado el 29 de mayo de 2012 .
- ^ Favre HA, Powell WH, eds. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 . Cambridge: The Royal Society of Chemistry . pág. 131.
- ^ "Ácido clorhídrico". www.chemsrc.com .
- ^ ab Trummal A, Lipping L, Kaljurand I, Koppel IA, Leito I (mayo de 2016). "Acidez de ácidos fuertes en agua y dimetilsulfóxido". The Journal of Physical Chemistry A . 120 (20): 3663–9. Bibcode :2016JPCA..120.3663T. doi :10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ^ abc Sigma-Aldrich Co. , Ácido clorhídrico.
- ^ abcdefgh Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 946–48. ISBN 978-0-08-037941-8.
- ^ abc Austin, Severin; Glowacki, Arndt (2000). Ácido clorhídrico . doi :10.1002/14356007.a13_283. ISBN 3527306730.
- ^ "Ácido muriático" (PDF) . PPG Industries . 2005. Archivado desde el original (PDF) el 2 de julio de 2015 . Consultado el 10 de septiembre de 2010 .
- ^ Gay-Lussac (1814) "Mémoire sur l'iode" (Memoria sobre el yodo), Annales de Chemie , 91 : 5-160. De la página 9: "... mais pour les distinger, je proponed'ajouter au mot spécifique de l'acide que l'on considère, le mot générique de hydro ; de sorte que le combinaisons acide de hydrogène avec le chlore, l 'iode, et le soufre porteraient le nom d'acide hydrochlorique, d'acide hydroiodique, et d'acide hydrosulfurique... " (... pero para distinguirlos, propongo añadir al sufijo específico de la considerado ácido, el prefijo general hidro , de modo que las combinaciones ácidas de hidrógeno con cloro, yodo y azufre llevarán el nombre de ácido clorhídrico, ácido yodhídrico y ácido sulfhídrico...)
- ^ Multhauf 1966, págs. 141-142.
- ^ Stapleton, Henry E .; Azo, RF; Hidayat Husain, M. (1927). "Química en Irak y Persia en el siglo X d. C." Memorias de la Sociedad Asiática de Bengala . VIII (6): 317–418. OCLC 706947607.pág. 333.
- ^ Stapleton, Azo y Hidayat Husain 1927, pág. 333 (para obtener un glosario de los términos utilizados en esta receta, consulte la página 322). Traducción alemana del mismo pasaje en Ruska, Julius (1937). Buch Geheimnis der Geheimnisse de Al-Rāzī. Mit Einleitung und Erläuterungen in deutscher Übersetzung . Quellen und Studien zur Geschichte der Naturwissenschaften und der Medizin. vol. VI. Berlín: Springer.p. 182, §5. Se puede encontrar una traducción al inglés de la traducción de Ruska 1937 en Taylor, Gail Marlow (2015). La alquimia de Al-Razi: una traducción del "Libro de los secretos" . CreateSpace Independent Publishing Platform. ISBN 9781507778791.págs. 139–140.
- ^ Multhauf, Robert P. (1966). Los orígenes de la química . Londres: Oldbourne. OCLC 977570829.págs. 141–142.
- ^ Multhauf 1966, pág. 142. Multhauf hace referencia a varias recetas del Kitāb al-Asrār traducido por Ruska 1937, pp. 103-110, pero no parece haber notado la existencia de la receta en Ruska 1937, pág. 182, §5 citado anteriormente.
- ^ Multhauf 1966, págs. 160-162.
- ^ Multhauf 1966, págs. 162-163.
- ^ Karpenko, Vladimír; Norris, John A. (2002). "Vitriolo en la Historia de la Química". Lista química . 96 (12): 997–1005.pág. 1002.
- ^ Multhauf 1966, pág. 204.
- ^ Reti 1965, pág. 11.
- ^ Multhauf 1966, pág. 208, nota 29; cf. pág. 142, nota 79.
- ^ Reti, L. (1965). "¿Qué antigüedad tiene el ácido clorhídrico?". Chymia . 10 : 11–23. doi :10.2307/27757245. JSTOR 27757245.
- ^ Newman, William R. (2006). Átomos y alquimia: química y los orígenes experimentales de la revolución científica . Chicago: University of Chicago Press. ISBN 978-0226576961.pág. 98.
- ^ Ronalds BF (2019). «Bonnington Chemical Works (1822-1878): Compañía pionera de alquitrán de hulla». Revista internacional de historia de la ingeniería y la tecnología . 89 (1–2): 73–91. doi :10.1080/17581206.2020.1787807. S2CID 221115202.
- ^ abcdefghijkl "Ácido clorhídrico". Chemicals Economics Handbook . SRI International . 2001. págs. 733.4000A–733.3003F.
- ^ ab Aftalion F (1991). Una historia de la industria química internacional . Filadelfia: University of Pennsylvania Press. ISBN 978-0-8122-1297-6.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Química general: principios y aplicaciones modernas . Prentice Hall. págs. 668–669. ISBN 978-0-13-014329-7.
- ^ Agmon N (enero de 1998). "Estructura de soluciones concentradas de HCl". The Journal of Physical Chemistry A . 102 (1): 192–199. Bibcode :1998JPCA..102..192A. CiteSeerX 10.1.1.78.3695 . doi :10.1021/jp970836x. ISSN 1089-5639.
- ^ "Clor número de sistema 6". Gmelins Handbuch der Anorganischen Chemie . Química Berlín. 1927.
- ^ "Systemnummer 6 Cloro, Ergänzungsband Teil B - Lieferung 1". Gmelins Handbuch der Anorganischen Chemie . Química Weinheim. 1968.
- ^ abc Lide D (2000). Manual de química y física del CRC (81.ª edición). CRC Press . ISBN 978-0-8493-0481-1.
- ^ abc Perry R, Green D, Maloney J (1984). Manual de ingenieros químicos de Perry (sexta edición). McGraw-Hill Book Company. ISBN 978-0-07-049479-4.
- ^ ab Aspen Properties . software de modelado de mezclas binarias (cálculos de Akzo Nobel Engineering ed.). Aspen Technology. 2002–2003.
- ^ Mendham J, Denney RC, Barnes JD, Thomas MJ, Denney RC, Thomas MJ (2000). Análisis químico cuantitativo de Vogel (6.ª ed.). Nueva York: Prentice Hall. ISBN 978-0-582-22628-9.
- ^ Simhon R (13 de septiembre de 2003). «Household plc: really filthy bathroom». The Daily Telegraph . Londres. Archivado desde el original el 23 de febrero de 2009. Consultado el 31 de marzo de 2010 .
- ^ abc Maton A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD (1993). Biología humana y salud . Englewood Cliffs, Nueva Jersey, EE. UU.: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ Haas E (6 de diciembre de 2000). "Ayudas digestivas: ácido clorhídrico". healthy.net .
- ^ Arthur C, Guyton MD, Hall JE (2000). Libro de texto de fisiología médica (10.ª edición). WB Saunders Company. ISBN 978-0-7216-8677-6.
- ^ Bowen R (18 de marzo de 2003). "Control and Physiologic Effects of Secretin". Universidad Estatal de Colorado. Archivado desde el original el 16 de agosto de 2018. Consultado el 16 de marzo de 2009 .
- ^ Väänänen, HK; Zhao, H; Mulari, M; Halleen, JM (febrero de 2000). "La biología celular de la función de los osteoclastos". Revista de ciencia celular . 113 (3): 377–81. doi :10.1242/jcs.113.3.377. PMID 10639325 . Consultado el 13 de abril de 2024 .
- ^ «Reglamento (CE) n.º 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) n.º 1907/2006». EUR-lex . Consultado el 16 de diciembre de 2008 .
- ^ Lista de precursores y productos químicos frecuentemente utilizados en la fabricación ilícita de estupefacientes y sustancias sicotrópicas sujetas a fiscalización internacional (PDF) (undécima edición). Junta Internacional de Fiscalización de Estupefacientes . Enero de 2007. Archivado desde el original (PDF) el 27 de febrero de 2008.
- ^ Sustancias químicas necesarias para la fabricación ilícita de drogas (PDF) (Informe). UNDOC. 1998. Consultado el 20 de julio de 2022 .
Enlaces externos
- NIST WebBook, enlace general
- Ácido clorhídrico – Primera parte y Ácido clorhídrico – Segunda parte en La tabla periódica de vídeos (Universidad de Nottingham)
- Calculadoras: tensiones superficiales, densidades, molaridades y molalidades de HCl acuoso
Información general de seguridad
- Resumen de peligros de la EPA
- Hoja de datos de seguridad del ácido clorhídrico del Instituto Tecnológico de Georgia
- Guía de bolsillo del NIOSH sobre peligros químicos
Información sobre la contaminación
- Inventario nacional de contaminantes: hoja informativa sobre el ácido clorhídrico