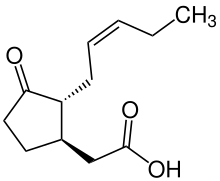
Ácido jasmónico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido {(1 R ,2 R )-3-Oxo-2-[(2 Z )-pent-2-en-1-il]ciclopentil}acético | |
| Otros nombres Ácido jasmónico Ácido (−)-jasmónico Ácido JA ( 1R,2R )-3-Oxo-2-( 2Z )-2-pentenilciclopentiletanoico Ácido {(1 R ,2 R )-3-Oxo-2-[(2 Z )-2-penten-1-il]ciclopentil}acético | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C12H18O3 | |
| Masa molar | 210,27 g/mol |
| Densidad | 1,1 g/ cm3 |
| Punto de ebullición | 160 °C (320 °F; 433 K) a 0,7 mmHg |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido jasmónico ( AJ ) es un compuesto orgánico que se encuentra en varias plantas, incluida la jazmín . La molécula es miembro de la clase de hormonas vegetales jasmonato . Se biosintetiza a partir del ácido linolénico por la vía octadecanoides . Fue aislado por primera vez en 1957 como el éster metílico del ácido jasmónico por el químico suizo Édouard Demole y sus colegas. [1]
Biosíntesis
Su biosíntesis parte del ácido graso ácido linolénico , que es oxigenado por la lipoxigenasa (13-LOX), formando un hidroperóxido . Este peróxido luego se cicla en presencia de la óxido de aleno sintasa para formar un óxido de aleno . La reorganización del óxido de aleno para formar ácido 12-oxofitodienoico es catalizada por la enzima óxido de aleno ciclasa . Una serie de β-oxidaciones da como resultado ácido 7-isojasmónico. En ausencia de enzima, este ácido isojasmónico se isomeriza a ácido jasmónico. [2]

Función
La función principal del JA y sus diversos metabolitos es regular las respuestas de las plantas a los estreses abióticos y bióticos, así como el crecimiento y desarrollo de las plantas. [3] Los procesos regulados de crecimiento y desarrollo de las plantas incluyen inhibición del crecimiento, senescencia , enrollamiento de los zarcillos , desarrollo de flores y abscisión de las hojas. El JA también es responsable de la formación de tubérculos en patatas y ñames. Tiene un papel importante en respuesta a heridas de plantas y resistencia sistémica adquirida . El gen Dgl es responsable de mantener los niveles de JA durante las condiciones habituales en Zea mays , así como de la liberación preliminar de ácido jasmónico poco después de ser alimentado. [4] Cuando las plantas son atacadas por insectos, responden liberando JA, que activa la expresión de inhibidores de proteasas , entre muchos otros compuestos de defensa antiherbívoros. Estos inhibidores de proteasas previenen la actividad proteolítica de las proteasas digestivas de los insectos o "proteínas salivares", [5] impidiéndoles así adquirir el nitrógeno necesario en la proteína para su propio crecimiento. [6] El JA también activa la expresión de la polifenol oxidasa , que promueve la producción de quinolinas . Estas pueden interferir con la producción de enzimas del insecto y disminuir el contenido nutricional de la planta ingerida. [7]
El JA puede tener un papel en el control de plagas. [8] De hecho, el JA ha sido considerado como un tratamiento de semillas para estimular las defensas naturales contra plagas de las plantas que germinan a partir de las semillas tratadas. En esta aplicación, los jasmonatos se rocían sobre plantas que ya han comenzado a crecer. [9] Estas aplicaciones estimulan la producción de inhibidor de proteasa en la planta. [10] Esta producción de inhibidor de proteasa puede proteger a la planta de los insectos, disminuyendo las tasas de infestación y el daño físico sufrido debido a los herbívoros. [11] Sin embargo, debido a su relación antagónica con el ácido salicílico (una señal importante en la defensa de los patógenos) en algunas especies de plantas, puede resultar en una mayor susceptibilidad a los agentes virales y otros patógenos. [12] En Zea mays , el ácido salicílico y el JA están mediados por NPR1 (no expresor de genes relacionados con la patogénesis1), que es esencial para evitar que los herbívoros exploten este sistema antagónico. [13] Los gusanos cogolleros ( orugas Spodoptera ), a través de mecanismos desconocidos, son capaces de aumentar la actividad de la vía del ácido salicílico en el maíz, lo que resulta en la depresión de la síntesis de JA, pero gracias a la mediación de NPR1, los niveles de JA no disminuyen en una cantidad significativa. [13]
Derivados
El ácido jasmónico también se convierte en una variedad de derivados, incluido el éster metil jasmonato . Esta conversión es catalizada por la enzima carboxil metiltransferasa del ácido jasmónico. [14] También se puede conjugar con aminoácidos en algunos contextos biológicos. La descarboxilación proporciona la fragancia relacionada jasmona .
Referencias
- ^ Demole, E.; Lederer, E.; Mercier, D. (1962). "Isolement et determination de la structure du jasmonate de methyle, component odorant characteristique de l'essence de jasmin" [Aislamiento y determinación de la estructura del metiljasmonato, el componente aromático característico del aceite esencial de jazmín]. Helvetica Chimica Acta (en francés). 45 (2): 675–685. doi :10.1002/hlca.19620450233.
- Chapuis, Christian (diciembre de 2011). “La química y el legado creativo del metil jasmonato y la hediona”. Perfumer & Flavorist . 36 : 36–48.
- ^ Dewick, Paul (2009). Productos naturales medicinales: un enfoque biosintético . Reino Unido: John Wiley & Sons. pp. 42–53. ISBN 978-0-470-74168-9.
- ^ Delker, C.; Stenzel, I.; Casa, B.; Miersch, O.; Feussner, I.; Wasternack, C. (2006). "Biosíntesis de jasmonato en Arabidopsis thaliana - enzimas, productos, regulación". Biología Vegetal . 8 (3): 297–306. doi :10.1055/s-2006-923935. PMID 16807821.
- ^ Gális, I.; Gaquerel, E.; Pandey, SP; Baldwin, INT (2009). "Mecanismos moleculares que subyacen a la memoria vegetal en las respuestas de defensa mediadas por JA". Plant, Cell & Environment . 32 (6): 617–627. doi : 10.1111/j.1365-3040.2008.01862.x . PMID 18657055.
- ^ Lutz, Diana (2012). "Se revela una parte clave del sistema de respuesta rápida de las plantas". Universidad de Washington en St. Louis .
- ^ Zavala, JA; Patankar, AG; Gase, K.; Hui, D.; Baldwin, IT (2004). "La manipulación de la producción endógena del inhibidor de la proteinasa de tripsina en Nicotiana attenuata demuestra su función como defensas antiherbívoras". Fisiología vegetal . 134 (3): 1181–1190. doi :10.1104/pp.103.035634. PMC 389942 . PMID 14976235.
- ^ Los efectos de los tratamientos con ácido bacteriano y jasmónico sobre los insectos de la canola. 2008.
- ^ "Éxito en el control de plagas en las plantas". BBC News . 2008-10-07 . Consultado el 2010-05-05 .
- ^ Worrall, D.; Holroyd, GH; Moore, JP; Glowacz, M.; Croft, P.; Taylor, JE; Paul, ND; Roberts, MR (2012). "El tratamiento de semillas con activadores de defensa de las plantas genera una preparación duradera de resistencia a plagas y patógenos" (PDF) . New Phytologist . 193 (3): 770–778. doi : 10.1111/j.1469-8137.2011.03987.x . PMID 22142268.
- ^ Farmer, EE; Johnson, RR; Ryan, CA (marzo de 1992). "Regulación de la expresión de genes inhibidores de proteinasa por metil jasmonato y ácido jasmónico". Fisiología vegetal . 98 (3): 995–1002. doi :10.1104/pp.98.3.995. ISSN 0032-0889. PMC 1080300 . PMID 16668777.
- ^ Fouad, Hany Ahmed; El-Gepaly, Hosam Mohamed Khalil Hammam; Fouad, Osama Ahmed (2016-08-26). "Nanosílice y ácido jasmónico como métodos alternativos para el control de Tuta absoluta (Meyrick) en el cultivo de tomate en condiciones de campo". Archivos de Fitopatología y Protección Vegetal . 49 (13–14): 362–370. doi :10.1080/03235408.2016.1219446. ISSN 0323-5408. S2CID 89119004.
- ^ Lyons, R.; Manners, JM; Kazan, K. (2013). "Biosíntesis y señalización de jasmonato en monocotiledóneas: una descripción comparativa". Plant Cell Reports . 32 (6): 815–27. doi :10.1007/s00299-013-1400-y. PMID 23455708. S2CID 10778582.
- ^ ab Ballaré, Carlos L. (2011). "Defensas inducidas por jasmonato: Una historia de inteligencia, colaboradores y bribones". Tendencias en la ciencia vegetal . 16 (5): 249–57. doi : 10.1016/j.tplants.2010.12.001 . hdl : 11336/97245 . PMID 21216178.
- ^ Seo, H.-S.; Song, J.-T.; Cheong, J.-J.; Lee, Y.-H.; Lee, Y.-W.; Hwang, I.; Lee, J.-S.; Choi, Y.-D. (10 de abril de 2001). "Carboxilmetiltransferasa del ácido jasmónico: una enzima clave para las respuestas de las plantas reguladas por jasmonato". Actas de la Academia Nacional de Ciencias . 98 (8): 4788–4793. Bibcode :2001PNAS...98.4788S. doi : 10.1073/pnas.081557298 . ISSN 0027-8424. PMC 31912 . PMID 11287667.
- Sankawa, Ushio; Barton, Derek HR; Nakanishi, Koji; Meth-Cohn, Otto, eds. (1999). Química integral de productos naturales: policétidos y otros metabolitos secundarios, incluidos los ácidos grasos y sus derivados . Pergamon Press. ISBN 978-0-08-043153-6.


