Tilacoides
| Biología celular | |
|---|---|
| Cloroplasto | |
 Componentes de un cloroplasto típico 1 Granum 3 Tilacoide ◄ Estás aquí
4 Tilacoides estromales |
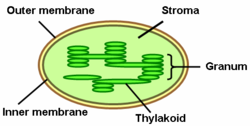
Los tilacoides son compartimentos delimitados por membranas dentro de los cloroplastos y las cianobacterias . Son el sitio de las reacciones dependientes de la luz de la fotosíntesis . Los tilacoides consisten en una membrana tilacoide que rodea un lumen tilacoide. Los tilacoides de los cloroplastos con frecuencia forman pilas de discos denominados grana (singular: granum ). Los grana están conectados por tilacoides intergranulares o estromales , que unen las pilas de granum como un solo compartimento funcional.
En las membranas tilacoides, los pigmentos de clorofila se encuentran en paquetes llamados cuantosomas . Cada cuantosoma contiene entre 230 y 250 moléculas de clorofila.
Etimología
La palabra tilacoide proviene del griego thylakos o θύλακος , que significa "saco" o "bolsa". [1] Por lo tanto, tilacoide significa "similar a un saco" o "similar a una bolsa".
Estructura



Los tilacoides son estructuras unidas por membranas que se encuentran incrustadas en el estroma del cloroplasto . Una pila de tilacoides se denomina granum y se asemeja a una pila de monedas.
Membrana
La membrana tilacoide es el sitio de las reacciones dependientes de la luz de la fotosíntesis con los pigmentos fotosintéticos incrustados directamente en la membrana. Es un patrón alterno de bandas oscuras y claras que miden cada una 1 nanómetro . [3] La bicapa lipídica tilacoide comparte rasgos característicos con las membranas procariotas y la membrana interna del cloroplasto. Por ejemplo, se pueden encontrar lípidos ácidos en las membranas tilacoides, cianobacterias y otras bacterias fotosintéticas y están involucrados en la integridad funcional de los fotosistemas. [4] Las membranas tilacoides de las plantas superiores están compuestas principalmente de fosfolípidos [5] y galactolípidos que están dispuestos asimétricamente a lo largo y a través de las membranas. [6] Las membranas tilacoides son más ricas en galactolípidos que en fosfolípidos; también consisten predominantemente en lípidos monogalacotosil diglicéridos formadores de fase II hexagonal. A pesar de esta composición única, se ha demostrado que las membranas tilacoides de las plantas asumen en gran medida una organización dinámica de bicapa lipídica. [7] Los lípidos que forman las membranas tilacoides, más ricas en ácido linolénico de alta fluidez [8], se sintetizan en una vía compleja que implica el intercambio de precursores lipídicos entre el retículo endoplásmico y la membrana interna de la envoltura del plástido y se transportan desde la membrana interna a los tilacoides a través de vesículas. [9]
Lúmenes
El lumen del tilacoide es una fase acuosa continua encerrada por la membrana del tilacoide . Desempeña un papel importante en la fotofosforilación durante la fotosíntesis . Durante la reacción dependiente de la luz, los protones se bombean a través de la membrana del tilacoide hacia el lumen, lo que lo vuelve ácido hasta un pH de 4.
Láminas del granum y del estroma
En las plantas superiores, los tilacoides se organizan en un conjunto de membranas de estroma y granum. Un granum (plural grana ) es una pila de discos tilacoides. Los cloroplastos pueden tener de 10 a 100 grana. Los grana están conectados por tilacoides del estroma, también llamados tilacoides intergranulares o láminas . Los tilacoides de grana y los tilacoides del estroma se pueden distinguir por su diferente composición proteica. Los grana contribuyen a la gran relación entre la superficie de los cloroplastos y el volumen. Un estudio reciente de tomografía electrónica de las membranas tilacoides ha demostrado que las láminas del estroma están organizadas en láminas anchas perpendiculares al eje de la pila de grana y forman múltiples superficies helicoidales dextrógiras en la interfaz granal. [2] Las superficies helicoidales zurdas se consolidan entre las hélices y láminas dextrógiras. Se ha demostrado que esta compleja red de superficies de membrana helicoidales alternadas de diferentes radios y pasos minimiza las energías de superficie y de flexión de las membranas. [2] Este nuevo modelo, el más extenso generado hasta la fecha, reveló que en la estructura coexisten características de dos modelos más antiguos aparentemente contradictorios [10] [11] . Cabe destacar que se propuso la presencia de disposiciones similares de elementos helicoidales de quiralidad alternada, a menudo denominadas estructuras de "garaje de estacionamiento", en el retículo endoplasmático [12] y en la materia nuclear ultradensa. [13] [14] [15] Esta organización estructural puede constituir una geometría fundamental para la conexión entre capas o láminas densamente empaquetadas. [2]
Formación
Los cloroplastos se desarrollan a partir de los proplástidos cuando las plántulas emergen del suelo. La formación de tilacoides requiere luz. En el embrión de la planta y en ausencia de luz, los proplástidos se convierten en etioplastos que contienen estructuras de membrana semicristalinas llamadas cuerpos prolamelares. Cuando se exponen a la luz, estos cuerpos prolamelares se convierten en tilacoides. Esto no sucede en las plántulas cultivadas en la oscuridad, que sufren etiolación . Una subexposición a la luz puede provocar que los tilacoides fallen. Esto hace que los cloroplastos fallen y la planta muera.
La formación de tilacoides requiere la acción de la proteína inductora de vesículas en los plástidos 1 (VIPP1). Las plantas no pueden sobrevivir sin esta proteína, y los niveles reducidos de VIPP1 conducen a un crecimiento más lento y plantas más pálidas con una capacidad reducida para realizar la fotosíntesis. VIPP1 parece ser necesaria para la formación básica de la membrana tilacoide, pero no para el ensamblaje de complejos proteicos de la membrana tilacoide. [16] Se conserva en todos los organismos que contienen tilacoides, incluidas las cianobacterias, [17] las algas verdes, como Chlamydomonas , [18] y las plantas superiores, como Arabidopsis thaliana . [19]
Aislamiento y fraccionamiento
Los tilacoides se pueden purificar a partir de células vegetales utilizando una combinación de centrifugación diferencial y de gradiente . [20] La disrupción de los tilacoides aislados, por ejemplo mediante cizallamiento mecánico, libera la fracción luminal. Las fracciones periféricas e integrales de la membrana se pueden extraer de la fracción de membrana restante. El tratamiento con carbonato de sodio (Na 2 CO 3 ) separa las proteínas de membrana periféricas , mientras que el tratamiento con detergentes y solventes orgánicos solubiliza las proteínas integrales de membrana .
Proteínas
Los tilacoides contienen muchas proteínas de membrana periféricas e integrales, así como proteínas luminales. Estudios proteómicos recientes de fracciones tilacoides han proporcionado más detalles sobre la composición proteica de los tilacoides. [21] Estos datos se han resumido en varias bases de datos de proteínas de plástidos que están disponibles en línea. [22] [23]
Según estos estudios, el proteoma tilacoidal consta de al menos 335 proteínas diferentes. De estas, 89 están en el lumen, 116 son proteínas integrales de membrana, 62 son proteínas periféricas en el lado del estroma y 68 proteínas periféricas en el lado luminal. Se pueden predecir proteínas luminales de baja abundancia adicionales mediante métodos computacionales. [20] [24] De las proteínas tilacoides con funciones conocidas, el 42% están involucradas en la fotosíntesis. Los siguientes grupos funcionales más grandes incluyen proteínas involucradas en la orientación , procesamiento y plegamiento de proteínas con un 11%, respuesta al estrés oxidativo (9%) y traducción (8%). [22]
Proteínas integrales de membrana
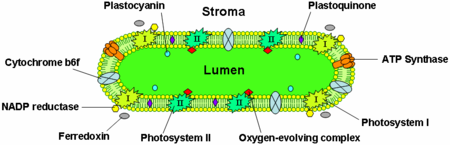
Las membranas tilacoidales contienen proteínas de membrana integrales que desempeñan un papel importante en la captación de luz y en las reacciones dependientes de la luz de la fotosíntesis. Existen cuatro complejos proteicos principales en la membrana tilacoide:
El fotosistema II se encuentra principalmente en los tilacoides de la grana, mientras que el fotosistema I y la ATP sintasa se encuentran principalmente en los tilacoides del estroma y en las capas externas de la grana. El complejo citocromo b6f se distribuye uniformemente por las membranas de los tilacoides. Debido a la ubicación separada de los dos fotosistemas en el sistema de membranas de los tilacoides, se requieren transportadores móviles de electrones para transportar electrones entre ellos. Estos transportadores son la plastoquinona y la plastocianina. La plastoquinona transporta electrones desde el fotosistema II al complejo citocromo b6f, mientras que la plastocianina transporta electrones desde el complejo citocromo b6f al fotosistema I.
Juntas, estas proteínas utilizan la energía de la luz para impulsar cadenas de transporte de electrones que generan un potencial quimiosmótico a través de la membrana del tilacoide y NADPH , un producto de la reacción redox terminal. La ATP sintasa utiliza el potencial quimiosmótico para producir ATP durante la fotofosforilación .
Fotosistemas
Estos fotosistemas son centros redox impulsados por la luz, cada uno de los cuales consta de un complejo de antena que utiliza clorofilas y pigmentos fotosintéticos accesorios como carotenoides y ficobiliproteínas para captar luz en una variedad de longitudes de onda. Cada complejo de antena tiene entre 250 y 400 moléculas de pigmento y la energía que absorben se transporta por transferencia de energía de resonancia a una clorofila a especializada en el centro de reacción de cada fotosistema. Cuando cualquiera de las dos moléculas de clorofila a en el centro de reacción absorbe energía, un electrón se excita y se transfiere a una molécula aceptora de electrones. El fotosistema I contiene un par de moléculas de clorofila a , designadas P700 , en su centro de reacción que absorben al máximo la luz de 700 nm. El fotosistema II contiene clorofila P680 que absorbe mejor la luz de 680 nm (tenga en cuenta que estas longitudes de onda corresponden al rojo oscuro; consulte el espectro visible ). La P es la abreviatura de pigmento y el número es el pico de absorción específico en nanómetros para las moléculas de clorofila en cada centro de reacción. Este es el pigmento verde presente en las plantas que no es visible a simple vista.
Complejo citocromo b6f
El complejo citocromo b6f forma parte de la cadena de transporte de electrones del tilacoide y acopla la transferencia de electrones al bombeo de protones hacia el lumen del tilacoide. Energéticamente, está situado entre los dos fotosistemas y transfiere electrones del fotosistema II-plastoquinona al fotosistema I-plastocianina.
ATP sintasa
La ATP sintasa de los tilacoides es una ATP sintasa CF1FO similar a la ATPasa mitocondrial. Está integrada en la membrana de los tilacoides y la parte CF1 se adhiere al estroma. Por lo tanto, la síntesis de ATP se produce en el lado estromal de los tilacoides, donde el ATP es necesario para las reacciones independientes de la luz de la fotosíntesis.
Proteínas del lumen
La proteína transportadora de electrones plastocianina está presente en el lumen y transporta electrones desde el complejo proteico citocromo b6f al fotosistema I. Mientras que las plastoquinonas son solubles en lípidos y, por lo tanto, se mueven dentro de la membrana tilacoide, la plastocianina se mueve a través del lumen tilacoide.
El lumen de los tilacoides también es el sitio de oxidación del agua por el complejo generador de oxígeno asociado con el lado lumen del fotosistema II.
Las proteínas luminales se pueden predecir computacionalmente en función de sus señales de orientación. En Arabidopsis, de las proteínas luminales predichas que poseen la señal Tat , los grupos más grandes con funciones conocidas son: 19% involucradas en el procesamiento de proteínas (proteólisis y plegamiento), 18% en la fotosíntesis, 11% en el metabolismo y 7% como transportadores redox y defensa. [20]
Expresión de proteínas
Los cloroplastos tienen su propio genoma , que codifica varias proteínas tilacoides. Sin embargo, durante el curso de la evolución de los plástidos a partir de sus ancestros endosimbióticos cianobacterianos , se produjo una extensa transferencia de genes desde el genoma del cloroplasto al núcleo celular . Esto da como resultado que los cuatro complejos proteicos tilacoides principales estén codificados en parte por el genoma del cloroplasto y en parte por el genoma nuclear. Las plantas han desarrollado varios mecanismos para co-regular la expresión de las diferentes subunidades codificadas en los dos orgánulos diferentes para asegurar la estequiometría y el ensamblaje adecuados de estos complejos proteicos. Por ejemplo, la transcripción de genes nucleares que codifican partes del aparato fotosintético está regulada por la luz . La biogénesis, la estabilidad y el recambio de los complejos proteicos tilacoides están regulados por la fosforilación a través de quinasas sensibles a redox en las membranas tilacoides. [25] La tasa de traducción de las proteínas codificadas por los cloroplastos está controlada por la presencia o ausencia de socios de ensamblaje (control por epistasis de síntesis). [26] Este mecanismo implica una retroalimentación negativa a través de la unión del exceso de proteína a la región 5' no traducida del ARNm del cloroplasto . [27] Los cloroplastos también necesitan equilibrar las proporciones del fotosistema I y II para la cadena de transferencia de electrones. El estado redox del transportador de electrones plastoquinona en la membrana del tilacoide afecta directamente la transcripción de los genes del cloroplasto que codifican las proteínas de los centros de reacción de los fotosistemas, contrarrestando así los desequilibrios en la cadena de transferencia de electrones. [28]
Orientación de proteínas a los tilacoides
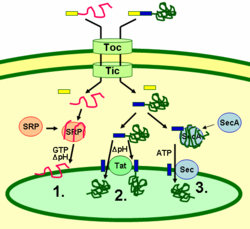
Las proteínas tilacoides se dirigen a su destino a través de péptidos señal y vías secretoras de tipo procariota dentro del cloroplasto. La mayoría de las proteínas tilacoides codificadas por el genoma nuclear de una planta necesitan dos señales de orientación para una localización adecuada: un péptido de orientación del cloroplasto N-terminal (mostrado en amarillo en la figura), seguido de un péptido de orientación del tilacoide (mostrado en azul). Las proteínas se importan a través del translocón de los complejos de membrana externa e interna ( Toc y Tic ). Después de entrar en el cloroplasto, el primer péptido de orientación es escindido por una proteasa que procesa las proteínas importadas. Esto desenmascara la segunda señal de orientación y la proteína se exporta desde el estroma al tilacoide en un segundo paso de orientación. Este segundo paso requiere la acción de los componentes de translocación de proteínas de los tilacoides y depende de la energía. Las proteínas se insertan en la membrana a través de la vía dependiente de SRP (1), la vía dependiente de Tat (2) o espontáneamente a través de sus dominios transmembrana (no se muestran en la figura). Las proteínas luminales se exportan a través de la membrana del tilacoide hacia el lumen mediante la vía dependiente de Tat (2) o la vía dependiente de Sec (3) y se liberan por escisión de la señal de orientación del tilacoide. Las diferentes vías utilizan diferentes señales y fuentes de energía. La vía Sec (secretora) requiere ATP como fuente de energía y consta de SecA, que se une a la proteína importada y un complejo de membrana Sec para transportar la proteína a través. Las proteínas con un motivo de arginina gemela en su péptido señal tilacoide se transportan a través de la vía Tat (translocación de arginina gemela), que requiere un complejo Tat unido a la membrana y el gradiente de pH como fuente de energía. Algunas otras proteínas se insertan en la membrana a través de la vía SRP ( partícula de reconocimiento de señal ). La SRP del cloroplasto puede interactuar con sus proteínas diana de forma postraduccional o cotraduccional, transportando así las proteínas importadas así como las que se traducen dentro del cloroplasto. La vía de la SRP requiere GTP y el gradiente de pH como fuentes de energía. Algunas proteínas transmembrana también pueden insertarse espontáneamente en la membrana desde el lado del estroma sin necesidad de energía. [29]
Función

Los tilacoides son el sitio donde se llevan a cabo las reacciones de la fotosíntesis dependientes de la luz , entre las que se incluyen la oxidación del agua y la evolución del oxígeno impulsadas por la luz , el bombeo de protones a través de las membranas de los tilacoides junto con la cadena de transporte de electrones de los fotosistemas y el complejo citocromo, y la síntesis de ATP por parte de la ATP sintasa utilizando el gradiente de protones generado.
Fotólisis del agua
El primer paso de la fotosíntesis es la reducción (división) del agua impulsada por la luz para proporcionar los electrones para las cadenas de transporte de electrones fotosintéticos, así como los protones para el establecimiento de un gradiente de protones. La reacción de división del agua se produce en el lado luminal de la membrana tilacoide y es impulsada por la energía de la luz capturada por los fotosistemas. Esta oxidación del agua produce convenientemente el producto de desecho O 2 que es vital para la respiración celular . El oxígeno molecular formado por la reacción se libera a la atmósfera.
Cadenas de transporte de electrones
Durante la fotosíntesis se utilizan dos variantes diferentes de transporte de electrones:
- El transporte de electrones no cíclico o fotofosforilación no cíclica produce NADPH + H + y ATP.
- El transporte cíclico de electrones o fotofosforilación cíclica produce sólo ATP.
La variedad no cíclica implica la participación de ambos fotosistemas, mientras que el flujo de electrones cíclico depende únicamente del fotosistema I.
- El fotosistema I utiliza la energía de la luz para reducir NADP + a NADPH+ H + y está activo tanto en el transporte de electrones cíclico como no cíclico. En el modo cíclico, el electrón energizado pasa a través de una cadena que finalmente lo devuelve (en su estado básico) a la clorofila que lo energizó.
- El fotosistema II utiliza la energía de la luz para oxidar las moléculas de agua, produciendo electrones (e − ), protones (H + ) y oxígeno molecular (O 2 ), y solo es activo en el transporte no cíclico. Los electrones en este sistema no se conservan, sino que entran continuamente desde el 2H 2 O oxidado (O 2 + 4 H + + 4 e − ) y salen con NADP + cuando finalmente se reduce a NADPH.
Quimiosmosis
Una de las principales funciones de la membrana tilacoide y sus fotosistemas integrantes es el establecimiento del potencial quimiosmótico. Los transportadores en la cadena de transporte de electrones utilizan parte de la energía de los electrones para transportar activamente protones desde el estroma hasta el lumen . Durante la fotosíntesis, el lumen se vuelve ácido , con un pH tan bajo como 4, en comparación con el pH 8 en el estroma. [30] Esto representa un gradiente de concentración de 10 000 veces para los protones a través de la membrana tilacoide.
Fuente del gradiente de protones
Los protones en el lumen provienen de tres fuentes principales.
- La fotólisis por el fotosistema II oxida el agua a oxígeno , protones y electrones en el lumen.
- La transferencia de electrones del fotosistema II a la plastoquinona durante el transporte electrónico no cíclico consume dos protones del estroma. Estos se liberan en el lumen cuando el complejo proteico citocromo b6f oxida el plastoquinol reducido en el lado del lumen de la membrana del tilacoide. Desde el depósito de plastoquinona, los electrones pasan a través del complejo citocromo b6f. Este conjunto de membrana integral se asemeja al citocromo bc1.
- La reducción de plastoquinona por ferredoxina durante el transporte cíclico de electrones también transfiere dos protones del estroma al lumen.
El gradiente de protones también es causado por el consumo de protones en el estroma para producir NADPH a partir de NADP+ en la NADP reductasa.
Generación de ATP
El mecanismo molecular de generación de ATP (trifosfato de adenosina) en los cloroplastos es similar al de las mitocondrias y toma la energía necesaria de la fuerza motriz de protones (PMF). [ cita requerida ] Sin embargo, los cloroplastos dependen más del potencial químico de la PMF para generar la energía potencial necesaria para la síntesis de ATP. La PMF es la suma de un potencial químico de protones (dado por el gradiente de concentración de protones) y un potencial eléctrico transmembrana (dado por la separación de cargas a través de la membrana). En comparación con las membranas internas de las mitocondrias, que tienen un potencial de membrana significativamente más alto debido a la separación de cargas, las membranas tilacoides carecen de un gradiente de carga. [ cita requerida ] Para compensar esto, el gradiente de concentración de protones de 10,000 veces a través de la membrana tilacoide es mucho más alto en comparación con un gradiente de 10 veces a través de la membrana interna de las mitocondrias. El potencial quimiosmótico resultante entre el lumen y el estroma es lo suficientemente alto como para impulsar la síntesis de ATP mediante la ATP sintasa . A medida que los protones viajan de regreso por el gradiente a través de los canales de la ATP sintasa , ADP + P i se combinan para formar ATP. De esta manera, las reacciones dependientes de la luz se acoplan a la síntesis de ATP a través del gradiente de protones. [ cita requerida ]
Membranas tilacoides en cianobacterias
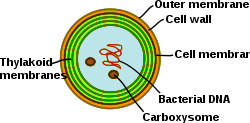
Las cianobacterias son procariotas fotosintéticos con sistemas de membrana altamente diferenciados. Las cianobacterias tienen un sistema interno de membranas tilacoides donde residen las cadenas de transferencia de electrones completamente funcionales de la fotosíntesis y la respiración . La presencia de diferentes sistemas de membrana le otorga a estas células una complejidad única entre las bacterias . Las cianobacterias deben ser capaces de reorganizar las membranas, sintetizar nuevos lípidos de membrana y dirigir adecuadamente las proteínas al sistema de membrana correcto. La membrana externa , la membrana plasmática y las membranas tilacoides tienen funciones especializadas en la célula cianobacteriana. Comprender la organización, la funcionalidad, la composición proteica y la dinámica de los sistemas de membrana sigue siendo un gran desafío en la biología celular de las cianobacterias. [31]
A diferencia de la red tilacoidal de las plantas superiores, que se diferencia en láminas de grana y estroma, los tilacoides en las cianobacterias están organizados en múltiples capas concéntricas que se dividen y fusionan en capas paralelas formando una red altamente conectada. Esto da como resultado una red continua que encierra un solo lumen (como en los cloroplastos de las plantas superiores) y permite que las moléculas solubles en agua y solubles en lípidos se difundan a través de toda la red de membranas. Además, a menudo se observan perforaciones dentro de las láminas tilacoidales paralelas. Estos huecos en la membrana permiten el tráfico de partículas de diferentes tamaños a través de la célula, incluidos los ribosomas, los gránulos de glucógeno y los cuerpos lipídicos. [32] La distancia relativamente grande entre los tilacoides proporciona espacio para las antenas externas que captan luz, los ficobilisomas . [33] Esta macroestructura, como en el caso de las plantas superiores, muestra cierta flexibilidad durante los cambios en el entorno fisicoquímico. [34]
Véase también
- Arthur Meyer (botánico)
- André Jagendorf
- Quimiosmosis
- Gradiente electroquímico
- Endosimbiosis
- Evolución del oxígeno
- Fotosíntesis
Referencias
- ^ θύλακος. Liddell, Henry George ; Scott, Robert ; Un léxico griego-inglés en el Proyecto Perseo
- ^ abcde Bussi Y, Shimoni E, Weiner A, Kapon R, Charuvi D, Nevo R, Efrati E, Reich Z (2019). "La geometría helicoidal fundamental consolida la membrana fotosintética de la planta". Proc Natl Acad Sci USA . 116 (44): 22366–22375. Bibcode :2019PNAS..11622366B. doi : 10.1073/pnas.1905994116 . PMC 6825288 . PMID 31611387.
- ^ "Fotosíntesis" McGraw Hill Encyclopedia of Science and Technology, 10.ª ed. 2007. Vol. 13, pág. 469
- ^ Sato N (2004). "Funciones de los lípidos ácidos sulfoquinovosil diacilglicerol y fosfatidilglicerol en la fotosíntesis: su especificidad y evolución". J Plant Res . 117 (6): 495–505. Bibcode :2004JPlR..117..495S. doi :10.1007/s10265-004-0183-1. PMID 15538651. S2CID 27225926.
- ^ "fotosíntesis". Encyclopædia Britannica, 2008. Encyclopædia Britannica 2006 Ultimate Reference Suite DVD , 9 de abril de 2008
- ^ Spraque SG (1987). "Organización estructural y funcional de los galactolípidos en la organización de la membrana tilacoidal". J Bioenerg Biomembr . 19 (6): 691–703. doi :10.1007/BF00762303. PMID 3320041. S2CID 6076741.
- ^ YashRoy, RC (1990). "Estudios de resonancia magnética de la organización dinámica de los lípidos en las membranas de los cloroplastos" (PDF) . Journal of Biosciences . 15 (4): 281–288. doi :10.1007/bf02702669. S2CID 360223.
- ^ YashRoy, RC (1987). "Estudios de RMN de 13C de cadenas lipídicas de acilo graso de membranas de cloroplastos". Revista india de bioquímica y biofísica . 24 (3): 177–178. PMID 3428918.
- ^ Benning C, Xu C, Awai K (2006). "Tráfico de lípidos vesicular y no vesicular que involucra a los plástidos". Curr Opin Plant Biol . 9 (3): 241–7. Bibcode :2006COPB....9..241B. doi :10.1016/j.pbi.2006.03.012. PMID 16603410.
- ^ Shimoni E, Rav-Hon O, Ohad I, Brumfeld V, Reich Z (2005). "Organización tridimensional de las membranas tilacoides de los cloroplastos de plantas superiores revelada por tomografía electrónica". Célula vegetal . 17 (9): 2580–6. doi :10.1105/tpc.105.035030. PMC 1197436 . PMID 16055630.
- ^ Mustárdy, L.; Buttle, K.; Steinbach, G.; Garab, G. (2008). "La red tridimensional de las membranas tilacoides en plantas: modelo cuasihelicoidal del ensamblaje granum-estroma". Célula vegetal . 20 (10): 2552–2557. doi :10.1105/tpc.108.059147. PMC 2590735 . PMID 18952780.
- ^ Terasaki M, Shemesh T, Kasthuri N, Klemm R, Schalek R, Hayworth K, Hand A, Yankova M, Huber G, Lichtman J, Rapoport T, Kozlov M (2013). "Las láminas apiladas del retículo endoplasmático están conectadas por motivos de membrana helicoidales". Cell . 154 (2): 285–96. doi :10.1016/j.cell.2013.06.031. PMC 3767119 . PMID 23870120.
- ^ Berry DK; Caplan ME; Horowitz CJ; Huber G; Schneider AS (2016). "Estructuras de "garaje de estacionamiento" en astrofísica nuclear y biofísica celular". Physical Review C . 94 (5). American Physical Society: 055801. arXiv : 1509.00410 . Bibcode :2016PhRvC..94e5801B. doi : 10.1103/PhysRevC.94.055801 . S2CID 36462725.
- ^ Horowitz CJ; Berry DK; Briggs CM; Caplan ME; Cumming A; Schneider AS (2015). "Pasta nuclear desordenada, decaimiento del campo magnético y enfriamiento de la corteza en estrellas de neutrones". Phys Rev Lett . 114 (3): 031102. arXiv : 1410.2197 . Código Bibliográfico :2015PhRvL.114c1102H. doi :10.1103/PhysRevLett.114.031102. PMID 25658989. S2CID 12021024.
- ^ Schneider AS; Berry DK; Caplan ME; Horowitz CJ; Lin Z (2016). "Efecto de los defectos topológicos en los observables de la "pasta nuclear"". Physical Review C . 93 (6): 065806. arXiv : 1602.03215 . Código Bibliográfico :2016PhRvC..93f5806S. doi :10.1103/PhysRevC.93.065806. S2CID 28272522.
- ^ Elena Aseeva; Friederich Ossenbühl; Claudia Sippel; Won K. Cho; Bernhard Stein; Lutz A. Eichacker; Jörg Meurer; Gerhard Wanner; Peter Westhoff; Jürgen Soll; Ute C. Vothknecht (2007). "Vipp1 es necesaria para la formación de membranas tilacoides básicas, pero no para el ensamblaje de complejos de proteínas tilacoides". Planta Physiol Biochem . 45 (2): 119–28. doi :10.1016/j.plaphy.2007.01.005. PMID 17346982.
- ^ Westphal S, Heins L, Soll J, Vothknecht U (2001). "Mutante de deleción de Vipp1 de Synechocystis: ¿Una conexión entre el choque fágico bacteriano y la biogénesis de tilacoides?". Proc Natl Acad Sci USA . 98 (7): 4243–8. doi : 10.1073/pnas.061501198 . PMC 31210 . PMID 11274448.
- ^ Liu C, Willmund F, Golecki J, Cacace S, Markert C, Heß B, Schroda M, Schroda M (2007). "Las chaperonas del cloroplasto HSP70B-CDJ2-CGE1 catalizan el ensamblaje y desensamblaje de oligómeros VIPP1 en Chlamydomonas". Plant J . 50 (2): 265–77. doi :10.1111/j.1365-313X.2007.03047.x. PMID 17355436.
- ^ Kroll D, Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht U, Soll J, Westhoff P (2001). "VIPP1, un gen nuclear de Arabidopsis thaliana esencial para la formación de la membrana tilacoidal". Proc Natl Acad Sci USA . 98 (7): 4238–42. doi : 10.1073/pnas.061500998 . PMC 31209 . PMID 11274447.
- ^ abc Peltier J, Emanuelsson O, Kalume D, Ytterberg J, Friso G, Rudella A, Liberles D, Söderberg L, Roepstorff P, von Heijne G , van Wijk KJ (2002). "Funciones centrales del proteoma tilacoide lumenal y periférico de Arabidopsis determinadas por experimentación y predicción de todo el genoma". Célula vegetal . 14 (1): 211–36. doi :10.1105/tpc.010304. PMC 150561 . PMID 11826309.
- ^ van Wijk K (2004). "Proteómica de plastidios". Bioquímica de fisiol vegetal . 42 (12): 963–77. Código Bib : 2004PlPB...42..963V. doi :10.1016/j.plaphy.2004.10.015. PMID 15707834.
- ^ ab Friso G, Giacomelli L, Ytterberg A, Peltier J, Rudella A, Sun Q, Wijk K (2004). "Análisis en profundidad del proteoma de la membrana tilacoide de los cloroplastos de Arabidopsis thaliana: nuevas proteínas, nuevas funciones y una base de datos del proteoma de plástidos". Plant Cell . 16 (2): 478–99. doi :10.1105/tpc.017814. PMC 341918 . PMID 14729914. - La base de datos del proteoma de los plastidios
- ^ Kleffmann T, Hirsch-Hoffmann M, Gruissem W, Baginsky S (2006). "plprot: una base de datos integral del proteoma para diferentes tipos de plástidos". Plant Cell Physiol . 47 (3): 432–6. doi :10.1093/pcp/pcj005. PMID 16418230.– Base de datos de proteínas de plastidios
- ^ Peltier J, Friso G, Kalume D, Roepstorff P, Nilsson F, Adamska I, van Wijk K (2000). "Proteómica del cloroplasto: identificación sistemática y análisis de la orientación de las proteínas tilacoides luminales y periféricas". Plant Cell . 12 (3): 319–41. doi :10.1105/tpc.12.3.319. PMC 139834 . PMID 10715320.
- ^ Vener AV, Ohad I, Andersson B (1998). "Fosforilación de proteínas y detección redox en tilacoides del cloroplasto". Curr Opin Plant Biol . 1 (3): 217–23. Bibcode :1998COPB....1..217V. doi :10.1016/S1369-5266(98)80107-6. PMID 10066592.
- ^ Choquet Y, Wostrikoff K, Rimbault B, Zito F, Girard-Bascou J, Drapier D, Wollman F (2001). "Regulación controlada por ensamblaje de la traducción de genes de cloroplastos". Biochem Soc Trans . 29 (Pt 4): 421–6. doi :10.1042/BST0290421. PMID 11498001.
- ^ Minai L, Wostrikoff K, Wollman F, Choquet Y (2006). "La biogénesis de los cloroplastos de los núcleos del fotosistema II implica una serie de pasos controlados por el ensamblaje que regulan la traducción". Célula vegetal . 18 (1): 159–75. doi :10.1105/tpc.105.037705. PMC 1323491 . PMID 16339851.
- ^ Allen J, Pfannschmidt T (2000). "Equilibrio entre los dos fotosistemas: la transferencia de electrones fotosintéticos rige la transcripción de genes del centro de reacción en los cloroplastos". Philos Trans R Soc Lond B Biol Sci . 355 (1402): 1351–9. doi :10.1098/rstb.2000.0697. PMC 1692884. PMID 11127990 .
- ^ ab Gutensohn M, Fan E, Frielingsdorf S, Hanner P, Hou B, Hust B, Klösgen R (2006). "Toc, Tic, Tat et al.: estructura y función de las maquinarias de transporte de proteínas en los cloroplastos". J. Plant Physiol . 163 (3): 333–47. doi :10.1016/j.jplph.2005.11.009. PMID 16386331.
- ^ Jagendorf AT y E. Uribe (1966). "Formación de ATP causada por la transición ácido-base de los cloroplastos de espinaca". Proc. Natl. Sci. USA . 55 (1): 170–177. Bibcode :1966PNAS...55..170J. doi : 10.1073/pnas.55.1.170 . PMC 285771 . PMID 5220864.
- ^ Herrero, Antonia; Flores, Enrique, eds. (2008). Las cianobacterias: biología molecular, genómica y evolución (1.ª ed.). Caister Academic Press. ISBN 978-1-904455-15-8.
- ^ Nevo R, Charuvi D, Shimoni E, Schwarz R, Kaplan A, Ohad I, Reich Z (2007). "Las perforaciones y la conectividad de la membrana tilacoidal permiten el tráfico intracelular en las cianobacterias". EMBO J . 26 (5): 1467–1473. doi :10.1038/sj.emboj.7601594. PMC 1817639 . PMID 17304210.
- ^ Oliva, J; Ajlani, G; Astier, C; Recuperador, M; Vernotte, C (1997). "Ultraestructura y adaptación a la luz de mutantes de ficobilisoma de Synechocystis PCC 6803". Biochimica et Biophysica Acta (BBA) - Bioenergética . 1319 (2–3): 275–282. doi :10.1016/S0005-2728(96)00168-5.
- ^ Nagy, G; Posselt, D; Kovács, L; Holm, JK; Szabó, M; Ughy, B; Rosta, L; Peters, J; Timmins, P; Garab, G (1 de junio de 2011). "Reorganizaciones reversibles de la membrana durante la fotosíntesis in vivo: reveladas por dispersión de neutrones de ángulo pequeño" (PDF) . The Biochemical Journal . 436 (2): 225–30. doi :10.1042/BJ20110180. PMID 21473741.
Fuentes de los libros de texto
- Heller, H. Craig; Orians, Gordan H.; Purves, William K. y Sadava, David (2004). LIFE: La ciencia de la biología (7.ª ed.). Sinauer Associates, Inc. ISBN 978-0-7167-9856-9.
- Raven, Peter H.; Ray F. Evert; Susan E. Eichhorn (2005). Biología de las plantas (7.ª ed.). Nueva York: WH Freeman and Company Publishers. págs. 115–127. ISBN 978-0-7167-1007-3.
- Herrero, Antonia; Flores, Enrique, eds. (2008). Las cianobacterias: biología molecular, genómica y evolución (1.ª ed.). Caister Academic Press. ISBN 978-1-904455-15-8.