Antagonista del receptor NK1
Los antagonistas de la neuroquinina 1 (NK 1 ) (-pitantes) son una nueva clase de medicamentos que poseen propiedades antidepresivas [1] [2] ansiolíticas [3] y antieméticas únicas. Los antagonistas de NK - 1 aumentan la eficacia de los antagonistas de 5-HT3 para prevenir las náuseas y losvómitos. El descubrimiento de los antagonistas del receptor de neuroquinina 1 ( NK 1 ) fue un punto de inflexión en la prevención de las náuseas y los vómitos asociados con la quimioterapia contra el cáncer . [4]
Un ejemplo de un fármaco de esta clase es el aprepitant . La emesis inducida por quimioterapia parece constar de fases agudas y retardadas. Hasta ahora, la emesis de fase aguda responde a los antagonistas de 5-HT 3 mientras que la fase retardada sigue siendo difícil de controlar. El descubrimiento y desarrollo de antagonistas del receptor NK 1 han provocado un efecto antiemético tanto en las fases agudas como, especialmente, en las retardadas de la emesis. [5] Casopitant , netupitant y rolapitant son algunas de las incorporaciones más recientes a este grupo. Rolapitant tiene una vida media significativamente más larga de 160 horas y fue aprobado por la FDA de EE. UU. en 2015.
El primer uso clínico registrado de los antagonistas del receptor NK 1 fue el tratamiento de la emesis, asociada con la quimioterapia contra el cáncer . [6]
Historia
En 1931, von Euler y Gaddum descubrieron la sustancia P (SP) en el cerebro y el intestino del caballo. La sustancia mostró fuertes efectos vasodilatadores y actividad contráctil en el intestino del conejo. Se hizo un gran esfuerzo para purificar esta sustancia de diversos tejidos de mamíferos, pero 30 años de investigación fueron sin éxito. Erspamer descubrió péptidos no mamíferos que provocaban los mismos efectos vasodilatadores y contráctiles que la SP a principios de la década de 1960. Estos péptidos tenían una secuencia C-terminal común y se agruparon como taquiquininas . En 1971, Chang logró purificar SP del intestino del caballo e identificar su secuencia de aminoácidos ; la SP se clasificó entonces como una taquiquinina de mamíferos . Más tarde quedó claro que la SP era un neuropéptido común en el sistema nervioso central y periférico . A mediados de la década de 1980, se descubrieron las taquiquininas de mamíferos adicionales neuroquinina A (NKA) y neuroquinina B (NKB). [7] [8] Esto condujo a una mayor investigación, que resultó en el aislamiento de los genes que codificaban las taquiquininas de los mamíferos y, finalmente, en el descubrimiento de tres receptores de taquiquininas diferentes. En 1984, se decidió que los receptores de taquiquininas deberían llamarse receptor de taquiquininas NK 1 , receptor de taquiquininas NK 2 y receptor de taquiquininas NK 3. [7] [9]
La investigación biológica que identificó las muchas funciones de las taquiquininas despertó el interés en el desarrollo de antagonistas del receptor de neuroquinina . [8] En la década de 1980, varios antagonistas peptídicos derivados de SP fueron los primeros antagonistas del receptor NK 1. Sin embargo, estos compuestos, como la mayoría de los compuestos peptídicos, tenían problemas de selectividad , potencia , solubilidad y biodisponibilidad . Por esta razón, las compañías farmacéuticas se concentraron en desarrollar antagonistas del receptor NK 1 no peptídicos , y en 1991, tres compañías diferentes revelaron sus primeros resultados. Desde entonces, los antagonistas del receptor NK 1 no peptídicos se han investigado ampliamente y han aparecido muchas estructuras y patentes . Al proponer el concepto a principios de la década de 1990, en 1998 Kramer, et al. informaron datos clínicos sobre la eficacia y seguridad de MK-869 (aprepitant) en pacientes con trastorno depresivo mayor. [1] En 2003, el primer antagonista del receptor NK 1 , aprepitant (Emend), recibió la aprobación para su comercialización por parte de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). [10] [11] [12]
El receptor de neuroquinina-1
Las taquiquininas son una familia de neuropéptidos que comparten la misma región hidrofóbica C-terminal con la secuencia de aminoácidos Phe -X- Gly- Leu- Met - NH2 , donde X representa un residuo hidrofóbico que es aromático o alifático ramificado en beta . La región N-terminal varía entre diferentes taquiquininas. [13] [14] [15] El término taquiquinina se origina en el inicio rápido de la acción causado por los péptidos en los músculos lisos. [15] SP es el miembro más investigado y potente de la familia de las taquiquininas. Es un undecapéptido con la secuencia de aminoácidos Arg - Pro - Lys - Pro - Gln - Gln - Phe - Phe - Gly - Leu - Met - NH2 . [13] SP se une a los tres receptores de taquiquinina, pero se une más fuertemente al receptor NK1 . [14]
El receptor de taquiquinina NK 1 , a menudo denominado receptor NK 1 , es un miembro de la familia 1 ( similar a la rodopsina ) de receptores acoplados a proteína G y se une a la proteína G αq . [8] El receptor NK 1 consta de 407 residuos de aminoácidos y tiene un peso molecular de 58.000. [13] [16] El receptor NK 1 , así como los otros receptores de taquiquinina, está formado por siete dominios transmembrana (TM) hidrófobos con tres bucles extracelulares y tres intracelulares , un extremo amino y un extremo carboxiterminal citoplasmático . Los bucles tienen sitios funcionales, incluidos dos aminoácidos cisteína para un puente disulfuro , Asp - Arg - Tyr , que es responsable de la asociación con arrestina y, Lys / Arg - Lys / Arg -XX- Lys / Arg , que interactúa con las proteínas G. [8] [16]
Descubrimiento y desarrollo de fármacos



En 1991, tres grupos diferentes investigaron diferentes antagonistas del receptor NK 1 mediante la selección de colecciones químicas. Eastman Kodak y Sterling Winthrop descubrieron una serie de esteroides antagonistas del receptor NK 1 de taquiquinina que produjeron algunos compuestos pero carecían de suficiente afinidad por el receptor NK 1 , a pesar de los estudios de relación estructura-actividad (SAR) que se realizaron. Esta serie demostró tener una toxicidad significativa. A pesar de que se han sintetizado muchos derivados de los compuestos esteroides , la actividad biológica no ha mejorado. [12] [17]
Rhône-Poulenc descubrió el compuesto RP-67580, que tiene una alta afinidad por el receptor NK 1 en ratas y ratones, pero no en humanos. Los estudios SAR que se realizaron con el fin de mejorar la selectividad por el receptor NK 1 humano dieron como resultado el desarrollo de un compuesto llamado RPR-100893. Este compuesto mostró una buena actividad in vivo y en modelos de dolor y se desarrolló hasta la fase II para el tratamiento de migrañas, pero luego se suspendió, como fue el caso de otros antagonistas del receptor NK 1 que se probaron para la misma indicación. [12] [17]
La tercera empresa, Pfizer , descubrió una estructura de quinuclidina bencilamino , que se denominó CP-96345 (figura 1). CP-96345 tiene una estructura bastante simple, compuesta por un andamiaje de quinuclidina rígido que contiene un átomo de nitrógeno básico, una fracción de benzhidril y un grupo o-metoxi-bencilamina. Este compuesto mostró una alta afinidad por el receptor NK 1 , pero también interactuó con los sitios de unión de Ca 2+ . Se consideró que el nitrógeno de quinuclidina fuertemente básico en el compuesto era responsable de esta unión de Ca 2+ , que causó una serie de efectos sistémicos, no relacionados con el bloqueo del receptor NK 1. Por esa razón y también para simplificar la estructura, se realizó una alquilación en este sitio para producir análogos.
El compuesto CP-99994 se sintetizó reemplazando el anillo de quinuclidina con un anillo de piperidina y la fracción benzhidrilo por un grupo bencilo (figura 2). [12] [17] CP-99994 tenía una alta afinidad por el receptor NK 1 humano y dio inicio a una gran cantidad de estudios de estructura-actividad, cada uno con la intención de identificar los requisitos estructurales para la interacción de alta afinidad con el receptor NK 1 , y hacer que la molécula sea aún más simple y mejorar sus propiedades químico-físicas y farmacológicas. [17] CP-99994 alivió el dolor dental en humanos y entró en ensayos clínicos de fase II; estos se interrumpieron debido a la baja biodisponibilidad. Pfizer investigó varios otros antagonistas del receptor NK 1 relacionados . CJ-11974, también llamado ezlopitant, era un análogo cercano de CP-96345 que tenía un grupo isopropilo en el anillo de metoxibencilo. Se desarrolló hasta la fase II de ensayos clínicos para la emesis inducida por quimioterapia antes de que se interrumpiera el desarrollo. CP-122721 era un análogo de CP-99994 que tenía un grupo trifluorometoxi en el anillo o-metoxibencilo. Entró en ensayos de fase II para el tratamiento de la depresión, la emesis y las enfermedades inflamatorias, pero no se ha informado de ningún desarrollo posterior. [12]
Desarrollo del primer fármaco
En 1993, Merck comenzó a realizar estudios SAR de antagonistas del receptor NK 1 , basados tanto en CP-96345 como en CP-99994. L-733,060 es uno de los compuestos que se desarrollaron a partir de CP-99994. Tiene una piperidina 3,5-bistrifluorometil benciléter en lugar de la fracción 2-metoxi bencilamina del compuesto CP-99994. Para mejorar la biodisponibilidad oral, se funcionalizó el nitrógeno de la piperidina para reducir su naturaleza básica. El grupo que dio los mejores efectos sobre la basicidad fue la fracción 3-oxo-1,2,4-triazol-5-ilo y dio compuestos como L-741671 y L-742694. Se descubrió que un núcleo de morfolina que se introdujo en L-742694 mejoraba la afinidad de unión a NK 1. [11] Este núcleo se conservó en modificaciones posteriores. Para evitar una posible desactivación metabólica, se introdujeron varios refinamientos como la metilación en la C alfa del anillo bencílico y la fluoración en el anillo fenilo . Estos cambios produjeron el compuesto MK-869, que mostró una alta afinidad por el receptor NK 1 y una alta actividad oral (figura 3). MK-869 también se llama aprepitant y se estudió en el dolor, las migrañas, la emesis y los trastornos psiquiátricos. Estos estudios condujeron al fármaco Emend aprobado por la FDA para las náuseas y los vómitos inducidos por la quimioterapia, y está disponible para uso oral. [12] Un profármaco de fosforilo soluble en agua para uso intravenoso, llamado fosaprepitant , también está disponible y se comercializa como Ivemend. [18] También se creía que el aprepitant era eficaz en el tratamiento de la depresión. Entró en ensayos de fase III antes de que se interrumpiera el desarrollo para esta indicación. [12]
Otros compuestos


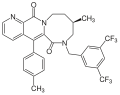
Además de los compuestos que llevaron al descubrimiento del aprepitant, varias compañías farmacéuticas han descrito muchos compuestos. El GR-205171 (figura 4) fue desarrollado por Glaxo y se basó en CP-99994. El GR-205171 tenía un anillo de tetrazol en la posición 4 del anillo de bencilo de CP-99994 que estaba destinado a aumentar la biodisponibilidad oral y mejorar las propiedades farmacocinéticas. Se desarrolló hasta los ensayos clínicos de fase II para el tratamiento de náuseas y vómitos posoperatorios, migraña y mareo por movimiento. Mostró buenos resultados en emesis , pero se interrumpió el desarrollo. [12]
El LY-303870, o lanepitant (figura 5), es una amida reducida N-acetilada de L-triptófano que fue descubierta por Eli Lilly . Se sometió a ensayos clínicos de fase IIa para el tratamiento del dolor de la osteoartritis, pero no mostró efectos significativos. Eli Lilly realizó algunos trabajos de SAR sobre su estructura y desarrolló algunos compuestos que no entraron en ensayos clínicos. [12]
En 1995, Takeda descubrió una serie de N-bencilcarboxiamidas a partir de una hipótesis general sobre el sitio de unión de los receptores acoplados a la proteína G peptídica. Uno de esos compuestos, el TAK-637 (figura 6), se sometió a ensayos clínicos de fase II para la incontinencia urinaria, la depresión y el síndrome del intestino irritable, pero su desarrollo se interrumpió. Existen otros compuestos que se han investigado en el pasado e incluso han llegado a ensayos clínicos, y la investigación continúa a pesar de la falta de éxito en los ensayos clínicos. [11] [12]
Vinculante
Hay más de un dominio de unión de ligando en el receptor NK 1 para los antagonistas no peptídicos , y estos dominios de unión se pueden encontrar en varios lugares. El principal sitio de unión del ligando está en el núcleo hidrofóbico entre los bucles y los segmentos externos de los dominios transmembrana 3-7 (TM3-TM7). [16] Varios residuos, como Gln 165 (TM4), His 197 (TM5), His265 (TM6) y Tyr 287 (TM7) están involucrados en la unión de muchos antagonistas no peptídicos de los receptores NK 1. [7] [16] Se ha afirmado que la sustitución de Ala de His197 disminuye la afinidad de unión de CP-96345 por el receptor NK 1. His197 interactúa con la fracción benzhidrilo de CP-96345. Los experimentos han demostrado que la sustitución de Val 116 (TM3) e Ile 290 (TM7) disminuye la afinidad de unión de CP-96345. La evidencia indica que estos residuos probablemente no interactúan con antagonistas, sino que más bien influirían indirectamente en la conformación general del sitio de unión del antagonista. El residuo Gln 165 (TM4) también ha demostrado ser significativo para la unión de varios antagonistas no peptídicos, posiblemente a través de la formación de un enlace de hidrógeno . [17] [19] Se han propuesto Phe 268 y Tyr 287 como posibles puntos de contacto para los dominios de unión tanto del agonista como del antagonista. [16]
Se ha confirmado la importancia de His265 en la unión de antagonistas al receptor NK 1. His265 interactúa favorablemente con el grupo 3,5-bis-trifluorometilfenilo (grupo TFMP) de un análogo CP-96345. No obstante, se ha demostrado que la sustitución de Ala de His265 no afecta la afinidad de unión de CP-96345. [11]
Se cree que otros residuos que intervienen en la unión de los antagonistas no peptídicos al receptor NK 1 son Ser 169, Glu 193, Lys 194, Phe 264, Phe 267, Pro 271 y Tyr 272. Cada clase estructural de antagonistas no peptídicos del receptor NK 1 parece interactuar con un conjunto específico de residuos dentro del bolsillo de unión común. [7] [16]
Relación estructura-actividad (SAR) y farmacóforo
Existen al menos tres elementos esenciales que son importantes para la interactividad de un ligando con el receptor NK 1 . Primero, la interactividad del sitio de par iónico con el nitrógeno de la cabeza de puente; segundo, la interactividad del sitio de unión accesorio con el grupo benzhidrilo ; y tercero, la interactividad del sitio específico con la cadena lateral (2-metoxibencil) amino. Los estudios han demostrado que los compuestos con anillo de piperidina tienen selectividad para el receptor NK 1 sobre los receptores NK 2 , NK 3 , opioides y 5-HT . Al agregar un grupo N-heteroaril-2-fenil-3-(benciloxi) a la piperidina , se produce un antagonista selectivo del receptor NK 1 . Los estudios también han demostrado que el ángulo diedro entre los grupos en C-2 y C-3 en CP-99994 es crítico para la actividad de los antagonistas del receptor NK 1. [15] Se cree que el nitrógeno básico de la cabeza de puente interactúa con el receptor NK 1 al mediar su reconocimiento a través del sitio de par iónico. [20] Se ha descubierto que los átomos de nitrógeno básicos en la pirido[3,4-b]piridina tienen una función de anclaje en el componente fosfolípido de la membrana celular. [15]
En el desarrollo de MK-869, se descubrió que la 3,5-disustitución del anillo bencílico en la serie del éter daba mayor potencia que la sustitución 2-metoxi en las estructuras de bencilamina anteriores . También se reveló que el grupo TFMP parecía ser especialmente importante, y se cree que mejora la actividad in vivo y el metabolismo. Otros grupos, como el grupo orto-metoxifenilo, pueden ser importantes en casos específicos, pero se cree que desempeñan un papel más importante en la preorganización del ligando a través de enlaces de hidrógeno intramoleculares, en lugar de a través de la interacción directa con el residuo del sitio de unión. [11] La presencia de una interacción π–π cara a cara intramolecular entre dos anillos aromáticos es una característica común de los antagonistas del receptor NK 1 de alta afinidad. Se cree que esta característica es importante para estabilizar la conformación bioactiva. Esta interacción se puede aumentar con un sistema conformacionalmente restringido, como un anillo de ocho miembros introducido en el anillo de naftiridina . [20]
Desarrollo futuro

La emesis inducida por quimioterapia es un problema importante en el tratamiento del cáncer. Para ello se estudia un nuevo compuesto, el T-2328 (figura 7), un antagonista no peptídico de la familia de las taquiquininas NK 1. El T-2328 se administra por vía intravenosa y trata tanto la emesis aguda como la tardía. Se propone que ejerza su efecto antiemético actuando sobre los receptores NK 1 del cerebro . El T-2328 es muy potente; la constante de inhibición es de rango subnanomolar y es 16 veces menor que la del aprepitant. La inhibición es altamente selectiva para los receptores NK 1 .
Los receptores NK 2 y NK 3 también son objetivos de nuevas clases de medicamentos y también muestran efectos antidepresivos y ansiolíticos destacados. [21] Los estudios mostraron que la constante de inhibición (Ki) para los receptores NK 2 era >10000 veces mayor y para los receptores NK 3 >1000 veces mayor que la de los receptores NK 1. La afinidad también fue mucho menor para los receptores NK 2 y NK 3. [5] Desde que se descubrieron las taquiquininas , se ha demostrado que poseen actividad biológica en varios sistemas patológicos y fisiológicos . Sin embargo, el potencial terapéutico de los antagonistas de las taquiquininas no se ha entendido por completo. [6]
Véase también
- Aprepitante
- Casopitante
- Fosaprepitant
- Maropitant
- Rolapitante
- Receptor de taquinina
- Receptores acoplados a proteína G
Referencias
- ^ ab Kramer MS, Cutler N, Feighner J, Shrivastava R, Carman J, Sramek JJ, et al. (septiembre de 1998). "Distinct mechanism for antidepressant activity by blockade of central substance P receptors" (Mecanismo distintivo de la actividad antidepresiva mediante el bloqueo de los receptores centrales de la sustancia P). Science . 281 (5383): 1640–5. Bibcode :1998Sci...281.1640K. doi :10.1126/science.281.5383.1640. PMID 9733503.
- ^ Varty GB, Cohen-Williams ME, Hunter JC (febrero de 2003). "Los efectos similares a los antidepresivos de los antagonistas del receptor de neuroquinina NK1 en una prueba de suspensión de la cola de un jerbo". Behav Pharmacol . 14 (1): 87–95. doi :10.1097/00008877-200302000-00009. PMID 12576885. S2CID 12218489.
- ^ Varty GB, Cohen-Williams ME, Morgan CA, et al. (2002), "El laberinto en cruz elevado del jerbo II: efectos similares a los ansiolíticos de los antagonistas selectivos del receptor de neuroquinina NK1", Neuropsychopharmacology , 27 (3): 371–9, doi : 10.1016/S0893-133X(02)00313-5 , PMID 12225694.
- ^ Hesketh, PJ (1994), "Nuevas opciones de tratamiento para las náuseas y los vómitos inducidos por la quimioterapia", Supportive Care in Cancer , 12 (8): 550–554, doi :10.1007/s00520-004-0651-0, PMID 15232725, S2CID 6081469, archivado desde el original el 29 de enero de 2013
- ^ ab Watanabe, Y.; Asai, H.; Ishii, T.; Kiuchi, S.; Okamoto, M.; Taniguchi, H.; Nagasaki, M.; Saito, A. (enero de 2008), "Caracterización farmacológica de T-2328, 2-fluoro-4 '-metoxi-3'-((((2S,3S)-2-fenil-3-piperidinil)amino)metill)(1,1 '-bifenil)-4-carbonitrilo dihidrocloruro, como antagonista del receptor de taquiquinina NK1 que penetra en el cerebro", Journal of Pharmacological Sciences , 106 (1): 121–127, doi : 10.1254/jphs.FP0071400 , PMID 18187929
- ^ ab Brain, SD; Cox, HM (2006), "Neuropéptidos y sus receptores: ciencia innovadora que proporciona nuevos objetivos terapéuticos", British Journal of Pharmacology , 147 (S1): S202–S211, doi :10.1038/sj.bjp.0706461, PMC 1760747 , PMID 16402106
- ^ abcd Maggi, CA (septiembre de 1994), "Receptores de taquiquinina en mamíferos", Farmacología general , 26 (5): 911–944, doi :10.1016/0306-3623(94)00292-U, PMID 7557266
- ^ abcd Satake, H.; Kawada, T. (agosto de 2006), "Descripción general de la estructura primaria, la distribución tisular y las funciones de las taquiquininas y sus receptores", Current Drug Targets , 7 (8): 963–974, doi :10.2174/138945006778019273, PMID 16918325
- ^ Saria, A. (junio de 1999), "El receptor de taquiquinina NK 1 en el cerebro: farmacología y funciones putativas", European Journal of Pharmacology , 375 (1–3): 51–60, doi :10.1016/S0014-2999(99)00259-9, PMID 10443564
- ^ Hoffman, T.; Bös, M.; Stadler, H.; Schnider, P.; Hunkeler, W.; Godel, T.; Galley, G.; Ballard, TM; et al. (marzo de 2006), "Diseño y síntesis de una nueva clase aquiral de antagonistas del receptor de neuroquinina-1 altamente potentes y selectivos, activos por vía oral", Bioorganic & Medicinal Chemistry Letters , 16 (5): 1362–5, doi :10.1016/j.bmcl.2005.11.047, PMID 16332435
- ^ abcde Humphrey, JM (2003), "Química medicinal de antagonistas selectivos de la neuroquinina-1", Temas actuales en química medicinal , 3 (12): 1423–1435, doi :10.2174/1568026033451925, PMID 12871173
- ^ abcdefghij Quartara, L.; Altamura, M. (agosto de 2006), "Antagonistas de los receptores de taquiquinina: de la investigación a la práctica clínica", Current Drug Targets , 7 (8): 975–992, doi :10.2174/138945006778019381, PMID 16918326
- ^ abc Ho, WZ; Douglas, SD (diciembre de 2004), "Modulación del VIH por el receptor de la sustancia P y la neuroquinina-1", Journal of Neuroimmunology , 157 (1–2): 48–55, doi :10.1016/j.jneuroim.2004.08.022, PMID 15579279, S2CID 14975995
- ^ ab Page, NM (agosto de 2005), "Nuevos desafíos en el estudio de las taquiquininas de mamíferos", Peptides , 26 (8): 1356–1368, doi :10.1016/j.peptides.2005.03.030, PMID 16042976, S2CID 23094292
- ^ abcd Datar, P.; Srivastava, S.; Coutinho, E.; Govil, G. (2004), "Sustancia P: Estructura, función y terapéutica", Temas actuales en química medicinal , 4 (1): 75–103, doi :10.2174/1568026043451636, PMID 14754378
- ^ abcdef Almeida, TA; Rojo, J.; Nieto, PM; Hernandez, FM; Martin, JD; Candenas, ML; Candenas, ML (agosto de 2004), "Tachyquinins and Tachyquinins Receptors: Structure and Activity Relationships", Current Medicinal Chemistry , 11 (15): 2045–2081, doi :10.2174/0929867043364748 (inactivo 2024-10-16), PMID 15279567
{{citation}}: CS1 maint: DOI inactivo a partir de octubre de 2024 ( enlace ) - ^ abcde Quartara, L.; Maggi, CA (diciembre de 1997), "El receptor de taquiquinina NK 1. Parte I: Ligandos y mecanismos de activación celular", Neuropeptides , 31 (6): 537–563, doi :10.1016/S0143-4179(97)90001-9, PMID 9574822, S2CID 13735836
- ^ Pennefather, JN; Lecci, A.; Candenas, ML; Patak, E.; Pinto, FM; Maggi, CA (2004), "Taquiquininas y receptores de taquiquinina: una familia en crecimiento", Ciencias de la vida , 74 (12): 1445–1463, doi :10.1016/j.lfs.2003.09.039, PMID 14729395
- ^ ab Seto, S.; Tanioka, A.; Ikeda, M.; Izawa, S. (marzo de 2005), "Diseño y síntesis de nuevas 9-sustituidas-7-aril-3,4,5,6-tetrahidro-2H-pirido(4,3-b)- y (2,3-b)-1,5-oxazocin-6-onas como antagonistas de NK 1 ", Bioorganic & Medicinal Chemistry Letters , 15 (5): 1479–1484, doi :10.1016/j.bmcl.2004.12.091, PMID 15713411
- ^ Salomé N, Stemmelin J, Cohen C, Griebel G (abril de 2006). "El bloqueo selectivo de los receptores NK2 o NK3 produce efectos similares a los ansiolíticos y antidepresivos en jerbos". Pharmacol. Biochem. Behav . 83 (4): 533–9. doi :10.1016/j.pbb.2006.03.013. PMID 16624395. S2CID 15134994.