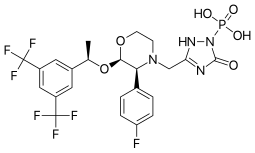
Fosaprepitant
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Enmendar, enmendar |
| AHFS / Drogas.com | Información detallada para el consumidor de Micromedex |
| MedlinePlus | a604003 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración | Intravenoso |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | n / A |
| Unión de proteínas | >95% (aprepitant) |
| Metabolismo | Para aprepitant |
| Vida media de eliminación | 9 a 13 horas (aprepitant) |
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C23H22F7N4O6P |
| Masa molar | 614,414 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
El fosaprepitant , que se comercializa bajo las marcas Emend (EE. UU.) e Ivemend (UE), entre otras, es un medicamento antiemético [6] que se administra por vía intravenosa . Es un profármaco del aprepitant .
Fosaprepitant fue desarrollado por Merck & Co. y fue aprobado para uso médico en los Estados Unidos, [7] y en la Unión Europea en enero de 2008. [5]
Referencias
- ^ "Base de datos de prescripción de medicamentos en el embarazo". Therapeutic Goods Administration (TGA) . 21 de junio de 2022. Archivado desde el original el 2 de marzo de 2023. Consultado el 28 de abril de 2023 .
- ^ "Emend IV fosaprepitant 150 mg (como fosaprepitant dimeglumina) polvo para vial inyectable (167061)". Administración de Productos Terapéuticos (TGA) . 27 de mayo de 2022. Consultado el 28 de abril de 2023 .
- ^ "Fosaprepitant MSN (Accelagen Pty Ltd)". Therapeutic Goods Administration (TGA) . 11 de noviembre de 2022. Archivado desde el original el 18 de marzo de 2023. Consultado el 28 de abril de 2023 .
- ^ "Emend- inyección de fosaprepitant dimeglumina, polvo, liofilizado, para solución". DailyMed . 2 de mayo de 2022. Archivado desde el original el 1 de diciembre de 2021 . Consultado el 27 de septiembre de 2022 .
- ^ ab "Ivemend EPAR". Agencia Europea de Medicamentos . 17 de septiembre de 2018. Archivado desde el original el 31 de diciembre de 2021. Consultado el 27 de septiembre de 2022 .
- ^ Garnock-Jones KP (septiembre de 2016). "Fosaprepitant Dimeglumine: una revisión sobre la prevención de náuseas y vómitos asociados con la quimioterapia". Drugs . 76 (14): 1365–72. doi :10.1007/s40265-016-0627-7. PMID 27510503. S2CID 30018182.
- ^ "Drugs.com, la FDA aprueba Emend (fosaprepitant dimeglumina) inyectable, la nueva terapia intravenosa de Merck, para su uso en combinación con otros antieméticos para la prevención de las náuseas y los vómitos provocados por la quimioterapia". Archivado desde el original el 9 de abril de 2008. Consultado el 15 de marzo de 2008 .


