Meristemo
En biología celular , el meristemo es un tipo de tejido que se encuentra en las plantas. Está formado por células indiferenciadas ( células meristemáticas ) capaces de realizar la división celular . Las células del meristemo pueden convertirse en todos los demás tejidos y órganos que existen en las plantas. Estas células continúan dividiéndose hasta que se diferencian y pierden la capacidad de dividirse.
Las células vegetales diferenciadas generalmente no pueden dividirse o producir células de un tipo diferente. Las células meristemáticas son indiferenciadas o incompletamente diferenciadas. Son totipotentes y capaces de continuar la división celular . La división de las células meristemáticas proporciona nuevas células para la expansión y diferenciación de tejidos y la iniciación de nuevos órganos, proporcionando la estructura básica del cuerpo de la planta. Las células son pequeñas, con pequeñas vacuolas o ninguna, y el protoplasma llena la célula por completo. Los plástidos ( cloroplastos o cromoplastos ) no están diferenciados, pero están presentes en forma rudimentaria ( proplástidos ). Las células meristemáticas están empaquetadas estrechamente entre sí sin espacios intercelulares. La pared celular es una pared celular primaria muy delgada.
El término meristemo fue utilizado por primera vez en 1858 por el botánico suizo Carl Wilhelm von Nägeli (1817-1891) en su libro Beiträge zur Wissenschaftlichen Botanik ("Contribuciones a la botánica científica"). [1] Se deriva del griego μερίζειν (merizein) 'dividir', en reconocimiento de su función inherente. [ cita requerida ]
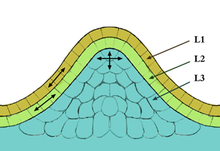
Existen tres tipos de tejidos meristemáticos: apical (en las puntas), intercalar o basal (en el medio) y lateral (en los lados, también conocido como cambium). En la cumbre del meristemo hay un pequeño grupo de células que se dividen lentamente, que comúnmente se denomina zona central. Las células de esta zona tienen una función de célula madre y son esenciales para el mantenimiento del meristemo. Las tasas de proliferación y crecimiento en la cumbre del meristemo suelen diferir considerablemente de las de la periferia.
Meristemas primarios
Los meristemos apicales dan origen al cuerpo primario de la planta y son responsables del crecimiento primario , o un aumento en longitud o altura. [2] [3] Los meristemos apicales pueden diferenciarse en tres tipos de meristemos primarios:
- Protodermo : se encuentra alrededor del exterior del tallo y se desarrolla hasta convertirse en la epidermis .
- Procambium : se encuentra justo dentro del protodermo y se desarrolla en xilema primario y floema primario . También produce el cambium vascular y el cambium corchoso (meristemas secundarios). El cambium corchoso se diferencia aún más en felodermo (hacia adentro) y el felema, o corcho (hacia afuera). Estas tres capas (cambium corchoso, felema y felodermo) constituyen el peridermo . En las raíces, el procambium también puede dar lugar al periciclo, que produce raíces laterales en las eudicotiledóneas. [4]
- Meristemo fundamental : Compuesto por células de parénquima , colénquima y esclerénquima [4] que se desarrollan en la corteza y la médula .
Meristemas secundarios
Después del crecimiento primario, se desarrollan meristemos laterales como crecimiento secundario de la planta. Este crecimiento aumenta el diámetro de la planta a partir del tallo establecido, pero no todas las plantas presentan crecimiento secundario. Existen dos tipos de meristemos secundarios: el cambium vascular y el cambium corchoso.
- Cámbium vascular , que produce xilema secundario y floema secundario. Este es un proceso que puede continuar durante toda la vida de la planta. Esto es lo que da origen a la madera en las plantas. Estas plantas se denominan arbóreas . Esto no ocurre en las plantas que no pasan por un crecimiento secundario (conocidas como plantas herbáceas ).
- Cámbium del corcho , que da origen al peridermo, que sustituye a la epidermis.
Meristemas apicales
Los meristemos apicales son los meristemos completamente indiferenciados (indeterminados) de una planta. Estos se diferencian en tres tipos de meristemos primarios. Los meristemos primarios a su vez producen los dos tipos de meristemos secundarios. Estos meristemos secundarios también se conocen como meristemos laterales, ya que participan en el crecimiento lateral.

- Zona central
- Zona periférica
- Meristemo medular (es decir, central)
- Tejido medular
Existen dos tipos de tejido meristemático apical: el meristemo apical del brote ( SAM ), que da origen a órganos como las hojas y las flores, y el meristemo apical de la raíz ( RAM ), que proporciona las células meristemáticas para el crecimiento futuro de las raíces. Las células SAM y RAM se dividen rápidamente y se consideran indeterminadas, ya que no poseen ningún estado final definido. En ese sentido, las células meristemáticas se comparan con frecuencia con las células madre de los animales, que tienen un comportamiento y una función análogos.
Los meristemos apicales están dispuestos en capas, y el número de capas varía según el tipo de planta. En general, la capa más externa se llama túnica, mientras que las capas más internas son el corpus . En las monocotiledóneas , la túnica determina las características físicas del borde y el margen de la hoja. En las dicotiledóneas , la segunda capa del corpus determina las características del borde de la hoja. El corpus y la túnica desempeñan un papel fundamental en la apariencia física de la planta, ya que todas las células vegetales se forman a partir de los meristemos. Los meristemos apicales se encuentran en dos lugares: la raíz y el tallo. Algunas plantas árticas tienen un meristemo apical en las partes inferior/media de la planta. Se cree que este tipo de meristemo evolucionó porque es ventajoso en condiciones árticas. [ cita requerida ]
Meristemas apicales de los brotes

Los meristemos apicales de los brotes son la fuente de todos los órganos que se encuentran sobre la superficie, como las hojas y las flores. Las células de la cima del meristemo apical de los brotes sirven como células madre para la región periférica circundante, donde proliferan rápidamente y se incorporan a los primordios de las hojas o flores que se diferencian.
El meristemo apical del brote es el sitio de la mayor parte de la embriogénesis en las plantas con flores. [ cita requerida ] Los primordios de hojas, sépalos, pétalos, estambres y ovarios se inician aquí a un ritmo de uno por intervalo de tiempo, llamado plastocrona . Es donde se manifiestan los primeros indicios de que se ha producido el desarrollo de la flor. Uno de estos indicios podría ser la pérdida de la dominancia apical y la liberación de células que de otro modo estarían latentes para desarrollarse como meristemos auxiliares de los brotes, en algunas especies en las axilas de los primordios a dos o tres de la cúpula apical.
El meristemo apical del brote consta de cuatro grupos de células distintos:
- Células madre
- Las células hijas inmediatas de las células madre
- Un centro organizador subyacente
- Células fundadoras para la iniciación de órganos en regiones circundantes
Estas cuatro zonas distintas se mantienen mediante una vía de señalización compleja. En Arabidopsis thaliana , se requieren 3 genes CLAVATA interactuantes para regular el tamaño del reservorio de células madre en el meristemo apical del brote controlando la tasa de división celular . [5] Se predice que CLV1 y CLV2 forman un complejo receptor (de la familia de quinasas similares al receptor LRR) del cual CLV3 es un ligando . [6] [7] [8] CLV3 comparte cierta homología con las proteínas ESR del maíz, con una región corta de 14 aminoácidos que se conserva entre las proteínas. [9] [10] Las proteínas que contienen estas regiones conservadas se han agrupado en la familia de proteínas CLE. [9] [10]
Se ha demostrado que CLV1 interactúa con varias proteínas citoplasmáticas que probablemente estén involucradas en la señalización descendente . Por ejemplo, se ha descubierto que el complejo CLV está asociado con proteínas pequeñas relacionadas con la GTPasa Rho/Rac . [5] Estas proteínas pueden actuar como un intermediario entre el complejo CLV y una proteína quinasa activada por mitógeno (MAPK), que a menudo está involucrada en cascadas de señalización. [11] KAPP es una proteína fosfatasa asociada a la quinasa que se ha demostrado que interactúa con CLV1. [12] Se cree que KAPP actúa como un regulador negativo de CLV1 al desfosforilarlo. [12]
Otro gen importante en el mantenimiento del meristemo de la planta es WUSCHEL (abreviado como WUS ), que es un objetivo de la señalización de CLV además de regular positivamente a CLV, formando así un ciclo de retroalimentación. [13] WUS se expresa en las células debajo de las células madre del meristemo y su presencia previene la diferenciación de las células madre. [13] CLV1 actúa para promover la diferenciación celular al reprimir la actividad de WUS fuera de la zona central que contiene las células madre. [5]
La función de WUS en el meristemo apical del brote está vinculada a la fitohormona citoquinina . La citoquinina activa las histidina quinasas que luego fosforilan las proteínas de fosfotransferencia de histidina. [14] Posteriormente, los grupos fosfato se transfieren a dos tipos de reguladores de respuesta de Arabidopsis (ARR): ARRS tipo B y ARR tipo A. Los ARR tipo B funcionan como factores de transcripción para activar genes aguas abajo de la citoquinina , incluidos los A-ARR. Los A-ARR son similares a los B-ARR en estructura; sin embargo, los A-ARR no contienen los dominios de unión al ADN que tienen los B-ARR, y que son necesarios para funcionar como factores de transcripción. [15] Por lo tanto, los A-ARR no contribuyen a la activación de la transcripción y, al competir por los fosfatos de las proteínas de fosfotransferencia, inhiben la función de los B-ARR. [16] En el SAM, los B-ARR inducen la expresión de WUS , que induce la identidad de las células madre. [17] Luego, WUS suprime los A-ARR. [18] Como resultado, los B-ARR ya no se inhiben, lo que provoca una señalización sostenida de citoquininas en el centro del meristemo apical del brote. Junto con la señalización de CLAVATA, este sistema funciona como un bucle de retroalimentación negativa . La señalización de citoquininas se refuerza positivamente por WUS para evitar la inhibición de la señalización de citoquininas, mientras que WUS promueve su propio inhibidor en forma de CLV3, que en última instancia mantiene bajo control la señalización de WUS y citoquininas. [19]
Meristemo apical de la raíz
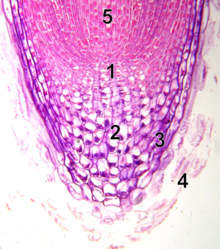
- centro quieto
- caliptrógeno (células vivas del capuchón radicular)
- cofia de raíz
- Se desprendieron las células muertas de la cofia radicular
- procambium
A diferencia del meristemo apical del brote, el meristemo apical de la raíz produce células en dos dimensiones. Alberga dos grupos de células madre alrededor de un centro organizador llamado células del centro quiescente (QC) y juntos producen la mayoría de las células en una raíz adulta. [20] [21] En su ápice, el meristemo de la raíz está cubierto por el casquete radicular, que protege y guía su trayectoria de crecimiento. Las células se desprenden continuamente de la superficie exterior del casquete radicular . Las células del QC se caracterizan por su baja actividad mitótica. La evidencia sugiere que el QC mantiene las células madre circundantes al evitar su diferenciación, a través de señales que aún no se han descubierto. Esto permite un suministro constante de nuevas células en el meristemo necesario para el crecimiento continuo de la raíz. Hallazgos recientes indican que el QC también puede actuar como un reservorio de células madre para reponer lo que se pierde o se daña. [22] Los patrones de tejido y meristemo apical de la raíz se establecen en el embrión en el caso de la raíz primaria, y en el nuevo primordio de la raíz lateral en el caso de las raíces secundarias.
Meristemo intercalar
En las angiospermas, los meristemos intercalares (a veces llamados basales) se presentan en los tallos de las monocotiledóneas (en particular, las gramíneas ) en la base de los nudos y las láminas de las hojas. Las colas de caballo y las welwitschia también presentan crecimiento intercalar. Los meristemos intercalares son capaces de división celular y permiten un rápido crecimiento y rebrote de muchas monocotiledóneas. Los meristemos intercalares en los nudos del bambú permiten una rápida elongación del tallo, mientras que los que se encuentran en la base de las láminas de las hojas de la mayoría de las gramíneas permiten que las hojas dañadas vuelvan a crecer rápidamente. Este rebrote de las hojas en las gramíneas evolucionó en respuesta al daño causado por el pastoreo de herbívoros y/o incendios forestales.
Meristemo floral
Cuando las plantas comienzan a florecer, el meristemo apical del brote se transforma en un meristemo de inflorescencia, que luego produce el meristemo floral, que produce los sépalos, pétalos, estambres y carpelos de la flor.
A diferencia de los meristemos apicales vegetativos y algunos meristemos de eflorescencia, los meristemos florales no pueden seguir creciendo indefinidamente. Su crecimiento se limita a la flor con un tamaño y forma particulares. La transición del meristemo del brote al meristemo floral requiere genes de identidad del meristemo floral, que especifican los órganos florales y causan la terminación de la producción de células madre. AGAMOUS ( AG ) es un gen homeótico floral requerido para la terminación del meristemo floral y necesario para el desarrollo adecuado de los estambres y carpelos . [5] AG es necesario para prevenir la conversión de meristemos florales a meristemos del brote de inflorescencia, pero es el gen de identidad LEAFY ( LFY ) y WUS y está restringido al centro del meristemo floral o los dos verticilos internos. [23] De esta manera se logra la identidad floral y la especificidad de la región. WUS activa AG uniéndose a una secuencia de consenso en el segundo intrón de AG y LFY se une a los sitios de reconocimiento adyacentes. [23] Una vez que se activa AG, reprime la expresión de WUS, lo que lleva a la terminación del meristemo. [23]
A lo largo de los años, los científicos han manipulado los meristemos florales por razones económicas. Un ejemplo es la planta de tabaco mutante "Maryland Mammoth". En 1936, el departamento de agricultura de Suiza realizó varias pruebas científicas con esta planta. "Maryland Mammoth" tiene la particularidad de que crece mucho más rápido que otras plantas de tabaco.
Dominancia apical
La dominancia apical es cuando un meristemo impide o inhibe el crecimiento de otros meristemos. Como resultado, la planta tendrá un tronco principal claramente definido. Por ejemplo, en los árboles, la punta del tronco principal lleva el meristemo del brote dominante. Por lo tanto, la punta del tronco crece rápidamente y no se ve sombreada por las ramas. Si se corta el meristemo dominante, una o más puntas de las ramas asumirán la dominancia. La rama comenzará a crecer más rápido y el nuevo crecimiento será vertical. Con el paso de los años, la rama puede comenzar a parecerse cada vez más a una extensión del tronco principal. A menudo, varias ramas exhibirán este comportamiento después de la eliminación del meristemo apical, lo que da lugar a un crecimiento tupido.
El mecanismo de dominancia apical se basa en las auxinas , unos tipos de reguladores del crecimiento de las plantas. Estas se producen en el meristemo apical y se transportan hacia las raíces en el cambium . Si la dominancia apical es completa, impiden que se formen ramas mientras el meristemo apical esté activo. Si la dominancia es incompleta, se desarrollarán ramas laterales. [ cita requerida ]
Investigaciones recientes sobre la dominancia apical y el control de la ramificación han revelado una nueva familia de hormonas vegetales denominadas estrigolactonas . Se sabía que estos compuestos estaban involucrados en la germinación de las semillas y la comunicación con los hongos micorrízicos y ahora se ha demostrado que están involucrados en la inhibición de la ramificación. [24]
Diversidad en las arquitecturas de los meristemos
El SAM contiene una población de células madre que también producen los meristemos laterales mientras el tallo se alarga. Resulta que el mecanismo de regulación del número de células madre podría estar conservado evolutivamente. El gen CLAVATA CLV2 responsable de mantener la población de células madre en Arabidopsis thaliana está muy estrechamente relacionado con el gen del maíz FASCIATED EAR 2 ( FEA2 ) también involucrado en la misma función. [25] De manera similar, en el arroz, el sistema FON1-FON2 parece tener una relación cercana con el sistema de señalización CLV en Arabidopsis thaliana . [26] Estos estudios sugieren que la regulación del número, la identidad y la diferenciación de las células madre podría ser un mecanismo conservado evolutivamente en las monocotiledóneas , si no en las angiospermas . El arroz también contiene otro sistema genético distinto de FON1-FON2 , que está involucrado en la regulación del número de células madre . [26] Este ejemplo subraya la innovación que ocurre en el mundo vivo todo el tiempo.
Papel de los genes de la familia KNOX


Los análisis genéticos han identificado genes pertenecientes a la familia KNOX en esta función. Estos genes mantienen esencialmente las células madre en un estado indiferenciado. La familia KNOX ha experimentado bastante diversificación evolutiva, manteniendo al mismo tiempo el mecanismo general más o menos similar. Se han encontrado miembros de la familia KNOX en plantas tan diversas como Arabidopsis thaliana , arroz, cebada y tomate. Los genes similares a KNOX también están presentes en algunas algas , musgos, helechos y gimnospermas . La expresión incorrecta de estos genes conduce a la formación de características morfológicas interesantes. Por ejemplo, entre los miembros de Antirrhineae , solo las especies del género Antirrhinum carecen de una estructura llamada espolón en la región floral. Un espolón se considera una innovación evolutiva porque define la especificidad y la atracción de los polinizadores . Los investigadores llevaron a cabo mutagénesis de transposones en Antirrhinum majus y observaron que algunas inserciones conducían a la formación de espolones que eran muy similares a los otros miembros de Antirrhineae , [27] lo que indica que la pérdida de espolones en las poblaciones silvestres de Antirrhinum majus probablemente podría ser una innovación evolutiva.
La familia KNOX también ha sido implicada en la evolución de la forma de las hojas (ver más abajo para una discusión más detallada) . Un estudio observó el patrón de expresión del gen KNOX en A. thaliana , que tiene hojas simples y Cardamine hirsuta , una planta que tiene hojas complejas . En A. thaliana , los genes KNOX están completamente desactivados en las hojas, pero en C. hirsuta , la expresión continuó, generando hojas complejas. [28] Además, se ha propuesto que el mecanismo de acción del gen KNOX se conserva en todas las plantas vasculares , porque existe una estrecha correlación entre la expresión de KNOX y una morfología foliar compleja . [29]
Crecimiento indeterminado de los meristemos
Aunque cada planta crece de acuerdo con un conjunto de reglas, cada nuevo meristemo de raíz y brote puede seguir creciendo mientras esté vivo. En muchas plantas, el crecimiento meristemático es potencialmente indeterminado , lo que hace que la forma general de la planta no esté determinada de antemano. Este es el crecimiento primario . El crecimiento primario conduce al alargamiento del cuerpo de la planta y a la formación de órganos. Todos los órganos de la planta surgen en última instancia de las divisiones celulares en los meristemos apicales, seguidas de la expansión y diferenciación celular. El crecimiento primario da lugar a la parte apical de muchas plantas.
El crecimiento de los nódulos fijadores de nitrógeno en las raíces de las plantas leguminosas, como la soja y el guisante, es determinado o indeterminado. Así, la soja (o el frijol y el Lotus japonicus) producen nódulos determinados (esféricos), con un sistema vascular ramificado que rodea la zona central infectada. A menudo, las células infectadas por Rhizobium tienen solo pequeñas vacuolas. En cambio, los nódulos del guisante, el trébol y el Medicago truncatula son indeterminados, para mantener (al menos durante algún tiempo) un meristemo activo que produce nuevas células para la infección por Rhizobium. Por tanto, existen zonas de madurez en el nódulo. Las células infectadas suelen poseer una gran vacuola. El sistema vascular de la planta es ramificado y periférico.
Clonación
En condiciones adecuadas, cada meristemo de un brote puede convertirse en una planta nueva y completa o en un clon . Estas nuevas plantas pueden obtenerse a partir de esquejes de brotes que contienen un meristemo apical. Sin embargo, los meristemos apicales de las raíces no se clonan fácilmente. Esta clonación se denomina reproducción asexual o reproducción vegetativa y se practica ampliamente en horticultura para producir en masa plantas de un genotipo deseado . Se ha demostrado que este proceso, conocido como meristemo, reduce o elimina los virus presentes en la planta madre en múltiples especies de plantas. [30] [31]
La propagación a través de esquejes es otra forma de propagación vegetativa que inicia la producción de raíces o brotes a partir de células cambiales meristemáticas secundarias. Esto explica por qué la "herida" basal de los esquejes que llevan brotes a menudo ayuda a la formación de raíces. [32]
Meristemas inducidos
Los meristemos también pueden ser inducidos en las raíces de legumbres como la soja , Lotus japonicus , guisante y Medicago truncatula después de la infección con bacterias del suelo comúnmente llamadas Rhizobia . [ cita requerida ] Las células de la corteza interna o externa en la llamada "ventana de nodulación" justo detrás de la punta de la raíz en desarrollo son inducidas a dividirse. La sustancia señal crítica es el lipooligosacárido factor Nod , decorado con grupos laterales para permitir la especificidad de la interacción. Las proteínas receptoras del factor Nod NFR1 y NFR5 se clonaron de varias legumbres, incluyendo Lotus japonicus , Medicago truncatula y soja ( Glycine max ). La regulación de los meristemos de los nódulos utiliza una regulación de larga distancia conocida como autorregulación de la nodulación (AON). Este proceso involucra a las quinasas receptoras LRR ubicadas en el tejido vascular de las hojas (LjHAR1, GmNARK y MtSUNN), la señalización del péptido CLE y la interacción KAPP, similar a la observada en el sistema CLV1,2,3. LjKLAVIER también exhibe un fenotipo de regulación de nódulos, aunque aún no se sabe cómo se relaciona esto con las otras quinasas receptoras AON.
Meristemas laterales
Los meristemos laterales, la forma de crecimiento secundario de las plantas, añaden crecimiento a las plantas en su diámetro. Esto se observa principalmente en las dicotiledóneas perennes que sobreviven de un año a otro. Hay dos tipos de meristemos laterales: el cambium vascular y el cambium corchoso.
En el cambium vascular, el floema y el xilema primarios son producidos por el meristemo apical. Después de este desarrollo inicial, el floema y el xilema secundarios son producidos por el meristemo lateral. Los dos están conectados a través de una fina capa de células parenquimatosas que se diferencian en el cambium fascicular. El cambium fascicular se divide para crear el nuevo floema y xilema secundarios. A continuación, el parénquima cortical entre los cilindros vasculares diferencia el cambium interfascicular. Este proceso se repite para el crecimiento indeterminado. [33]
El cambium del corcho crea una cubierta protectora alrededor del exterior de una planta. Esto ocurre después de que el xilema secundario y el floema ya se han expandido. Las células parenquimatosas corticales se diferencian en cambium del corcho cerca de la epidermis, que forma nuevas células llamadas felodermo y células del corcho. Estas células del corcho son impermeables al agua y a los gases debido a una sustancia llamada suberina que las recubre. [34]
Véase también
Referencias
- ^ Galun, Esra (2007). Patrones vegetales: aspectos genéticos estructurales y moleculares. World Scientific Publishing Company. pág. 333. ISBN 9789812704085
- ^ Baucher, Marie; AlmJaziri, Mondher; Vandeputte, Olivier. "Del crecimiento primario al secundario: origen y desarrollo del sistema vascular". academic.oup.com . Consultado el 18 de marzo de 2023 .
- ^ Tognetti, Vanesa B.; Bielach, Agnieszka; Hrtyan, Mónika (octubre de 2017). "Regulación redox en el sitio de crecimiento primario: interacción entre auxinas, citoquininas y ROS: plasticidad de los meristemos apicales en respuesta al estrés". Plant, Cell & Environment . 40 (11): 2586–2605. doi : 10.1111/pce.13021 . PMID 28708264.
- ^ ab Evert, Ray y Susan Eichhorn. Raven Biology of Plants. Nueva York: WH Freeman and Company, 2013. Impreso.
- ^ abcd Fletcher, JC (2002). "Mantenimiento de brotes y meristemos florales en Arabidopsis". Annu. Rev. Plant Biol. 53 : 45–66. doi :10.1146/annurev.arplant.53.092701.143332. PMID 12221985.
- ^ Clark SE, Williams RW, Meyerowitz E (1997). "El gen CLAVATA1 codifica una supuesta quinasa receptora que controla el tamaño de los brotes y del meristemo floral en Arabidopsis". Cell . 89 (4): 575–85. doi : 10.1016/S0092-8674(00)80239-1 . PMID 9160749. S2CID 15360609.
- ^ Jeong S, Trotochaud AE, Clark S (1999). "El gen CLAVATA2 de Arabidopsis codifica una proteína similar a un receptor necesaria para la estabilidad de la quinasa similar al receptor CLAVATA1". Plant Cell . 11 (10): 1925–33. doi :10.1105/tpc.11.10.1925. PMC 144110 . PMID 10521522.
- ^ Fletcher JC, Brand U, Running MP, Simon R, Meyerowitz EM (1999). "Señalización de decisiones sobre el destino celular por CLAVATA3 en meristemos de brotes de Arabidopsis". Science . 283 (5409): 1911–14. Bibcode :1999Sci...283.1911F. doi :10.1126/science.283.5409.1911. PMID 10082464.
- ^ ab J. Mark Cock; Sheila McCormick (julio de 2001). "Una gran familia de genes que comparten homología con CLAVATA3". Fisiología vegetal . 126 (3): 939–942. doi :10.1104/pp.126.3.939. PMC 1540125 . PMID 11457943.
- ^ por Karsten Oelkers, Nicolas Goffard, Georg F Weiller, Peter M Gresshoff, Ulrike Mathesius y Tancred Frickey (3 de enero de 2008). "Análisis bioinformático de la familia de péptidos de señalización CLE". BMC Plant Biology . 8 : 1. doi : 10.1186/1471-2229-8-1 . PMC 2254619 . PMID 18171480.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Valster, AH; et al. (2000). "GTPasas de plantas: la Rhos en flor". Tendencias en biología celular . 10 (4): 141–146. doi :10.1016/s0962-8924(00)01728-1. PMID 10740268.
- ^ ab Stone, JM; et al. (1998). "Control del desarrollo del meristemo por interacciones entre la quinasa del receptor CLAVATA1 y la proteína fosfatasa asociada a la quinasa". Fisiología vegetal . 117 (4): 1217–1225. doi :10.1104/pp.117.4.1217. PMC 34886 . PMID 9701578.
- ^ ab Mayer, KF X; et al. (1998). "El papel de WUSCHEL en la regulación del destino de las células madre en el meristemo del brote de Arabidopsis". Cell . 95 (6): 805–815. doi : 10.1016/S0092-8674(00)81703-1 . PMID 9865698. S2CID 18995751.
- ^ Sheen, Jen ; Hwang, Ildoo (septiembre de 2001). "Circuitos de dos componentes en la transducción de señales de citoquinina de Arabidopsis". Nature . 413 (6854): 383–389. Bibcode :2001Natur.413..383H. doi :10.1038/35096500. ISSN 1476-4687. PMID 11574878. S2CID 4418158.
- ^ Lohmann, Jan U.; Kieber, Joseph J.; Demar, Monika; Andreas Kehle; Stehling, Sandra; Busch, Wolfgang; To, Jennifer PC; Leibfried, Andrea (diciembre de 2005). "WUSCHEL controla la función del meristemo mediante la regulación directa de los reguladores de respuesta inducibles por citoquinina". Nature . 438 (7071): 1172–1175. Bibcode :2005Natur.438.1172L. doi :10.1038/nature04270. ISSN 1476-4687. PMID 16372013. S2CID 2401801.
- ^ Kieber, Joseph J.; Ecker, Joseph R.; Alonso, Jose M.; Schaller, G. Eric; Mason, Michael G.; Deruère, Jean; Ferreira, Fernando J.; Haberer, Georg; To, Jennifer PC (1 de marzo de 2004). "Los reguladores de respuesta de tipo A de Arabidopsis son reguladores negativos parcialmente redundantes de la señalización de citoquininas". The Plant Cell . 16 (3): 658–671. doi :10.1105/tpc.018978. ISSN 1040-4651. PMC 385279 . PMID 14973166.
- ^ Jurgens, G.; Berger, J.; Mayer, KF; Laux, T. (1996-01-01). "El gen WUSCHEL es necesario para la integridad del meristemo floral y de los brotes en Arabidopsis". Desarrollo . 122 (1): 87–96. doi :10.1242/dev.122.1.87. ISSN 0950-1991. PMID 8565856.
- ^ Jackson, David; Simon, Rüdiger; Je, Byoung Il; Somssich, Marc (15 de septiembre de 2016). "Señalización de CLAVATA-WUSCHEL en el meristemo del brote". Desarrollo . 143 (18): 3238–3248. doi : 10.1242/dev.133645 . ISSN 0950-1991. PMID 27624829.
- ^ Gordon, SP; Chickarmane, VS; Ohno, C.; Meyerowitz, EM (26 de agosto de 2009). "Múltiples bucles de retroalimentación a través de la señalización de citoquininas controlan el número de células madre dentro del meristemo del brote de Arabidopsis". Actas de la Academia Nacional de Ciencias . 106 (38): 16529–16534. Bibcode :2009PNAS..10616529G. doi : 10.1073/pnas.0908122106 . ISSN 0027-8424. PMC 2752578 . PMID 19717465.
- ^ Sebastian, Jose; Lee, Ji-Young (2013). "Meristemos apicales de la raíz". eLS . doi :10.1002/9780470015902.a0020121.pub2. ISBN 978-0470016176.
- ^ Bennett, Tom; Scheres, Ben (2010). "Desarrollo de raíces: ¿dos meristemos por el precio de uno?". Temas actuales en biología del desarrollo . 91 : 67–102. doi :10.1016/S0070-2153(10)91003-X. ISBN. 9780123809100. Número de identificación personal 20705179.
- ^ Heidstra, Renze; Sabatini, Sabrina (2014). "Células madre vegetales y animales: similares pero diferentes". Nature Reviews Molecular Cell Biology . 15 (5): 301–12. doi :10.1038/nrm3790. PMID 24755933. S2CID 34386672.
- ^ abc Lohmann, JU et al. (2001) Un vínculo molecular entre la regulación de células madre y el patrón floral en células de Arabidopsis 105: 793-803
- ^ "Ramificación: una nueva clase de hormonas vegetales inhibe la formación de ramificaciones". Nature . 455 (7210). 2008-09-11 . Consultado el 2009-04-30 .
- ^ Taguchi-Shiobara; Yuan, Z; Hake, S; Jackson, D; et al. (2001). "El gen ear2 fasciado codifica una proteína similar a un receptor de repetición rico en leucina que regula la proliferación del meristemo de los brotes en el maíz". Genes & Development . 15 (20): 2755–2766. doi :10.1101/gad.208501. PMC 312812 . PMID 11641280.
- ^ ab Suzaki T.; Toriba, T; Fujimoto, M; Tsutsumi, N; Kitano, H; Hirano, HY (2006). "Conservación y diversificación del mecanismo de mantenimiento del meristemo en Oryza sativa: función del gen FLORAL ORGAN NUMBER2". Plant and Cell Physiol . 47 (12): 1591–1602. doi : 10.1093/pcp/pcl025 . PMID: 17056620.
- ^ Golz JF; Keck, Emma J.; Hudson, Andrew (2002). "Las mutaciones espontáneas en los genes KNOX dan lugar a una nueva estructura floral en Antirrhinum". Curr. Biol . 12 (7): 515–522. Bibcode :2002CBio...12..515G. doi : 10.1016/S0960-9822(02)00721-2 . PMID 11937019. S2CID 14469173.
- ^ Hay y Tsiantis; Tsiantis, M (2006). "La base genética de las diferencias en la forma de las hojas entre Arabidopsis thaliana y su pariente silvestre Cardamine hirsuta ". Nat. Genet . 38 (8): 942–947. doi :10.1038/ng1835. PMID 16823378. S2CID 5775104.
- ^ Bharathan G, et al. (2002). "Homologías en la forma de la hoja inferidas a partir de la expresión del gen KNOXI durante el desarrollo". Science . 296 (5574): 1858–1860. Bibcode :2002Sci...296.1858B. doi :10.1126/science.1070343. PMID 12052958. S2CID 45069635.
- ^ Adams, Alexa (abril de 2013). «Eliminación de virus del lúpulo (Humulus lupulus) mediante terapia de calor y cultivo de meristemos». Journal of Horticultural Science . 50 (2): 151–160. doi :10.1080/00221589.1975.11514616 . Consultado el 24 de enero de 2023 .
- ^ Alam, I; Sharmin, SA; Naher, MK; Alam, MJ; Anisuzzaman, M; Alam, MF (abril de 2013). "Eliminación y detección de virus en plántulas derivadas de meristemos de camote como una opción de bajo costo para la comercialización". 3 Biotech . 3 (2): 53–164. doi :10.1007/s13205-012-0080-6. PMC 3597136 . PMID 8324570.
- ^ Mackenzie, KAD; Howard, BH (1986). "La relación anatómica entre la regeneración cambial y la iniciación de la raíz en esquejes de invierno heridos del portainjerto de manzano M.26". Anales de botánica . 58 (5): 649–661. doi :10.1093/oxfordjournals.aob.a087228.
- ^ Nieminen, Kaisa; Blomster, Tiina; Helariutta, Ykä; Mähönen, Ari Pekka (enero de 2015). "Desarrollo del cambium vascular". El libro de Arabidopsis . 13 : e0177. doi :10.1199/tab.0177. ISSN 1543-8120. PMC 4463761 . PMID 26078728.
- ^ "Desarrollo de las plantas II: crecimiento primario y secundario | Biología de los organismos". organismalbio.biosci.gatech.edu . Consultado el 8 de abril de 2024 .
Fuentes
- Laboratorio de Anatomía Vegetal de la Universidad de Texas ; laboratorio de JD Mauseth. Micrografías de células y tejidos vegetales, con texto explicativo.
- Schoof, Heiko; Lenhard, M; Haecker, A; Mayer, KF; Jürgens, G; Laux, T (2000). "Los meristemos de los brotes de Arabidopsis se mantienen mediante un bucle regulador entre los genes Clavata y Wuschel". Cell . 100 (6): 635–644. doi : 10.1016/S0092-8674(00)80700-X . PMID 10761929. S2CID 8963007.
- Scofield y Murray (2006). El concepto evolutivo del meristemo. Plant Molecular Biology 60:v–vii.
Enlaces externos
- Meristemania.org – Investigación sobre los meristemos
