Germanio
El germanio es un elemento químico ; su símbolo es Ge y su número atómico es 32. Es brillante, duro y quebradizo, de color blanco grisáceo y de apariencia similar al silicio . Es un metaloide (menos frecuentemente considerado un metal ) del grupo del carbono que es químicamente similar a sus vecinos del grupo silicio y estaño . Al igual que el silicio, el germanio reacciona naturalmente y forma complejos con el oxígeno en la naturaleza.
Debido a que rara vez aparece en alta concentración, el germanio se encontró comparativamente tarde en el descubrimiento de los elementos . El germanio ocupa el puesto 50 en abundancia de los elementos en la corteza terrestre . En 1869, Dmitri Mendeleev predijo su existencia y algunas de sus propiedades a partir de su posición en su tabla periódica , y llamó al elemento ekasilicio . El 6 de febrero de 1886, Clemens Winkler en la Universidad de Freiberg encontró el nuevo elemento, junto con plata y azufre , en el mineral argirodita . Winkler nombró al elemento en honor a su país de nacimiento, Alemania . El germanio se extrae principalmente de la esfalrita (el mineral primario del zinc ), aunque el germanio también se recupera comercialmente de los minerales de plata, plomo y cobre .
El germanio elemental se utiliza como semiconductor en transistores y otros dispositivos electrónicos. Históricamente, la primera década de la electrónica de semiconductores se basó completamente en el germanio. En la actualidad, los principales usos finales son los sistemas de fibra óptica , la óptica infrarroja , las aplicaciones de células solares y los diodos emisores de luz (LED). Los compuestos de germanio también se utilizan para catalizadores de polimerización y, más recientemente, se han utilizado en la producción de nanocables . Este elemento forma una gran cantidad de compuestos de organogermanio , como el tetraetilgermanio , útiles en la química organometálica . El germanio se considera un elemento crítico para la tecnología . [10]
No se considera que el germanio sea un elemento esencial para ningún organismo vivo . Al igual que el silicio, los compuestos de germanio que se encuentran en la naturaleza tienden a ser insolubles en agua y, por lo tanto, tienen poca toxicidad oral . Sin embargo, las sales de germanio solubles sintéticas son nefrotóxicas y los compuestos de germanio sintéticos químicamente reactivos con halógenos e hidrógeno son irritantes y tóxicos.
Historia

En su informe sobre La ley periódica de los elementos químicos en 1869, el químico ruso Dmitri Mendeleev predijo la existencia de varios elementos químicos desconocidos , incluido uno que llenaría un vacío en la familia del carbono , ubicado entre el silicio y el estaño . [11] Debido a su posición en su tabla periódica, Mendeleev lo llamó ekasilicio (Es) , y estimó que su peso atómico era 70 (más tarde 72).
A mediados de 1885, en una mina cerca de Freiberg, Sajonia , se descubrió un nuevo mineral y se lo denominó argirodita debido a su alto contenido de plata . [nota 1] El químico Clemens Winkler analizó este nuevo mineral, que resultó ser una combinación de plata, azufre y un nuevo elemento. Winkler pudo aislar el nuevo elemento en 1886 y lo encontró similar al antimonio . Inicialmente consideró que el nuevo elemento era eka-antimonio, pero pronto se convenció de que en realidad era eka-silicio. [13] [14] Antes de que Winkler publicara sus resultados sobre el nuevo elemento, decidió que nombraría a su elemento neptunio , ya que el reciente descubrimiento del planeta Neptuno en 1846 había sido precedido de manera similar por predicciones matemáticas de su existencia. [nota 2] Sin embargo, el nombre "neptunio" ya se había dado a otro elemento químico propuesto (aunque no al elemento que hoy lleva el nombre de neptunio , que fue descubierto en 1940). [nota 3] Así que, en su lugar, Winkler nombró al nuevo elemento germanio (de la palabra latina , Germania , para Alemania) en honor a su tierra natal. [14] La argirodita demostró empíricamente ser Ag 8 GeS 6 . Debido a que este nuevo elemento mostró algunas similitudes con los elementos arsénico y antimonio, su lugar apropiado en la tabla periódica estaba bajo consideración, pero sus similitudes con el elemento predicho por Dmitri Mendeleev "ekasilicón" confirmaron ese lugar en la tabla periódica. [14] [21] Con material adicional de 500 kg de mineral de las minas de Sajonia, Winkler confirmó las propiedades químicas del nuevo elemento en 1887. [13] [14] [22] También determinó un peso atómico de 72,32 analizando tetracloruro de germanio puro ( GeCl
4), mientras que Lecoq de Boisbaudran dedujo 72,3 mediante una comparación de las líneas en el espectro de chispa del elemento. [23]
Winkler fue capaz de preparar varios compuestos nuevos de germanio, incluyendo fluoruros , cloruros , sulfuros , dióxido y tetraetilgermano (Ge(C 2 H 5 ) 4 ), el primer organogermano. [13] Los datos físicos de esos compuestos, que se correspondían bien con las predicciones de Mendeleev, hicieron que el descubrimiento fuera una confirmación importante de la idea de Mendeleev sobre la periodicidad de los elementos . Aquí hay una comparación entre la predicción y los datos de Winkler: [13]
| Propiedad | Predicción de Mendeleev sobre Ekasilicon (1871) | Descubrimiento del germanio por Winkler (1887) |
|---|---|---|
| masa atómica | 72,64 | 72,63 |
| densidad (g/ cm3 ) | 5.5 | 5.35 |
| punto de fusión (°C) | alto | 947 |
| color | gris | gris |
| tipo de óxido | dióxido refractario | dióxido refractario |
| densidad de óxido (g/cm 3 ) | 4.7 | 4.7 |
| actividad de óxido | Débilmente básico | Débilmente básico |
| punto de ebullición del cloruro (°C) | menos de 100 | 86 ( GeCl4 ) |
| Densidad de cloruro (g/cm 3 ) | 1.9 | 1.9 |
Hasta finales de la década de 1930, se pensaba que el germanio era un metal poco conductor . [24] El germanio no adquirió importancia económica hasta después de 1945, cuando se reconocieron sus propiedades como semiconductor electrónico . Durante la Segunda Guerra Mundial , se utilizaron pequeñas cantidades de germanio en algunos dispositivos electrónicos especiales , principalmente diodos . [25] [26] El primer uso importante fueron los diodos Schottky de contacto puntual para la detección de pulsos de radar durante la guerra. [24] Las primeras aleaciones de silicio-germanio se obtuvieron en 1955. [27] Antes de 1945, solo se producían unos pocos cientos de kilogramos de germanio en fundiciones cada año, pero a fines de la década de 1950, la producción mundial anual había alcanzado las 40 toneladas métricas (44 toneladas cortas ). [28]
El desarrollo del transistor de germanio en 1948 [29] abrió la puerta a innumerables aplicaciones de la electrónica de estado sólido . [30] Desde 1950 hasta principios de la década de 1970, esta área proporcionó un mercado creciente para el germanio, pero luego el silicio de alta pureza comenzó a reemplazar al germanio en transistores, diodos y rectificadores . [31] Por ejemplo, la empresa que se convirtió en Fairchild Semiconductor se fundó en 1957 con el propósito expreso de producir transistores de silicio. El silicio tiene propiedades eléctricas superiores, pero requiere una pureza mucho mayor que no se podía lograr comercialmente en los primeros años de la electrónica de semiconductores . [32]
Mientras tanto, la demanda de germanio para redes de comunicación de fibra óptica , sistemas de visión nocturna por infrarrojos y catalizadores de polimerización aumentó drásticamente. [28] Estos usos finales representaron el 85% del consumo mundial de germanio en 2000. [31] El gobierno de los EE. UU. incluso designó al germanio como un material estratégico y crítico, solicitando un suministro de 146 toneladas (132 toneladas métricas ) en el arsenal de defensa nacional en 1987. [28]
El germanio se diferencia del silicio en que su oferta está limitada por la disponibilidad de fuentes explotables, mientras que la oferta de silicio está limitada únicamente por la capacidad de producción, ya que el silicio proviene de arena y cuarzo comunes . Mientras que en 1998 el silicio se podía comprar por menos de 10 dólares el kg [28] , el precio del germanio era de casi 800 dólares el kg [28] .
Características
En condiciones estándar , el germanio es un semiconductor frágil, de color blanco plateado, [33] Esta forma constituye un alótropo conocido como α-germanio , que tiene un brillo metálico y una estructura cristalina cúbica de diamante , la misma estructura que el silicio y el diamante . [31] En esta forma, el germanio tiene una energía de desplazamiento umbral de . [34] A presiones superiores a 120 kbar , el germanio se convierte en el alótropo metálico β-germanio con la misma estructura que el β- estaño . [35] Al igual que el silicio, el galio , el bismuto , el antimonio y el agua , el germanio es una de las pocas sustancias que se expande a medida que se solidifica (es decir, se congela ) desde el estado fundido. [35]
El germanio es un semiconductor que tiene una banda prohibida indirecta , al igual que el silicio cristalino. Las técnicas de refinación por zonas han llevado a la producción de germanio cristalino para semiconductores que tiene una impureza de solo una parte en 10 10 , [36] lo que lo convierte en uno de los materiales más puros jamás obtenidos. [37] El primer material semimetálico descubierto (en 2005) que se convirtió en un superconductor en presencia de un campo electromagnético extremadamente fuerte fue una aleación de germanio, uranio y rodio . [38]
Se sabe que el germanio puro extruye espontáneamente dislocaciones helicoidales muy largas , conocidas como bigotes de germanio . El crecimiento de estos bigotes es una de las principales razones de falla de los diodos y transistores más antiguos hechos de germanio, ya que, dependiendo de lo que finalmente toquen, pueden provocar un cortocircuito eléctrico . [39]
Química
El germanio elemental comienza a oxidarse lentamente en el aire a alrededor de 250 °C, formando GeO 2 . [40] El germanio es insoluble en ácidos y álcalis diluidos , pero se disuelve lentamente en ácidos sulfúricos y nítricos concentrados y calientes y reacciona violentamente con álcalis fundidos para producir germanatos ( [GeO
3]2−
). El germanio se presenta principalmente en el estado de oxidación +4, aunque se conocen muchos compuestos +2. [41] Otros estados de oxidación son raros: +3 se encuentra en compuestos como Ge 2 Cl 6 , y +3 y +1 se encuentran en la superficie de los óxidos, [42] o estados de oxidación negativos en germanuros , como −4 en Mg
2Los aniones del grupo de germanio ( iones Zintl ) como Ge 4 2− , Ge 9 4− , Ge 9 2− , [(Ge 9 ) 2 ] 6− se han preparado mediante la extracción de aleaciones que contienen metales alcalinos y germanio en amoníaco líquido en presencia de etilendiamina o un criptando . [41] [43] Los estados de oxidación del elemento en estos iones no son números enteros, similares a los ozónidos O 3 − .
Se conocen dos óxidos de germanio: el dióxido de germanio ( GeO
2, germania) y monóxido de germanio , ( GeO ). [35] El dióxido, GeO 2 , se puede obtener tostando disulfuro de germanio ( GeS
2), y es un polvo blanco que es sólo ligeramente soluble en agua pero reacciona con álcalis para formar germanatos . [35] El monóxido, óxido germanoso, se puede obtener por la reacción a alta temperatura de GeO 2 con Ge elemental. [35] El dióxido (y los óxidos y germanatos relacionados) exhiben la propiedad inusual de tener un alto índice de refracción para la luz visible, pero transparencia a la luz infrarroja . [44] [45] El germanato de bismuto , Bi 4 Ge 3 O 12 (BGO), se utiliza como centelleador . [46]
También se conocen compuestos binarios con otros calcógenos , como el disulfuro ( GeS
2) y diselenuro ( GeSe
2), y el monosulfuro (GeS), monoseleniuro (GeSe) y monotelururo (GeTe). [41] El GeS 2 se forma como un precipitado blanco cuando el sulfuro de hidrógeno pasa a través de soluciones fuertemente ácidas que contienen Ge(IV). [41] El disulfuro es apreciablemente soluble en agua y en soluciones de álcalis cáusticos o sulfuros alcalinos. Sin embargo, no es soluble en agua ácida, lo que permitió a Winkler descubrir el elemento. [47] Al calentar el disulfuro en una corriente de hidrógeno , se forma el monosulfuro (GeS), que sublima en placas delgadas de color oscuro y brillo metálico, y es soluble en soluciones de álcalis cáusticos. [35] Al fundirse con carbonatos alcalinos y azufre , los compuestos de germanio forman sales conocidas como tiogermanatos. [48]

Se conocen cuatro tetrahaluros . En condiciones normales, el tetrayoduro de germanio (GeI 4 ) es un sólido, el tetrafluoruro de germanio (GeF 4 ) un gas y los demás líquidos volátiles. Por ejemplo, el tetracloruro de germanio , GeCl 4 , se obtiene como un líquido fumante incoloro que hierve a 83,1 °C calentando el metal con cloro. [35] Todos los tetrahaluros se hidrolizan fácilmente a dióxido de germanio hidratado. [35] El GeCl 4 se utiliza en la producción de compuestos de organogermanio. [41] Se conocen los cuatro dihaluros y, a diferencia de los tetrahaluros, son sólidos poliméricos. [41] Además, se conocen Ge 2 Cl 6 y algunos compuestos superiores de fórmula Ge n Cl 2 n +2 . [35] Se ha preparado el compuesto inusual Ge 6 Cl 16 que contiene la unidad Ge 5 Cl 12 con una estructura de neopentano . [49]
El germano (GeH 4 ) es un compuesto de estructura similar al metano . Se conocen poligermanos (compuestos similares a los alcanos ) con la fórmula Ge n H 2 n +2 que contienen hasta cinco átomos de germanio. [41] Los germanos son menos volátiles y menos reactivos que sus análogos de silicio correspondientes. [41] El GeH 4 reacciona con metales alcalinos en amoníaco líquido para formar MGeH 3 cristalino blanco que contiene el anión GeH 3 − . [41] Los hidrohaluros de germanio con uno, dos y tres átomos de halógeno son líquidos reactivos incoloros. [41]

El primer compuesto de organogermanio fue sintetizado por Winkler en 1887; la reacción del tetracloruro de germanio con dietilzinc produjo tetraetilgermano ( Ge(C
2yo
5)
4). [13] Organogermanos del tipo R 4 Ge (donde R es un alquilo ) como el tetrametilgermano ( Ge(CH
3)
4) y el tetraetilgermano se obtienen a través del precursor de germanio más barato disponible, el tetracloruro de germanio, y de nucleófilos de alquilo. Los hidruros orgánicos de germanio, como el isobutilgermano ( (CH
3)
2CHCH
2GeH
3) resultaron ser menos peligrosos y pueden utilizarse como sustituto líquido del gas germano tóxico en aplicaciones de semiconductores . Se conocen muchos intermediarios reactivos del germanio: radicales libres germilo , germilenos (similares a los carbenos ) y germinos (similares a los carbinos ). [50] [51] El compuesto de organogermanio 2-carboxietilgermasesquioxano se informó por primera vez en la década de 1970 y, durante un tiempo, se utilizó como suplemento dietético y se pensó que posiblemente tuviera cualidades antitumorales. [52]
Mediante el uso de un ligando llamado Eind (1,1,3,3,5,5,7,7-octaetil-s-hidrindacen-4-il) germanio, se puede formar un doble enlace con el oxígeno (germanona). El hidruro de germanio y el tetrahidruro de germanio son muy inflamables e incluso explosivos cuando se mezclan con aire. [53]
Isótopos
El germanio se presenta en cinco isótopos naturales :70
En
,72
En
,73
En
,74
En
, y76
En
De estos,76
En
es muy ligeramente radiactivo y se desintegra por doble desintegración beta con una vida media de1,78 × 10 21 años .74
En
es el isótopo más común, con una abundancia natural de aproximadamente el 36%.76
En
es el menos común con una abundancia natural de aproximadamente el 7%. [54] Cuando se bombardea con partículas alfa, el isótopo72
En
generará estabilidad77
Sí
, liberando electrones de alta energía en el proceso. [55] Debido a esto, se utiliza en combinación con el radón para baterías nucleares . [55]
También se han sintetizado al menos 27 radioisótopos , cuya masa atómica varía entre 58 y 89. El más estable de ellos es68
En
, que se desintegra por captura de electrones con una vida media de270,95 días. El menos estable es60
En
, con una vida media de30 ms . Si bien la mayoría de los radioisótopos del germanio se desintegran por desintegración beta ,61
En
y64
En
decadencia por
β+
emisión retardada de protones . [54] 84
En
a través de87
En
Los isótopos también exhiben valores menores.
β−
trayectorias de desintegración retardada por emisión de neutrones . [54]
Aparición

El germanio se crea mediante nucleosíntesis estelar , principalmente mediante el proceso s en estrellas gigantes asintóticas . El proceso s es una captura lenta de neutrones de elementos más ligeros dentro de estrellas gigantes rojas pulsantes . [56] Se ha detectado germanio en algunas de las estrellas más distantes [57] y en la atmósfera de Júpiter. [58]
La abundancia de germanio en la corteza terrestre es de aproximadamente 1,6 ppm . [59] Solo unos pocos minerales como la argirodita , la briartita , la germanita , la renierita y la esfalrita contienen cantidades apreciables de germanio. [31] [60] Solo unos pocos de ellos (especialmente la germanita) se encuentran, muy raramente, en cantidades explotables. [61] [62] [63] Algunos cuerpos minerales de zinc, cobre y plomo contienen suficiente germanio para justificar la extracción del concentrado de mineral final. [59] Un proceso de enriquecimiento natural inusual causa un alto contenido de germanio en algunas vetas de carbón, descubierto por Victor Moritz Goldschmidt durante un amplio estudio de depósitos de germanio. [64] [65] La concentración más alta jamás encontrada fue en cenizas de carbón Hartley con hasta un 1,6% de germanio. [64] [65] Los depósitos de carbón cerca de Xilinhaote , Mongolia Interior , contienen aproximadamente 1600 toneladas de germanio. [59]
Producción
En 2011 se produjeron alrededor de 118 toneladas de germanio en todo el mundo, principalmente en China (80 t), Rusia (5 t) y Estados Unidos (3 t). [31] El germanio se recupera como subproducto de los minerales de zinc esfalerita , donde se concentra en cantidades de hasta un 0,3%, [66] especialmente de depósitos masivos de Zn - Pb - Cu (– Ba ) alojados en sedimentos de baja temperatura y depósitos de Zn-Pb alojados en carbonatos. [67] Un estudio reciente encontró que al menos 10.000 t de germanio extraíble están contenidas en reservas de zinc conocidas, en particular las alojadas en depósitos de tipo Mississippi-Valley , mientras que al menos 112.000 t se encontrarán en reservas de carbón. [68] En 2007, el 35% de la demanda se satisfizo con germanio reciclado. [59]
| Año | Costo ( $ /kg) [69] |
|---|---|
| 1999 | 1.400 |
| 2000 | 1.250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1.240 |
| 2008 | 1.490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1.625 |
| 2012 | 1.680 |
| 2013 | 1.875 |
| 2014 | 1.900 |
| 2015 | 1.760 |
| 2016 | 950 |
| 2017 | 1.358 |
| 2018 | 1.300 |
| 2019 | 1.240 |
| 2020 | 1.000 |
Aunque se produce principalmente a partir de esfalrita , también se encuentra en minerales de plata , plomo y cobre . Otra fuente de germanio son las cenizas volantes de las centrales eléctricas alimentadas con depósitos de carbón que contienen germanio. Rusia y China utilizaron esto como fuente de germanio. [70] Los depósitos de Rusia se encuentran en el extremo este de la isla de Sajalín y al noreste de Vladivostok . Los depósitos de China se encuentran principalmente en las minas de lignito cerca de Lincang , Yunnan ; el carbón también se extrae cerca de Xilinhaote , Mongolia Interior . [59]
Los concentrados de mineral son en su mayoría sulfídicos ; se convierten en óxidos calentándolos al aire en un proceso conocido como tostación :
- GeS2 + 3O2 → GeO2 + 2SO2
Parte del germanio queda en el polvo producido, mientras que el resto se convierte en germanatos, que luego se lixivian (junto con el cinc) de la ceniza mediante ácido sulfúrico. Después de la neutralización, solo el cinc permanece en solución mientras que el germanio y otros metales precipitan. Después de eliminar parte del cinc en el precipitado mediante el proceso Waelz , el óxido Waelz restante se lixivia una segunda vez. El dióxido se obtiene como precipitado y se convierte con gas cloro o ácido clorhídrico en tetracloruro de germanio , que tiene un punto de ebullición bajo y se puede aislar por destilación: [70]
- GeO 2 + 4 HCl → GeCl 4 + 2 H 2 O
- GeO 2 + 2 Cl 2 → GeCl 4 + O 2
El tetracloruro de germanio se hidroliza hasta el óxido (GeO 2 ) o se purifica por destilación fraccionada y luego se hidroliza. [70] El GeO 2 altamente puro ahora es adecuado para la producción de vidrio de germanio. Se reduce al elemento al reaccionar con hidrógeno, produciendo germanio adecuado para la óptica infrarroja y la producción de semiconductores:
- GeO 2 + 2 H 2 → Ge + 2 H 2 O
El germanio para la producción de acero y otros procesos industriales normalmente se reduce utilizando carbono: [71]
- GeO2 + C → Ge + CO2
Aplicaciones
Se estima que los principales usos finales del germanio en 2007, a nivel mundial, fueron: 35% para fibra óptica , 30% para óptica infrarroja , 15% para catalizadores de polimerización y 15% para aplicaciones electrónicas y solares. [31] El 5% restante se destinó a usos como fósforos, metalurgia y quimioterapia. [31]
Óptica
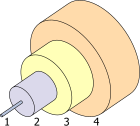
- Núcleo de 8 µm
- Revestimiento 125 µm
- Tampón 250 µm
- Chaqueta 400 µm
Las propiedades notables de la germania (GeO 2 ) son su alto índice de refracción y su baja dispersión óptica . Estas lo hacen especialmente útil para lentes de cámara de gran angular , microscopía , [72] y la parte central de las fibras ópticas . [73] [74] Ha reemplazado al titanio como dopante para la fibra de sílice, eliminando el tratamiento térmico posterior que hacía que las fibras se volvieran quebradizas. [75] A fines de 2002, la industria de la fibra óptica consumía el 60% del uso anual de germanio en los Estados Unidos, pero esto es menos del 10% del consumo mundial. [74] GeSbTe es un material de cambio de fase utilizado por sus propiedades ópticas, como el que se usa en los DVD regrabables . [76]
Debido a que el germanio es transparente en las longitudes de onda infrarrojas, es un material óptico infrarrojo importante que se puede cortar y pulir fácilmente en lentes y ventanas. Se utiliza especialmente como óptica frontal en cámaras termográficas que funcionan en el rango de 8 a 14 micrones para imágenes térmicas pasivas y para la detección de puntos calientes en aplicaciones militares, de visión nocturna móvil y de lucha contra incendios. [71] Se utiliza en espectroscopios infrarrojos y otros equipos ópticos que requieren detectores infrarrojos extremadamente sensibles . [74] Tiene un índice de refracción muy alto (4,0) y debe estar recubierto con agentes antirreflejos. En particular, un recubrimiento antirreflejo especial muy duro de carbono tipo diamante (DLC), índice de refracción 2,0, es una buena combinación y produce una superficie dura como el diamante que puede soportar mucho abuso ambiental. [77] [78]
Electrónica
El germanio se puede alear con silicio , y las aleaciones de silicio-germanio se están convirtiendo rápidamente en un material semiconductor importante para circuitos integrados de alta velocidad. Los circuitos que utilizan las propiedades de las heterojunciones Si-SiGe pueden ser mucho más rápidos que los que utilizan solo silicio. [79] Los chips de SiGe, con propiedades de alta velocidad, se pueden fabricar con técnicas de producción de bajo costo y bien establecidas de la industria de chips de silicio . [31]
Los paneles solares de alta eficiencia son un uso importante del germanio. Debido a que el germanio y el arseniuro de galio tienen una constante de red casi idéntica , los sustratos de germanio se pueden utilizar para fabricar células solares de arseniuro de galio . [80] El germanio es el sustrato de las obleas para células fotovoltaicas multiunión de alta eficiencia para aplicaciones espaciales, como los Mars Exploration Rovers , que utilizan arseniuro de galio de triple unión sobre células de germanio. [81] Los LED de alto brillo, utilizados para faros de automóviles y para retroiluminar pantallas LCD, también son una aplicación importante. [31]
Los sustratos de germanio sobre aislante (GeOI) se consideran un posible reemplazo del silicio en chips miniaturizados. [31] Recientemente se ha informado de un circuito CMOS basado en sustratos de GeOI. [82] Otros usos en electrónica incluyen fósforos en lámparas fluorescentes [36] y diodos emisores de luz (LED) de estado sólido. [31] Los transistores de germanio todavía se utilizan en algunos pedales de efectos por músicos que desean reproducir el carácter tonal distintivo del tono "fuzz" de la era temprana del rock and roll , en particular el Dallas Arbiter Fuzz Face . [83]
Se ha estudiado el germanio como un material potencial para sensores bioelectrónicos implantables que se reabsorben en el cuerpo sin generar gas hidrógeno dañino, reemplazando las implementaciones basadas en óxido de zinc y óxido de indio, galio y zinc . [84]
Otros usos

El dióxido de germanio también se utiliza en catalizadores para la polimerización en la producción de tereftalato de polietileno (PET). [85] El alto brillo de este poliéster es especialmente favorable para las botellas de PET comercializadas en Japón. [85] En los Estados Unidos, el germanio no se utiliza para catalizadores de polimerización. [31]
Debido a la similitud entre la sílice (SiO 2 ) y el dióxido de germanio (GeO 2 ), la fase estacionaria de sílice en algunas columnas de cromatografía de gases puede reemplazarse por GeO 2 . [86]
En los últimos años, el germanio se ha utilizado cada vez más en aleaciones de metales preciosos. En las aleaciones de plata esterlina , por ejemplo, reduce la formación de incrustaciones , aumenta la resistencia al deslustre y mejora el endurecimiento por precipitación. Una aleación de plata resistente al deslustre, denominada Argentium , contiene un 1,2 % de germanio. [31]
Los detectores semiconductores fabricados con germanio monocristalino de alta pureza pueden identificar con precisión las fuentes de radiación, por ejemplo, en la seguridad de los aeropuertos. [87] El germanio es útil para monocromadores para líneas de luz utilizadas en dispersión de neutrones monocristalinos y difracción de rayos X de sincrotrón . La reflectividad tiene ventajas sobre el silicio en aplicaciones de neutrones y rayos X de alta energía . [88] Los cristales de germanio de alta pureza se utilizan en detectores para espectroscopia gamma y la búsqueda de materia oscura . [89] Los cristales de germanio también se utilizan en espectrómetros de rayos X para la determinación de fósforo, cloro y azufre. [90]
El germanio está surgiendo como un material importante para la espintrónica y las aplicaciones de computación cuántica basadas en el espín . En 2010, los investigadores demostraron el transporte de espín a temperatura ambiente [91] y, más recientemente, se ha demostrado que los espines de los electrones donantes en el germanio tienen tiempos de coherencia muy largos . [92]
Importancia estratégica
Debido a su uso en electrónica y óptica avanzadas, el germanio se considera un elemento tecnológico crítico (por ejemplo, por la Unión Europea ), esencial para cumplir con la transición verde y digital . Como China controla el 60% de la producción mundial de germanio, mantiene una posición dominante en las cadenas de suministro mundiales.
El 3 de julio de 2023, China impuso restricciones de represalia a las exportaciones de germanio (y galio ), contra las restricciones comerciales y tecnológicas impuestas por las potencias occidentales. Invocando "intereses de seguridad nacional", el Ministerio de Comercio chino informó que las empresas que pretendan vender productos que contengan germanio necesitarían una licencia de exportación. Los productos/compuestos a los que se dirige son: dióxido de germanio, sustrato de crecimiento epitaxial de germanio, lingote de germanio, germanio metálico, tetracloruro de germanio y fosfuro de zinc y germanio. Considera que estos productos son artículos de "doble uso" que pueden tener fines militares y, por lo tanto, justifican una capa adicional de supervisión. [ cita requerida ]
La nueva disputa abrió un nuevo capítulo en la cada vez más feroz carrera tecnológica que enfrenta a Estados Unidos, y en menor medida a Europa, contra China. Estados Unidos quiere que sus aliados limiten severamente, o prohíban directamente, los componentes electrónicos avanzados destinados al mercado chino para impedir que Pekín asegure la supremacía tecnológica global. China negó cualquier intención de represalia detrás de las restricciones a la exportación de germanio. [93] [94] [95]
A raíz de las restricciones a las exportaciones de China, la empresa estatal rusa Rostec anunció un aumento en la producción de germanio para satisfacer la demanda interna. [96]
El germanio y la salud
El germanio no se considera esencial para la salud de las plantas o los animales. [97] El germanio en el medio ambiente tiene poco o ningún impacto en la salud. Esto se debe principalmente a que generalmente solo se presenta como un elemento traza en minerales y materiales carbonosos , y las diversas aplicaciones industriales y electrónicas implican cantidades muy pequeñas que no es probable que se ingieran. [31] Por razones similares, el germanio de uso final tiene poco impacto en el medio ambiente como riesgo biológico. Algunos compuestos intermedios reactivos del germanio son venenosos (ver precauciones, a continuación). [98]
Los suplementos de germanio, elaborados a partir de germanio orgánico e inorgánico, se han comercializado como una medicina alternativa capaz de tratar la leucemia y el cáncer de pulmón . [28] Sin embargo, no hay evidencia médica de beneficio; algunas evidencias sugieren que dichos suplementos son activamente dañinos. [97] La investigación de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha concluido que el germanio inorgánico, cuando se usa como suplemento nutricional , "presenta un riesgo potencial para la salud humana ". [52]
Algunos compuestos de germanio han sido administrados por profesionales de la medicina alternativa como soluciones inyectables no permitidas por la FDA. Las formas inorgánicas solubles de germanio utilizadas al principio, en particular la sal de citrato-lactato, dieron lugar a algunos casos de disfunción renal , esteatosis hepática y neuropatía periférica en personas que las utilizaban durante un largo periodo. Las concentraciones de germanio en el plasma y la orina en estos individuos, varios de los cuales murieron, fueron varios órdenes de magnitud mayores que los niveles endógenos . Una forma orgánica más reciente, el sesquióxido de beta-carboxietilgermanio ( propagermanium ), no ha mostrado el mismo espectro de efectos tóxicos. [99]
Ciertos compuestos de germanio tienen baja toxicidad para los mamíferos , pero tienen efectos tóxicos contra ciertas bacterias . [33]
Precauciones para los compuestos de germanio químicamente reactivos
Si bien el uso del germanio en sí no requiere precauciones, algunos de los compuestos de germanio producidos artificialmente son bastante reactivos y presentan un peligro inmediato para la salud humana en caso de exposición. Por ejemplo, el tetracloruro de germanio y el germano (GeH 4 ) son un líquido y un gas, respectivamente, que pueden ser muy irritantes para los ojos, la piel, los pulmones y la garganta. [100]
Véase también
Notas
- ^ Del griego, argirodita significa que contiene plata . [12]
- ^ De la misma forma que se había predicho la existencia del nuevo elemento, la existencia del planeta Neptuno había sido predicha alrededor de 1843 por los matemáticos John Couch Adams y Urbain Le Verrier , utilizando los métodos de cálculo de la mecánica celeste . Hicieron esto en un intento de explicar el hecho de que el planeta Urano , tras una observación muy cercana, parecía estar siendo sacado ligeramente de su posición en el cielo. [15] James Challis comenzó a buscarlo en julio de 1846, y avistó este planeta el 23 de septiembre de 1846. [16]
- ^ R. Hermann publicó en 1877 afirmaciones sobre su descubrimiento de un nuevo elemento debajo del tantalio en la tabla periódica, al que llamó neptunio , en honor al dios griego de los océanos y los mares. [17] [18] Sin embargo, más tarde se reconoció que este metal era una aleación de los elementos niobio y tantalio. [19] El nombre de " neptunio " se le dio más tarde al elemento sintético un paso después del uranio en la tabla periódica, que fue descubierto por investigadores de física nuclear en 1940. [20]
Referencias
- ^ "Pesos atómicos estándar: germanio". CIAAW . 2009.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ "Nuevo tipo de compuesto de estaño de valencia cero". Chemistry Europe . 27 de agosto de 2016.
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Susceptibilidad magnética de los elementos y compuestos inorgánicos, en Handbook of Chemistry and Physics 81.a edición, CRC press.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ abcd "Propiedades del germanio". Instituto Ioffe .
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Avarmaa, Katri; Klemettinen, Lassi; O'Brien, Hugh; Taskinen, Pekka; Jokilaakso, Ari (junio de 2019). "Metales críticos Ga, Ge e In: evidencia experimental de mejoras en la recuperación de fundiciones". Minerales . 9 (6): 367. Bibcode : 2019 Mío....9..367A. doi : 10,3390/min9060367 .
- ^ Kaji, Masanori (2002). «El concepto de elementos químicos de D. I. Mendeleev y los principios de la química» (PDF) . Boletín de Historia de la Química . 27 (1): 4–16. Archivado desde el original (PDF) el 17 de diciembre de 2008. Consultado el 20 de agosto de 2008 .
- ^ Argyrodite – Ag8GeS6 (PDF) (Informe). Mineral Data Publishing. Archivado (PDF) del original el 2016-03-03 . Consultado el 2008-09-01 .
- ^ ABCDE Winkler, Clemens (1887). "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Química (en alemán). 36 (1): 177–209. doi :10.1002/prac.18870360119. Archivado desde el original el 3 de noviembre de 2012 . Consultado el 20 de agosto de 2008 .
- ^ abcd Winkler, Clemens (1887). "germanio, Ge, un nuevo elemento no metálico". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 19 (1): 210–211. doi :10.1002/cber.18860190156. Archivado desde el original el 7 de diciembre de 2008.
- ^ Adams, JC (13 de noviembre de 1846). «Explicación de las irregularidades observadas en el movimiento de Urano, sobre la hipótesis de perturbación por un planeta más distante». Monthly Notices of the Royal Astronomical Society . 7 (9): 149–152. Bibcode :1846MNRAS...7..149A. doi : 10.1093/mnras/7.9.149 . Archivado (PDF) desde el original el 2 de mayo de 2019 . Consultado el 25 de agosto de 2019 .
- ^ Challis, Rev. J. (13 de noviembre de 1846). «Relato de las observaciones en el observatorio de Cambridge para detectar el planeta exterior a Urano». Monthly Notices of the Royal Astronomical Society . 7 (9): 145–149. Bibcode :1846MNRAS...7..145C. doi : 10.1093/mnras/7.9.145 . Archivado (PDF) desde el original el 4 de mayo de 2019 . Consultado el 25 de agosto de 2019 .
- ^ Sears, Robert (julio de 1877). Scientific Miscellany . Vol. 24. pág. 131. ISBN 978-0-665-50166-1.OCLC 16890343 .
{{cite book}}:|journal=ignorado ( ayuda ) - ^ "Editor's Scientific Record". Harper's New Monthly Magazine . 55 (325): 152–153. Junio de 1877. Archivado desde el original el 26 de mayo de 2012 . Consultado el 22 de septiembre de 2008 .
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict: Niobium". Archivado desde el original el 23 de enero de 2010. Consultado el 20 de agosto de 2008 .
- ^ Westgren, A. (1964). «El Premio Nobel de Química 1951: discurso de presentación». Nobel Lectures, Chemistry 1942–1962 . Elsevier. Archivado desde el original el 2008-12-10 . Consultado el 2008-09-18 .
- ^ "Germanio, un nuevo elemento no metálico". The Manufacturer and Builder : 181. 1887. Archivado desde el original el 19 de diciembre de 2008. Consultado el 20 de agosto de 2008 .
- ^ Brunck, O. (1886). "Obituario: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (en alemán). 39 (4): 4491–4548. doi :10.1002/cber.190603904164. Archivado desde el original el 1 de agosto de 2020 . Consultado el 7 de junio de 2020 .
- ^ de Boisbaudran, M. Lecoq (1886). "Sur le poids atomique du germanium". Comptes Rendus (en francés). 103 : 452. Archivado desde el original el 20 de junio de 2013 . Consultado el 20 de agosto de 2008 .
- ^ ab Haller, EE (14 de junio de 2006). "Germanio: desde su descubrimiento hasta los dispositivos SiGe" (PDF) . Departamento de Ciencia e Ingeniería de Materiales, Universidad de California, Berkeley, y División de Ciencias de los Materiales, Laboratorio Nacional Lawrence Berkeley, Berkeley . Archivado (PDF) desde el original el 10 de julio de 2019. Consultado el 22 de agosto de 2008 .
- ^ WK (1953-05-10). «Germanio para dispositivos electrónicos». The New York Times . Archivado desde el original el 2013-06-13 . Consultado el 2008-08-22 .
- ^ "1941 – Los rectificadores de diodos semiconductores sirven en la Segunda Guerra Mundial". Museo de Historia de la Computación. Archivado desde el original el 24 de septiembre de 2008. Consultado el 22 de agosto de 2008 .
- ^ "Historia de SiGe". Universidad de Cambridge. Archivado desde el original el 5 de agosto de 2008. Consultado el 22 de agosto de 2008 .
- ^ abcdef Halford, Bethany (2003). "Germanio". Chemical & Engineering News . Sociedad Química Estadounidense. Archivado desde el original el 13 de mayo de 2008. Consultado el 22 de agosto de 2008 .
- ^ Bardeen, J.; Brattain, WH (1948). "El transistor, un triodo semiconductor". Physical Review . 74 (2): 230–231. Bibcode :1948PhRv...74..230B. doi : 10.1103/PhysRev.74.230 .
- ^ "Historia de la electrónica 4: transistores". Academia Nacional de Ingeniería. Archivado desde el original el 20 de octubre de 2007. Consultado el 22 de agosto de 2008 .
- ^ abcdefghijklmn Servicio Geológico de Estados Unidos (2008). "Germanio: estadísticas e información". Servicio Geológico de Estados Unidos, Resúmenes de productos minerales . Archivado desde el original el 16 de septiembre de 2008. Consultado el 28 de agosto de 2008. Seleccionar
2008
- ^ Teal, Gordon K. (julio de 1976). "Monocristales de germanio y silicio: básicos para transistores y circuitos integrados". IEEE Transactions on Electron Devices . ED-23 (7): 621–639. Bibcode :1976ITED...23..621T. doi :10.1109/T-ED.1976.18464. S2CID 11910543.
- ^ ab Emsley, John (2001). Los bloques de construcción de la naturaleza . Oxford: Oxford University Press. págs. 506–510. ISBN 978-0-19-850341-5.
- ^ Agnese, R.; Aralis, T.; Aramaki, T.; Arnquist, IJ; Azadbakht, E.; Baker, W.; Banik, S.; Barker, D.; Bauer, DA (2018-08-27). "Pérdida de energía debido a la formación de defectos a partir de retrocesos de 206Pb en detectores de germanio SuperCDMS". Applied Physics Letters . 113 (9): 092101. arXiv : 1805.09942 . Código Bibliográfico :2018ApPhL.113i2101A. doi :10.1063/1.5041457. ISSN 0003-6951. S2CID 118627298.
- ^ abcdefghi Holleman, AF; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102ª ed.). de Gruyter. ISBN 978-3-11-017770-1.OCLC 145623740 .
- ^ ab "Germanio". Laboratorio Nacional de Los Álamos. Archivado desde el original el 22 de junio de 2011. Consultado el 28 de agosto de 2008 .
- ^ Chardin, B. (2001). "Materia oscura: detección directa". En Binetruy, B (ed.). El universo primordial: 28 de junio – 23 de julio de 1999. Springer. pág. 308. ISBN 978-3-540-41046-1.
- ^ Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, A. (agosto de 2005). "Superconductividad inducida por campo magnético en el ferroimán URhGe". Science . 309 (5739): 1343–1346. Bibcode :2005Sci...309.1343L. doi :10.1126/science.1115498. PMID 16123293. S2CID 38460998.
- ^ Givargizov, EI (1972). "Morfología de los bigotes de germanio". Kristall und Technik . 7 (1–3): 37–41. doi :10.1002/crat.19720070107.
- ^ Tabet, N; Salim, Mushtaq A. (1998). "Estudio KRXPS de la oxidación de la superficie de Ge(001)". Applied Surface Science . 134 (1–4): 275–282. Código Bibliográfico :1998ApSS..134..275T. doi :10.1016/S0169-4332(98)00251-7.
- ^ abcdefghij Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Tabet, N; Salim, MA; Al-Oteibi, AL (1999). "Estudio XPS de la cinética de crecimiento de películas delgadas obtenidas por oxidación térmica de sustratos de germanio". Journal of Electron Spectroscopy and Related Phenomena . 101–103: 233–238. Bibcode :1999JESRP.101..233T. doi :10.1016/S0368-2048(98)00451-4.
- ^ Xu, Li; Sevov, Slavi C. (1999). "Acoplamiento oxidativo de iones deltaédricos [Ge 9 ] 4− Zintl". J. Am. Chem. Soc . 121 (39): 9245–9246. doi :10.1021/ja992269s.
- ^ Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. (2002). "Viocerámica germanada transparente infrarroja". Revista de la Sociedad Estadounidense de Cerámica . 85 (12): 3114–3116. doi :10.1111/j.1151-2916.2002.tb00594.x.
- ^ Drugoveiko, OP; Evstrop'ev, KK; Kondrat'eva, BS; Petrov, Yu. A.; Shevyakov, AM (1975). "Espectros de reflectancia y transmisión infrarroja del dióxido de germanio y sus productos de hidrólisis". Journal of Applied Spectroscopy . 22 (2): 191–193. Bibcode :1975JApSp..22..191D. doi :10.1007/BF00614256. S2CID 97581394.
- ^ Lightstone, AW; McIntyre, RJ; Lecomte, R.; Schmitt, D. (1986). "Un módulo de fotodiodo de avalancha de germanato de bismuto diseñado para su uso en tomografía por emisión de positrones de alta resolución". IEEE Transactions on Nuclear Science . 33 (1): 456–459. Bibcode :1986ITNS...33..456L. doi :10.1109/TNS.1986.4337142. S2CID 682173.
- ^ Johnson, Otto H. (1952). "Germanio y sus compuestos inorgánicos". Chem . Rev. 51 (3): 431–469. doi :10.1021/cr60160a002.
- ^ Fröba, Michael; Oberender, Nadine (1997). "Primera síntesis de tiogermanatos mesoestructurados". Chemical Communications (18): 1729–1730. doi :10.1039/a703634e.
- ^ Beattie, IR; Jones, PJ; Reid, G.; Webster, M. (1998). "La estructura cristalina y el espectro Raman de Ge 5 Cl 12 ·GeCl 4 y el espectro vibracional de Ge 2 Cl 6 ". Inorg. Chem . 37 (23): 6032–6034. doi :10.1021/ic9807341. PMID 11670739.
- ^ Satge, Jacques (1984). "Intermedios reactivos en la química del organogermanio". Pure Appl. Chem . 56 (1): 137–150. doi : 10.1351/pac198456010137 . S2CID : 96576323.
- ^ Quane, Denis; Bottei, Rudolph S. (1963). "Química del organogermanio". Chemical Reviews . 63 (4): 403–442. doi :10.1021/cr60224a004.
- ^ ab Tao, SH; Bolger, PM (junio de 1997). "Evaluación de riesgos de los suplementos de germanio". Toxicología y farmacología regulatorias . 25 (3): 211–219. doi :10.1006/rtph.1997.1098. PMID 9237323. Archivado desde el original el 2020-03-10 . Consultado el 2019-06-30 .
- ^ Broadwith, Phillip (25 de marzo de 2012). «El doble enlace germanio-oxígeno ocupa un lugar central». Chemistry World . Archivado desde el original el 17 de mayo de 2014. Consultado el 15 de mayo de 2014 .
- ^ abc Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11. 001
- ^ ab Perreault, Bruce A. "Válvula de energía eléctrica de fusión alfa", patente estadounidense 7800286, expedida el 21 de septiembre de 2010. Copia en PDF en Wayback Machine (archivada el 12 de octubre de 2007)
- ^ Sterling, NC; Dinerstein, Harriet L. ; Bowers, Charles W. (2002). "Descubrimiento de abundancias mejoradas de germanio en nebulosas planetarias con el Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters . 578 (1): L55–L58. arXiv : astro-ph/0208516 . Código Bibliográfico :2002ApJ...578L..55S. doi :10.1086/344473. S2CID 119395123.
- ^ Cowan, John (1 de mayo de 2003). "Astronomía: elementos de sorpresa". Nature . 423 (29): 29. Bibcode :2003Natur.423...29C. doi : 10.1038/423029a . PMID 12721614. S2CID 4330398.
- ^ Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, JP; Marten, A.; Chedin, A.; Husson, N.; Scott, N. (1982). "La composición del gas troposférico del cinturón ecuatorial norte de Júpiter /NH 3 , PH 3 , CH 3 D, GeH 4 , H 2 O/ y la relación isotópica D/H joviana". Astrophysical Journal . 263 : 443–467. Bibcode :1982ApJ...263..443K. doi :10.1086/160516.
- ^ abcde Höll, R.; Kling, M.; Schroll, E. (2007). "Metalogénesis del germanio: una revisión". Ore Geology Reviews . 30 (3–4): 145–180. doi :10.1016/j.oregeorev.2005.07.034.
- ^ Frenzel, Max (2016). «La distribución de galio, germanio e indio en recursos convencionales y no convencionales: implicaciones para la disponibilidad global (Descarga en PDF disponible)». ResearchGate . Sin publicar. doi :10.13140/rg.2.2.20956.18564. Archivado desde el original el 2018-10-06 . Consultado el 2017-06-10 .
- ^ Roberts, Andrew C.; et al. (diciembre de 2004). "Eyselita, Fe3+Ge34+O7(OH), una nueva especie mineral de Tsumeb, Namibia". The Canadian Mineralogist . 42 (6): 1771–1776. Bibcode :2004CaMin..42.1771R. doi :10.2113/gscanmin.42.6.1771.
- ^ "Copia archivada" (PDF) . Archivado (PDF) desde el original el 2018-10-06 . Consultado el 2018-10-06 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ "Copia archivada" (PDF) . Archivado (PDF) desde el original el 20 de marzo de 2020 . Consultado el 6 de octubre de 2018 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ ab Goldschmidt, VM (1930). "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse : 141–167. Archivado desde el original el 3 de marzo de 2018 . Consultado el 25 de agosto de 2008 .
- ^ ab Goldschmidt, VM; Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse : 141–167. Archivado desde el original el 1 de diciembre de 2008 . Consultado el 25 de agosto de 2008 .
- ^ Bernstein, L (1985). "Geoquímica y mineralogía del germanio". Geochimica et Cosmochimica Acta . 49 (11): 2409–2422. Código Bibliográfico :1985GeCoA..49.2409B. doi :10.1016/0016-7037(85)90241-8.
- ^ Frenzel, Max; Hirsch, Tamino; Gutzmer, Jens (julio de 2016). "Galio, germanio, indio y otros elementos menores y traza en la esfalrita en función del tipo de depósito: un metaanálisis". Ore Geology Reviews . 76 : 52–78. Bibcode :2016OGRv...76...52F. doi :10.1016/j.oregeorev.2015.12.017.
- ^
- Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (2013-12-29). "Sobre la disponibilidad geológica del germanio". Mineralium Deposita . 49 (4): 471–486. Bibcode :2014MinDe..49..471F. doi :10.1007/s00126-013-0506-z. ISSN 0026-4598. S2CID 129902592.
- Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (19 de enero de 2014). "Fe de erratas de: Sobre la disponibilidad geológica del germanio". Mineralium Deposita . 49 (4): 487. Bibcode :2014MinDe..49..487F. doi : 10.1007/s00126-014-0509-4 . ISSN 0026-4598. S2CID 140620827.
- ^ RN Soar (1977). Información sobre minerales del USGS. Enero de 2003, enero de 2004, enero de 2005, enero de 2006, enero de 2007, enero de 2010. ISBN 978-0-85934-039-7. OCLC 16437701. Archivado desde el original el 7 de mayo de 2013. Consultado el 22 de abril de 2013 .
{{cite book}}:|journal=ignorado ( ayuda ) - ^ abc Naumov, AV (2007). "El mercado mundial del germanio y sus perspectivas". Revista rusa de metales no ferrosos . 48 (4): 265–272. doi :10.3103/S1067821207040049. S2CID 137187498.
- ^ ab Moskalyk, RR (2004). "Revisión del procesamiento de germanio en todo el mundo". Ingeniería de minerales . 17 (3): 393–402. Código Bibliográfico :2004MiEng..17..393M. doi :10.1016/j.mineng.2003.11.014.
- ^ "Germanio (Ge) | AMERICAN ELEMENTS ®". American Elements: The Materials Science Company . Consultado el 4 de octubre de 2024 .
- ^ Rieke, GH (2007). "Matrices de detectores infrarrojos para astronomía". Revista anual de astronomía y astrofísica . 45 (1): 77–115. Bibcode :2007ARA&A..45...77R. doi :10.1146/annurev.astro.44.051905.092436. S2CID 26285029.
- ^ abc Brown, Robert D. Jr. (2000). "Germanio" (PDF) . Servicio Geológico de Estados Unidos. Archivado (PDF) desde el original el 8 de junio de 2011. Consultado el 22 de septiembre de 2008 .
- ^ "Capítulo III: Fibra óptica para comunicaciones" (PDF) . Stanford Research Institute. Archivado (PDF) desde el original el 5 de diciembre de 2014. Consultado el 22 de agosto de 2008 .
- ^ "Understanding Recordable & Rewritable DVD" (PDF) (Primera edición). Asociación de Tecnología de Almacenamiento Óptico (OSTA). Archivado desde el original (PDF) el 2009-04-19 . Consultado el 2008-09-22 .
- ^ Lettington, Alan H. (1998). "Aplicaciones de películas delgadas de carbono tipo diamante". Carbon . 36 (5–6): 555–560. Código Bibliográfico :1998Carbo..36..555L. doi :10.1016/S0008-6223(98)00062-1.
- ^ Gardos, Michael N.; Bonnie L. Soriano; Steven H. Propst (1990). Feldman, Albert; Holly, Sandor (eds.). "Estudio sobre la correlación de la resistencia a la erosión por lluvia con la resistencia a la abrasión por deslizamiento de DLC sobre germanio". Proc. SPIE . Actas del SPIE. 1325 (Propiedades mecánicas): 99. Bibcode :1990SPIE.1325...99G. doi :10.1117/12.22449. S2CID 137425193.
- ^ Washio, K. (2003). "Tecnologías SiGe HBT y BiCMOS para sistemas de transmisión óptica y comunicación inalámbrica". IEEE Transactions on Electron Devices . 50 (3): 656–668. Bibcode :2003ITED...50..656W. doi :10.1109/TED.2003.810484.
- ^ Bailey, Sheila G.; Raffaelle, Ryne; Emery, Keith (2002). "Energía fotovoltaica espacial y terrestre: sinergia y diversidad". Progreso en energía fotovoltaica: investigación y aplicaciones . 10 (6): 399–406. Bibcode :2002sprt.conf..202B. doi :10.1002/pip.446. hdl : 2060/20030000611 . S2CID 98370426.
- ^ Crisp, D.; Pathare, A.; Ewell, RC (enero de 2004). "El rendimiento de las células solares de arseniuro de galio/germanio en la superficie marciana". Acta Astronautica . 54 (2): 83–101. Código Bibliográfico :2004AcAau..54...83C. doi :10.1016/S0094-5765(02)00287-4.
- ^ Wu, Heng; Ye, Peide D. (agosto de 2016). "Dispositivos CMOS Ge completamente agotados y circuitos lógicos en Si" (PDF) . IEEE Transactions on Electron Devices . 63 (8): 3028–3035. Bibcode :2016ITED...63.3028W. doi :10.1109/TED.2016.2581203. S2CID 3231511. Archivado (PDF) desde el original el 2019-03-06 . Consultado el 2019-03-04 .
- ^ Szweda, Roy (2005). "Germanio fénix". III-Vs Review . 18 (7): 55. doi :10.1016/S0961-1290(05)71310-7.
- ^ Zhao, H.; Xue, Z.; et al. (21 de julio de 2022). "Electrónica de germanio biodegradable para la biodetección integrada de señales fisiológicas". npj Flexible Electronics . 6 . 63. doi : 10.1038/s41528-022-00196-2 . S2CID 250702946.
- ^ ab Thiele, Ulrich K. (2001). "El estado actual de la catálisis y el desarrollo de catalizadores para el proceso industrial de policondensación de poli(tereftalato de etileno)". Revista internacional de materiales poliméricos . 50 (3): 387–394. doi :10.1080/00914030108035115. S2CID 98758568.
- ^ Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul (2007). "Recubrimientos orgánicos-inorgánicos híbridos sol-gel basados en Germania para microextracción capilar y cromatografía de gases". Anal. Química . 79 (24): 9441–9451. doi :10.1021/ac071056f. PMID 17994707.
- ^ Keyser, Ronald; Twomey, Timothy; Upp, Daniel. "Rendimiento de detectores de germanio de alta pureza, livianos y que funcionan con baterías para uso en campo" (PDF) . Oak Ridge Technical Enterprise Corporation (ORTEC). Archivado desde el original (PDF) el 26 de octubre de 2007 . Consultado el 6 de septiembre de 2008 .
- ^ Ahmed, FU; Yunus, SM; Kamal, I.; Begum, S.; Khan, Aysha A.; Ahsan, MH; Ahmad, AAZ (1996). "Optimización de germanio para difractómetros de neutrones". Revista Internacional de Física Moderna E . 5 (1): 131–151. Código Bibliográfico :1996IJMPE...5..131A. doi :10.1142/S0218301396000062.
- ^ Diehl, R.; Prantzos, N.; Vonballmoos, P. (2006). "Restricciones astrofísicas de la espectroscopia de rayos gamma". Física nuclear A . 777 (2006): 70–97. arXiv : astro-ph/0502324 . Código Bibliográfico :2006NuPhA.777...70D. CiteSeerX 10.1.1.256.9318 . doi :10.1016/j.nuclphysa.2005.02.155. S2CID 2360391.
- ^ Eugene P. Bertin (1970). Principios y práctica del análisis espectrométrico de rayos X , Capítulo 5.4 – Cristales analizadores, Tabla 5.1, pág. 123; Plenum Press
- ^ Shen, C.; Trypiniotis, T.; Lee, KY; Holmes, SN; Mansell, R.; Husain, M.; Shah, V.; Li, XV; Kurebayashi, H. (18 de octubre de 2010). "Transporte de espín en germanio a temperatura ambiente" (PDF) . Applied Physics Letters . 97 (16): 162104. Bibcode :2010ApPhL..97p2104S. doi :10.1063/1.3505337. ISSN 0003-6951. Archivado (PDF) desde el original el 22 de septiembre de 2017 . Consultado el 16 de noviembre de 2018 .
- ^ Sigillito, AJ; Jock, RM; Tyryshkin, AM; Beeman, JW; Haller, EE; Itoh, KM; Lyon, SA (7 de diciembre de 2015). "Coherencia de espín electrónico de donantes superficiales en germanio natural e isotópicamente enriquecido". Physical Review Letters . 115 (24): 247601. arXiv : 1506.05767 . Código Bibliográfico :2015PhRvL.115x7601S. doi :10.1103/PhysRevLett.115.247601. PMID 26705654. S2CID 13299377.
- ^ China restringe las exportaciones de dos metales que la UE considera de importancia "estratégica", Euronews, 4 de julio de 2023.
- ^ China contraataca en la guerra de los chips, imponiendo restricciones a la exportación de materias primas cruciales, CNN, 3 de julio de 2023.
- ^ China restringirá las exportaciones de materiales para la fabricación de chips mientras Estados Unidos evalúa nuevas restricciones, Reuters, 4 de julio de 2023.
- ^ "Una empresa rusa dice estar dispuesta a aumentar la producción de germanio para uso doméstico". Reuters. 5 de julio de 2023. Archivado desde el original el 24 de julio de 2023. Consultado el 9 de julio de 2023 .
- ^ ab Ades TB, ed. (2009). "Germanio". Guía completa de terapias alternativas y complementarias contra el cáncer de la Sociedad Estadounidense del Cáncer (2.ª ed.). Sociedad Estadounidense del Cáncer. págs. 360–363. ISBN 978-0944235713.
- ^ Brown, Robert D. Jr. Commodity Survey:Germanium (PDF) (Informe). Servicio Geológico de Estados Unidos. Archivado (PDF) desde el original el 4 de marzo de 2018. Consultado el 9 de septiembre de 2008 .
- ^ Baselt, R. (2008). Disposición de fármacos y sustancias químicas tóxicas en el hombre (8.ª ed.). Foster City, CA: Biomedical Publications. págs. 693–694.
- ^ Gerber, GB; Léonard, A. (1997). "Mutagenicidad, carcinogenicidad y teratogenicidad de compuestos de germanio". Toxicología y farmacología regulatorias . 387 (3): 141–146. Bibcode :1997MRRMR.387..141G. doi :10.1016/S1383-5742(97)00034-3. PMID 9439710.
Enlaces externos
- Germanio en la tabla periódica de vídeos (Universidad de Nottingham)







