Trifosfato de sodio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Trifosfato de pentasodio | |
| Otros nombres Tripolifosfato de sodio, polígono, STPP | |
| Identificadores | |
| Tarjeta informativa de la ECHA | 100.028.944 |
| Número E | E451 (espesantes, ...) |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| Propiedades | |
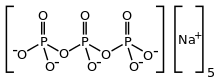
| Na5P3O10 | |
| Masa molar | 367,864 g/mol |
| Apariencia | polvo blanco |
| Densidad | 2,52 g/ cm3 |
| Punto de fusión | 622 °C (1152 °F; 895 K) |
| 14,5 g/100 ml (25 °C) | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Ficha de datos de seguridad (FDS) | ICSC 1469 |
| Compuestos relacionados | |
Otros aniones | Fosfato trisódico Pirofosfato tetrasódico Hexametafosfato de sodio |
Otros cationes | Trifosfato de pentapotasio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El trifosfato de sodio (STP), también tripolifosfato de sodio (STPP), o tripolifosfato (TPP), [1] ) es un compuesto inorgánico con fórmula Na 5 P 3 O 10 . Es la sal sódica del pentaanión polifosfato , que es la base conjugada del ácido trifosfórico . Se produce a gran escala como componente de muchos productos domésticos e industriales, especialmente detergentes. Los problemas ambientales asociados con la eutrofización se atribuyen a su uso generalizado. [2]
Preparación y propiedades
El tripolifosfato de sodio se produce calentando una mezcla estequiométrica de fosfato disódico , Na 2 HPO 4 , y fosfato monosódico , NaH 2 PO 4 , en condiciones cuidadosamente controladas. [2]
- 2 Na 2 HPO 4 + NaH 2 PO 4 → Na 5 P 3 O 10 + 2 H 2 O
De esta manera se producen aproximadamente 2 millones de toneladas anuales. [3]
El STPP es una sal incolora que existe tanto en forma anhidra como en hexahidrato. El anión puede describirse como la cadena pentaniónica [O 3 POP(O) 2 OPO 3 ] 5− . [4] [5] Se conocen muchos di-, tri- y polifosfatos relacionados, incluido el trifosfato cíclico (por ejemplo, trimetafosfato de sodio ). Se une fuertemente a los cationes metálicos como agente quelante bidentado y tridentado .

Usos
Detergentes
La mayor parte del STPP se consume como componente de detergentes comerciales . Sirve como "constructor", término que en la jerga industrial se utiliza para referirse a un ablandador de agua. En agua dura (agua que contiene altas concentraciones de Mg 2+ y Ca 2+ ), los detergentes se desactivan. Al ser un agente quelante altamente cargado , el TPP 5− se une firmemente a los dicamentos y evita que interfieran con el detergente de sulfonato. [3]
Alimento
El STPP es un conservante para mariscos, carnes, aves y alimentos para animales . [3] Es común en la producción de alimentos como número E E451 . En los alimentos, el STPP se utiliza como emulsionante y para retener la humedad. Muchos gobiernos regulan las cantidades permitidas en los alimentos, ya que puede aumentar sustancialmente el peso de venta de los mariscos en particular. La Administración de Alimentos y Medicamentos de los Estados Unidos clasifica al STPP como generalmente reconocido como seguro . [6]
Otro
Otros usos (cientos de miles de toneladas/año) incluyen cerámica (disminución de la viscosidad de los esmaltes hasta un cierto límite), curtido de cuero (como agente enmascarador y agente curtiente sintético - SYNTAN), agentes antiaglomerantes , retardadores de fraguado, retardantes de llama , papel , pigmentos anticorrosión , textiles , fabricación de caucho , fermentación , anticongelante ". [3] El TPP se utiliza como reticulante de polianiones en la administración de fármacos a base de polisacáridos . [7] La pasta de dientes puede contener trifosfato de sodio. [8] [9] [10] [11] [12] [13] [14]
Efectos sobre la salud
Se ha identificado que una concentración elevada de fosfato sérico es un predictor de eventos cardiovasculares y mortalidad. Si bien el fosfato está presente en el cuerpo y en los alimentos en formas orgánicas, las formas inorgánicas de fosfato, como el trifosfato de sodio, se adsorben fácilmente y pueden dar lugar a niveles elevados de fosfato en suero. [15] Las sales de aniones de polifosfato son moderadamente irritantes para la piel y las membranas mucosas porque son ligeramente alcalinas. [1]
Efectos ambientales
Debido a que es muy soluble en agua , el STPP no se elimina significativamente mediante el tratamiento de aguas residuales . El STPP se hidroliza a fosfato , que se asimila en el ciclo natural del fósforo . Los detergentes que contienen fósforo contribuyen a la eutrofización de muchas aguas dulces. [1]

Véase también
- Trimetafosfato de sodio , un trifosfato cíclico
Referencias
- ^ abc Agentes complejantes, Evaluación ambiental y sanitaria de sustancias en detergentes domésticos y productos detergentes cosméticos, Agencia de Protección Ambiental de Dinamarca Archivado el 24 de agosto de 2017 en Wayback Machine , consultado el 15 de julio de 2008
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ abcd Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Ácido fosfórico y fosfatos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.S2CID 94458523 .
- ^ Corbridge, DEC (1 de marzo de 1960). "La estructura cristalina del trifosfato de sodio, Na 5 P 3 O 10 , fase I". Acta Crystallographica . 13 (3): 263–269. Código Bibliográfico :1960AcCry..13..263C. doi :10.1107/S0365110X60000583.
- ^ Davies, DR; Corbridge, DEC (1 de mayo de 1958). "La estructura cristalina del trifosfato de sodio, Na5P3O10, fase II". Acta Crystallographica . 11 (5): 315–319. Código Bibliográfico :1958AcCry..11..315D. doi : 10.1107/S0365110X58000876 .
- ^ "Sustancias añadidas a los alimentos (antes EAFUS)".
- ^ Calvo, P.; Remuñán-López, C.; Vila-Jato, JL; Alonso, MJ (3 de enero de 1997). "Nuevas nanopartículas hidrófilas de quitosano y óxido de polietileno como portadores de proteínas". Journal of Applied Polymer Science . 63 (1): 125–132. doi :10.1002/(SICI)1097-4628(19970103)63:1<125::AID-APP13>3.0.CO;2-4.
- ^ Saxton, CA; Ouderaa, FJG (enero de 1989). "El efecto de un dentífrico que contiene citrato de zinc y triclosán en el desarrollo de la gingivitis". Journal of Periodontal Research . 24 (1): 75–80. doi :10.1111/j.1600-0765.1989.tb00860.x. PMID 2524573.
- ^ Lobene, RR; Weatherford, T; Ross, NM; Lamm, RA; Menaker, L (1986). "Un índice gingival modificado para su uso en ensayos clínicos". Odontología preventiva clínica . 8 (1): 3–6. PMID 3485495.
- ^ Lobene, RR; Soparkar, PM; Newman, MB (1982). "Uso de hilo dental. Efecto sobre la placa y la gingivitis". Odontología preventiva clínica . 4 (1): 5–8. PMID 6980082.
- ^ Mankodi, Suru; Bartizek, Robert D.; Leslie Winston, J.; Biesbrock, Aaron R.; McClanahan, Stephen F.; He, Tao (enero de 2005). "Eficacia antigingivitis de un dentífrico estabilizado con fluoruro de estaño al 0,454 %/hexametafosfato de sodio. Un ensayo clínico controlado de 6 meses". Revista de Periodontología Clínica . 32 (1): 75–80. doi : 10.1111/j.1600-051X.2004.00639.x . PMID 15642062.
- ^ Mankodi, S; Petrone, DM; Battista, G; Petrone, ME; Chaknis, P; DeVizio, W; Volpe, AR; Proskin, HM (1997). "Eficacia clínica de un dentífrico optimizado con fluoruro de estaño, Parte 2: Un estudio clínico de 6 meses sobre placa/gingivitis, noreste de EE. UU." Compendio de educación continua en odontología . 18 N.º de especificación: 10–5. PMID 12206029.
- ^ Mallatt, Mark; Mankodi, Suru; Bauroth, Karen; Bsoul, Samer A.; Bartizek, Robert D.; He, Tao (septiembre de 2007). "Un ensayo clínico controlado de 6 meses para estudiar los efectos de un dentífrico con fluoruro de estaño sobre la gingivitis". Journal of Clinical Periodontology . 34 (9): 762–767. doi :10.1111/j.1600-051X.2007.01109.x. PMID 17645550.
- ^ Lang, Niklaus P. (1990). "Epidemiología de la enfermedad periodontal". Archivos de Biología Oral . 35 : S9–S14. doi :10.1016/0003-9969(90)90125-t. PMID 2088238.
- ^ Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martín K; Mann, Johannes (2012). "Los aditivos de fosfato en los alimentos: un riesgo para la salud". Deutsches Ärzteblatt Internacional . 109 (4): 49–55. doi :10.3238/arztebl.2012.0049. PMC 3278747 . PMID 22334826.



