Efecto anomérico
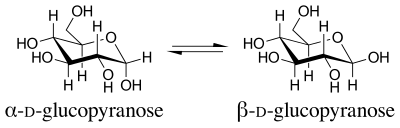
En química orgánica , el efecto anomérico o efecto Edward-Lemieux (en honor a JT Edward y Raymond Lemieux ) es un efecto estereoelectrónico que describe la tendencia de los sustituyentes heteroatómicos adyacentes a un heteroátomo dentro de un anillo de ciclohexano a preferir la orientación axial en lugar de la orientación ecuatorial menos obstaculizada que se esperaría a partir de consideraciones estéricas . [1] Este efecto fue observado originalmente en anillos de piranosa por JT Edward en 1955 cuando estudiaba la química de los carbohidratos .
El término efecto anomérico se introdujo en 1958. [2] El nombre proviene del término utilizado para designar el carbono de anillo de menor número de una piranosa, el carbono anomérico . Los isómeros que difieren solo en la configuración en el carbono anomérico se denominan anómeros . Los anómeros de la D -glucopiranosa son diastereómeros , con el anómero beta que tiene un grupo hidroxilo ( −OH ) apuntando hacia arriba ecuatorialmente, y el anómero alfa que tiene ese grupo ( −OH ) apuntando hacia abajo axialmente.
El efecto anomérico también se puede generalizar a cualquier sistema ciclohexílico o lineal con la fórmula general C−Y−C−X , donde Y es un heteroátomo con uno o más pares solitarios y X es un átomo o grupo electronegativo . [3] La magnitud del efecto anomérico se estima en 4-8 kJ/mol en el caso de los azúcares, pero es diferente para cada molécula.

En el caso anterior, el grupo metoxi −O−CH 3 ) en el anillo de ciclohexano (arriba) prefiere la posición ecuatorial. Sin embargo, en el anillo de tetrahidropirano (abajo), el grupo metoxi prefiere la posición axial. Esto se debe a que en el anillo de ciclohexano, Y = carbono, que no es un heteroátomo, por lo que no se observa el efecto anomérico y la estérica domina la posición del sustituyente observada. En el anillo de tetrahidropirano, Y = oxígeno, que es un heteroátomo, por lo que el efecto anomérico contribuye y estabiliza la posición del sustituyente observada. En ambos casos, X = grupo metoxi.
El efecto anomérico se observa con mayor frecuencia cuando Y = oxígeno, pero también se puede ver con otros heteroátomos que contienen pares solitarios en el anillo, como nitrógeno, azufre y fósforo. [4] El método exacto por el cual el efecto anomérico causa estabilización es un punto de controversia, y se han propuesto varias hipótesis para explicarlo.
Explicación física y controversia
La razón física del efecto anomérico no se entiende por completo. Se han ofrecido varias explicaciones, en parte contradictorias, y el tema aún no está resuelto. [5]
Hiperconjugación
Moléculas cíclicas
Una explicación ampliamente aceptada es que existe una interacción estabilizadora ( hiperconjugación ) entre el par de electrones no compartido en el heteroátomo endocíclico (dentro del anillo de azúcar) y el orbital σ* del enlace axial (exocíclico) C–X. [6] Esto hace que la molécula alinee el par solitario de electrones donante antiperiplanar (180°) al enlace σ CX exocíclico, lo que reduce la energía general del sistema y provoca más estabilidad. [7]

Algunos autores también cuestionan la validez de este modelo de hiperconjugación basándose en los resultados de la teoría cuántica de átomos en moléculas . [8] Si bien la mayoría de los estudios sobre los efectos anoméricos han sido de naturaleza teórica, la hipótesis n–σ* (hiperconjugación) también ha sido ampliamente criticada sobre la base de que la redistribución de la densidad electrónica en acetales propuesta por esta hipótesis no es congruente con la química experimental conocida de los acetales y, en particular, la química de los monosacáridos. [9] [10]
Moléculas acíclicas
La hiperconjugación también se encuentra en moléculas acíclicas que contienen heteroátomos, otra forma del efecto anomérico. Si una molécula tiene un átomo con un par solitario de electrones y el átomo adyacente puede aceptar electrones en el orbital σ*, se produce la hiperconjugación, estabilizando la molécula. Esto forma una forma de resonancia de "sin enlace". Para que se produzca esta superposición orbital, la conformación trans , trans es la preferida para la mayoría de los heteroátomos, sin embargo, para que se produzca la estabilización en dimetoximetano , la conformación gauche , gauche es aproximadamente 3-5 kcal/mol menor en energía (más estable) que la conformación trans , trans ; esto es aproximadamente dos veces más grande que el efecto en los azúcares porque hay dos enlaces rotativos (por lo tanto, es trans alrededor de ambos enlaces o gauche alrededor de ambos) que se ven afectados. [11]

Minimización de dipolos
Otra explicación aceptada para el efecto anomérico es que la configuración ecuatorial tiene los dipolos que involucran a ambos heteroátomos parcialmente alineados y, por lo tanto, se repelen entre sí. [12] Por el contrario, la configuración axial tiene estos dipolos aproximadamente opuestos, lo que representa un estado de energía más estable y más bajo.

Tanto la hiperconjugación como la minimización del dipolo contribuyen a la conformación (Z) preferida de los ésteres sobre la conformación (E). En la conformación (Z), el par solitario de electrones en el oxígeno alfa puede donarse al orbital σ* de CO vecino. Además, el dipolo se minimiza en la conformación (Z) y se maximiza en la conformación (E). [7]

Repulsiones nn y enlaces de hidrógeno CH
Si se muestran los pares de electrones solitarios en los oxígenos en el centro anomérico del 2-metoxipirano, entonces un breve examen de las conformaciones de los anómeros revela que el anómero β siempre tiene al menos un par de pares solitarios eclipsantes (que interactúan coplanarmente en 1,3); esta repulsión nn es una situación de alta energía. Por otro lado, el anómero α tiene conformaciones en las que no hay repulsiones nn, y eso es cierto en la conformación exoanomérica. Se ha sugerido [referencias 7 y 8] que la repulsión nn energéticamente desfavorable presente en el anómero β, junto con el enlace de hidrógeno energéticamente favorable entre el H-5 axial y un par de electrones solitarios en el sustituyente α-anomérico axial (enlace de hidrógeno CH/n), explica la mayor parte de la diferencia energética entre los anómeros, el efecto anomérico. El programa de mecánica molecular StruMM3D, que no está especialmente parametrizado para el efecto anomérico, estima que las contribuciones dipolares al efecto anomérico (principalmente la repulsión nn y el enlace de hidrógeno CH analizados anteriormente) son de aproximadamente 1,5 kcal/mol.
Influencias
Si bien el efecto anomérico es una explicación general de este tipo de estabilización de una molécula, el tipo y la cantidad de estabilización pueden verse afectados por los sustituyentes examinados, así como por el solvente estudiado.
Efecto sustituyente
En un sistema cerrado, se observa una diferencia en el efecto anomérico para diferentes sustituyentes en un anillo de ciclohexano o tetrahidropirano (Y=Oxígeno). Cuando X=OH, se puede observar el efecto anomérico genérico, como se explicó anteriormente. Cuando X=CN, se observan los mismos resultados, donde se prefiere la posición ecuatorial en el anillo de ciclohexano, pero se prefiere la posición axial en el anillo de tetrahidropirano. Esto es consistente con la estabilización del efecto anomérico. Cuando X=F, el efecto anomérico se observa de hecho para ambos anillos. Sin embargo, cuando X=NH2 , no se observa estabilización del efecto anomérico y ambos sistemas prefieren la posición ecuatorial. Esto se atribuye tanto a la estérica como a un efecto llamado efecto anomérico inverso (ver a continuación). [3]
Efecto disolvente
Una crítica común a la teoría de la hiperconjugación es que no explica por qué no se observa el efecto anomérico cuando las moléculas de tetrahidropirano sustituidas se colocan en disolventes polares y se prefiere nuevamente la posición ecuatorial. Sin embargo, se ha demostrado que la hiperconjugación depende del disolvente en el sistema. Cada uno de los sistemas sustituidos descritos anteriormente se probaron en fase gaseosa (es decir, sin disolvente) y en solución acuosa (es decir, disolvente polar). Cuando X = F, se observó el efecto anomérico en ambos medios y siempre se prefirió la posición axial. Esto se atribuye a la hiperconjugación. Cuando X = OH o CN, se observó el efecto anomérico en la fase gaseosa, cuando se prefirió la posición axial. Sin embargo, en soluciones acuosas, ambos sustituyentes prefirieron la posición ecuatorial. Esto se atribuye al hecho de que hay más repulsiones electrostáticas con el sustituyente posicionado axialmente y el disolvente polar, lo que hace que se prefiera la posición ecuatorial. Cuando X=NH 2 , nuevamente no se observó ningún efecto anomérico y siempre se prefirió la posición ecuatorial. [13]
Superando el efecto anomérico
Si bien el efecto anomérico puede provocar la estabilización de las moléculas, su estabilización tiene una magnitud que puede ser superada por otros efectos más desestabilizadores en algunos casos.
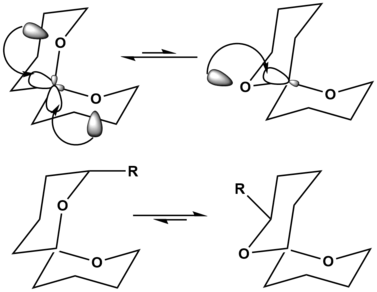
En el ejemplo de los espirocetales, la orientación de la parte superior izquierda muestra la estabilización por el efecto anomérico hiperconjugativo dos veces, lo que estabiliza en gran medida la orientación de la molécula. La orientación de la parte superior derecha solo muestra esta estabilización anomérico hiperconjugativo una vez, lo que hace que sea la estructura menos preferida. Sin embargo, cuando se añaden sustituyentes a la cadena principal del espirocetal, la estructura más preferida puede cambiar. Cuando se añade un sustituyente grande a la cadena principal del espirocetal, como se ve en la parte inferior izquierda, la tensión de tener este sustituyente grande, R, en la posición axial es muy desestabilizadora para la molécula. En la molécula de la parte inferior derecha, R está ahora en la posición ecuatorial, lo que ya no provoca desestabilización en la molécula. Por lo tanto, sin sustituyentes, la reacción de equilibrio superior se favorece en el lado izquierdo, mientras que el equilibrio inferior se favorece en el lado derecho, simplemente por la adición de un sustituyente grande y desestabilizador. [14]
Efecto exoanomérico
Una extensión del efecto anomérico, el efecto exomérico es la preferencia de los sustituyentes que salen de un anillo para adoptar la conformación gauche, mientras que los estéricos sugerirían que se preferiría una conformación antiperiplanar.

Un ejemplo de esto es el 2-metoxitetrahidropirano. Como predice el efecto anomérico, el sustituyente metoxi muestra una mayor preferencia por la conformación axial. Sin embargo, en realidad hay más de una conformación axial posible debido a la rotación alrededor del enlace CO entre el sustituyente metoxi y el anillo. Cuando se aplican los principios del efecto anomérico inverso, se puede predecir que se prefiere el confórmero gauche, lo que sugiere que la conformación superior izquierda es la mejor en la figura anterior. Esta predicción está respaldada por evidencia experimental. Además, esta preferencia por la posición gauche todavía se observa en la conformación ecuatorial. [15]
Efecto anomérico inverso
Este término se refiere a la aparente preferencia de los sustituyentes de nitrógeno cargados positivamente por la conformación ecuatorial más allá de lo que predecirían las interacciones estéricas normales en anillos que contienen un átomo electronegativo, como el oxígeno. No se observa que los sustituyentes que contienen carbonos con cargas positivas parciales exhiban el mismo efecto. [16] Las explicaciones teóricas para el efecto anomérico inverso incluyen una explicación electrostática y la deslocalización de los electrones sp 3 del par solitario de carbono y oxígeno anomérico. [17] Existe cierto debate sobre si este es o no un fenómeno real. Los sustituyentes que contienen nitrógeno con los que se ha informado son bastante voluminosos, lo que dificulta separar los efectos normales del volumen estérico y el efecto anomérico inverso, si existe. [18] Por ejemplo, en la molécula que se muestra a continuación, el sustituyente piridinio prefiere fuertemente la posición ecuatorial, como predecirían los factores estéricos, pero en realidad muestra una preferencia más fuerte por esta conformación de lo predicho, lo que sugiere que el efecto anomérico inverso está contribuyendo.

Efecto metaloanomérico
Los metales de transición tardía de los grupos 10, 11 y 12, cuando se colocan en el carbono anomérico, muestran fuertes preferencias axiales. [19] Este fenómeno, denominado efecto metaloanomérico, se origina a partir de interacciones hiperconjugativas estabilizadoras entre oxígeno u otros heteroátomos con pares solitarios y orbitales antienlazantes CM que actúan como buenos aceptores. El efecto metaloanomérico generalizado se refiere a la estabilización termodinámica de los confórmeros sinclinales de compuestos con la fórmula general M-CH 2 -OR. Las preferencias axiales/ecuatoriales pueden verse influenciadas por ligandos unidos al metal y la configuración electrónica. En términos generales, al pasar de un elemento más ligero a uno más pesado en el grupo, la magnitud del efecto metaloanomérico aumenta. Además, los estados de oxidación más altos favorecen los confórmeros axiales/sinclinales.
Aplicaciones sintéticas
El efecto anomérico se tiene en cuenta sintéticamente. Debido a su descubrimiento en los azúcares, la química de los azúcares y los carbohidratos es uno de los usos sintéticos más comunes del efecto anomérico. Por ejemplo, la glicosidación de Koenigs-Knorr instala un grupo α-OR o β-OR en alta diastereoselectividad que se ve afectada por el efecto anomérico. La lactona soforolipídica , la (+)-lepicidina A y la (−)-litospermósida son algunos de los productos sintetizados a través de la glicosidación de Koenigs-Knorr que superan el efecto anomérico. [20]

Véase también
- Estereoquímica de los alcanos
- Anómero
- Conformación de carbohidratos
- Isomería conformacional
- Conformación del ciclohexano
- Efecto gauche
- Fuerzas intramoleculares
- Monosacárido
- Raymond Lemieux
- Efectos estéricos
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (1996) "Efecto anomérico". doi :10.1351/goldbook.A00372
- ^ Juaristi, E.; Cuevas, G. (1992). "Estudios recientes del efecto anomérico". Tetrahedron . 48 (24): 5019–5087. doi :10.1016/S0040-4020(01)90118-8.
- ^ ab Bauerfeldt, Glauco F.; Cardozo, Thiago M.; Pereira, Márcio S.; da Silva, Clarissa O. (1 de enero de 2013). "El efecto anomérico: el predominio de los efectos de intercambio en sistemas de capa cerrada". Química orgánica y biomolecular . 11 (2): 299–308. doi :10.1039/c2ob26818c. PMID 23172415.
- ^ Kirby, Anthony J. (1983). El efecto anomérico y los efectos estereoelectrónicos relacionados en el oxígeno; con 24 tablas . Berlín [ua]: Springer. ISBN 978-0-387-11684-6.
- ^ "Blog del Mundo de la Química » Argumento anomérico". Archivado desde el original el 16 de mayo de 2019. Consultado el 13 de septiembre de 2013 .
- ^ Sundberg, Francis A. Carey; Richard J. (2007). Química orgánica avanzada: Parte A: Estructura y mecanismos (5.ª ed.). Berlín: Springer US. pág. 229. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ ab Cuevas, Eusebio Juaristi, Gabriel (1995). El efecto anomérico . Boca Ratón: CRC Press. ISBN 978-0-8493-8941-2.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Vila, A.; Mosquera, RA (2007). "Interpretación del efecto anomérico en la unidad O—C—O por átomos en moléculas". J. Comput. Chem. 28 (9): 1516–1530. doi :10.1002/jcc.20585. PMID 17330885. S2CID 19238371.
- ^ Box, VGS (1990). "El papel de las interacciones de pares solitarios en la química de los monosacáridos. El efecto anomérico". Heterocycles . 31 (6): 1157–1181. doi : 10.3987/REV-90-414 .
- ^ Box, VGS (1991). "El papel de las interacciones de pares solitarios en la química de los monosacáridos. Efectos estereoelectrónicos en monosacáridos insaturados". Heterocycles . 32 (4): 795–807. doi : 10.3987/REV-91-425 .
- ^ Sundberg, Francis A. Carey; Richard J. (2007). Química orgánica avanzada: Parte A: Estructura y mecanismos (5.ª ed.). Berlín: Springer US. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Sundberg, Francis A. Carey; Richard J. (2007). Química orgánica avanzada: Parte A: Estructura y mecanismos (5.ª ed.). Berlín: Springer US. págs. 229–230. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Freitas, Matheus P. (1 de enero de 2013). "El efecto anomérico sobre la base del análisis de orbitales de enlace natural". Química orgánica y biomolecular . 11 (17): 2885–90. doi :10.1039/c3ob40187a. PMID 23515623.
- ^ Perron, Francoise; Albizati, Kim F. (1 de noviembre de 1989). "Química de los espirocetales". Chemical Reviews . 89 (7): 1617–1661. doi :10.1021/cr00097a015.
- ^ Szarek, Walter A. (1979). Efecto anomérico: orígenes y consecuencias . Washington: American Chemical Society. ISBN 978-0-8412-0470-6.
- ^ Kirby, AJ (1983). El efecto anomérico y los efectos estereoelectrónicos relacionados en el oxígeno . Nueva York: Springer-Verlag. ISBN 978-0-387-11684-6.
- ^ Perrin, Charles L. (octubre de 1995). "Efecto anomérico inverso: ¿realidad o ficción?". Tetrahedron . 51 (44): 11901–11935. doi :10.1016/0040-4020(95)00560-u. ISSN 0040-4020.
- ^ Thatcher, Gregory RJ (1993). El efecto anomérico y los efectos estereoelectrónicos asociados . Washington: American Chemical Society. ISBN 978-0-8412-2729-3.
- ^ Zhu, Feng; Walczak, Maciej A. (4 de agosto de 2020). "Estereoquímica de complejos de metales de transición controlados por el efecto metaloanomérico". Revista de la Sociedad Química Estadounidense . 142 (35): 15127–15136. doi :10.1021/jacs.0c06882. PMC 9622273. PMID 32786781. S2CID 221121672 .
- ^ Kürti, László; Czakó, Barbara (2007). Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica: antecedentes y mecanismos detallados; 250 reacciones con nombre (Pbk. ed., [Nachdr.]. ed.). Ámsterdam [ua]: Elsevier Academic Press. ISBN 978-0-12-429785-2.
