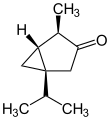
Tuyona
| |||
 Modelo de bolas y barras de (−)-α-tuyona [1] | |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC α: (1 S ,4 R ,5 R )-4-Metil-1-(propan-2-il)biciclo[3.1.0]hexan-3-ona β: (1 S ,4 S ,5 R )-4-metil-1-propan-2-ilbiciclo[3.1.0]hexan-3-ona | |||
| Otros nombres Biciclo[3.1.0]hexan-3-ona, 4-metil-1-(1-metiletil)-, [1 S -(1α,4α,5α)]- α-Tuyona β-Tuyona Tuyona, cis 3-Tuyanona, (1 S ,4 R ,5 R )-(−)- Tuyona 3-Tuyanona, (−)- l -Tuyona; 4-Metil-1-(1-metiletil)biciclo[3.1.0]hexan-3-ona-, (1S,4R,5R)- 3-Tuyona; cis -Tuyona ( Z )-Tuyona (−)-Tuyona; Biciclo(3.1.0)hexan-3-ona, 4-metil-1-(1-metiletil)-, (1 S ,4 R ,5 R )- NSC 93742 1-isopropil-4-metilbiciclo[3.1.0]hexan-3-ona | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 4660369 | |||
| EBICh | |||
| Química biológica |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.013.096 | ||
| Número CE |
| ||
| |||
| BARRIL |
| ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C10H16O | |||
| Masa molar | 152,237 g·mol −1 | ||
| Densidad | 0,92 g/cm 3 (β-tuyona); 0,9116 g/cm 3 (α-tuyona) | ||
| Punto de fusión | <25 °C | ||
| Punto de ebullición | 203 °C (397 °F; 476 K) (alfa,beta-tujona) | ||
| 407 mg/l | |||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| Advertencia | |||
| H302 | |||
| P264 , P270 , P301+P312 , P330 , P501 | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
Tujona ( / ˈ θ uː dʒ oʊ n / [2]) es unacetonay unmonoterpenoque se presenta predominantemente en dosdiastereoméricas(epiméricas):(−)-α-tuyonay(+)-β-tuyona.[3][4]
Aunque es más conocido como un compuesto químico presente en el licor absenta , es poco probable que sea responsable de los supuestos efectos estimulantes y psicoactivos de la absenta debido a las pequeñas cantidades presentes. [5] [6] [7]
La tuyona actúa sobre el receptor GABA A como antagonista. Como antagonista competitivo del receptor GABA A , la tuyona por sí sola se considera convulsiva , [8] aunque al interferir con el transmisor inhibidor GABA, puede transmitir efectos estimulantes y de elevación del estado de ánimo en dosis bajas. [ cita requerida ] También se encuentra en perfumería como componente de varios aceites esenciales. [ cita requerida ]
Además de las formas naturales (−)-α-tuyona y (+)-β-tuyona, existen otras dos posibles formas: (+)-α-tuyona y (−)-β-tuyona . En 2016, también se encontraron en la naturaleza [9] en Salvia officinalis .
- (−)-α-tuyona
- (+)-α-tuyona
- (+)-β-tuyona
- (−)-β-tuyona
Fuentes
La tuyona se encuentra en varias plantas, como la tuya (género Thuja , de ahí la derivación del nombre), el ciprés de Nootka , algunos enebros , la artemisa , el orégano , la salvia común , el tanaceto y el ajenjo , sobre todo el ajenjo gigante ( Artemisia absinthium ), generalmente como una mezcla de isómeros en una proporción de 1:2. También se encuentra en varias especies de Mentha (menta).
Biosíntesis
La biosíntesis de la tuyona es similar a la síntesis de otros monoterpenos y comienza con la formación de difosfato de geranilo (GPP) a partir de pirofosfato de dimetilalilo (DMAPP) y difosfato de isopentenilo (IPP), catalizada por la enzima sintasa de difosfato de geranilo. [10] El análisis espectroscópico cuantitativo de RMN de 13 C ha demostrado que las unidades de isopreno utilizadas para formar tuyona en las plantas se derivan de la vía del fosfato de metileritritol (MEP). [11]
Las reacciones que generan el esqueleto de tuyona en sabineno a partir de GPP están mediadas por la enzima sabineno sintasa que tiene GPP como sustrato. [10] GPP ( 1 ) primero se isomeriza a difosfato de linalilo (LPP) ( 2 ) y difosfato de nerilo (NPP) ( 3 ). LPP forma preferentemente un catión alílico deslocalizado-difosfato ( 4 ). El intermedio de par iónico luego se cicla en una adición electrofílica para producir el catión terciario α-terpinilo ( 5 ). [10]
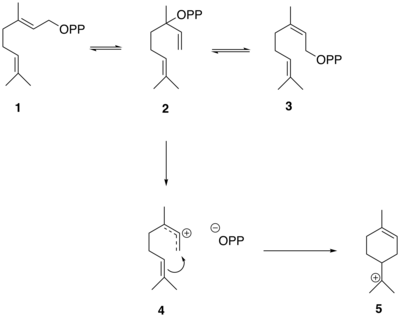
El catión α-terpinilo ( 5 ) luego sufre un desplazamiento de hidruro 1,2 a través de un reordenamiento de Wagner-Meerwein , lo que lleva a la formación del catión terpinen-4-ilo ( 6 ). Este catión sufre una segunda ciclización para formar el intermedio de catión tuyilo ( 7 ) antes de la pérdida de un protón para formar el precursor de tuyona, (+)-sabineno ( 8 ).
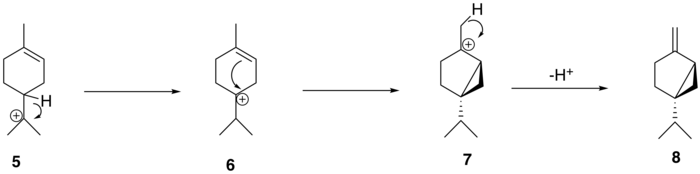
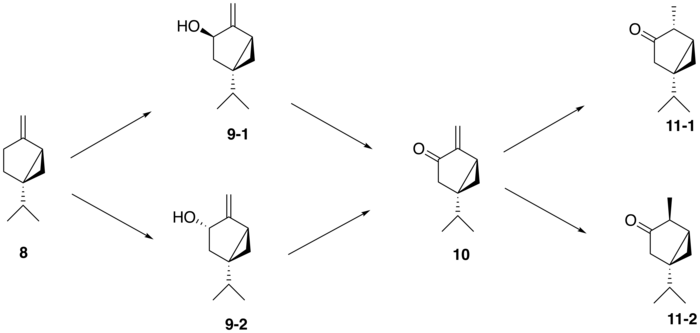
A partir del (+)-sabineno ( 8 ), la ruta biosintética propuesta para generar tuyona sigue una vía de tres pasos: el (+)-sabineno se oxida primero a un isómero de (+)-sabinol ( 9-1 , 9-2 ) por una enzima del citocromo P450 , seguido de la conversión a (+)-sabinona ( 10 ) a través de una deshidrogenasa . Finalmente, una reductasa media la conversión a α-tuyona ( 11-1 ) y β-tuyona ( 11-2 ). [12] La isomería del intermediario (+)-sabinol varía entre las plantas productoras de tuyona; Por ejemplo, en el cedro rojo occidental ( Thuja plicata ), la tuyona se deriva exclusivamente del intermediario (+)- trans -sabinol ( 9-1 ), mientras que en la salvia de jardín común ( Salvia officinalis ), la tuyona se forma a partir del intermediario (+)- cis -sabinol ( 9-2 ). [13]
Farmacología

Basándose en una hipótesis que solo consideraba la forma molecular, se especuló que la tuyona puede actuar de manera similar al THC en los receptores cannabinoides , [14] sin embargo, la tuyona no logró evocar una respuesta cannabimimética en un estudio de investigación de 1999. [15] La tuyona es un antagonista del receptor GABA A [16] y más específicamente, un antagonista competitivo del receptor GABA A . Al inhibir la activación del receptor GABA, las neuronas pueden activarse más fácilmente, lo que puede causar espasmos musculares y convulsiones. [17] Esta interacción con el receptor GABA A es específica de la alfa-tuyona. [18] La tuyona también es un antagonista de 5-HT 3 . [19] [20]
La dosis letal media , o DL50 , de la α-tuyona, el más activo de los dos isómeros, en ratones, es de alrededor de 45 mg/kg, con una tasa de mortalidad del 0% con 30 mg/kg y del 100% con 60 mg/kg. Los ratones expuestos a la dosis más alta tienen convulsiones que conducen a la muerte en un minuto. De 30 a 45 mg/kg, los ratones experimentan espasmos musculares en las piernas, que progresan a convulsiones generales hasta la muerte o la recuperación. Estos efectos están en línea con otros antagonistas del GABA. Además, la α-tuyona se metaboliza rápidamente en el hígado de los ratones. [17] El pretratamiento con moduladores alostéricos positivos del GABA como el diazepam , el fenobarbital o 1 g/kg de etanol protege contra una dosis letal de 100 mg/kg. [ cita requerida ]
Se ha probado la capacidad de atención con dosis bajas y altas de tuyona en alcohol. La dosis alta tuvo un efecto negativo a corto plazo en la capacidad de atención. La dosis más baja no mostró ningún efecto notable. [5]
Se ha informado [ ¿quién lo ha informado? ] que la tuyona es tóxica para las células del cerebro, los riñones y el hígado y que puede provocar convulsiones si se utiliza en dosis demasiado altas. Otras plantas que contienen tuyona, como el árbol de la vida ( Thuja occidentalis ), se utilizan en la medicina herbaria, principalmente por sus supuestos efectos estimulantes del sistema inmunológico [ cita requerida ] . Los efectos secundarios del aceite esencial de esta planta incluyen ansiedad, insomnio y convulsiones, lo que confirma los efectos de la tuyona sobre el sistema nervioso central. [8] [21]
En absenta
La tuyona es más conocida por ser un compuesto en el espíritu absenta . En el pasado, se pensaba que la absenta contenía hasta 260–350 mg/L de tuyona, [22] pero las pruebas modernas han demostrado que esta estimación es demasiado alta. Un estudio de 2008 de 13 botellas anteriores a la prohibición (1895–1910) utilizando cromatografía de gases-espectrometría de masas (GC-MS) encontró que las botellas tenían entre 0,5 y 48,3 mg/L y un promedio de 25,4 mg/L [6] [23] Un estudio de 2005 recreó tres recetas de 1899 con alto contenido de ajenjo y las probó con GC-MS, y encontró que la más alta contenía 4,3 mg/L de tuyona. [24] La prueba GC-MS es importante en este sentido, porque la cromatografía de gases por sí sola puede registrar una lectura incorrectamente alta de tuyona, ya que otros compuestos pueden interferir y aumentar la cantidad medida aparente. [25]
Historia
El compuesto fue descubierto después de que la absenta se volviera popular a mediados del siglo XIX. Valentin Magnan , que estudiaba el alcoholismo, probó aceite de ajenjo puro en animales y descubrió que causaba convulsiones independientemente de los efectos del alcohol. En base a esto, se asumió que la absenta, que contiene una pequeña cantidad de aceite de ajenjo, era más peligrosa que el alcohol común. Finalmente, se aisló la tuyona como la causa de estas reacciones. Magnan pasó a estudiar a 250 abusadores de alcohol y notó que aquellos que bebían absenta tenían convulsiones y alucinaciones . Las convulsiones son causadas por la (+)-α-tuyona que interactúa con los receptores GABA, causando actividad epiléptica. [18] A la luz de la evidencia moderna, estas conclusiones son cuestionables, ya que se basan en una comprensión deficiente de otros compuestos y enfermedades, [26] y están nubladas por la creencia de Magnan de que el alcohol y la absenta estaban degenerando la raza francesa. [27]
Después de que se prohibiera la absenta, la investigación se detuvo hasta la década de 1970, cuando la revista científica británica Nature publicó un artículo que comparaba la forma molecular de la tuyona con el tetrahidrocannabinol (THC), la principal sustancia psicoactiva que se encuentra en el cannabis , y planteó la hipótesis de que actuaría de la misma manera en el cerebro, lo que desató el mito de que la tuyona era un cannabinoide . [14] [28]
Más recientemente, a raíz de la Directiva 88/388/EEC del Consejo Europeo (1988) que permite ciertos niveles de tuyona en los alimentos en la UE, [29] se realizaron los estudios descritos anteriormente y solo se encontraron niveles mínimos de tuyona en la absenta.
Reglamento
unión Europea
Los niveles máximos de tuyona en la UE son: [30] [31]
- 0,5 mg/kg en alimentos preparados con especies de Artemisia , excluidos los preparados con salvia y bebidas no alcohólicas
- 10 mg/kg en bebidas alcohólicas no preparadas con especies de Artemisia
- 25 mg/kg en alimentos preparados con salvia
- 35 mg/kg en bebidas alcohólicas preparadas con especies de Artemisia
Estados Unidos
En Estados Unidos, no se permite la adición de tuyona pura a los alimentos. [32] Los alimentos o bebidas que contienen especies de Artemisia , cedro blanco , musgo de roble , tanaceto o milenrama deben estar libres de tuyona, [33] lo que en la práctica significa que contienen menos de 10 partes por millón de tuyona. [34] Otras hierbas que contienen tuyona no tienen restricciones. Por ejemplo, la salvia y el aceite de salvia (que puede contener hasta un 50% de tuyona) están en la lista de sustancias generalmente reconocidas como seguras (GRAS) de la Administración de Alimentos y Medicamentos . [35]
La absenta que se ofrece a la venta en los Estados Unidos debe estar libre de tuyona según el mismo estándar que se aplica a otras bebidas que contienen Artemisia, [34] por lo que la absenta con pequeñas cantidades de tuyona puede importarse legalmente.
Canadá
En Canadá, las leyes sobre bebidas alcohólicas son competencia de los gobiernos provinciales. Alberta, Ontario y Nueva Escocia permiten 10 mg/kg de tuyona; Quebec permite 15 mg por kg; [ cita requerida ] Manitoba permite de 6 a 8 mg de tuyona por litro; Columbia Británica se adhiere a los mismos niveles que Ontario. Sin embargo, en Saskatchewan y Quebec, se puede comprar cualquier licor disponible en el mundo con la compra de un máximo de una caja, generalmente 12 botellas de 750 ml o 9 L. Las juntas de bebidas alcohólicas individuales deben aprobar cada producto antes de que pueda venderse en los estantes.
Véase también
- Piołunówka : preparación alcohólica polaca con un contenido de tuyona mayor que el de la absenta
Referencias
- ^ Richert, Clemens; Krupp, Felix; Frey, Wolfgang (2020). "Configuración absoluta de moléculas pequeñas por cocristalización". Angew. Chem. Int. Ed. 59 (37): 15875–15879. doi : 10.1002/anie.202004992 . PMC 7540501 . PMID 32441841.
- ^ Deriva del griego antiguo θυία, thuj(a) , una especie de cedro + -ωνη, -ona , patronímico femenino de un pariente químico de la acetona.
- ^ Perry NB, Anderson RE, Brennan NJ, Douglas MH, Heaney AJ, McGimpsey JA, Smallfield BM (1999). "Aceites esenciales de salvia dálmata ( Salvia officinalis L.): variaciones entre individuos, partes de la planta, estaciones y sitios". J. Agric. Food Chem. 47 (5): 2048–2054. doi :10.1021/jf981170m. PMID 10552494.
- ^ Oppolzer W, Pimm A, Stammen B, Hume WE (1997). "Ciclizaciones intramoleculares catalizadas por paladio de carbonatos propargílicos olefínicos y aplicación a la síntesis diastereoselectiva de (−)-α-tuyona enantioméricamente pura". Helv. Chim. Acta . 80 (3): 623–639. doi : 10.1002/hlca.19970800302 .
- ^ ab Dettling A, Grass H, Schuff A, Skopp G, Strohbeck-Kuehner P, Haffner HT (2004). "Absenta: rendimiento atencional y estado de ánimo bajo la influencia de la tuyona". J. Stud. Alcohol . 65 (5): 573–81. doi :10.15288/jsa.2004.65.573. PMID 15536765.
- ^ Los mitos sobre la absenta finalmente se olvidaron
- ^ Composición química de la absenta preban añeja con especial referencia a las concentraciones de tuyona, fenchona, pinocanfona, metanol, cobre y antimonio
- ^ ab Olsen, Richard W. (25 de abril de 2000). "Receptores de absenta y ácido γ-aminobutírico". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (9): 4417–4418. Bibcode :2000PNAS...97.4417O. doi : 10.1073/pnas.97.9.4417 . ISSN 0027-8424. PMC 34311 . PMID 10781032.
- ^ Williams, Jack D.; Yazarians, Jessica A.; Almeyda, Chelcie C.; Anderson, Kristin A.; Boyce, Gregory R. (23 de mayo de 2016). "Detección de los estereoisómeros de tuyona no observados previamente en el aceite esencial y productos consumibles de salvia (Salvia officinalis L.) mediante microextracción en fase sólida en el espacio de cabeza, cromatografía de gases y espectrometría de masas". Journal of Agricultural and Food Chemistry . 64 (21): 4319–4326. doi :10.1021/acs.jafc.6b01065. PMID 27181395.
- ^ abc Dewick, Paul M (2009). Productos naturales medicinales: un enfoque biosintético (3.ª ed.). John Wiley & Sons Ltd., págs. 195-197. ISBN 978-0-470-74167-2.
- ^ Umlauf, Dirk; Zapp, Josef (septiembre de 2004). "Biosíntesis de la cetona monoterpénica irregular de artemisia, el sesquiterpeno germacreno D y otros isoprenoides en Tanacetum vulgare L. (Asteraceae)". Fitoquímica . 65 (17): 2463–2470. Código Bib : 2004PChem..65.2463U. doi :10.1016/j.phytochem.2004.08.019. PMID 15381410.
- ^ Foster, Adam J.; Hall, Dawn E. (abril de 2013). "Identificación de genes en las defensas terpenoides foliares de Thuja plicata". Fisiología vegetal . 161 (4): 1993–2004. doi :10.1104/pp.112.206383. PMC 3613470 . PMID 23388118.
- ^ Gesell, Andreas; Blaukopf, Markus (mayo de 2015). "El citocromo P450 CYP750B1 de las gimnospermas cataliza la hidroxilación estereoespecífica de monoterpenos de (+)-sabineno en la biosíntesis de tuyona en el cedro rojo occidental". Fisiología vegetal . 168 (1): 94–106. doi :10.1104/pp.15.00315. PMC 4424034 . PMID 25829465.
- ^ ab Conrad, Barnaby, III ; (1988). Absenta: Historia en una botella. Chronicle Books . ISBN 0-8118-1650-8 pág. 152
- ^ Meschler JP, Howlett AC (marzo de 1999). "La tuyona exhibe baja afinidad por los receptores cannabinoides pero no logra provocar respuestas cannabimiméticas". Pharmacol. Biochem. Behav . 62 (3): 473–480. doi :10.1016/S0091-3057(98)00195-6. PMID 10080239. S2CID 30865036.
- ^ Olsen RW (abril de 2000). "Receptores de absenta y ácido gamma-aminobutírico". Proc. Natl. Sci. EE. UU . . 97 (9): 4417–4418. Bibcode :2000PNAS...97.4417O. doi : 10.1073/pnas.97.9.4417 . PMC 34311 . PMID 10781032.
- ^ ab Höld KM, Sirisoma NS, Ikeda T, Narahashi T, Casida JE (abril de 2000). "Alfa-tuyona (el componente activo de la absenta): modulación del receptor de tipo A del ácido gamma-aminobutírico y desintoxicación metabólica". Proc. Natl. Sci. EE. UU . . 97 (8): 3826–31. Bibcode :2000PNAS...97.3826H. doi : 10.1073/pnas.070042397 . PMC 18101 . PMID 10725394.
- ^ ab Höld, Karin M.; Sirisoma, Nilantha S.; Ikeda, Tomoko; Narahashi, Toshio; Casida, John E. (11 de abril de 2000). "α-Tujona (el componente activo de la absenta): modulación del receptor de ácido γ-aminobutírico tipo A y desintoxicación metabólica". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (8): 3826–3831. Bibcode :2000PNAS...97.3826H. doi : 10.1073/pnas.070042397 . ISSN 0027-8424. PMC 18101 . PMID 10725394.
- ^ Deiml T, Haseneder R, Zieglgänsberger W, Rammes G, Eisensamer B, Rupprecht R, Hapfelmeier G (febrero de 2004). "La alfa-tuyona reduce la actividad del receptor 5-HT3 mediante un efecto sobre la desensibilización reducida por agonistas". Neurofarmacología . 46 (2): 192–201. doi :10.1016/j.neuropharm.2003.09.022. PMID 15002407. S2CID 54346490.
- ^ Modulación de los receptores ionotrópicos GABA por productos naturales de origen vegetal
- ^ Naser B, Bodinet C, Tegtmeier M, Lindequist U (marzo de 2005). "Thuja occidentalis (Arbor vitae): una revisión de sus propiedades farmacéuticas, farmacológicas y clínicas". Medicina complementaria y alternativa basada en evidencias . 2 (1): 69–78. doi :10.1093/ecam/neh065. PMC 1062158 . PMID 15841280.
- ^ Absinthism: a ficticy 19th-century syndrome with present impact (Absinthismo: un síndrome ficticio del siglo XIX con repercusiones actuales), Padosch et al. Recuperado el 28 de octubre de 2006.
- ^ Composición química de la absenta preban añeja con especial referencia a las concentraciones de tuyona, fenchona, pinocanfona, metanol, cobre y antimonio
- ^ Tujona: ¿causa del absintismo? Lachenmeier, Emmert et al. Consultado el 28 de octubre de 2006.
- ^ Determinación de α-/β-Tujona y terpenos relacionados en absenta mediante extracción en fase sólida y cromatografía de gases Archivado el 27 de noviembre de 2007 en Wayback Machine , Emmert et al. Consultado el 28 de octubre de 2006.
- ^ Lachenmeier, Dirk; Nathan-Maister, David; Breaux, Theodore; Luaute, Jean-Pierre; Emmert, Joachim (2010). "Absenta, absintismo y tuyona: nueva perspectiva sobre el impacto del alcohol en la salud pública". The Open Addiction Journal . 3 : 32–38. doi : 10.2174/1874941001003010032 .
- ^ Conrad III, Barnaby ; (1988). Absenta: Historia en una botella . Libros de crónicas . ISBN 0-8118-1650-8 Pág. 101-105
- ^ Del Castillo J.; Anderson M.; Rubottom GM (1975). "Cartas a la naturaleza: marihuana, absenta y el sistema nervioso central". Nature . 253 (5490): 365–366. doi :10.1038/253365a0. PMID 1110781. S2CID 4245058.
- ^ Directiva 88/388/CEE del Consejo Europeo, de 22 de junio de 1988.
- ^ Reglamento (CE) n.º 1334/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, Comisión Europea .
- ^ Opinión del Comité Científico de Alimentos sobre la Tujona Comité Científico de Alimentos (2003) Consultado el 28 de octubre de 2006.
- ^ Laurie C. Dolan; Ray A. Matulka y George A. Burdock (2010). "Toxinas alimentarias de origen natural". Toxins . 2 (9): 2289–2332. doi : 10.3390/toxins2092289 . PMC 3153292 . PMID 22069686.
- ^ Regulación 21 CFR 172.510 de la FDA: Aditivos alimentarios permitidos para su adición directa a alimentos destinados al consumo humano. Administración de Alimentos y Medicamentos (2003). Consultado el 28 de octubre de 2006.
- ^ Circular industrial 2007-5 de la Oficina de Comercio e Impuestos sobre el Alcohol y el Tabaco del Departamento del Tesoro Archivado el 9 de febrero de 2014 en Wayback Machine el 17 de octubre de 2007. Consultado el 5 de mayo de 2009
- ^ Sustancias generalmente reconocidas como seguras. Archivado el 30 de noviembre de 2005 en la Wayback Machine . Administración de Alimentos y Medicamentos (2003). Consultado el 28 de octubre de 2006.
Lectura adicional
- Lachenmeier DW, Nathan-Maister D, Breaux TA, Sohnius EM, Schoeberl K, Kuballa T (mayo de 2008). "Composición química de absenta preban añeja con especial referencia a concentraciones de tuyona, fenchona, pinocanfona, metanol, cobre y antimonio". J. Agric. Food Chem . 56 (9): 3073–81. doi : 10.1021/jf703568f . PMID 18419128.
Enlaces externos
- Absenta absuelta Archivado el 19 de marzo de 2012 en Wayback Machine , Cern Courier , 8 de julio de 2008
- La inestable historia de la tuyona: artículo de la Wormwood Society sobre la tuyona y su historia.