Estereoquímica

La estereoquímica , una subdisciplina de la química , estudia la disposición espacial de los átomos que forman la estructura de las moléculas y su manipulación. [1] El estudio de la estereoquímica se centra en las relaciones entre los estereoisómeros , que por definición tienen la misma fórmula molecular y secuencia de átomos enlazados (constitución), pero difieren en la posición geométrica de los átomos en el espacio. Por esta razón, también se la conoce como química 3D (el prefijo "stereo-" significa "tridimensionalidad"). [2]
La estereoquímica abarca todo el espectro de la química orgánica , inorgánica , biológica , física y, especialmente, supramolecular . La estereoquímica incluye métodos para determinar y describir estas relaciones; el efecto que estas relaciones confieren a las moléculas en cuestión sobre las propiedades físicas o biológicas y la manera en que estas relaciones influyen en la reactividad de las moléculas en cuestión ( estereoquímica dinámica ).
Historia
No fue hasta después de las observaciones de ciertos fenómenos moleculares que se desarrollaron los principios estereoquímicos. En 1815, la observación de la actividad óptica por parte de Jean-Baptiste Biot marcó el comienzo de la historia de la estereoquímica orgánica. Observó que las moléculas orgánicas podían rotar el plano de la luz polarizada en una solución o en la fase gaseosa. [3] A pesar de los descubrimientos de Biot, Louis Pasteur es comúnmente descrito como el primer estereoquímico, habiendo observado en 1842 que las sales de ácido tartárico recolectadas de los recipientes de producción de vino podían rotar el plano de la luz polarizada , pero que las sales de otras fuentes no lo hacían. Esta era la única propiedad física que difería entre los dos tipos de sales de tartrato, que se debe al isomerismo óptico . En 1874, Jacobus Henricus van 't Hoff y Joseph Le Bel explicaron la actividad óptica en términos de la disposición tetraédrica de los átomos unidos al carbono. Kekulé utilizó modelos tetraédricos anteriormente en 1862, pero nunca los publicó; Emanuele Paternò probablemente conocía estos, pero fue el primero en dibujar y discutir estructuras tridimensionales, como la del 1,2-dibromoetano en el Giornale di Scienze Naturali ed Economiche en 1869. [4] El término "quiral" fue introducido por Lord Kelvin en 1904. Arthur Robertson Cushny , farmacólogo escocés, en 1908, ofreció por primera vez un ejemplo definitivo de una diferencia de bioactividad entre los enantiómeros de una molécula quiral, a saber, la (-)-adrenalina es dos veces más potente que la forma (±)- como vasoconstrictor y en 1926 sentó las bases para la farmacología quiral/estereofarmacología [5] [6] (relaciones biológicas de sustancias ópticamente isoméricas). Más tarde, en 1966, se ideó la nomenclatura de Cahn-Ingold-Prelog o regla de secuencia para asignar una configuración absoluta al centro estereogénico /quiral (notación R y S) [7] y se extendió para aplicarse a través de enlaces olefínicos (notación E y Z).
Significado
Las reglas de prioridad de Cahn-Ingold-Prelog forman parte de un sistema para describir la estereoquímica de una molécula. Clasifican los átomos alrededor de un estereocentro de una manera estándar, lo que permite describir de forma inequívoca la posición relativa de estos átomos en la molécula. Una proyección de Fischer es una forma simplificada de representar la estereoquímica alrededor de un estereocentro.
Ejemplo de talidomida

La estereoquímica tiene importantes aplicaciones en el campo de la medicina, particularmente en los productos farmacéuticos. Un ejemplo que se cita a menudo de la importancia de la estereoquímica se relaciona con el desastre de la talidomida. La talidomida es un fármaco farmacéutico , preparado por primera vez en 1957 en Alemania, prescrito para tratar las náuseas matutinas en mujeres embarazadas. Se descubrió que el fármaco era teratogénico , causando graves daños genéticos al crecimiento y desarrollo embrionario temprano, lo que lleva a la deformación de las extremidades en los bebés. Algunos de los varios mecanismos propuestos de teratogenicidad implican una función biológica diferente para los enantiómeros ( R )- y ( S )-talidomida. [8] Sin embargo, en el cuerpo humano, la talidomida sufre racemización : incluso si solo uno de los dos enantiómeros se administra como fármaco, el otro enantiómero se produce como resultado del metabolismo. [9] En consecuencia, es incorrecto afirmar que un estereoisómero es seguro mientras que el otro es teratogénico. [10] La talidomida se utiliza actualmente para el tratamiento de otras enfermedades, en particular el cáncer y la lepra . Se han implementado estrictas regulaciones y controles para evitar su uso por parte de mujeres embarazadas y prevenir malformaciones en el desarrollo. Este desastre fue una fuerza impulsora para exigir pruebas estrictas de los medicamentos antes de ponerlos a disposición del público.
Definiciones
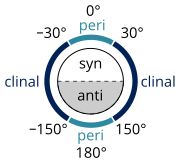
Existen muchas definiciones que describen un confórmero específico ( IUPAC Gold Book ), desarrolladas por William Klyne y Vladimir Prelog , que constituyen su sistema de nomenclatura Klyne-Prelog:
- Un ángulo de torsión de ±60° se llama gauche [11]
- Un ángulo de torsión entre 0° y ±90° se llama syn (s)
- Un ángulo de torsión entre ±90° y 180° se llama anti (a)
- Un ángulo de torsión entre 30° y 150° o entre –30° y –150° se denomina clinal .
- Un ángulo de torsión entre 0° y 30° o 150° y 180° se llama periplanar (p)
- Un ángulo de torsión entre 0° y 30° se denomina sinperiplanar o conformación sin o cis (sp)
- Un ángulo de torsión entre 30° y 90° y –30° y –90° se denomina sinclinal o gauche o sesgado (sc) [12]
- Un ángulo de torsión entre 90° y 150° y entre –90° y –150° se denomina anticlinal (ac)
- Un ángulo de torsión entre ±150° y 180° se denomina antiperiplanar o anti o trans (ap).
La deformación torsional resulta de la resistencia a la torsión alrededor de un enlace.
Tipos
- Atropisomería
Una forma energética de quiralidad axial. Esta forma de quiralidad se deriva de la sustitución diferencial alrededor de un enlace, comúnmente entre dos átomos con hibridación sp². [13] - Isomería cis - trans
También conocidos como isómeros geométricos, estos compuestos tienen diferentes configuraciones debido a la estructura inflexible de la molécula. Se deben cumplir dos requisitos para que una molécula presente isomería cis-trans: [14]
1. La rotación dentro de la molécula debe estar restringida.
2. Dos grupos no idénticos deben estar en cada átomo de carbono con doble enlace. - Isomería conformacional
Esta forma de isomería también se conoce como confórmeros, isómeros rotacionales y rotámeros. La isomería conformacional se produce por rotación alrededor del enlace simple . - Diastereómeros
Estos estereoisómeros no son idénticos ni tienen forma de imagen. Los diastereómeros se producen cuando los estereoisómeros de un compuesto tienen configuraciones diferentes en los estereocentros correspondientes. [15] - Enantiómeros
Estereoisómeros que son imágenes especulares no superponibles. [16]
Véase también
- Estereoquímica de los alcanos
- Resolución quiral , que a menudo implica cristalización.
- Quiralidad (química) ( R / S , d / l )
- Interruptor quiral
- Fórmula esquelética#Estereoquímica que describe cómo se denota la estereoquímica en las fórmulas esqueléticas.
- Química del estado sólido
- Teoría VSEPR
- Efecto Overhauser nuclear , un método de espectroscopia de resonancia magnética nuclear (RMN) empleado para dilucidar la estereoquímica de las moléculas orgánicas.
Referencias
- ^ Ernest Eliel Estereoquímica orgánica básica , 2001 ISBN 0471374997 ; Bernard Testa y John Caldwell Estereoquímica orgánica: principios rectores y relevancia biomedicinal 2014 ISBN 3906390691 ; Estereoquímica orgánica Hua-Jie Zhu : métodos experimentales y computacionales 2015 ISBN 3527338225 ; László Poppe, Mihály Nógrádi, József Nagy, Gábor Hornyánszky, Zoltán Boros Estereoquímica y síntesis estereoselectiva: introducción 2016 ISBN 3527339019
- ^ "la definición de stereo-". Dictionary.com . Archivado desde el original el 9 de junio de 2010.
- ^ Nasipuri, D (2021). Estereoquímica de compuestos orgánicos: principios y aplicaciones (4.ª ed.). Nueva Delhi: New Age International. pág. 1. ISBN 978-93-89802-47-4.
- ^ Paternò, Emanuele (1869). "Intorno all'azione del percloruro di fosforo sul clorale". Giorn. Ciencia. Nat. Economía . 5 : 117-122.
- ^ Smith, Silas W. (4 de mayo de 2009). "Toxicología quiral: es lo mismo... pero diferente". Toxicological Sciences . 110 (1): 4–30. doi : 10.1093/toxsci/kfp097 . ISSN 1096-6080. PMID 19414517.
- ^ Patočka, Jiří; Dvořák, Aleš (31 de julio de 2004). "Aspectos biomédicos de las moléculas quirales". Revista de Biomedicina Aplicada . 2 (2): 95-100. doi : 10.32725/jab.2004.011 .
- ^ Cahn, RS; Ingold, Christopher; Prelog, V. (abril de 1966). "Especificación de la quiralidad molecular". Angewandte Chemie International Edition en inglés . 5 (4): 385–415. doi :10.1002/anie.196603851. ISSN 0570-0833.
- ^ Stephens TD, Bunde CJ, Fillmore BJ (junio de 2000). "Mecanismo de acción en la teratogénesis de la talidomida". Farmacología bioquímica . 59 (12): 1489–99. doi :10.1016/S0006-2952(99)00388-3. PMID 10799645.
- ^ Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL (2004). "Farmacocinética clínica de la talidomida". Clin. Pharmacokinet . 43 (5): 311–327. doi :10.2165/00003088-200443050-00004. PMID 15080764. S2CID 37728304.
- ^ Francl, Michelle (2010). "Leyendas urbanas de la química". Nature Chemistry . 2 (8): 600–601. Bibcode :2010NatCh...2..600F. doi :10.1038/nchem.750. PMID 20651711.
- ^ Anslyn, Eric V. y Dougherty, Dennis A. Química orgánica física moderna . University Science (2005), 1083 págs. ISBN 1-891389-31-9
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "gauche". doi :10.1351/goldbook.G02593
- ^ Toenjes, Sean T; Gustafson, Jeffrey L (febrero de 2018). "Atropisomería en química medicinal: desafíos y oportunidades". Química medicinal futura . 10 (4): 409–422. doi :10.4155/fmc-2017-0152. ISSN 1756-8919. PMC 5967358 . PMID 29380622.
- ^ "13.2: Isómeros cis-trans (isómeros geométricos)". Chemistry LibreTexts . 2014-07-17 . Consultado el 2022-11-27 .
- ^ Garrett, Reginald H.; Grisham, Charles M. (2005). Bioquímica (3.ª ed.). Belmont, CA: Thomson Brooks/Cole. ISBN 0-534-49033-6.OCLC 56058171 .
- ^ Caillet, Céline; Chauvelot-Moachon, Laurence; Montastruc, Jean-Louis; Bagheri, Haleh; Asociación Francesa de Centros Regionales de Farmacovigilancia (noviembre de 2012). "Perfil de seguridad de enantiómeros frente a mezclas racémicas: ¿es lo mismo?: Informe breve". British Journal of Clinical Pharmacology . 74 (5): 886–889. doi :10.1111/j.1365-2125.2012.04262.x. PMC 3495153 . PMID 22404187.
