Toxocariasis
| Toxocariasis | |
|---|---|
| Especialidad | Parasitología , enfermedades infecciosas |
| Síntomas | fiebre , ganglios linfáticos agrandados , tos, broncoespasmo , sibilancia , dolor abdominal, dolores de cabeza, dificultad para respirar , deterioro visual |
| Complicaciones | insuficiencia respiratoria , meningitis , encefalitis , convulsiones epilépticas , miocarditis , ceguera |
| Causas | Lombriz intestinal del perro ( Toxocara canis ), lombriz intestinal del gato ( Toxocara cati ) |
| Método de diagnóstico | Pruebas serológicas ( IgE total sérica , ELISA para detectar IgE anti-Toxocara específica) |
| Diagnóstico diferencial | Baylisascaris procyonis , filariasis |
| Prevención | Control de parásitos en perros y gatos domésticos, eliminación adecuada de heces de mascotas, higiene de manos |
| Tratamiento | medicamentos antihelmínticos |
| Medicamento | albendazol , dietilcarbamazina |
La toxocariasis es una enfermedad de los humanos causada por el gusano redondo del perro ( Toxocara canis ) y, con menor frecuencia, el gusano redondo del gato ( Toxocara cati ). [1] Estos son los gusanos redondos intestinales más comunes de los perros, coyotes, lobos y zorros y gatos domésticos , respectivamente. [2] Los humanos se encuentran entre los muchos huéspedes "accidentales" o paraténicos de estos gusanos redondos. [3]
Aunque esta infección zoonótica suele ser asintomática, puede causar una enfermedad grave. Hay tres síndromes distintos de toxocariasis: la toxocariasis encubierta es una enfermedad relativamente leve muy similar al síndrome de Löffler . Se caracteriza por fiebre, eosinofilia , urticaria , ganglios linfáticos agrandados , tos, broncoespasmo , sibilancia , dolor abdominal, dolores de cabeza y/o hepatoesplenomegalia . La larva migratoria visceral (VLM) es una forma más grave de la enfermedad; los signos y síntomas dependen del sistema orgánico específico afectado. La afectación pulmonar puede manifestarse como dificultad para respirar , enfermedad pulmonar intersticial , derrame pleural e incluso insuficiencia respiratoria . La afectación cerebral puede manifestarse como meningitis , encefalitis o convulsiones epilépticas . La afectación cardíaca puede manifestarse como miocarditis . La larva migratoria ocular (LMO) es el tercer síndrome y se manifiesta como uveítis , endoftalmitis , deterioro visual o incluso ceguera en el ojo afectado. [4]
Signos y síntomas
Las reacciones fisiológicas a la infección por Toxocara dependen de la respuesta inmunitaria del huésped y de la carga parasitaria. La mayoría de los casos de infección por Toxocara son asintomáticos , especialmente en adultos. [4] [5] [6] Cuando aparecen síntomas, son el resultado de la migración de larvas de Toxocara de segunda etapa a través del cuerpo. [7]
Toxocariasis encubierta
La toxocariasis encubierta es el menos grave de los tres síndromes y se cree que se debe a una exposición crónica. [8] Los signos y síntomas de la toxocariasis encubierta son tos, fiebre, dolor abdominal, dolores de cabeza y cambios en el comportamiento y la capacidad para dormir. [9] En el examen médico, a menudo se observan sibilancias, hepatomegalia y linfadenitis . [4]
Larva migratoria visceral
Las altas cargas parasitarias o la infección repetida pueden dar lugar a larva migratoria visceral (VLM). [5] La VLM se diagnostica principalmente en niños pequeños, porque son más propensos a la exposición e ingestión de huevos infecciosos. [7] La infección por Toxocara suele resolverse por sí sola en cuestión de semanas, pero puede producirse eosinofilia crónica . En la VLM, la migración de larvas provoca inflamación de los órganos internos y, a veces, del sistema nervioso central. Los síntomas dependen de los órganos afectados. Los niños pueden presentar palidez, fatiga, pérdida de peso, anorexia, fiebre, dolor de cabeza, urticaria , tos, asma, opresión en el pecho, aumento de la irritabilidad, dolor abdominal, náuseas y vómitos. [7] A veces se pueden ver las huellas de migración subcutánea de las larvas. [7] A los niños se les diagnostica comúnmente neumonía , broncoespasmos , inflamación pulmonar crónica, hipereosinofilia , hepatomegalia , hipergammaglobulinemia (clases IgM, IgG e IgE), leucocitosis y niveles elevados de isohemaglutininas anti-A y anti-B. [7] [10] [5] [9] Se han producido casos graves en personas hipersensibles a los alérgenos; en casos raros, la VLM ha provocado epilepsia , inflamación del corazón , derrame pleural , insuficiencia respiratoria y muerte. [4] [9]

Larva migratoria ocular
La larva migratoria ocular (LMO) es rara en comparación con la LMO. [7] [11] Se cree que una carga ligera de Toxocara induce una respuesta inmunitaria baja, lo que permite que una larva entre en el ojo del huésped. [9] Aunque ha habido casos de LMO y LMO concurrentes, estos son extremadamente excepcionales. [9] La LMO a menudo ocurre en un solo ojo y a partir de una sola larva que migra y se enquista dentro de la órbita. [7] [12] La pérdida de visión ocurre en días o semanas. [9] Otros signos y síntomas son ojo rojo, pupila blanca, pupila fija, fibrosis retiniana, desprendimiento de retina , inflamación de los tejidos oculares, granulomas retinianos y estrabismo . [7] [9] [12] [13] Los granulomas oculares resultantes de la LMO se diagnostican con frecuencia de forma errónea como retinoblastomas . [7] El daño por Toxocara en el ojo es permanente y puede provocar ceguera. [5] [12]
Otro
Las manifestaciones cutáneas son comunes, incluyendo urticaria crónica, prurito crónico y diversas formas de eczema. [14] Un estudio de caso publicado en 2008 respaldó la hipótesis de que la celulitis eosinofílica también puede ser causada por una infección con Toxocara : el paciente adulto presentó celulitis eosinofílica, hepatoesplenomegalia , anemia y un ELISA positivo para T. cani s. [15]
Causa
Transmisión
La transmisión de Toxocara a los humanos se produce generalmente a través de la ingestión de huevos infecciosos. [5] [16] T. canis puede poner alrededor de 200.000 huevos por día. [17] Estos huevos se excretan en las heces de gatos o perros, pero los hábitos de defecación de los perros hacen que la transmisión de T. canis sea más común que la de T. cati . [7] [16] Tanto los huevos de Toxocara canis como los de Toxocara cati requieren un período de incubación de varias semanas en un clima húmedo y húmedo fuera de un huésped antes de volverse infecciosos, por lo que los huevos frescos no pueden causar toxocariasis. [7] [16] [17]
Muchos objetos y superficies pueden contaminarse con huevos infecciosos de Toxocara . Las moscas que se alimentan de heces pueden propagar los huevos de Toxocara a superficies o alimentos. [9] Los niños pequeños que se llevan objetos contaminados a la boca o comen tierra ( pica ) corren el riesgo de desarrollar síntomas. [7] [10] [9] Los humanos también pueden contaminar los alimentos al no lavarse las manos antes de comer. [5]
Los humanos no son los únicos huéspedes accidentales de Toxocara . [18] Comer conejo, pollo u oveja poco cocidos puede provocar una infección; las larvas enquistadas en la carne pueden reactivarse y migrar a través de un huésped humano, causando toxocariasis. [18] Se debe prestar especial atención a cocinar bien los menudillos y el hígado para evitar la transmisión. [7] [9]
Período de incubación
El período de incubación de los huevos de Toxocara canis y cati depende de la temperatura y la humedad. [7] [16] Las hembras de T. canis , específicamente, son capaces de producir hasta 200.000 huevos al día que requieren de 2 a 6 semanas como mínimo hasta un par de meses antes del desarrollo completo en la etapa infecciosa. [19] En condiciones ideales de verano , los huevos pueden madurar hasta la etapa infecciosa después de dos semanas fuera de un huésped. [9] [16] Si se proporciona suficiente oxígeno y humedad, los huevos de Toxocara pueden seguir siendo infecciosos durante años, ya que su capa exterior resistente permite la protección de la mayoría de las amenazas ambientales. [20] [21] [22] Sin embargo, como se identifica en un estudio de caso presentado en la revista de helmintología, la segunda etapa del desarrollo de las larvas plantea vulnerabilidades estrictas a ciertos elementos ambientales. Las altas temperaturas y los bajos niveles de humedad degradarán rápidamente las larvas durante esta etapa de crecimiento. [20]
| Toxocariasis | |
|---|---|
| Clasificación científica | |
| Dominio: | Eucariota |
| Reino: | Animalia |
| Filo: | Nematodos |
| Clase: | Cromadorea |
| Orden: | Ascarididae |
| Familia: | Toxocaridae |
| Género: | Toxocara |
| Especies | |
Las especies incluyen: [23]
| |
Depósito

Los perros y los zorros son el reservorio de Toxocara canis , pero los cachorros y las crías representan el mayor riesgo de propagación de la infección a los humanos. [5] La infección en la mayoría de los perros adultos se caracteriza por larvas enquistadas de segunda etapa. Sin embargo, estas larvas pueden reactivarse en hembras preñadas y cruzar la barrera placentaria para infectar a las crías. La transmisión vertical también puede ocurrir a través de la leche materna. [7] [16] [25] Las madres infecciosas y los cachorros menores de cinco semanas eliminan huevos en sus heces. [16] [25] Aproximadamente el 50% de los cachorros y el 20% de los perros adultos están infectados con T. canis . [7]
Los gatos son el reservorio de Toxocara cati . [5] Al igual que con T. canis , las larvas enquistadas de segundo estadio en gatas gestantes o lactantes se reactivan. Sin embargo, la transmisión vertical solo puede ocurrir a través de la lactancia materna. [16]
Las moscas pueden actuar como vectores mecánicos de Toxocara , pero la mayoría de las infecciones ocurren sin un vector. [9] La mayoría de los incidentes con Toxocariasis son resultado de vectores de expresión procariotas y su transmisión a través del contacto físico directo con heces que resulta en la contracción de la enfermedad. [26]
Morfología
Ambas especies producen huevos de color marrón y con hoyuelos. [11] [21] [22] Los huevos de T. canis miden 75-90 μm y tienen forma esférica, mientras que los huevos de T. cati tienen un diámetro de 65-70 μm y son oblongos. [7] [21] [22] Las larvas de segundo estadio nacen de estos huevos y miden aproximadamente 0,5 mm de largo y 0,02 mm de ancho. [4] Los adultos de ambas especies tienen sistemas digestivos completos y tres labios, cada uno compuesto por una cresta dentígera. [21] [22]
Los adultos de T. canis se encuentran solo en perros y zorros y los machos miden entre 4 y 6 cm de largo, con un extremo posterior curvado. [10] [21] Los machos tienen espículas y un “testículo tubular”. [21] Las hembras pueden medir hasta 15 cm de largo, y la vulva se extiende un tercio de la longitud de su cuerpo. [21] Las hembras no se curvan en el extremo posterior. [10] [21]
Las hembras adultas de T. cati miden aproximadamente 10 cm de largo, mientras que los machos miden típicamente 6 cm o menos. Los adultos de T. cati solo se encuentran en los gatos, y los machos de T. cati tienen el extremo posterior curvado. [22]
Ciclo vital
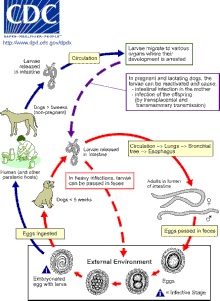
Los gatos, perros y zorros pueden infectarse con Toxocara a través de la ingestión de huevos o por transmisión de las larvas de una madre a su descendencia. [16] [25] La transmisión a gatos y perros también puede ocurrir por ingestión de huéspedes accidentales infectados, como lombrices de tierra, cucarachas, roedores, conejos, pollos u ovejas. [9] [22]
Los huevos eclosionan como larvas de segunda etapa en los intestinos del gato, perro o zorro huésped (para mantener la coherencia, este artículo asumirá que las larvas de segunda etapa emergen de los huevos de Toxocara , aunque existe un debate sobre si las larvas están realmente en su segunda o tercera etapa de desarrollo). [10] [9] Las larvas ingresan al torrente sanguíneo y migran a los pulmones, donde se tosen y se tragan. Las larvas maduran hasta convertirse en adultos dentro del intestino delgado de un gato, perro o zorro, donde ocurre el apareamiento y la puesta de huevos. [9] [12] [16] [21] Los huevos se eliminan en las heces y solo se vuelven infecciosos después de tres semanas fuera de un huésped. [27] Durante este período de incubación, la muda de la larva de primera a segunda (y posiblemente tercera) etapa tiene lugar dentro del huevo. [9] [22] En la mayoría de los perros, gatos y zorros adultos, el ciclo de vida completo no ocurre, sino que las larvas de segunda etapa se enquistan después de un período de migración a través del cuerpo. La reactivación de las larvas es común sólo en gatas, perras y zorros preñados o lactantes. El ciclo de vida completo generalmente sólo ocurre en estas hembras y sus crías. [16] [25]
Las larvas de segunda etapa también eclosionarán en el intestino delgado de un huésped accidental, como un ser humano, después de la ingestión de huevos infecciosos. [28] Las larvas luego migrarán a través de los órganos y tejidos del huésped accidental, más comúnmente los pulmones, el hígado, los ojos y el cerebro. [29] Dado que las larvas L2 no pueden madurar en huéspedes accidentales, después de este período de migración, las larvas de Toxocara se enquistarán como larvas de segunda etapa. [7] [16]
Diagnóstico
Encontrar larvas de Toxocara dentro de un paciente es el único diagnóstico definitivo para la toxocariasis; sin embargo, las biopsias para buscar larvas de segundo estadio en humanos generalmente no son muy efectivas. [9] La PCR , ELISA y las pruebas serológicas se utilizan más comúnmente para diagnosticar la infección por Toxocara . [9] Las pruebas serológicas dependen de la cantidad de larvas dentro del paciente y, lamentablemente, no son muy específicas. [9] Las ELISA son mucho más confiables y actualmente tienen una sensibilidad del 78% y una especificidad del 90%. [30] Un estudio de 2007 anunció una ELISA específica para Toxocara canis , que minimizará los falsos positivos de las reacciones cruzadas con gusanos redondos similares y ayudará a distinguir si un paciente está infectado con T. canis o T. cati . [31] La OLM a menudo se diagnostica después de un examen clínico. [30] Los granulomas se pueden encontrar en todo el cuerpo y se pueden visualizar utilizando tecnologías de ultrasonido, resonancia magnética y tomografía computarizada. [9]
Prevención
La participación activa de los veterinarios y los dueños de mascotas es importante para controlar la transmisión de Toxocara de las mascotas a los humanos. Un grupo que participa muy activamente en la promoción de una reducción de las infecciones en perros en los Estados Unidos es el Companion Animal Parasite Council - CAPC . Dado que las perras y gatas preñadas o lactantes y sus crías tienen la carga parasitaria activa más alta, estos animales deben incluirse en un programa de desparasitación. [5] [9] [16] Las heces de las mascotas deben recogerse y desecharse o enterrarse, ya que pueden contener huevos de Toxocara . [5] Practicar esta medida en áreas públicas, como parques y playas, es especialmente esencial para disminuir la transmisión. [7] [10] Hasta el 20% de las muestras de suelo de los parques infantiles de EE. UU. han encontrado huevos de lombrices intestinales. [17] Además, las cajas de arena deben cubrirse cuando no se utilicen para evitar que los gatos las utilicen como cajas de arena. Lavarse las manos antes de comer y después de jugar con las mascotas, así como después de manipular tierra, reducirá las posibilidades de ingerir huevos de Toxocara . [7] [5] [9] Lavar todas las frutas y verduras, mantener a las mascotas fuera de los jardines y cocinar bien las carnes también pueden prevenir la transmisión. [9] Por último, enseñar a los niños a no llevarse a la boca elementos no comestibles, especialmente tierra, reducirá drásticamente las posibilidades de infección. [5]
La toxocariasis ha sido considerada una de las enfermedades olvidadas de la pobreza en Estados Unidos , debido a su prevalencia en los Apalaches , el sur de Estados Unidos , los centros urbanos y las poblaciones minoritarias. [32]
Actualmente no hay ninguna vacuna disponible ni en desarrollo. [6] [32] Los genomas mitocondriales de T. cati y T. canis se secuenciaron en 2008, lo que podría conducir a avances en el tratamiento y la prevención. [33]
Tratamiento
La toxocariasis suele resolverse por sí sola, porque las larvas de Toxocara no pueden madurar en huéspedes humanos. [7] Se prescriben corticosteroides en casos graves de VLM o si al paciente se le diagnostica OLM. Se puede prescribir albendazol (preferido) o mebendazol (“terapia de segunda línea”). [7] [12] [30] Los granulomas se pueden extirpar quirúrgicamente, o se puede utilizar fotocoagulación láser y criorretinopexia para destruir los granulomas oculares. [9] [12] [30] [34]
La toxocariasis visceral en humanos puede tratarse con fármacos antiparasitarios como albendazol o mebendazol , tiabendazol o dietilcarbamazina, generalmente en combinación con medicamentos antiinflamatorios. Se han utilizado esteroides con algunos resultados positivos. La terapia antihelmíntica se reserva para infecciones graves (pulmones, cerebro) porque la terapia puede inducir, debido a la matanza masiva de larvas, una fuerte respuesta inflamatoria. El tratamiento de la toxocariasis ocular es más difícil y generalmente consiste en medidas para prevenir el daño progresivo al ojo. [35]
Epidemiología
Los humanos son huéspedes accidentales de Toxocara , pero la toxocariasis se observa en todo el mundo. La mayoría de los casos de toxocariasis se observan en personas menores de veinte años. [6] La seroprevalencia es mayor en los países en desarrollo, pero también puede ser considerable en los países del primer mundo. [9] En Bali, Santa Lucía, Nepal y otros países, la seroprevalencia es superior al cincuenta por ciento. [9] Antes de 2007, se pensaba que la seroprevalencia en EE. UU. era de alrededor del 5 % en niños. [7] Sin embargo, Won et al. descubrieron que la seroprevalencia en EE. UU. es en realidad del 14 % para la población en general. [6] En muchos países, la toxocariasis se considera muy rara. Aproximadamente se ven 10 000 casos clínicos al año en EE. UU., de los cuales el diez por ciento son OLM. [6] [12] La pérdida permanente de la visión ocurre en 700 de estos casos. [12]
Los niños pequeños corren el mayor riesgo de infección porque juegan al aire libre y tienden a llevarse a la boca objetos contaminados y suciedad. [7] [10] [9] La tenencia de perros es otro factor de riesgo conocido de transmisión. [10] También existe una correlación significativa entre los títulos altos de anticuerpos contra Toxocara y la epilepsia en los niños. [7] [36]
En humanos se han observado cargas parasitarias de hasta 300 larvas en un solo gramo de hígado. [9] Los "antígenos excretores-secretores de las larvas... liberados de su capa epicutánea externa [y]... fácilmente desprendidos cuando se unen a anticuerpos específicos" incitan la respuesta inmunitaria del huésped. [4] Se cree que el punto de inflexión entre el desarrollo de VLM y OLM es entre 100 y 200 larvas. [9] Se cree que la infección más leve en OLM estimula una respuesta inmunitaria menor y permite la migración de una larva al ojo. Se cree que las larvas ingresan al ojo a través del nervio óptico, la arteria central de la retina, las arterias ciliares posteriores cortas, los tejidos blandos o el líquido cefalorraquídeo. [9] [12] Los granulomas oculares que se forman alrededor de una larva generalmente son periféricos en la retina o el disco óptico. [12]
La larva migratoria visceral parece afectar con mayor frecuencia a los niños de 1 a 4 años, mientras que la larva migratoria ocular afecta con mayor frecuencia a los niños de 7 a 8 años. Entre el 4,6% y el 23% de los niños estadounidenses han sido infectados con el huevo del gusano redondo del perro. Esta cifra es mucho mayor en otras partes del mundo; en los países tropicales hay una seroprevalencia de hasta el 80-90%, como en Colombia, donde hasta el 81% de los niños han sido infectados, u Honduras, donde se informó que la seroprevalencia entre los niños en edad escolar era del 88%. [17] [36] [37] En la parte occidental del mundo, la seroprevalencia es menor, alrededor del 35-42%. [36]
Historia
En 1782, Werner describió un nematodo parásito en perros al que llamó Ascaris canis . Johnston determinó que lo que Werner había descrito era en realidad un miembro del género Toxocara establecido por Stiles en 1905. Fülleborn especuló que las larvas de T. canis podrían causar nódulos granulomatosos en humanos. En 1947, Perlingiero y Gyorgy describieron el primer caso de lo que probablemente era toxocariasis. Su paciente era un niño de 2 años de Florida que tenía síntomas clásicos y granulomas necrotizantes eosinofílicos. [3] En 1950, Campbell-Wilder fue la primera en describir la toxocariasis en humanos; publicó un artículo que describía granulomas oculares en pacientes con endoftalmitis, enfermedad de Coat o pseudoglioma. Dos años después, Beaver et al. publicaron la presencia de larvas de Toxocara en granulomas extirpados de pacientes con síntomas similares a los de los pacientes de Wilder. [9] [10] Los peligros de la toxocariasis se plantearon por primera vez en Gran Bretaña en la década de 1970, lo que provocó un problema de salud pública. [38]
Otros animales
Gatos
Algunos tratamientos para la infección por Toxocara cati incluyen medicamentos diseñados para hacer que los gusanos adultos se anestesien parcialmente y se desprendan del revestimiento intestinal, lo que les permite ser excretados vivos en las heces. Dichos medicamentos incluyen piperazina y pirantel . Estos se combinan con frecuencia con el fármaco praziquantel , que parece hacer que el gusano pierda su resistencia a ser digerido por el animal huésped. Otros tratamientos eficaces incluyen ivermectina , milbemicina y selamectina . [39] El diclorvos también ha demostrado ser eficaz como veneno, aunque las medidas para prohibirlo debido a las preocupaciones sobre su toxicidad han hecho que no esté disponible en algunas áreas. [ cita requerida ]
Sin embargo, el tratamiento de este parásito en los felinos salvajes es difícil, ya que la detección es la mejor manera de encontrar qué individuos tienen el parásito. Esto puede ser difícil, ya que las especies infectadas son difíciles de detectar. Una vez detectados, los individuos infectados tendrían que ser eliminados de la población, con el fin de reducir el riesgo de exposición continua a los parásitos. Un método principal que se ha utilizado para reducir la cantidad de infección es la eliminación a través de la caza. La eliminación también puede ocurrir a través de los propietarios de tierras, como Dare y Watkins (2012) descubrieron a través de su investigación sobre pumas. Tanto los cazadores como los propietarios de tierras pueden proporcionar muestras que se pueden utilizar para detectar la presencia de lombrices felinas en el área, así como ayudar a eliminarlas de la población. Este método es más práctico que administrar medicamentos a las poblaciones salvajes, ya que los animales salvajes, como se mencionó anteriormente, son más difíciles de encontrar para administrarles atención médica. [ cita requerida ]
Sin embargo, el tratamiento con medicamentos es otro método utilizado en los estudios sobre lombrices intestinales, como el experimento sobre el manejo de la lombriz intestinal del mapache realizado por Smyser et al. (2013) en el que se utilizaron cebos médicos. Sin embargo, los medicamentos suelen ser caros y el éxito de los cebos depende de si los individuos infectados consumen el cebo. Además, puede resultar costoso (en términos de tiempo y recursos) controlar las áreas cebadas. La eliminación mediante la caza permite a las agencias reducir los costos y les da una mayor posibilidad de eliminar a los individuos infectados. [ cita requerida ]
Referencias
- ^ https://academic.oup.com/ajcp/article/142/suppl_1/A104/1771175 Pseudoleucemia eosinofílica debida a toxocariasis en un paciente de 3 años: informe de un caso raro
- ^ Wu T, Bowman DD (2020). "Larvas migratorias viscerales de Toxocara canis y Toxocara cati en hospedadores no cánidos ni félidos". Advances in Parasitology . 109 . Elsevier: 63–88. doi :10.1016/bs.apar.2020.02.001. ISBN 978-0-12-820958-5. Número de identificación personal 32381221. Número de identificación personal 216238751.
- ^ ab Marty A (2000). "Toxocariasis Capítulo 27". En Meyers WM, Neafie RC, Marty AM, Wear DJ (eds.). Patología de las enfermedades infecciosas. Vol. I: Helmintiasis. Washington DC: Instituto de Patología de las Fuerzas Armadas. págs. 411–21. Archivado desde el original el 27 de diciembre de 2010. Consultado el 20 de noviembre de 2014 .
- ^ abcdef Toxocariasis en eMedicine
- ^ abcdefghijkl «Hoja informativa: Toxocariasis». División de enfermedades parasitarias . Centros para el Control y la Prevención de Enfermedades. 2007. Archivado desde el original el 27 de marzo de 2011. Consultado el 17 de septiembre de 2017 .
- ^ abcde "Nuevos resultados de un estudio de los CDC muestran que la infección por Toxocara es más común de lo que se pensaba" (PDF) . División de Enfermedades Parasitarias . Centros para el Control y la Prevención de Enfermedades. 2009. Archivado (PDF) desde el original el 10 de marzo de 2010 . Consultado el 17 de septiembre de 2017 .
- ^ abcdefghijklmnopqrstu vwxy Markell EK, Voge M (2006). Parasitología médica de Markell y Voge (9ª ed.). San Luis: Saunders Elsevier.
- ^ Sariego I, Kanobana K, Rojas L, Speybroeck N, Polman K, Núñez FA (2012). Carabin H (ed.). "Toxocariasis en Cuba: una revisión de la literatura". PLOS Neglected Tropical Diseases . 6 (2): e1382. doi : 10.1371/journal.pntd.0001382 . PMC 3289590 . PMID 22389726.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae Holland C, Smith HV, eds. (2006). Toxocara: el parásito enigmático. Wallingford, Reino Unido y Cambridge, MA: CABI Publishing.
- ^ abcdefghi Despommier D (2003). "Toxocariasis: aspectos clínicos, epidemiología, ecología médica y aspectos moleculares". Clinical Microbiology Reviews . 16 (2): 265–72. doi :10.1128/CMR.16.2.265-272.2003. PMC 153144 . PMID 12692098.
- ^ ab "Lombriz intestinal". Manual veterinario de Merck. 2008. Archivado desde el original el 26 de mayo de 2011.
- ^ abcdefghij "Toxocariasis: Larva migratoria ocular". Revisión de Optometry Online: Handbook of Ocular Disease Management. Enero de 2009. Archivado desde el original el 19 de noviembre de 2011. Consultado el 3 de julio de 2011 .
- ^ Stewart JM, Cubillan LD, Cunningham ET (2005). "Prevalencia, características clínicas y causas de pérdida de visión entre pacientes con toxocariasis ocular". Retina . 25 (8): 1005–13. doi :10.1097/00006982-200512000-00009. PMID 16340531. S2CID 8659870.
- ^ Gavignet, Béatrice; Piarroux, Renaud; Aubin, François; Millon, Laurence; Humbert, Philippe (diciembre de 2008). "Manifestaciones cutáneas de la toxocariasis humana". Revista de la Academia Americana de Dermatología . 59 (6): 1031–1042. doi :10.1016/j.jaad.2008.06.031. ISSN 0190-9622. PMID 18793816.
- ^ Bassukas ID, Gaitanis G, Zioga A, Boboyianni C, Stergiopoulou C (2008). Celulitis eosinofílica "febril" migratoria "con hepatoesplenomegalia: toxocariasis en adultos: reporte de un caso". Diario de Casos . 1 (1): 356. doi : 10.1186/1757-1626-1-356 . PMC 2621125 . PMID 19038064.
- ^ abcdefghijklm "Directrices para veterinarios: prevención de la transmisión zoonótica de ascárides y anquilostomas en perros y gatos". División de enfermedades parasitarias . Centros para el Control y la Prevención de Enfermedades. 2004. Archivado desde el original el 21 de agosto de 2010. Consultado el 17 de septiembre de 2017 .
- ^ abcd Cheprasov A (2012). "Muerte en el patio de recreo". Revista Guru . 11 : 59–61.
- ^ ab Fan CK, Holland CV, Loxton K, Barghouth U (2015). "Toxocariasis cerebral: ¿progresión silenciosa hacia trastornos neurodegenerativos?". Clinical Microbiology Reviews . 28 (3): 663–86. doi :10.1128/CMR.00106-14. PMC 4462679 . PMID 26062575.
- ^ Azam D, Ukpai OM, Said A, Abd-Allah GA, Morgan ER (2012). "Temperatura y desarrollo y supervivencia de larvas infecciosas de Toxocara canis". Parasitology Research . 110 (2): 649–56. doi :10.1007/s00436-011-2536-8. PMID 21779864. S2CID 10075744.
- ^ ab Gamboa MI (diciembre de 2005). "Efectos de la temperatura y la humedad en el desarrollo de huevos de Toxocara canis en condiciones de laboratorio". Journal of Helminthology . 79 (4): 327–31. doi :10.1079/JOH2005287. PMID 16336716. S2CID 30220871. ProQuest 213503935.
- ^ abcdefghij Harris-Linton M (2001). "Toxocara canis". Museo de Zoología de la Universidad de Michigan: Animal Diversity Web. Archivado desde el original el 1 de mayo de 2010. Consultado el 23 de febrero de 2009 .
- ^ abcdefg Soskolne G (2001). "Toxocara cati". Museo de Zoología de la Universidad de Michigan: Web sobre diversidad animal. Archivado desde el original el 5 de junio de 2011. Consultado el 17 de enero de 2010 .
- ^ Johnstone C (2000). "Nems-topics". The Nematodes. Universidad de Pensilvania. Archivado desde el original el 16 de febrero de 2009. Consultado el 23 de febrero de 2009 .
- ^ abc "Navegador de taxonomía". www.ncbi.nlm.nih.gov . Consultado el 14 de enero de 2019 .
- ^ abcd "Toxocariasis". DPDx: parásitos y salud . Centros para el Control y la Prevención de Enfermedades. 2009. Archivado desde el original el 13 de mayo de 2006. Consultado el 7 de marzo de 2006 .
- ^ Mohamad S, Azmi NC, Noordin R (2009). "Desarrollo y evaluación de un ensayo sensible y específico para el diagnóstico de la toxocariasis humana mediante el uso de tres antígenos recombinantes (TES-26, TES-30USM y TES-120)". Journal of Clinical Microbiology . 47 (6): 1712–17. doi :10.1128/JCM.00001-09. PMC 2691092 . PMID 19369434.
- ^ Becerril Flores MA (2019). Parasitología médica (Quinta edición ed.). México: McGraw-Hill Interamericana. ISBN 978-1-4562-6784-1.OCLC 1117384861 .
- ^ Ahn SJ, Ryoo NK, Woo SJ (2014). "Toxocariasis ocular: características clínicas, diagnóstico, tratamiento y prevención". Asia Pacific Allergy . 4 (3): 134–41. doi :10.5415/apallergy.2014.4.3.134. PMC 4116038 . PMID 25097848.
- ^ Lee RM, Moore LB, Bottazzi ME, Hotez PJ (2014). "Toxocariasis en América del Norte: una revisión sistemática". PLOS Neglected Tropical Diseases . 8 (8): e3116. doi : 10.1371/journal.pntd.0003116 . PMC 4148222 . PMID 25166906.
- ^ abcd Auweerter P (2008). "Toxocariasis". Centro de tecnología de la información en el punto de atención: Guía ABX . Johns Hopkins.[ enlace muerto permanente ]
- ^ Iddawela RD, Rajapakse RP, Perera NA, Agatsuma T (2007). "Caracterización de un antígeno excretor-secretor específico de la especie Toxocara canis (TcES-57) y desarrollo de una prueba ELISA de doble sándwich para el diagnóstico de la larva migratoria visceral". Revista Coreana de Parasitología . 45 (1): 19–26. doi :10.3347/kjp.2007.45.1.19. PMC 2526337 . PMID 17374974.
- ^ ab Hotez PJ (2008). Brooker S (ed.). "Infecciones desatendidas de la pobreza en los Estados Unidos de América". PLOS Neglected Tropical Diseases . 2 (6): e256. doi : 10.1371/journal.pntd.0000256 . PMC 2430531 . PMID 18575621.
- ^ Li MW, Lin RQ, Song HQ, Wu XY, Zhu XQ (2008). "Los genomas mitocondriales completos de tres especies de Toxocara de importancia para la salud humana y animal". BMC Genomics . 9 : 224. doi : 10.1186/1471-2164-9-224 . PMC 2396643 . PMID 18482460.
- ^ Werner JC, Ross RD, Green WR, Watts JC (1999). "Vitrectomía pars plana y cirugía subretinal para toxocariasis ocular". Archivos de Oftalmología . 117 (4): 532–4. doi : 10.1001/archopht.117.4.532 . PMID 10206586.
- ^ "Toxocariasis". Parásitos. Centros para el Control y la Prevención de Enfermedades, 10 de enero de 2013. "CDC - Toxocariasis - Tratamiento". 2017. Archivado desde el original el 6 de septiembre de 2017. Consultado el 17 de septiembre de 2017 .. 22 de abril de 2014
- ^ abc Luna J, Cicero CE, Rateau G, Quattrocchi G, Marin B, Bruno E, et al. (2018). Fleury A (ed.). "Evidencia actualizada de la asociación entre toxocariasis y epilepsia: revisión sistemática y metanálisis". PLOS Neglected Tropical Diseases . 12 (7): e0006665. doi : 10.1371/journal.pntd.0006665 . PMC 6070292 . PMID 30028858.
- ^ Hernandez, SA (2020). "Estudio integrado de la infección por Toxocara en niños hondureños: seroepidemiología humana y contaminación ambiental en una comunidad costera". Trop Med Infect Dis . 5 (3): 135. doi : 10.3390/tropicalmed5030135 . PMC 7559065 . PMID 32842560.
- ^ Pemberton N. "Suciedad de perro, repugnancia y propaganda sanitaria británica de los años 70: municiones de la mente". blogs.kent.ac.uk .
- ^ Bowman DD, Hendrix CM, Lindsay DS, Barr SC (2002). Parasitología clínica felina (Primera edición). Ames, Iowa: Iowa State University. pág. 275. ISBN 978-0-8138-0333-3Archivado desde el original el 26 de abril de 2018.
Enlaces externos
- Gusanos redondos: gatos y gatitos de la biblioteca de salud de mascotas
- Gusanos redondos: perros y cachorros de The Pet Health Library